La aplicación de una solución antiséptica previa al uso de los catéteres tunelizados es una práctica recomendada. Estas medidas habituales en la manipulación de los catéteres para hemodiálisis son cruciales para evitar complicaciones. Presentamos un brote de infección por Serratia marcescens (S. marcescens) en varias unidades de hemodiálisis de la Comunidad Autónoma de Madrid.
Material y métodosLos primeros casos de bacteriemia por S. marcescens fueron aislados en diciembre de 2014. La detección de un germen infrecuente en varios pacientes se puso en conocimiento de los Servicios de Medicina Preventiva por sospecha de probable brote nosocomial. Se recogieron datos de 4 centros donde se detectaron episodios de bacteriemias similares por S. marcescens.
ResultadosFueron detectados un total de 21 casos de bacteriemia por S. marcescens. La edad media de los pacientes era de 72±10 años. El tiempo medio en hemodiálisis de los pacientes afectados era de 33±13 meses (rango: 3-83), el tiempo medio del catéter tunelizado era de 22±13 meses. En 11 casos el cuadro clínico fue semejante, caracterizado por hipotensión y malestar general durante la sesión de hemodiálisis. En otros 7 pacientes se asoció fiebre. En 3 casos la forma de presentación fue asintomática y se detectó por hemocultivos. Todos eran portadores de catéteres tunelizados (12 pacientes con catéter en la vena yugular derecha, 5 en la yugular izquierda, 2en la femoral derecha y 2 en la subclavia izquierda). El tratamiento que se aplicó en 6 casos fue gentamicina posdiálisis intravenosa (1mg/kg) más sellado del catéter con solución de ciprofloxacino durante 3 semanas. En 12 pacientes el tratamiento fue ceftazidima 2g iv más sellado de catéter con el mismo antibiótico durante 2semanas. Cuatro pacientes recibieron dosis de ciprofloxacino oral, en un caso se asoció a vancomicina iv, durante 2semanas. A las 48h de iniciar el tratamiento, los pacientes quedaron asintomáticos y no presentaron nuevos episodios. No se observó ninguna complicación mayor. Esta situación fue comunicada por los equipos a las autoridades sanitarias. Posteriormente, se notificó la presencia de lotes de antiséptico de clorhexidina acuosa al 0,05 y 2% colonizados por S. marcescens. Dada la aplicación de forma rutinaria del antiséptico en el manejo de los catéteres en estas unidades, este fue considerado el foco de contagio. Tras la retirada de los lotes no acontecieron nuevos casos.
ConclusionesLas bacteriemias por gérmenes no convencionales deben ponernos sobre aviso para investigar posibles brotes. La aplicación de una solución contaminada por S. marcescens en los catéteres en hemodiálisis fue la vía de bacteriemia. El tratamiento antibiótico intravenoso y el sellado de los catéteres permitió una excelente supervivencia tanto de los pacientes como de los catéteres.
The application of antiseptic solution for handling tunnelled catheters is recommended in patients undergoing haemodialysis. These routine antiseptic procedures in handling catheters are crucial to avoid complications. We report an outbreak of Serratia marcescens (S. marcescens) bacteraemia in numerous haemodialysis units of the Community of Madrid.
Material and methodsThe first cases of bacteraemia due to S. marcescens were isolated in December 2014. The Preventive Medicine Services were informed of the detection of an atypical pathogen in several patients, suspecting a probable nosocomial outbreak. Information from 4 centres with similar S. marcescens bacteraemia was analysed.
ResultsTwenty-one cases of bacteraemia related to S. marcescens were identified. The mean age of affected patients was 72±10 years. The mean time on haemodialysis of affected patients was 33±13 months (range: 3–83 months), the median time of tunnelled catheter was 22±13 months. In 11 cases the clinical picture was similar, with hypotension and general malaise during the haemodialysis session. Fever was present in a further 7 cases. In 3 cases the presentation was asymptomatic and was detected by blood cultures. All patients had tunnelled catheters (12 patients with catheter in the right jugular vein, 5 in the left jugular, 2 in the right femoral artery and 2 in the left subclavian artery). Gentamicin intravenous doses (1mg/kg) with catheter lock solution with ciprofloxacin post-dialysis were administered for 3 weeks in 6 patients. In 12 patients the treatment was ceftazidime (2g IV) plus catheter lock solution with the same antibiotic, for 2 weeks. Four patients received oral ciprofloxacin for 2 weeks, in one case together with IV vancomycin. The patients were asymptomatic and without new episodes 48hours after the treatment. No major complications were observed. The teams informed the health authorities of the situation, which then reported the presence of batches of antiseptic (chlorhexidine 0.05 and 2%) colonised by S. marcescens. Given the routine application of this antiseptic in handling catheters at these units, this was considered the source of contagion and new cases were not observed after the removal of the batches.
ConclusionsThe presence of bacteraemia due to unconventional germs should alert us to a potential outbreak. The application of a solution contaminated by S. marcescens in haemodialysis catheters was the source of bacteraemia. The intravenous antibiotic treatment and the catheter lock solution allowed an excellent survival of patients and catheters.
Los catéteres venosos son la alternativa para aquellos pacientes que no presentan una fístula arteriovenosa o una prótesis funcionante para el tratamiento renal sustitutivo con hemodiálisis. Los actuales catéteres tunelizados (CT), aun con mejoras en su diseño, siguen presentado mayor morbimortalidad y tasas de complicaciones que otros accesos vasculares1–3. Su principal problema son las infecciones, con un elevado riesgo de bacteriemias, que condicionan la expectativa vital de los pacientes en tratamiento renal sustitutivo4. Las medidas de profilaxis en la manipulación de los catéteres son cruciales para evitar este tipo de complicaciones. La aplicación de una solución antiséptica para la manipulación de los CT es una práctica recomendada para disminuir los riesgos en los pacientes portadores de ese tipo de catéteres5,6. El agente causante de bacteriemias asociadas a catéteres más frecuente es el Staphylocccus aureus, con un alta comorbilidad asociada y, aunque otros gérmenes son más inusuales, también pueden observarse bacteriemias secundarias a gérmenes menos convencionales7–9. Presentamos un brote inusual de bacteriemias asociadas a Serratia marcescens (S. marcescen) en pacientes portadores de CT para hemodiálisis en 4 hospitales de la Comunidad Autónoma de Madrid.
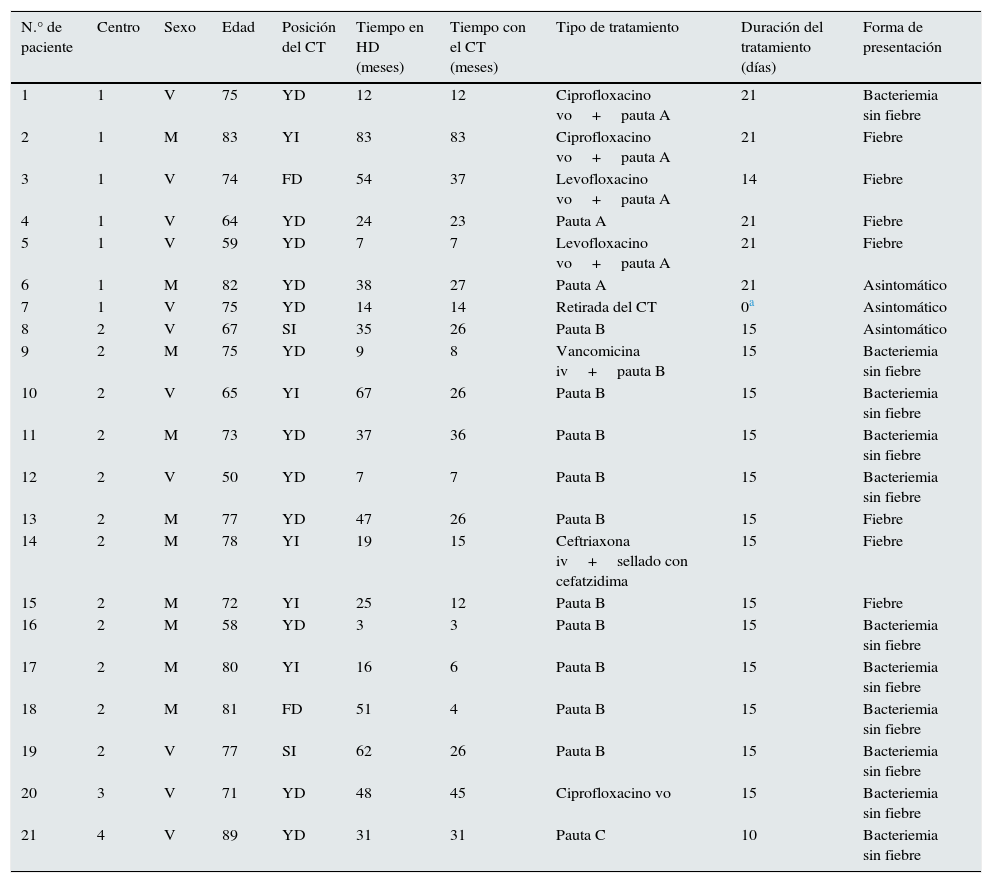
Material y métodosEl estudio se ha realizado en 4 centros donde se identificaron casos de bacteriemias asociadas a S. marcescens en pacientes portadores de CT para hemodiálisis. El 17 de diciembre de 2014, tras la identificación de 2 pacientes portadores de CT con hemocultivos positivos para un germen infrecuente (S. marcescens), se activaron los mecanismos de prevención ante la posibilidad de un brote nosocomial. Se investigó toda la unidad de hemodiálisis, al personal y los posibles focos de contagio, procediendo a controlar mediante hemocultivos a los pacientes en riesgo, portadores de catéteres, de prótesis y de aquellos en técnica de button-hole. Se cultivaron muestras de las líneas, de las máquinas de diálisis y de las soluciones antisépticas que se aplicaban de forma protocolaria en las unidades. Se realizó un estudio retrospectivo, multicéntrico y descriptivo de todos los casos identificados desde la aparición del primer evento hasta la consideración del cierre del brote. El objetivo era identificar el número de afectos, las características de los pacientes, el tratamiento recibido y la evolución. Se consideró caso a aquel paciente con identificación en hemocultivos de S. marcescens y portador de CT para hemodiálisis, tuviera o no clínica asociada. No se incluyó a pacientes que no estuvieran en tratamiento renal sustitutivo. Los 4 centros que realizaron un análisis conjunto de dichas medidas aplicadas se muestran en la tabla 1. Los centros eran independientes y las pautas de tratamiento fueron individualizadas en cada hospital, cada centro tenía su propia sección de Nefrología y de Medicina Preventiva. Para establecer si se trataba de una misma cepa de S. marcescens, se llevó a cabo la genotipificación mediante electroforesis en campos pulsados: debían coincidir los hemocultivos y las muestras de las soluciones contaminadas.
Características de los pacientes
| N.° de paciente | Centro | Sexo | Edad | Posición del CT | Tiempo en HD (meses) | Tiempo con el CT (meses) | Tipo de tratamiento | Duración del tratamiento (días) | Forma de presentación |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 1 | V | 75 | YD | 12 | 12 | Ciprofloxacino vo+pauta A | 21 | Bacteriemia sin fiebre |
| 2 | 1 | M | 83 | YI | 83 | 83 | Ciprofloxacino vo+pauta A | 21 | Fiebre |
| 3 | 1 | V | 74 | FD | 54 | 37 | Levofloxacino vo+pauta A | 14 | Fiebre |
| 4 | 1 | V | 64 | YD | 24 | 23 | Pauta A | 21 | Fiebre |
| 5 | 1 | V | 59 | YD | 7 | 7 | Levofloxacino vo+pauta A | 21 | Fiebre |
| 6 | 1 | M | 82 | YD | 38 | 27 | Pauta A | 21 | Asintomático |
| 7 | 1 | V | 75 | YD | 14 | 14 | Retirada del CT | 0a | Asintomático |
| 8 | 2 | V | 67 | SI | 35 | 26 | Pauta B | 15 | Asintomático |
| 9 | 2 | M | 75 | YD | 9 | 8 | Vancomicina iv+pauta B | 15 | Bacteriemia sin fiebre |
| 10 | 2 | V | 65 | YI | 67 | 26 | Pauta B | 15 | Bacteriemia sin fiebre |
| 11 | 2 | M | 73 | YD | 37 | 36 | Pauta B | 15 | Bacteriemia sin fiebre |
| 12 | 2 | V | 50 | YD | 7 | 7 | Pauta B | 15 | Bacteriemia sin fiebre |
| 13 | 2 | M | 77 | YD | 47 | 26 | Pauta B | 15 | Fiebre |
| 14 | 2 | M | 78 | YI | 19 | 15 | Ceftriaxona iv+sellado con cefatzidima | 15 | Fiebre |
| 15 | 2 | M | 72 | YI | 25 | 12 | Pauta B | 15 | Fiebre |
| 16 | 2 | M | 58 | YD | 3 | 3 | Pauta B | 15 | Bacteriemia sin fiebre |
| 17 | 2 | M | 80 | YI | 16 | 6 | Pauta B | 15 | Bacteriemia sin fiebre |
| 18 | 2 | M | 81 | FD | 51 | 4 | Pauta B | 15 | Bacteriemia sin fiebre |
| 19 | 2 | V | 77 | SI | 62 | 26 | Pauta B | 15 | Bacteriemia sin fiebre |
| 20 | 3 | V | 71 | YD | 48 | 45 | Ciprofloxacino vo | 15 | Bacteriemia sin fiebre |
| 21 | 4 | V | 89 | YD | 31 | 31 | Pauta C | 10 | Bacteriemia sin fiebre |
Centro 1: Hospital Univ. del Henares; Centro 2: Hospital Univ. Príncipe de Asturias; Centro 3: Hospital Univ. Infanta Leonor; Centro 4: Hospital Univ. Infanta Sofía; CT: catéter tunelizado; FD: femoral derecha; HD: hemodiálisis; iv: intravenoso; M: mujer; Pauta A: gentamicina iv (1mg/kg/peso)+sellado con ciprofloxacino; Pauta B: ceftazidima 2 g iv+sellado con ceftazidima; Pauta C: ciprofloxacino vo+vancomicina iv+sellado con gentamicina; SI: subclavia izquierda; V: varón; vo: vía oral; YD: yugular derecha; YI: yugular izquierda.
Análisis estadístico: Los resultados se expresan con media y desviación estándar. Se incluye la mediana y el rango cuando la serie lo requiere.
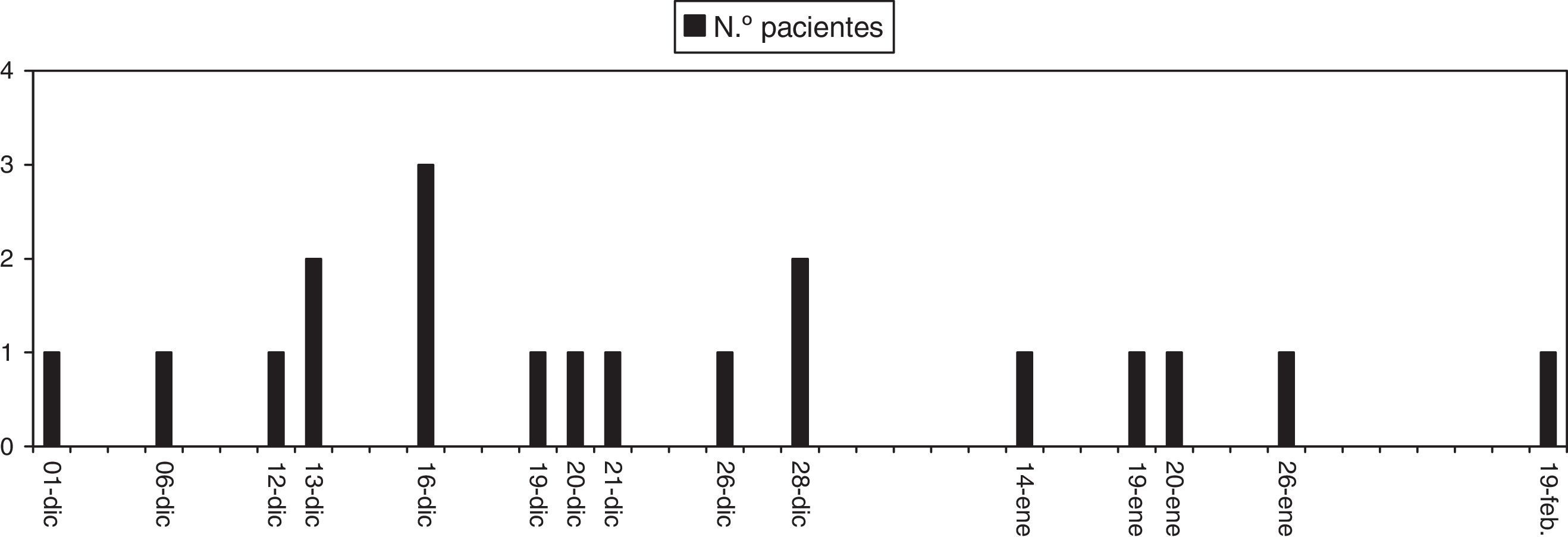
ResultadosEl primer caso confirmado por hemocultivo fue el 6 de diciembre de 2014. Se sospechó el brote el 17 de diciembre ante la presencia de otros 2 pacientes con hemocultivos positivos por el mismo germen. El brote se dio por finalizado el 19 de febrero de 2015, fecha del último caso positivo. Una vez concluido el brote, el total de pacientes identificados fue de 21, todos ellos con hemocultivos positivos para S. marcescens y portadores de CT. Una vez confirmados los primeros casos en las distintas unidades de hemodiálisis esto se puso en conocimiento de los responsables de Medina Preventiva de cada centro. En ese periodo se realizó un estudio epidemiológico de los potenciales focos de contagio según protocolos de cada centro, que incluyó al personal sanitario, materiales y maquinaria; también se intensificaron las medidas de control preventivo. Finalmente, los afectados fueron 11 varones y 10 mujeres, con una edad media de 72±10 años. El tiempo medio en hemodiálisis de los pacientes afectados era de 33±13 meses (rango: 3-83) y el tiempo medio desde la implantación del catéter era de 22±13 meses. No todos los pacientes eran coincidentes en los turnos, ni en el puesto de diálisis, ni en el personal que los atendía. La forma de presentación más habitual fue la aparición de hipotensión, malestar general y tiritona, con bacteriemia asociada sin fiebre en 11 casos, durante la sesión de diálisis. En 7 casos se constató fiebre con temperatura mayor de 38°C. En 3 casos el diagnóstico se realizó mediante cultivos positivos en situación clínica asintomática. Los hemocultivos se extrajeron de las líneas durante la sesión de hemodiálisis, tanto en los pacientes con clínica como en aquellos asintomáticos. La distribución por centros y la localización del CT se describen en la tabla 1. En los 2centros con más pacientes afectados la pauta de tratamiento fue diferente. En uno se realizó tratamiento con ceftazidima iv (2 g) posdiálisis y sellado con la solución del mismo antibiótico (1ml de 500mg de ceftazidima en 50cc de suero salino fisiológico, con solución de heparina hasta completar las ramas del catéter) durante 2semanas (en 11pacientes), tras la confirmación de la sensibilidad. En otro centro la pauta instaurada fue gentamicina iv a dosis de 1mg/kg/peso posdiálisis y sellado con solución de ciprofloxacino (3ml de antibiótico [vial 200mg/100ml]+3 cc de heparina al 5%) durante 3 semanas, tras verificación de la sensibilidad mediante antibiograma. En 3 casos se asoció quinolona oral ante lo infrecuente de la infección, 2 casos también recibieron vancomicina iv (1 g posdiálisis), un paciente recibió ciprofloxacino oral exclusivamente y otro ceftriaxona iv (2 g posdiálisis) junto al sellado con ceftazidima. La tasa de ataque en los centros con más casos descritos fue de un 36,8% (7 pacientes afectados de 19 portadores de CT) y de un 46,15% (12 infecciones por S. marcescens en 26 pacientes con CT). Ningún paciente con prótesis o en técnica de button-hole presentó bacteriemia y sus hemocultivos de control fueron negativos.
Una vez tomadas las medidas de prevención de riesgos, revisados los potenciales vectores de transmisión y notificado a las autoridades sanitarias, se recibió el 19 de diciembre de 2014 el comunicado de la presencia de lotes de antiséptico de piel sana BohmClorh solución acuosa al 2% de clorhexidina (250 cc, lotes I-33, I-34 e I-35) colonizados por S. marcescens. Unas semanas después la prohibición del uso de dicha solución fue ampliada a los lotes del 0,05%. Dado que dichas formulaciones se aplicaban de forma rutinaria en el manejo de los catéteres en estos hospitales, se consideró que esa clorhexidina contaminada fue el foco de contagio. Tras la retirada de los lotes comprometidos, tanto de solución acuosa como alcohólica, no acontecieron nuevos casos. El último caso registrado fue en febrero de 2015. El cronograma de los casos se muestra en la figura 1. Los centros 3 y 4 presentaron un episodio aislado. En el centro 1, ante la primera notificación, se retiraron todos los lotes de la solución de clorhexidina; en el centro 2 se retiraron solo los del 2% ante la recomendación inicial y ya posteriormente los del 0,05%. Para establecer si se trataba de la misma cepa de S. marcescens, se realizó la genotipificación: los hemocultivos y la muestra de clorhexidina de uno de los lotes retirados coincidieron. La evolución en todos los casos fue favorable, sin reaparición de la fiebre, y no fue necesaria la retirada de ningún CT por la infección. El único CT retirado fue programado, dada la recuperación de función renal residual del paciente. La detección de hemocultivos positivos en este caso fue a posteriori, durante el control general de la unidad. Ante la ausencia de clínica y la retirada del foco, no se inició tratamiento antibiótico asociado. Ningún paciente falleció debido a una complicación secundaria a la infección.
DiscusiónLa S. marcescens es un bacilo gramnegativo incluido en la familia Enterobacteriaceae a la que también pertenecen Klebsiella, Proteus o Escherichia. Es una causa importante de infecciones de origen nosocomial como bacteriemias, neumonías e infecciones del tracto urinario. Con frecuencia afecta a pacientes ingresados en UCI y en unidades neonatales10–12. Los brotes nosocomiales en adultos se relacionan comúnmente con colonización de los tractos respiratorio y urinario. Presenta la capacidad de colonizar el tracto gastrointestinal, piel y vehículos inorgánicos de las terapias, así como la de sobrevivir en sustancias desinfectantes. Su presencia en unidades de vigilancia intensiva está descrita y, aunque existen brotes descritos hace más de 20 años en hemodiálisis, su hallazgo en unidades de diálisis es excepcional13,14. En el trabajo publicado en el año 1991, la colonización de los dializadores que se usaban en ese momento fue considerada el origen del brote15. Hoy en día con los métodos de control y esterilización actuales esta posibilidad es muy baja.
La morbimortalidad asociada a bacteriemias secundarias a infección del catéter es elevada, por lo que las medidas de cuidado de los CT son extremas en las unidades de hemodiálisis2,4. Es bien conocido que las tasas de contaminación se reducen en equipos implicados, con buena formación y reentrenamiento periódico; con especial atención en el lavado de manos, como diversos trabajos han puesto de manifiesto16,17. No obstante, pese a todas estas medidas, las bacteriemias acontecen y suponen una de las principales causas de fallecimiento de los pacientes en hemodiálisis. La aplicación de soluciones antisépticas previa a la manipulación de los CT es una práctica aceptada para disminuir los riesgos de infección5,18. La tasa de ataque elevada, la aparición de casos en un breve periodo de tiempo y en varios centros a la vez hizo pensar en la presencia de un vehículo común. Aunque en todos los centros se aplicaban las medidas de prevención convencionales, el hecho de que la fuente de contaminación fuera la solución antiséptica utilizada habitualmente determinó una tasa de contagio elevada. Inicialmente, la alerta de retirada se asoció solo a una concentración de clorhexidina, aunque más tarde fue extendida a todas las concentraciones, dado el origen común. Probablemente este hecho es el que condicionó una mayor prolongación del brote, si bien en el centro 1, se eliminaron todas las concentraciones en la unidad de hemodiálisis, en el centro 2 se mantuvieron otras formulaciones, según recomendaciones de las autoridades sanitarias, hasta la indicación definitiva de la retirada completa de todas las presentaciones de la misma marca.
A su vez, la afectación exclusiva de los pacientes portadores de CT, sin detectar bacteriemia en otros pacientes también con potencial riesgo como pudieran ser los portadores de prótesis de PTFE o en técnica de button-hole, pone de manifiesto la mayor exposición de los pacientes con CT a las soluciones contaminadas.
El germen más frecuentemente implicado en las bacteriemias asociadas a CT es el Staphylococcus aureus, aunque las bacteriemias también pueden ser secundarias a otras bacterias grampositivas, gramnegativas e incluso de origen fúngico7. En general, ante cualquier bacteriemia secundaria a catéteres está indicada su retirada como medida principal19,20. No obstante, en los pacientes en hemodiálisis, portadores de CT, es aceptable el tratamiento farmacológico si no existen criterios de gravedad con el fin de evitar la retirada del CT, dada la condición vital del acceso vascular21. Una situación de sepsis severa, una condición hemodinámicamente inestable, la presencia de infección a otros niveles, la evidencia de tunelitis complicada, la persistencia de fiebre durante 48-72h tras iniciar antibioterapia o el hallazgo de infección por Pseudomonas, Cándida u otras agentes fúngicos, así como la detección de patógenos multirresistentes o ante el hallazgo de un Staphylococcus aureus resistente son criterios de retirada de un CT colonizado22. En nuestras series los pacientes no cumplieron criterios de gravedad y se procedió al tratamiento farmacológico. El mantenimiento del CT es una opción terapéutica razonable si la bacteriemia no se acompaña de criterios de gravedad, tal como algunas guías proponen. En esas condiciones, es aceptable un intento terapéutico durante al menos 2 semanas de antibióticos por vía iv23. Este tratamiento debe incluir, como algunos estudios ya han demostrado, junto al antibiótico sistémico (oral o iv), el sellado del CT21,24.
Es conocido que la presencia de un biofilm en el catéter puede actuar de reservorio, por lo que el tratamiento debe incluir dicho sellado25. En nuestra serie se procedió al tratamiento con pauta iv y sellado de los catéteres con base en el antibiograma, aplicando 2 formulaciones diferentes que mostraron resultados similares. Tanto la ceftazidima como la gentamicina presentan eficacia frente a gramnegativos y, aunque la experiencia con gentamicina es más amplia en diálisis, esta puede presentar mayores efectos secundarios26,27. Aunque las pautas de antibioterapia suelen aconsejar 2 semanas de tratamiento, en el centro 1 se optó por ampliar a 3 semanas ante la incertidumbre de la evolución de un germen atípico22,24. En nuestra serie la evolución fue favorable, sin requerir retirada del CT y sin complicaciones importantes asociadas. Probablemente el tratamiento precoz y la práctica de sellado con antibiótico permitió dicho resultado, una vez se eliminó de las unidades de hemodiálisis la fuente del contaminante.
ConclusionesLa aparición de bacteriemias por un germen no convencional, como es la S. marcescens, debe ponernos sobre aviso en las unidades de hemodiálisis. La colonización de las soluciones antisépticas es excepcional, pero puede ocurrir, por lo que debe ser un vector que analizar en dichas situaciones. El tratamiento debe ser lo más precoz posible y debe incluir el sellado del CT. La retirada del catéter puede no ser necesaria ante la ausencia de criterios de gravedad. La rapidez de actuación, la colaboración de todos los estamentos y la aplicación de las medidas de control son clave para interrumpir la propagación del brote y conseguir una evolución favorable de las infecciones. En esta situación el principal factor de riesgo fue ser portador de un CT, por lo que siempre que sea posible sería recomendable insistir en la reducción del número de CT en las unidades de diálisis.
Conflicto de interesesNinguno.