Existe evidencia suficiente sobre la seguridad a corto plazo en el donante vivo tras el trasplante renal. Sin embargo, las complicaciones a largo plazo continúan siendo un área de estudio en la actualidad, de especial interés en el donante joven. Previamente se han realizado análisis en donantes de edad más avanzada para enfermos renales adultos. Presentamos un estudio de complicaciones a largo plazo en donantes renales para nuestra población pediátrica.
MétodosEstudiamos a largo plazo a los donantes de los 54 trasplantes renales de donante vivo realizados en nuestro servicio desde 1979 hasta junio del 2014. Hemos monitorizado el filtrado glomerular (FG) mediante aclaramiento de creatinina en orina de 24 h, proteinuria en orina de 24 h y el desarrollo de hipertensión arterial (HTA) en los 48 donantes que han presentado un seguimiento mayor de un año. En el análisis de resultados se han incluido tan solo a los 39 pacientes que han sido exclusivamente controlados en nuestro servicio.
ResultadosEl FG mediante aclaramiento de creatinina fue estable tras su descenso inicial. No se observó proteinuria en ninguno de los casos. Se observó enfermedad renal crónica (ERC) avanzada en un paciente, lo cual supuso una incidencia acumulada del 2%, no describiéndose FG menor de 60mL/min/1,73m2 en ningún otro paciente. La HTA fue diagnosticada en el 25% de los donantes, con tratamiento hipotensor en el 90% de ellos.
ConclusionesEl riesgo de ERC y de HTA en donantes renales vivos para receptor pediátrico cuidadosamente monitorizados en su evolución es similar al de la población general por lo que parece tratarse de una técnica segura a corto y largo plazo.
There is enough evidence concerning the short-term safety of living donors after kidney transplantation. However, long-term complications continue to be studied, with a particular interest in young donors. Previous studies have been conducted in older donors for adult renal patients. We present a study of long-term complications in kidney donors for our paediatric population.
MethodsWe carried out a long-term donor study for the 54 living kidney-donor transplantations performed at our department from 1979 to June 2014. We monitored the glomerular filtration rate (GFR) on the basis of 24-hour urine creatinine clearance, 24-hour proteinuria and the development of arterial hypertension in the 48 donors who were followed up for more than one year. Only the 39 patients who were exclusively followed up by our department have been included in the results analysis.
ResultsGFR through creatinine clearance was stable after an initial decrease. No proteinuria was observed in any of the cases. One patient developed chronic kidney disease (CKD), which resulted in a cumulative incidence of 2%. GFR below 60mL/min/1.73 m2 was not reported in any other patients. Arterial hypertension was diagnosed in 25% of donors, 90% of which were treated with antihypertensives.
ConclusionsRisk of CKD and hypertension in living kidney donors for paediatric recipients, who are carefully monitored throughout their evolution, is similar to that of the general population. Therefore, this technique appears to be safe in both the short and long term.
El trasplante renal de donante vivo (TRDV) es el tratamiento de elección para el niño con enfermedad renal crónica avanzada. Reduce el tiempo de espera al trasplante, la morbimortalidad y mejora la supervivencia tanto del injerto como del receptor1,2. En los últimos años su frecuencia ha aumentado por varios motivos. Por un lado debido al aumento de la prevalencia de la enfermedad renal crónica avanzada3 y por un descenso en el número de donantes en muerte encefálica idóneos (factor que afecta especialmente a los niños)4 y, por otro lado, por la mejora en la seguridad del procedimiento para el donante5, consiguiendo minimizar los riesgos a corto plazo de la cirugía con el uso de la laparoscopia. No obstante, siendo el objetivo primario del TRDV garantizar la seguridad del donante, la comunidad científica se ha interesado recientemente en las posibles complicaciones a largo plazo, como consecuencia de su situación posterior de monorreno.
Hasta la fecha han predominado estudios de cohorte, retrospectivos, y de escaso tiempo de seguimiento en los que la supervivencia del donante renal parece ser igual a la población general cuando no más larga6. Sin embargo, recientemente se han incluido estudios de más larga duración y con población especialmente sana comparable con la población de donantes renales, en los que se describe un aumento de la incidencia de patología renal crónica y de la mortalidad a largo plazo7-13.
Por tanto, el riesgo de complicaciones a largo plazo es un área de estudio de especial interés en el trasplante pediátrico pues los donantes suelen ser los padres, en general jóvenes4, y con una alta probabilidad de mayor supervivencia. Esto les va a exponer al desarrollo de patología general con daño renal y a la ocurrencia de complicaciones derivadas de su situación de monorrenos.
El objetivo de este estudio es evaluar las consecuencias a largo plazo de la nefrectomía en nuestra población de donantes para TRDV realizadas en nuestro Servicio de Nefrología Pediátrica. A ese efecto hemos analizado la evolución del filtrado glomerular (FG), la medida de la presión arterial (PA), la incidencia de hipertensión arterial (HTA), y la existencia de proteinuria o microalbuminuria de forma periódica como indicadores de patología renal durante su seguimiento.
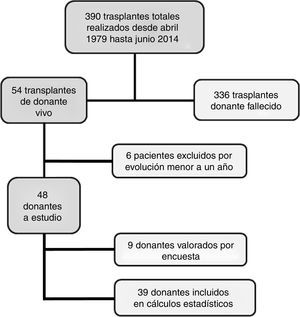
Material y métodosPresentamos un estudio de cohorte, prospectivo y unicéntrico. Desde abril de 1979 en que se inicia nuestro programa de trasplante renal pediátrico hasta junio del 2014 se han realizado en nuestro servicio 390 trasplantes, de los que 54 han sido con donante vivo. Todos ellos emparentados, 30 madres, 22 padres, un hermano y una tía.
Del grupo total de 54 donantes, 6 donantes han sido excluidos por tener un tiempo de seguimiento menor de un año al cierre del estudio en junio del 2014. Así, 48 donantes forman el grupo inicial con un año de seguimiento mínimo. La edad mediana de los donantes ha sido de 38 años (18-51) y el tiempo mediano de seguimiento de 12,5 años (1-30). De este grupo de 48 donantes, en 9 de ellos hemos valorado su evolución y estado final mediante encuesta telefónica y/o personal dada su residencia fuera de nuestra área. Hemos comprobado su evolución y estado clínico al cierre del estudio mediante la historia y la valoración de la analítica realizada, descartando patología general, renal y definiendo su estado funcional final. Sin embargo, no hemos incluido estos pacientes en el análisis estadístico al no haber sido realizado por nosotros el control clínico, ni los exámenes realizados, por lo que el análisis se centra en los 39 donantes restantes (fig. 1).
El consentimiento informado se ha obtenido de todos ellos y el estudio ha sido aprobado por el comité ético de nuestro hospital.
Tanto el estudio prenefrectomía de los donantes para la valoración de su estado clínico, como el estudio y seguimiento posterior se realiza en nuestro Servicio de Nefrología Pediátrica. En el estudio previo se excluye patología renal, sistémica y/o psicológica que contraindique la donación, siendo confirmada su idoneidad por el Servicio de Medicina Interna según las guías recomendadas para ello14. Hasta el momento actual, han sido descartados hasta un 40% de posibles donantes por motivos médicos y/o psicológicos como consecuencia de la estricta valoración realizada. Posteriormente, se cumple un protocolo de seguimiento posdonación que incluyen visitas periódicas para entrevista médica, controlando y descartando otras patologías sistémicas como dislipidemia, diabetes u obesidad que puedan repercutir de forma negativa en la evolución renal. Realizamos igualmente un control periódico de la PA, cálculo del FG e investigación de la presencia de proteinuria. La periodicidad es trimestral el primer año y posteriormente anual o bianual, coincidiendo con las revisiones del receptor.
La PA se mide mediante 3 tomas sucesivas en estado de reposo en consulta externa hospitalaria y mediante monitorización ambulatoria. Definimos HTA como PA sistólica de 140mmHg o mayor, PA diastólica de 90mmHg o mayor y/o tratamiento con hipotensores6.
El FG se estima mediante cálculo del aclaramiento de creatinina (CCr) en orina de 24 h corregido por superficie corporal (mL/min/1,73 m2). La proteinuria se estudia en orina de 24 h y se define como > 300mg/día, considerando microalbuminuria la proteinuria urinaria entre 30 y 300mg/día.
Se exponen los datos con su mediana ± desviación estándar y/o rango. La significación estadística de datos no paramétricos fue analizada con la prueba de la t de Student. La incidencia acumulada se expresa de forma porcentual (tabla 1).
Resultados
| Donantes TRDV (n=39) | |
|---|---|
| Edad mediana (máx-mín) (años) | 38 (18-51) |
| Masculino/femenino (n) | 22/17 |
| Emparentados (%) | 100 |
| Tiempo mediano seguimiento (máx-mín) (años) | 12,5 (1-30) |
| FG (CCr) (ml/min/1,73m2) | |
| Pre-1 año-5 años-10 años-15 años | 128-101-100-98-110 |
| Cr sérica (mg/dL) | |
| Pre-1 año-5 años-10 años-15 años | 0,86-1,06-1,03-1,03-1,07 |
| PAS/PAD (mmHg) | |
| Pre-1 año-5 años-10 años-15 años | 111/70-116/73-118/74-126/80 |
| Microalbuminuria (μg/min) | |
| Pre-1 año-5 años-10 años-15 años | 2,1-8,2-19,7-35,4-35,9 |
La muestra se refiere a los 39 donantes con datos completos recogidos en nuestro centro.
CCr: aclaramiento de creatinina; FG: filtrado glomerular; n: muestra; PAD: presión arterial diastólica; PAS: presión arterial sistólica; TRDV: trasplante renal donante vivo.
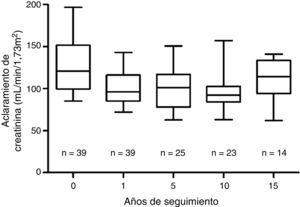
El parámetro más estable a lo largo del tiempo ha sido el CCr. La media pretrasplante ha sido de 128mL/min/1,73 m2 ± 30mL/min/1,73 m2. Tras una disminución inicial sobre el valor prenefrectomía, al año del trasplante el FG queda estabilizado en 100mL/min/1,73m2 ± 20mL/min/1,73m2, estabilidad que se mantiene durante los 15 años de seguimiento (fig. 2). En ningún caso se ha observado un CCr inferior a 60mL/min/1,73 m2. No se ha detectado proteinuria, definida como albuminuria>300mg/día en ninguno de los donantes.
Por entrevista telefónica y posteriormente personal se ha constatado un caso de enfermedad renal terminal (ERT). Se trata de un paciente no controlado por iniciativa propia, en el que se constata a los 18 años de la nefrectomía en control ambulatorio una HTA, proteinuria y dislipidemia. Rechaza el tratamiento y un seguimiento controlado posterior. Presenta una insuficiencia renal progresiva con necesidad de diálisis a los 28 años posnefrectomía, recibiendo un trasplante renal a los 60 años de edad (33 años posnefrectomía). El receptor (hijo) mantiene en la actualidad una normalidad funcional del injerto tras 33 años del trasplante con una creatinina inferior a 1mg/dl, siendo su patología de base una displasia renal con uropatía malformativa.
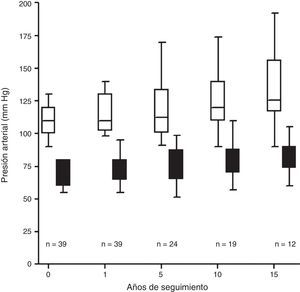
Hipertensión arterialPrevia a la donación, la presión sistólica media ha sido de 118±19mmHg y la presión diastólica media de 74±12mmHg. A lo largo del seguimiento aumenta la PA con criterio diagnóstico de HTA en 10 de los 39 donantes estudiados (25%) (fig. 3), prescribiendo tratamiento farmacológico hipotensor en el 90% de ellos.
DiscusiónNuestro análisis muestra una estabilidad del FG en nuestra población de estudio durante los 15 años de seguimiento, tras un descenso inmediato inicial atribuido a la pérdida de parénquima renal y observado habitualmente en otras series15. Hemos visto progresión a ERT en un caso de los 48 donantes, lo cual supone una incidencia acumulada del 2,01%. Este paciente denegó seguimiento y tratamiento con necesidad de terapia sustitutiva renal 28 años posnefrectomía, como se ha comentado. Ningún otro paciente ha presentado FG menor a 60mL/min/1,73 m2, siendo la prevalencia de ERC en estadio 3-4 menor del 3,3% descrito para población general de similares características16.
La evolución de este donante a la ERT, sin ninguna patología de base relacionada con la ERT del receptor y supuestamente en relación con la noxa inducida por la hipertensión, la dislipidemia y la obesidad que fue constatada en su evolución, fundamenta y confirma la necesidad de un control estricto de los donantes posnefrectomía que pueda prevenir, controlar y tratar estas situaciones con el fin de evitar o cuanto menos retrasar la evolución a una ERT.
Numerosos estudios previos, mayoritariamente en población norteamericana, han evaluado la función renal, describiendo prevalencias de ERT entre el 0,15 y el 0,87% y de ERC entre el 5,2 y el 14,5%7,9,15,17-19. Gran parte de estos estudios se basan en cohortes retrospectivas extraídas de registros estatales de trasplante, de escaso tiempo de evolución y en referencia a población general como grupo control. Sin embargo, la comunidad donante es población especialmente sana por lo que recientemente se han incorporado resultados de estudios cuyo grupo control de referencia ha escogido población especialmente seleccionada, más comparables con las características de salud de una población de donantes20-22. Mjoen et al. muestran una incidencia acumulada de ERC del 0,31% en su cohorte prospectiva de 1.901 donantes noruegos con una media de seguimiento larga de 15 años y con una hazard ratio de 11,4 en comparación con una población control especialmente sana. En la misma dirección, Muzaale et al. observan una incidencia acumulada de ERC del 0,31% en donantes vivos respecto a un 0,03% en el grupo control sano.
La incidencia acumulada de HTA en nuestro estudio es del 25%, inferior a la observada en población general en el mismo rango de edad reflejado por Banegas en un estudio transversal en población española23. Con un seguimiento activo todos nuestros pacientes eran conscientes de su hipertensión, controlada con tratamiento médico hipotensor en un 90% de los hipertensos. En estudios realizados en donantes renales también se describen prevalencias de HTA comparables con población general15,17.
La comunidad trasplantadora ha expresado su preocupación sobre las complicaciones a largo plazo que se puedan derivar de la donación renal. En los últimos años, la preocupación se ha focalizado de una manera importante en el donante joven24,25. Ellos se encontrarán expuestos durante más tiempo a la disminución en su parénquima renal y a las complicaciones que de ello se pueda derivar. Además, al tener una alta probabilidad de supervivencia, presentaran un riesgo mayor para el desarrollo de patología médica que pueda ocasionar una nefropatía evolutiva. En este sentido, Gibney et al. describen en 2008 un mayor riesgo de ERT en sus donantes menores de 35 años25. Nuestros pacientes en ERT son pediátricos y tienen donantes con una edad mediana de 38 años, siendo hasta 13 años más jóvenes que los donantes para pacientes adultos4. Son, por tanto, una cohorte de gran interés para el estudio de las complicaciones renales a largo plazo en este colectivo.
Si bien nuestro estudio presenta un corto número de donantes respecto a series publicadas para trasplante en el adulto, su larga duración y su carácter prospectivo lo hacen especialmente interesante en la valoración del riesgo de HTA y/o desarrollo de ERC. Su carácter unicéntrico, tanto el estudio pre y posnefrectomía, se realiza en nuestro servicio de Nefrología Pediátrica, otorga uniformidad y homogeneidad en la recogida y recopilación de las variables clínicas y analíticas del estudio. De este modo se han descartado los datos de los 9 donantes no controlados directamente por nosotros, valorando únicamente su estado final respecto a su situación clínica.
En conclusión, nuestros resultados muestran que la incidencia de ERC, HTA y de sobrecarga funcional renal en el donante puede ser similar al visto en población general y que la donación renal para el enfermo renal pediátrico es razonablemente segura si está asociada a un control estricto previo y posterior a la nefrectomía que permita el diagnóstico, control y tratamiento precoz de posibles complicaciones. Sin embargo, la mayor probabilidad de supervivencia respecto a los donantes para receptor adulto exige estudios con tiempo de seguimiento mayor que permitan confirmar esta seguridad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.