El interés principal en el desarrollo de nuevos inmunosupresores para el trasplante renal no sólo radica en la mejora de los resultados a corto plazo, sino también en un mejor perfil de seguridad, una menor nefrotoxicidad y un mejor perfil cardiovascular y metabólico. Belatacept es una proteína de fusión que bloquea la coestimulación de los linfocitos al unirse a los antígenos CD80 y CD86. En los estudios clínicos, especialmente BENEFIT y BENEFIT-EXE, se ha demostrado que belatacept preserva la función y la estructura del injerto renal y que sus efectos se mantienen a largo plazo. En comparación con los inhibidores de la calcineurina, belatacept se asocia a una menor incidencia de nefropatía crónica del injerto y ofrece un perfil cardiovascular y metabólico más favorable. Su eficacia y seguridad se mantienen en trasplantes renales de donantes con criterios ampliados.
The development of new immunosuppressants for renal transplantation is aimed not only at improving short-term outcomes, but also at achieving better safety, cardiovascular, and metabolic profiles and at decreasing nephrotoxicity. Belatacept is a fusion protein that inhibits T cell activation by binding to CD80 and CD86 antigens. Clinical trials, particularly the BENEFIT and BENEFIT-EXT studies, have shown that belatacept preserves function and structure in renal grafts. The effects of belatacept provide long-term, sustained results, and the safety and efficacy of this drug have been demonstrated in cases of renal transplantation from expanded criteria donors. Compared to calcineurin inhibitors, belatacept is associated with a lower incidence of chronic allograft nephropathy and a more favourable cardiovascular and metabolic profile.
INTRODUCCIÓN
El objetivo de la inmunosupresión en el trasplante renal es prevenir y tratar el rechazo agudo y evitar la lesión crónica del injerto, minimizando los efectos adversos de los inmunosupresores. La introducción de ciclosporina, tacrolimus y micofenolato mofetil (MMF) disminuyó el rechazo agudo y aumentó la supervivencia a corto y medio plazo del injerto1,2, como lo confirman datos de la Red de Obtención y Trasplante de Órganos (OPTN) y el Registro Científico de Receptores de Trasplantes (SRTR) de Estados Unidos3 y del Grupo Español de Estudio de la Nefropatía Crónica del Trasplante4.
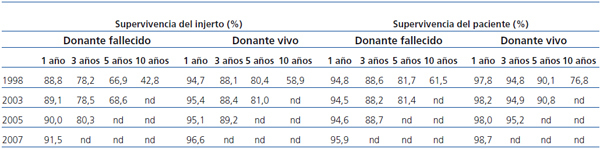
No obstante, la disminución de la tasa de rechazo agudo no se ha correspondido con una mayor supervivencia del injerto a largo plazo5. Los datos del informe de OPTN/SRTR 2009 no muestran diferencias significativas con el tiempo (tabla 1)3. Por lo tanto, sigue siendo necesario buscar estrategias para aumentar la supervivencia a largo plazo del injerto y del paciente.
La disfunción crónica del injerto continúa siendo una causa frecuente de pérdida del injerto. En el estudio epidemiológico español ICEBERG, un 55,5% de los pacientes presentó una nefropatía crónica del aloinjerto durante un seguimiento medio de 8 años6. En un estudio español con 1029 receptores de un trasplante renal durante el período 1997-2007, no se hallaron diferencias significativas en la supervivencia del injerto a 5 y 10 años al incluir en el análisis sólo los injertos que sobrevivieron más de 12 meses7. En una segunda fase del estudio del Grupo Español para el Estudio de la Nefropatía Crónica del Trasplante se incluyó también a los pacientes que recibieron un trasplante renal en 20028. A los 12 meses del trasplante, la media del filtrado glomerular (FG) calculado (FGc) fue de 51,7 ± 18,8 ml/min/1,73 m2. Durante un seguimiento medio de 74,0 ± 43,9 meses, se observó una media de reducción del FGc de –1,6 ± 6,24 ml/min/año. Esta reducción fue más acentuada en los pacientes tratados con ciclosporina (n = 3163) en comparación con los tratados con tacrolimus (n =1044) y, sobre todo, con los que no recibieron inhibidores de la calcineurina (n = 133, fármacos no especificados)9.
La enfermedad cardiovascular después del trasplante renal ha sido investigada por el grupo español Forum Renal, que creó una base de datos prospectiva y multicéntrica con 2600 trasplantados renales durante el período 2000-2002. La tasa de rechazo agudo a los 12 meses fue del 14,8%. A los 4 años, la supervivencia del injerto y la del paciente fueron del 85,6 y 91,7%, respectivamente. La causa principal de muerte fue la enfermedad cardiovascular, sobre todo la enfermedad coronaria durante el primer año. Las causas principales de pérdida del injerto fueron las siguientes: la enfermedad vascular y la trombosis el primer año, la muerte con injerto funcionante el segundo y tercer años y la nefropatía crónica del aloinjerto el cuarto año10.
Además de la nefropatía crónica del aloinjerto y la morbimortalidad cardiovascular, la morbimortalidad infecciosa11, las complicaciones metabólicas12 y la elevada frecuencia de tumores también impiden que los resultados sean totalmente satisfactorios a largo plazo13.
El interés principal en el desarrollo de nuevos inmunosupresores ya no radica sólo en la mejora de los resultados a corto plazo, sino también en un mejor perfil de seguridad, una menor nefrotoxicidad y un mejor perfil cardiovascular y metabólico14. Además, la tolerabilidad y los efectos adversos de los inmunosupresores son tan importantes como su eficacia, sobre todo teniendo en cuenta que los receptores de un trasplante renal son cada vez de mayor edad y con comorbilidades cardiovasculares asociadas15.
NUEVOS INMUNOSUPRESORES PARA EL TRASPLANTE RENAL
Las pautas actuales de inmunosupresión están orientadas a bloquear la activación, proliferación y función de los linfocitos T16. La activación y proliferación de los linfocitos T depende de tres señales. La primera señal está dada por la interacción entre el receptor del LT y moléculas de clase II expresadas en las células presentadoras de antígenos (CPA). A este nivel se activa la calcineurina y es donde actúan los inhibidores de la calcineurina, como ciclosporina y tacrolimus. La segunda señal, o señal coestimuladora, depende de la interacción de CD80/86 en la CPA con CD28 expresado en la superficie del LT. Belatacept inhibe esta interacción. La primera y la segunda señal activan vías de transducción que generan factores de transcripción para la síntesis de citoquinas. Entre ellas, destaca la interleucina 2 (IL-2), que induce la tercera señal y permite la proliferación clonal de los linfocitos T (a este nivel es donde actúan los inmunosupresores que interfieren en el ciclo celular). Se han desarrollado una serie de estrategias para mejorar los resultados del trasplante renal con los inmunosupresores clásicos13,17-26, pero la nefropatía crónica del injerto y el riesgo cardiovascular y metabólico obligan a seguir buscando alternativas.
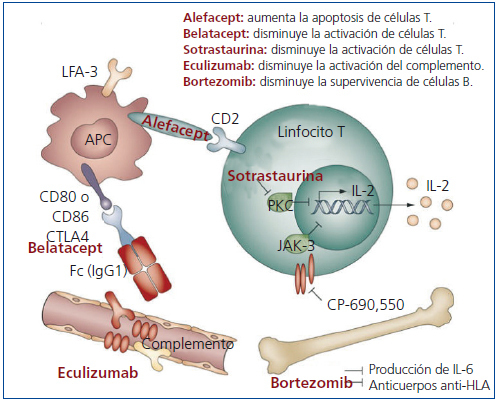
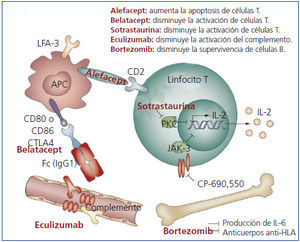
Diversos fármacos y agentes biológicos están siendo evaluados en ensayos clínicos o han sido aprobados recientemente para su uso en la inmunosupresión en el trasplante renal. Estos nuevos inmunosupresores tienen mecanismos de acción distintos. Algunos inhiben enzimas como la proteína cinasa C (PKC) o la cinasa Janus 3 (JAK3), y otros actúan sobre puntos clave de las vías implicadas en la activación de los linfocitos, como la vía CD28-CD80/86 o la LFA3-CD227 (figura 1).
Sotrastaurina es un inhibidor potente y selectivo de las isoformas clásicas (α y β) y nuevas (δ, ϵ, η y θ) de la PKC. Estas isoformas tienen una función clave en la primera y segunda señal de la activación de los linfocitos T. Su inhibición por sotrastaurina bloquea la activación inicial de los linfocitos T, aunque sin afectar a la proliferación linfocitaria mediada por la IL-228. Dos estudios de fase II se interrumpieron debido a un aumento del rechazo agudo14,29. En un estudio de fase II, sotrastaurina se comparó con tacrolimus en 125 pacientes que recibieron un trasplante renal de novo. A los 3 meses, sotrastaurina fue significativamente menos eficaz que tacrolimus en el criterio principal de valoración (rechazo agudo comprobado con biopsia, pérdida del injerto, muerte o pérdida para el seguimiento), un 25,7% frente a un 4,5% (p = 0,001). La diferencia en el rechazo agudo, 23,6% con sotrastaurina y 4,5% con tacrolimus (p = 0,003) motivó la interrupción del estudio30.
CP-690550 o tofacitinib (antes tasocitinib) es un inhibidor selectivo de la cinasa JAK3, que tiene un papel clave en la transducción de señales de los receptores de citoquinas31. En estudios de fase II, tofacitinib ha mostrado una eficacia comparable a tacrolimus sobre el rechazo agudo y la función renal14,32. En un estudio piloto, la dosis menor de CP-690550 mostró un perfil de eficacia y seguridad comparables a las de tacrolimus en pacientes que habían recibido un trasplante renal33. Posteriormente, se desarrolló un estudio multicéntrico y aleatorizado en el que 322 pacientes trasplantados renales fueron aleatorizados para recibir CP-690550 o ciclosporina durante 12 meses. La incidencia de rechazo agudo fue similar, aunque las infecciones graves fueron más frecuentes con CP-690550 que con ciclosporina34. Sin embargo, el FGc mejoró con CP-690550 desde el mes 1 y el efecto se mantuvo hasta el final del estudio, con diferencias significativas frente a ciclosporina (p < 0,05 para ambas pautas de CP-690550)35.
Alefacept es un anticuerpo monoclonal humanizado anti-CD2. Es una proteína de fusión LFA3-IgG1 que inhibe la adhesión de los linfocitos T. Los resultados de alefacept en el trasplante renal a primates fueron esperanzadores36, por lo que se empezó a investigar en estudios de fase I y II administrado por vía oral junto a tacrolimus en el trasplante renal. Sin embargo, los resultados de un estudio multicéntrico, aleatorizado, doble ciego y controlado con placebo de fase II con 212 pacientes receptores de un trasplante renal no han confirmado estas expectativas. Alefacept no fue estadísticamente superior al placebo, excepto en la activación de linfocitos T CD4+ y CD8+, sin diferencias en la supervivencia del injerto ni del paciente ni en la función renal37.
BELATACEPT
Belatacept es un bloqueante selectivo de la coestimulación de los linfocitos T. Consiste en una proteína de fusión humana que combina una porción extracelular modificada del antígeno asociado a los linfocitos T citotóxicos 4 (CTLA-4) y el fragmento de la región constante (Fc) de IgG1 humana. Bloquea la señal de coestimulación al unirse a los antígenos CD80 y CD86 de las CPA, y de este modo inhibe la activación completa de los linfocitos T y promueve la anergia y la apoptosis de los linfocitos T. Es un derivado de abatacept, una proteína de fusión eficaz en trastornos autoinmunes como la artritis reumatoide. En la molécula de belatacept hay dos sustituciones de aminoácidos que le confieren mayor avidez de unión a CD80 y CD86, mayor potencia de unión a los linfocitos T y eficacia para la profilaxis del rechazo38.
En junio de 2011, la European Medicines Agency (EMA) aprobó belatacept para su uso combinado con corticosteroides y ácido micofenólico en la profilaxis del rechazo del injerto en pacientes adultos que han recibido un trasplante renal39. Es el primer agente biológico que se aprueba para esta indicación, y desde hace una década el primer inmunosupresor con un nuevo mecanismo de acción.
Belatacept tiene una farmacocinética lineal en voluntarios sanos y receptores de un trasplante renal. Su exposición es proporcional a la dosis, con muy poca variabilidad día a día, predecible a partir de la dosis administrada por vía intravenosa e independiente del sexo, la edad, la raza, la función renal, la albuminemia, la diabetes y el tratamiento con diálisis40. En los ensayos clínicos, la concentración mínima se mantuvo estable hasta 5 años después del trasplante41.
La saturación de los receptores CD86 refleja la inhibición de la alorrespuesta de los linfocitos T. Estudios in vitro demostraron inhibición de la alorrespuesta con la concentración mínima de belatacept necesaria para saturar los receptores CD86. Los niveles de receptores CD86 libres en los pacientes tratados con belatacept son significativamente inferiores a los de antes del tratamiento, así como a los determinados en voluntarios sanos y pacientes tratados con ciclosporina42. En la extensión a 5 años de un estudio de fase II con belatacept o ciclosporina, la saturación de los receptores CD86 con belatacept se mantuvo hasta el final del seguimiento. Sin embargo, la saturación con belatacept cada 4 semanas (74%) era significativamente mayor que con belatacept cada 8 semanas (56%) (p < 0,05)41, confirmando que la saturación de los receptores CD86 depende de la dosis y la frecuencia de administración de belatacept.
Estudios de fase II
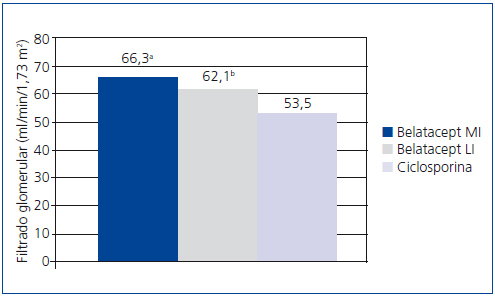
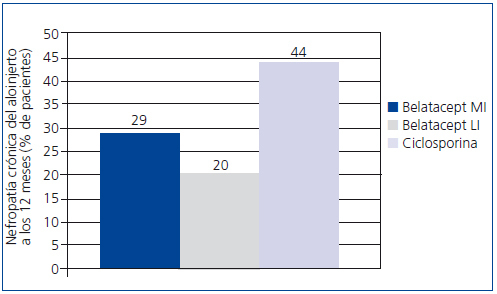
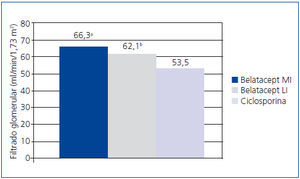
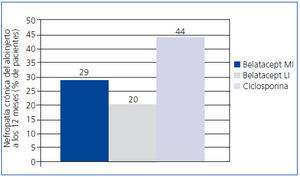
En un estudio aleatorizado, parcialmente ciego y con grupos paralelos, realizado en 22 centros de Europa, Estados Unidos y Canadá con 216 pacientes, se investigó la no inferioridad de belatacept, administrado en una pauta más intensiva (MI) y otra menos intensiva (LI), frente a ciclosporina, para prevenir el rechazo a los 6 meses38. La incidencia de rechazo agudo a los 6 meses fue similar en los tres grupos de tratamiento: 7% con belatacept MI, 6% con belatacept LI y 8% con ciclosporina. No hubo ningún rechazo a partir de los 6 meses. El FG medido (FGm) fue mayor con belatacept a los 12 meses (figura 2). Las mejores correlaciones entre el FGm y el FGc se obtuvieron con el método de Modificación de la Dieta en la Enfermedad Renal (MDRD). La nefropatía crónica del injerto fue menos frecuente con belatacept (figura 3). Los pacientes con nefropatía crónica del injerto que recibieron belatacept tuvieron un FGc mayor que el grupo tratado con ciclosporina. En el perfil cardiovascular y metabólico, la presión arterial y las concentraciones de lípidos en los pacientes tratados con belatacept fueron similares o ligeramente inferiores a las del grupo tratado con ciclosporina, a pesar de que en este grupo se observó un mayor uso de tratamientos antihipertensivos e hipolipemiantes.
El estudio demostró la no inferioridad de belatacept frente a ciclosporina y sugirió que belatacept puede conservar el FG y disminuir la incidencia de nefropatía crónica del injerto38.
Para evaluar la eficacia y seguridad de belatacept a largo plazo, 102 pacientes tratados con belatacept (90%) y 26 tratados con ciclosporina (51%) del estudio anterior completaron 60 meses de tratamiento41. Los porcentajes de participación muestran la buena aceptación de belatacept. La función renal se mantuvo estable durante todo el estudio en los pacientes tratados con belatacept, con un FGc (según el método MDRD) de 75,8 ± 20,1 ml/min/1,73 m2 a los 12 meses del trasplante y 77,2 ± 22,7 ml/min/1,73 m2 a los 5 años. En cambio, el FGc disminuyó en el grupo tratado con ciclosporina (74,4 ± 23,7 ml/min/1,73 m2 a los 12 meses y 59,3 ± 15,3 ml/min/1,73 m2 a los 5 años).
En cuanto a los factores de riesgo cardiovascular, hubo un ligero aumento de la presión arterial sistólica y diastólica entre los 24 y los 60 meses con ciclosporina, con unos valores finales de 138 ± 18,9 mmHg y 83 ± 8,9 mmHg, respectivamente, frente a 125 ± 13,9 mmHg y 76 ± 10,1 mmHg, respectivamente, con belatacept [Nota: no hay p, datos extraídos de la tabla 1 de Vincenti, 2010]. La concentración de colesterol no HDL disminuyó en ambos grupos, aunque el uso de hipolipemiantes fue menor en los pacientes tratados con belatacept. Durante la extensión a largo plazo, la frecuencia de diabetes de nuevo inicio después del trasplante (NODAT) fue similar en ambos grupos.
Las incidencias de muerte/pérdida del injerto y rechazo agudo fueron bajas. La incidencia de infecciones graves fue del 16% con belatacept y del 27% con ciclosporina. Hubo un 12% de neoplasias en ambos grupos, aunque un único caso de trastorno linfoproliferativo postrasplante (TLPT) con ciclosporina y ninguno con belatacept. La enfermedad coronaria fue más frecuente con ciclosporina (un 12% frente a un 2% con belatacept).
El estudio demostró una buena adherencia al tratamiento, una función renal estable, una buena seguridad y una farmacocinética predecible con belatacept durante un seguimiento de 5 años. No hubo nuevos casos de TLPT con belatacept41.
En otro estudio de fase II abierto, aleatorizado y controlado, receptores de un trasplante renal fueron tratados con belatacept/MMF (n = 33), belatacept/sirolimus (n = 26) o tacrolimus/MMF (n = 30) durante 12 meses. La incidencia de rechazo agudo a los 6 meses fue del 12% con belatacept/MMF, 4% con belatacept/sirolimus y 3% con tacrolimus/MMF. La función renal fue mejor con los dos regímenes con belatacept, con un FGc (calculado con la fórmula MDRD) medio 8-10 ml/min/1,73 m2 superior al del grupo con tacrolimus/MMF. No hubo diferencias significativas en la seguridad, incluyendo el perfil de riesgo cardiovascular43.
En este mismo estudio se demostró una potente actividad inhibidora de la combinación de belatacept/sirolimus, que puede ser tan eficaz como un inhibidor de la calcineurina (ICN) para anular las respuestas de los linfocitos T y las específicas de antígeno. Asimismo, en el primer año del estudio, el porcentaje de linfocitos T reguladores (Treg) en el compartimento de los linfocitos T de memoria era significativamente mayor en los pacientes tratados con belatacept/sirolimus. La combinación de depleción de linfocitos T, bloqueo de la coestimulación e inhibición de mTOR parece útil para conservar los Treg e inhibir las respuestas inmunes44.
En otro estudio de fase II abierto y aleatorizado se evaluó el cambio de un ICN (ciclosporina o tacrolimus) por belatacept o la continuación con el ICN en 175 pacientes que habían recibido un trasplante renal entre 6 y 36 meses antes y mostraban una función del injerto estable. A los 12 meses, se habían producido 6 casos de rechazo agudo en los pacientes convertidos a belatacept, pero sin pérdida del injerto. La supervivencia del injerto fue del 100% en el grupo tratado con belatacept y del 99% en el grupo tratado con un ICN. Con belatacept hubo un aumento medio del FGc (calculado con la fórmula MDRD) de 7,0 ± 11,99 ml/min/1,73 m2, mientras que con un ICN fue de 2,1 ± 10,34 ml/min/1,73 m2 (p = 0,0058). El cambio de un ICN a belatacept mejoró la función renal y se asoció a una tasa baja de rechazo agudo45.
Para averiguar si los beneficios de belatacept se mantenían a más largo plazo, se amplió a 2 años el seguimiento de 162 pacientes del estudio anterior. El FGc medio fue mayor con belatacept (62,0 ml/min/1,73 m2) que con un ICN (55,4 ml/min/1,73 m2). El cambio medio en el FGc desde el inicio del estudio fue muy superior con belatacept (8,8 ml/min/1,73 m2) comparado con los inhibidores de la calcineurina (0,3 ml/min/1,73 m2). El beneficio de belatacept sobre la función renal se observó en los pacientes tratados previamente con ciclosporina (7,8 ml/min/1,73 m2) o con tacrolimus (8,9 ml/min/1,73 m2) y fue independiente de la función renal al inicio del estudio. Hubo también diferencias en la incidencia de rechazo agudo, que con belatacept fue del 4,9% y sólo en el primer año, mientras que con un ICN fue del 3,7% y todos en el segundo año. El perfil de seguridad fue similar y no hubo casos de TLPT46.
Estudios de fase III
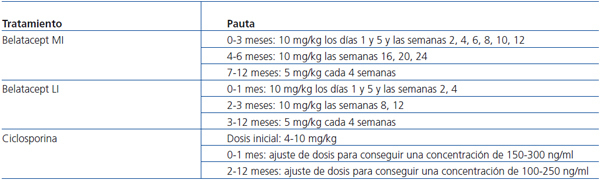
En el estudio internacional BENEFIT (Belatacept Evaluation of Nephroprotection and Efficacy as First-line Immunosuppression Trial), se compararon una pauta MI y otra LI de belatacept frente a ciclosporina (tabla 2) como inmunosupresores de mantenimiento en 666 pacientes con un trasplante renal. Los criterios principales de evaluación fueron la supervivencia del paciente y del trasplante, así como un criterio compuesto de deterioro renal y la incidencia de rechazo agudo. A los 12 meses, la supervivencia del paciente/injerto fue similar en los tres grupos de tratamiento (95, 97 y 93%, respectivamente). Sin embargo, la función renal fue significativamente mejor con ambas pautas de belatacept. El criterio compuesto de deterioro renal se alcanzó en un 55 y un 54% de pacientes con belatacept MI y LI, respectivamente, frente a un 78% con ciclosporina (p ¿ 0,001 para MI o LI frente a ciclosporina). El FGm fue 65 ml/min/1,73 m2 y 63 ml/min con belatacept MI y LI y 50 ml/min/1,73 m2 con ciclosporina (p ≤ 0,001 para MI o LI frente a ciclosporina). El FGc se calculó con la fórmula MDRD. El rechazo agudo fue más frecuente con belatacept (un 22% con MI y un 17% con LI) que con ciclosporina (7%). La seguridad fue similar con ambos fármacos, aunque hubo más casos de TLPT con belatacept47.
En el estudio de fase III BENEFIT-EXT (Belatacept Evaluation of Nephroprotection and Efficacy as First-line Immunosuppression Trial-EXTended criteria donors), se incluyó a 543 receptores de un trasplante renal que recibían riñones de donantes con criterios ampliados. Los criterios principales de evaluación fueron los mismos que en el estudio BENEFIT. No hubo diferencias significativas en la supervivencia del paciente/injerto: un 71% con MI, un 77% con LI y un 85% con ciclosporina (p = 0,002 para MI frente a ciclosporina y p = 0,06 para LI frente a ciclosporina). La función renal fue significativamente mejor con belatacept, con un FGc entre 4 y 7 ml/min/1,73 m2 superior (p = 0,008 para MI frente a ciclosporina y p = 0,1039 para LI frente a ciclosporina). El perfil cardiovascular y metabólico fue mejor con belatacept. La incidencia de rechazo agudo fue similar (un 18% con MI y LI y un 14% con ciclosporina)48.
El análisis conjunto de los datos de BENEFIT y BENEFIT-EXT a los 2 años de tratamiento incluyó a 840 pacientes. La proporción de pacientes supervivientes con un injerto funcional fue similar en todos los grupos de tratamiento. Belatacept continuó siendo superior a ciclosporina en la función renal, con un FGc 16-17 ml/min/1,73 m2 superior en BENEFIT y 8-10 ml/min/1,73 m2 superior en BENEFIT-EXT comparado con ciclosporina. Hubo muy pocos episodios de rechazo agudo en el segundo año de los estudios. El perfil cardiovascular y metabólico con belatacept fue mejor que con ciclosporina. La incidencia de TLPT es mayor en los pacientes con serología negativa para el virus de Epstein-Barr (EBV–), por lo que se analizó específicamente la eficacia en los pacientes EBV+ y los resultados coincidieron con los de la población del estudio en conjunto. No se observaron efectos adversos nuevos. Los autores concluyeron que la pauta LI de belatacept es preferible a la MI por su equilibrio entre eficacia y seguridad49.
Los resultados a los 3 años en ambos estudios mostraron que belatacept mantiene su efecto a largo plazo, con una supervivencia del paciente y del injerto elevadas50, incluso en pacientes cuyo injerto procedía de un donante con criterios ampliados51.
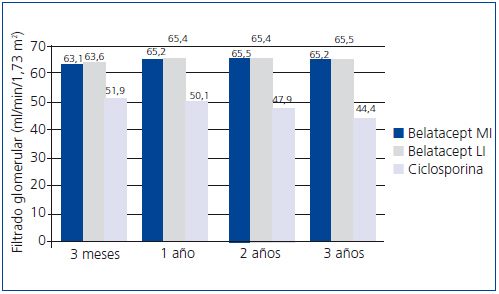
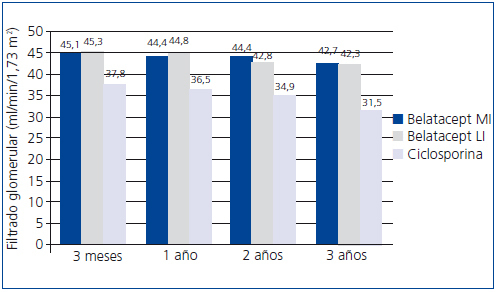
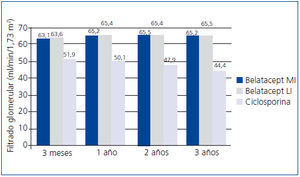
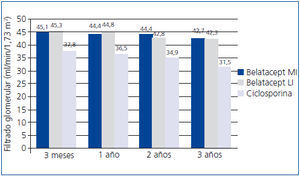
En el estudio BENEFIT, desde el tercer mes la función renal era mejor con belatacept que con ciclosporina y este hallazgo se mantuvo durante los 3 años. El tratamiento con belatacept se asoció a una mayor probabilidad de una mejor función renal52. En el análisis conjunto de los datos de la función renal en los estudios BENEFIT y BENEFIT-EXT, se demostró la superioridad de belatacept (figura 4 y figura 5). El cambio en el FGc medio (medida como ml/min/año) entre el mes 3 y el 36 fue 1,0 (belatacept MI), 1,2 (belatacept LI), y –2,0 (ciclosporina) en BENEFIT y –0,9, –0,6 y –1,9, respectivamente, en BENEFIT-EXT. Los casos de insuficiencia renal crónica avanzada (FGc < 30 ml/min) fueron más frecuentes con ciclosporina en ambos estudios: un 20% en BENEFIT y un 44% en BENEFIT-EXT, en comparación con belatacept MI o LI: 9% y 10% en BENEFIT y 27% y 30% en BENEFIT-EXT53. En otro análisis, se compararon los resultados de la función renal según el tipo de donante (fallecido o vivo) y no se hallaron diferencias entre ambas poblaciones en la mejora del FG en los pacientes tratados con belatacept54.
Seguridad de belatacept
Los estudios clínicos han demostrado la buena tolerabilidad de belatacept. El perfil de seguridad de belatacept se evaluó con un análisis de los datos agrupados de los tres estudios clave de belatacept en pacientes sometidos a un trasplante renal38,47,48. Se analizaron los datos de 1425 pacientes con un seguimiento medio de 2,4 años. Con belatacept LI, la incidencia de muerte (5%) fue menor que con ciclosporina o belatacept MI (7% con cada uno de los tratamientos), así como la frecuencia de neoplasias (32% frente a 36 y 37%, respectivamente). La frecuencia de infecciones fue similar con belatacept y ciclosporina. Se detectó un caso de leucoencefalopatía focal progresiva en un paciente tratado con belatacept a dosis superiores a las recomendadas y que recibía además un antagonista de los receptores de IL-2, MMF y corticosteroides. La tolerabilidad a la infusión fue buena, lo que facilitó el cumplimiento terapéutico, y no se comunicaron casos de anafilaxis ni hipersensibilidad. Según los resultados de este análisis, el régimen LI es preferible al MI55, ya que se asocia a un mejor perfil de seguridad y el régimen MI no resulta en una eficacia mayor que el LI.
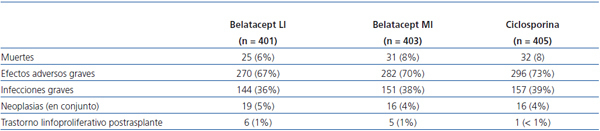
El estudio del perfil de seguridad de belatacept a los 3 años de tratamiento en los estudios BENEFIT y BENEFIT-EXT incluyó los datos de 1209 pacientes. Belatacept LI se asoció a un menor número de muertes y de infecciones graves comparada con belatacept MI y ciclosporina (tabla 3)56. El riesgo de TLPT con belatacept (un 1% con cada pauta) se encuentra dentro de la incidencia esperable para el trasplante renal57 y disminuyó a partir de los 18 meses.
En los estudios de fase II y III se han detectado casos de TLPT. Hubo 16 casos de TLPT: 8 con MI (2%), 6 con LI (1%) y 2 con ciclosporina (0,4%), con 9 casos de afectación del sistema nervioso central (SNC) en los pacientes tratados con belatacept (6 con MI y 3 con LI)55. El riesgo fue mayor en los primeros 18 meses de tratamiento, en pacientes que recibieron el régimen MI de belatacept y en aquellos con serología EBV– en el momento del trasplante. En un análisis posterior de biopsias evaluadas por un patólogo central, se observó que, en dos de los casos descritos como TLPT del injerto, ambos en pacientes del grupo LI, el diagnóstico era de rechazo agudo en un caso, y de proliferación inespecífica de células T en el otro55.
Los inhibidores de la calcineurina aumentan el riesgo de infección por citomegalovirus (CMV) al inhibir los linfocitos T de memoria específicos. Los resultados de estudios in vitro y en voluntarios seropositivos para CMV indican que belatacept protege del rechazo del trasplante, pero no altera la respuesta de los linfocitos T de memoria específicos de CMV. En consecuencia, belatacept no aumenta el riesgo de infección por CMV58, cuya coinfección con EBV se sabe que es un factor de riesgo para el desarrollo de TLPT.
El perfil de riesgo cardiovascular de belatacept puede ser más favorable que el de los inmunosupresores actuales. En los estudios BENEFIT y BENEFIT-EXT, belatacept mostró ser superior a ciclosporina en los parámetros evaluados59. La presión arterial sistólica media era 6-9 mmHg inferior y la presión arterial diastólica media fue 3-4 mmHg inferior en los pacientes tratados con belatacept comparados con los tratados con ciclosporina (p ≤ 0,002).
El colesterol no HDL era inferior con belatacept (p < 0,01 con belatacept MI o LI comparados con ciclosporina en ambos estudios), así como los triglicéridos séricos (p < 0,02 con belatacept MI o LI comparados con ciclosporina en ambos estudios).
En un análisis agrupado especificado con anterioridad, NODAT fue significativamente menos frecuente con belatacept MI o LI (5%) que con ciclosporina (10%) (p < 0,05 para belatacept MI o LI comparados con ciclosporina). Los resultados de BENEFIT y BENEFIT-EXT mostraron que belatacept posee un perfil cardiovascular y metabólico mejor que el de ciclosporina59.
En uno de los estudios de fase II, antes de la infusión de belatacept se obtuvieron muestras de sangre al menos cada 12 meses y se analizaron con un inmunoensayo de electroquimioluminiscencia sensible y validado para la detección de anticuerpos antibelatacept dirigidos contra la molécula entera o contra la porción CTLA-4 modificada de belatacept. Se detectó este tipo de anticuerpos en seis pacientes tratados con la pauta de 4 semanas y en diez de los tratados con la pauta de 8 semanas, aunque en la última visita del estudio sólo permanecían positivos dos en el primer grupo y seis en el segundo. Dos de los pacientes del grupo de 8 semanas desarrollaron anticuerpos neutralizantes, pero ambos continuaron el tratamiento. En ninguno de los pacientes con anticuerpos antibelatacept se produjo una pérdida del injerto o un rechazo agudo, y ninguno de ellos murió ni sufrió efectos adversos graves autoinmunes o relacionados con la infusión41.
A diferencia del resto de los inmunosupresores utilizados como tratamiento de base en el trasplante de órganos, belatacept no requiere monitorización de niveles, ya que no es un fármaco de estrecho margen terapéutico.
El riesgo de interacciones con otros fármacos es muy bajo, ya que, a diferencia del resto de los inmunosupresores utilizados en trasplante, belatacept es una proteína de fusión que no se metaboliza por las enzimas del citocromo P450 (CYP) ni por las UDP-glucuronosiltransferasas40.
COMENTARIOS
Belatacept es el primer fármaco de una nueva clase de inmunosupresores. Los datos de los ensayos clínicos comparativos con ciclosporina señalan una eficacia similar, pero belatacept preserva la función y la estructura del injerto renal, y se asocia a una menor incidencia de nefropatía crónica del injerto. En la extensión a largo plazo, la función renal se mantuvo estable, lo que contrasta con la disminución anual de 1-3 ml/min/m2 que suele observarse con los inhibidores de la calcineurina a dosis estables, y concuerda con los resultados del primer año41,60. La dosis recomendada en la fase inicial es de 10 mg/kg los días 1 (antes de la intervención), 5, 14 y 28 y al final de las semanas 8 y 12 después del trasplante. En la fase de mantenimiento, la dosis recomendada es de 5 mg/kg cada 4 semanas (± 3 días), empezando al final de la semana 16 después del trasplante39.
Belatacept ofrece un perfil cardiovascular y metabólico más favorable que el de los inhibidores de la calcineurina. Según los resultados de una revisión sistemática de estudios aleatorizados y controlados, los pacientes tratados con belatacept tienen un 69% menos de probabilidades de morir, en comparación con los tratados con tacrolimus61. La enfermedad cardiovascular es la causa más frecuente de muerte en pacientes con un trasplante de riñón e injerto funcionante. En los ensayos clínicos como BENEFIT y BENEFIT-EXT, la incidencia de NODAT con belatacept ha sido inferior a la de los inhibidores de la calcineurina, y belatacept ha demostrado un perfil cardiovascular y metabólico mejor que los inmunosupresores actuales. En resumen, belatacept puede aportar un perfil de riesgo cardiovascular y metabólico mejor que los inmunosupresores actuales.
Los trasplantes renales de donante con criterios ampliados son cada vez más frecuentes por el aumento de la demanda de órganos. Sin embargo, el riesgo de pérdida o disfunción del injerto es mayor con este tipo de donantes, que suelen ser personas de edad avanzada o con morbilidad asociada. La supervivencia del injerto a un año es inferior a la de injertos de donante sin criterios ampliados y en años posteriores la supervivencia todavía es menor, sobre todo debido a la nefropatía crónica del injerto62,63. El estudio BENEFIT-EXT ha demostrado que belatacept es eficaz en receptores de riñones de donantes con criterios ampliados y su uso en este contexto permitiría evitar la nefrotoxicidad de los inhibidores de la calcineurina41.
En los ensayos clínicos el principal riesgo del tratamiento con belatacept ha sido el TLPT, especialmente en los primeros 18 meses de tratamiento. Se ha propuesto que podría haber una relación con la intensidad de la inmunosupresión, porque en los pacientes tratados con belatacept MI fue más frecuente la afectación del SNC y el riesgo de infecciones del SNC fue mayor. Se propuso que el riesgo de TLPT podría reducirse administrando el régimen de belatacept LI y evitando el tratamiento en pacientes EBV– o con serología desconocida49, ya que el principal factor de riesgo es una serología EBV–, pero también aumentan el riesgo la infección por CMV y la terapia de depleción de linfocitos T. Actualmente, la ficha técnica de belatacept especifica que está contraindicado en pacientes EBV– o con serología desconocida64.
Asimismo, dado que la afectación del SNC en el TLPT es más frecuente con belatacept que con ciclosporina, ha de tenerse en cuenta esta posibilidad ante un paciente trasplantado renal y tratado con belatacept que presenta signos y síntomas neurológicos, cognitivos y conductuales64.
El uso de belatacept como terapia de base en el trasplante renal preserva la función renal y se asocia a una menor incidencia de factores de riesgo cardiovascular y de NODAT. La inclusión de belatacept en los protocolos de inmunosupresión en el trasplante renal puede suponer una mejora importante en la supervivencia del paciente y del injerto.
Puntos clave
- A pesar de contar con inmunosupresores útiles y eficaces en la prevención del rechazo agudo en el trasplante, renal, los resultados a largo plazo son insatisfactorios y se necesitan nuevos tratamientos inmunosupresores que aporten una mayor eficacia y seguridad.
- Belatacept es un inmunosupresor con un mecanismo de acción selectivo y cuyas principales características son:
- La mejor función renal sostenida en el tiempo.
- Un perfil de riesgo cardiovascular y metabólico mucho más favorable que el de los inhibidores de la calcineurina.
- Buena tolerabilidad.
- Sin reacciones infusionales.
- Está contraindicado en receptores de trasplante con serología de EBV negativa o desconocida.
Agradecimientos
Los autores agradecen a Content Ed Net Communications su asistencia editorial.
Conflictos de interés
La asistencia editorial para la redacción de este trabajo fue financiada por Bristol Myers Squibb.
Tabla 1. Evolución de la supervivencia del injerto y del paciente entre los años 1998 y 2007 según datos del informe OPTN/SRTR 2009
Tabla 2. Tratamientos del estudio BENEFIT
Tabla 3. Perfil de seguridad en los estudios BENEFIT y BENEFIT-EXT
Figura 1. Señalización intracelular e inhibición por nuevos compuestos
Figura 2. Ambas pautas de belatacept fueron significativamente superiores a ciclosporina en la función renal
Figura 3. La nefropatía crónica del injerto fue menos frecuente con ambas pautas de belatacept
Figura 4. Filtrado glomerular con belatacept y ciclosporina en el estudio BENEFIT
Figura 5. Filtrado glomerular con belatacept y ciclosporina en el estudio BENEFIT-EXT