La amiloidosis secundaria o AA es una grave complicación de la enfermedad de Crohn (EC) evolucionada para la que no se dispone de un tratamiento eficaz. Presentamos un caso excepcional de un varón de 33 años afecto de insuficiencia renal moderada y proteinuria, que fue diagnosticado simultáneamente de nefropatía amiloide AA y de EC oligosintomática. Fue tratado con infliximab, 5 mg/kg/8 semanas durante 4 años, azatioprina 1-1,5 mg/kg/día (primer año) y un bloqueante del sistema renina-angiotensina-aldosterona, sin complicaciones. El tratamiento se siguió de una reducción de la proteinuria, mejoría de la función renal y de los parámetros inflamatorios a lo largo del tiempo. A propósito de este caso revisamos la literatura médica y concluimos que infliximab puede ser de utilidad para el tratamiento precoz de la amiloidosis secundaria en la EC.
Secondary amyloidosis (AA) is a severe complication of progressed Crohn’s disease (CD) for which no effective treatment exists. We present the exceptional case of a 33 year-old male with moderate renal failure and proteinuria, who was simultaneously diagnosed with AA amyloid nephropathy and oligosymptomatic CD. He was treated with infliximab at 5mg/kg/8 weeks for 4 years, azathioprine at 1-1.5mg/kg/day (first year) and renin-angiotensin-aldosterone system blockers, with no complications. Treatment caused a decrease in proteinuria, improved renal function, and improved inflammatory parameters over time. Inspired by this case, we performed a review of the medical literature and found that infliximab could be a useful tool in the early treatment of amyloidosis secondary to CD.
INTRODUCCIÓN
La amiloidosis secundaria o AA es una complicación infrecuente pero grave asociada con la enfermedad de Crohn (EC). Los riñones son los órganos principalmente afectados por el depósito de material amiloide en la amiloidosis AA, cuyas manifestaciones clínicas principales son la proteinuria y la insuficiencia renal. La progresión de la enfermedad renal crónica asociada a la amiloidosis secundaria en la EC en ausencia de un tratamiento eficaz conlleva una elevada morbimortalidad1-3.
Sin embargo, en los últimos años los agentes bloqueantes del factor de necrosis tumoral alfa (anti-TNFα), especialmente infliximab, han sido utilizados con éxito para el tratamiento de la amiloidosis AA en algunas enfermedades inflamatorias reumatológicas4 y también en algunos casos de EC5-8.
Presentamos el caso de un paciente diagnosticado simultáneamente de EC oligosintomática y amiloidosis renal AA, tratado con éxito con infliximab durante 4 años con buena respuesta y ausencia de complicaciones.
CASO CLÍNICO
Un varón de 33 años consultó con Nefrología a finales de 2006 por elevación de la creatinina sérica (Crs) a 1,4 mg/dl. No refería antecedentes ni manifestaciones clínicas de enfermedad urológica ni renal. Cinco años antes, la Crs era de 0,9 mg/dl.
A los 18 años fue diagnosticado de anemia por deficiencia de hierro y reflujo gastroesofágico. En los últimos 4 años refería disfagia y pesadez posprandial, sin otras manifestaciones gastrointestinales; también dolor lumbar de características mecánicas. Ausencia de episodios febriles, inflamación articular, lesiones cutáneas, serositis, ni de otros órganos o sistemas.
Antecedentes familiares de espondilitis anquilopoyética en varios varones de su rama paterna; un tío paterno, además, fue diagnosticado de enfermedad renal crónica en estadio 5 secundaria a nefropatía por abuso de analgésicos.
Exploración física normal, presión arterial: 130/79 mmHg, índice de masa corporal: 21 kg/m2.
Exploraciones complementarias
Análisis de sangre: Crs: 1,47 mg/dl; filtrado glomerular estimado (FGe) por MDRD-4: 59 ml/min/1,73 m2; urea: 33 mg/dl; iones, enzimas hepáticas y lípidos: normales. Proteínas totales, proteinograma, inmunoglobulinas y complemento: normales. Factor reumatoide negativo. Proteína C reactiva (PCR): 13 mg/l (valor normal [VN] < 10 mg/l). Los anticuerpos antinucleares, anticuerpos anti-DNA, anticuerpos anticitoplásmicos de neutrófilos y antígenos de histocompatibilidad-B27 fueron negativos. Parámetros férricos: sideremia: 25 µg/dl (VN: 40-60); ferritina: 38 ng/ml (VN: 20-300), índice de saturación de la transferrina: 12%. Vitamina B12: 181 pg/ml (VN: 208-930) y ácido fólico: 3,3 ng/ml (VN: 7,2-15).
Análisis de orina: proteinuria: 200 mg/24 h; albuminuria: 47 mg/24 h, sin cadenas ligeras libres monoclonales. Sedimento de orina normal.
Radiografías de tórax y columna vertebral sin alteraciones significativas. Ecografía abdominal, renal y de vías urinarias: normal. Valorado por el Servicio de Reumatología, se descartó espondilitis anquilopoyética.
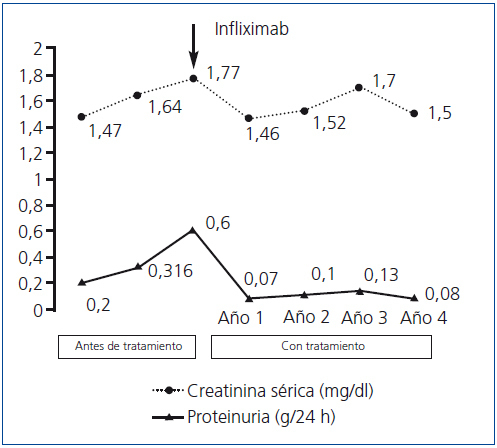
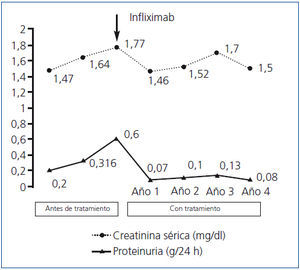
La analítica a los 2 meses mostró: Crs: 1,64 mg/dl; FGe (MDRD-4): 52 ml/min/1,73 m2; proteinuria: 316 mg/24 h; albuminuria: 163 mg/24 h. Y 4 meses más tarde: Crs: 1,77 mg/dl; FGe (MDRD-4): 47 ml/min/1,73 m2; proteinuria: 640 mg/24 h. Las deficiencias de hierro y vitaminas B12 y ácido fólico se corrigieron parcialmente con suplementos orales.
Ante la persistencia de los síntomas gastrointestinales (disfagia, dispepsia) y sospecha de malabsorción intestinal (deficiencias de hierro y vitaminas), nos planteamos un estudio endoscópico del tubo digestivo con toma de biopsias. Las principales alteraciones se encontraron a nivel de la mucosa del íleon terminal: arquitectura vellositaria ulcerada, reacción inflamatoria linfoplasmocitaria en lámina propia, con infiltración de neutrófilos (abscesos en criptas) y granulomas de histiocitos epitelioides; compatible con EC. En la mucosa del recto, en las paredes de los vasos sanguíneos de la lámina propia, se encontró un depósito de material con características tintoriales (rojo congo e inmunohistoquímica) típicas de amiloidosis AA, sin signos inflamatorios.
También se realizó una biopsia renal percutánea ante la progresión desfavorable de los parámetros renales (función renal y proteinuria), que mostró: 7 glomérulos, 3 con esclerosis prácticamente global, y los restantes con depósitos escasos de material eosinófilo en el hilio del ovillo glomerular; áreas ocasionales de fibrosis intersticial, y depósito de material eosinófilo en las paredes de los vasos sanguíneos más extensos e intensos que los glomerulares. Los depósitos fueron rojo congo positivo con birrefringencia verde a la luz polarizada y la inmunohistoquímica determinó la presencia de proteína amiloide A.
Este paciente no tenía ni ha tenido en la evolución posterior ningún síntoma o signo clínico sugestivo de otro tipo de enfermedad inflamatoria, infecciosa o tumoral, ni fiebre mediterránea familiar.
Con el diagnóstico de EC y amiloidosis AA secundaria se decidió un tratamiento etiológico de la EC basado en infliximab 5 mg/kg por vía intravenosa cada 2 meses, azatioprina 1-1,5 mg/kg/día (sólo el primer año, suspendida por leucopenia) y un bloqueante del sistema renina-angiotensina-aldosterona. Los parámetros renales mejoraron (figura 1), así como los marcadores inflamatorios (PCR: 5 mg/l, y proteína sérica amiloide A < 5 mg/l), y se mantienen tras 4 años de seguimiento. No ha habido complicaciones mayores de la EC ni efectos secundarios de la medicación.
DISCUSIÓN
Entre el 0,9 y el 3% de los pacientes con EC desarrollan amiloidosis secundaria1-3, con una frecuencia 2,5-3 veces superior en los varones1,2.
El tiempo medio habitual desde el diagnóstico de EC hasta la aparición de amiloidosis es de 10-15 años1,2; excepcionalmente, el diagnóstico de ambas entidades clínicas concurre en el tiempo2 e incluso en algún caso se ha sugerido que la amiloidosis puede preceder a la EC9. En nuestro paciente el diagnóstico de ambas entidades se obtuvo al mismo tiempo, si bien unas manifestaciones digestivas leves e inespecíficas ya estaban presentes desde hacía varios años. En las dos series más largas publicadas hasta la fecha1,2, dos tercios de las personas con amiloidosis secundaria a EC tuvieron previamente complicaciones supurativas (fístulas o abscesos), y la mitad o más, manifestaciones extraintestinales; de lo que podemos deducir que la amiloidosis AA en la EC también puede desarrollarse en ausencia de infecciones crónicas o complicaciones extraintestinales, como así mismo sucedió en nuestro caso. De acuerdo con lo anteriormente expuesto, parecería que la nefropatía amiloide AA puede debutar como una complicación precoz en la EC y no estar asociada de forma necesaria a una enfermedad clínicamente manifiesta, extensa y agresiva.
Los principales objetivos del tratamiento de la amiloidosis renal secundaria consistirían en la inducción y el mantenimiento de la remisión de la enfermedad causal, evitar el depósito renal de la proteína amiloide A y detener o revertir la progresión de la enfermedad renal crónica. El efecto de la resección intestinal por sí misma para prevenir o tratar la amiloidosis renal en la EC es controvertido1,3, por lo que la mayoría de los autores abogan por el tratamiento farmacológico como de elección. Fármacos como colchicina, azatioprina y dimetilsulfóxido pueden enlentecer la progresión de la nefropatía amiloide, pero su eficacia no ha sido completamente demostrada3. El eprodisato, primera droga de un nuevo grupo farmacológico, inhibidor de la polimerización de las proteínas amiloides y de su depósito en los tejidos, reduce la declinación de la tasa de filtración glomerular en los pacientes con amiloidosis AA, pero con escasos efectos sobre la proteinuria y la supervivencia10.
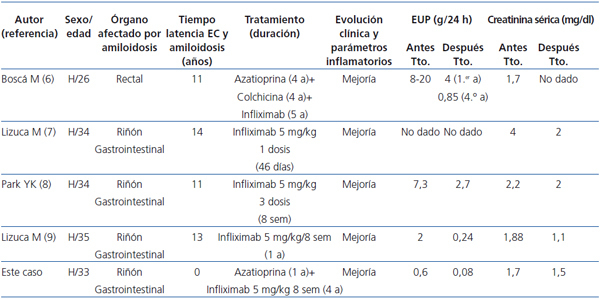
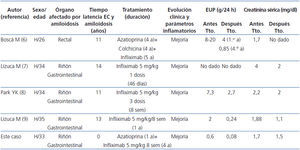
En los últimos años, el anti-TNFα infliximab ha sido utilizado con éxito en el tratamiento de casos aislados de amiloidosis renal secundaria a EC. Hemos realizado una búsqueda en PubMed con las palabras «systemic or secondary amyloidosis, Crohn’s disease, infliximab» y hemos seleccionado aquellos casos publicados en lengua inglesa no asociados a otras enfermedades inflamatorias reumáticas, infecciosas o fiebre mediterránea familiar5-8. Las principales características clínicas de los cuatro casos recogidos junto con el nuestro están resumidas en la tabla 1. En todos ellos, el tratamiento con infliximab se inició precozmente tras el diagnóstico de amiloidosis; y se siguió de una mejoría clínica rápida y mantenida de la enfermedad intestinal y de los parámetros inflamatorios de laboratorio, una rápida reducción de la proteinuria y mejoría de la función renal, y sin complicaciones asociadas a la medicación. En uno de estos estudios pudo demostrarse disminución de los depósitos histológicos de amiloide en mucosa intestinal a los 5 años de tratamiento con infliximab5.
Los efectos adversos más frecuentes relacionados con el uso continuado de infliximab en pacientes con amiloidosis y enfermedades reumáticas son el aumento de la susceptibilidad a las infecciones y la pérdida de la eficacia del fármaco4. En los casos de resistencia o pérdida de eficacia o efectos adversos, en los pacientes con EC, otro anti-TNFα, adalimumab, puede ser una alternativa11,12.
Se ha postulado que los anti-TNFα pueden mejorar la nefropatía amiloide en las enfermedades inflamatorias por dos mecanismos: 1) porque reducen la inflamación glomerular y el aumento de la permeabilidad glomerular a la albúmina inducido por las citoquinas TNFα e interleucina-6; y 2) porque su uso disminuye la síntesis de proteínas de fase aguda mediadas por las mismas citoquinas4. De hecho, se ha demostrado que el nivel de proteína sérica amiloide A alcanzado es un factor pronóstico en la amiloidosis AA; niveles medios inferiores a 10 mg/l se asocian con una mayor probabilidad de regresión de los depósitos de sustancia amiloide y mayor supervivencia13.
En conclusión, la amiloidosis renal AA puede debutar como una complicación precoz en los pacientes con EC, incluso en aquéllos con enfermedad clínicamente poco sintomática. Parece oportuno recomendar a los pacientes diagnosticados de EC un análisis de la función renal y de la excreción urinaria de proteínas en el momento del diagnóstico y después periódicamente, con la finalidad de diagnosticar y tratar de forma precoz una posible enfermedad renal asociada. Infliximab parece ser útil y eficaz en el tratamiento precoz de la amiloidosis secundaria a EC y ofrece expectativas esperanzadoras.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Figura 1. Evolución de la creatinina sérica y de la excreción urinaria de proteínas antes y después del tratamiento con infliximab.
Tabla 1. Evolución de los parámetros renales de 5 pacientes con amiloidosis AA y enfermedad de Crohn tratados con infliximab