Las infecciones continúan siendo un problema relevante en el paciente trasplantado renal, en especial las infecciones virales.
La infección por el parvovirus humano B19 causa anemia refractaria grave, pancitopenia y microangiopatía trombótica. Dicha infección se diagnostica mediante el análisis de la reacción en cadena de la polimerasa (PCR) en sangre y por la presencia de proeritroblastos gigantes típicos en la médula ósea.
Presentamos el caso clínico de un varón de 65 años con trasplante renal de donante cadáver en septiembre de 2014. A los 38 días del trasplante comienza con anemia progresiva y resistente a los agentes estimulantes de la eritropoyesis. A los 64 días se produce hipertermia, con deterioro progresivo de su estado general. La serología vírica resultó negativa, al igual que la PCR inicial en sangre del parvovirus humano B19. A los 4 meses y 19 días se realiza una biopsia de médula ósea en la que se observan eritroblastos gigantes con inclusiones víricas nucleares compatibles con parvovirus, por lo que se realiza una PCR en dicho tejido que confirma el diagnóstico. Una segunda PCR en sangre resultó positiva. Tras el tratamiento con inmunoglobulinas intravenosas (IGIV) y la suspensión temporal del micofenolato de mofetilo, se produce una remisión completa de la enfermedad, aunque persistía positiva la PCR para el parvovirus B19 en sangre, lo que hace necesario vigilar probables recidivas.
Infections remain an issue of particular relevance in renal transplant patients, particularly viral infections.
Human parvovirus B19 infection causes severe refractory anaemia, pancytopenia and thrombotic microangiopathy. Its presence is recognized by analysing blood polymerase chain reaction (PCR) and by the discovery of typical giant proerythroblasts in the bone marrow.
We report the case of a 65 year-old man with a history of deceased donor renal transplant in September 2014. At 38 days after the transplant, the patient presented progressive anaemia that was resistant to erythropoiesis-stimulating agents. At 64 days after transplant, hyperthermia occurred with progressive deterioration of the patient's general condition. The viral serology and the first blood PCR for human parvovirus B19 were both negative. At 4 months and 19 days after, a bone marrow biopsy was conducted, showing giant erythroblasts with nuclear viral inclusions that were compatible with parvovirus; a PCR in the tissue confirmed the diagnosis. A second blood PCR was positive for parvovirus. After treatment with intravenous immunoglobulin and the temporary discontinuation of mycophenolate mofetil, a complete remission of the disease occurred, although the blood PCR for parvovirus B19 remained positive, so monitoring is necessary for future likely recurrence.
La anemia postrasplante es un proceso en el que intervienen las pérdidas hemáticas, el déficit de hierro, de folatos y de la eritropoyetina, así como el hiperparatiroidismo, las neoplasias, los inhibidores de la enzima conversora de la angiotensina y los antagonistas de los receptores de la angiotensina ii. Los fármacos inmunosupresores, el valganciclovir, el cotrimoxazol y la disfunción crónica del injerto son otras de las causas1, junto a las infecciones provocadas por el citomegalovirus (CMV), virus Epstein Barr (VEB) y el parvovirus B19, que pueden conducir a la aplasia medular1,2.
Desde el punto de vista epidemiológico, la infección por parvovirus B19 afecta al 40- 60% de la población, y su máxima incidencia se encuentra en la edad escolar («quinta enfermedad»).
En el trasplante renal, la infección por parvovirus B19 es una rara complicación infecciosa. Las técnicas de biología molecular han mostrado la presencia de ADN viral en la sangre del 20-30% de los pacientes trasplantados3. Diversos autores informan de que la incidencia de este virus en trasplantes de órganos sólidos es del 2%4. No obstante, la incidencia exacta de la infección en el trasplante renal se desconoce, aunque existen cifras de hasta el 12%5.
En sujetos sanos no trasplantados, la transmisión del parvovirus B19 se realiza a través de las secreciones respiratorias, de la sangre y de la orina6, así como por vía placentaria al feto5. En el paciente trasplantado renal se han postulado otras posibles vías, bien a través de una reactivación viral secundaria por una intensa inmunosupresión, bien por transfusiones sanguíneas, o incluso por vías derivadas del donante5,7.
La sintomatología de la infección por parvovirus B19 consiste en fiebre, artralgias y exantema. Otras alteraciones clínicas son: artropatía, crisis aplásica transitoria, hidropesía fetal, aborto y muerte fetal; asimismo, se ha asociado con vasculitis, neuropatía periférica, miocarditis, fallo hepático fulminante y síndrome de Nezelof8. En el trasplantado renal el signo predominante es la presencia de anemia aplásica aguda o crónica1.
Presentamos una revisión corta acompañando a un caso clínico de un paciente trasplantado renal que presenta anemia refractaria a los agentes estimulantes de la eritropoyesis en los primeros meses postrasplante. Posteriormente aparece fiebre y malestar general y tanto los estudios serológicos como la reacción en cadena de la polimerasa (PCR) para el parvovirus B19 resultaron negativos.
Caso clínicoSe trata de un varón de 65 años con antecedentes de hipertensión arterial secundaria a hiperaldosteronismo primario y enfermedad renal crónica desde el año 1999 con proteinuria nefrótica secundaria a una glomerulonefritis crónica (no biopsiado renal). Recibe tratamiento con hemodiálisis desde mayo de 2012 hasta el 30/9/2014, momento en el que se realiza un trasplante renal de donante cadáver con 6 incompatibilidades. La biopsia del donante, con 41 glomérulos, revela la existencia de un 7,3% de glomérulos esclerosados, leve engrosamiento hialino, atrofia tubular inferior al 25% y fibrosis intersticial inferior al 5%. El tratamiento inmunosupresor de inducción se realizó con basiliximab, tacrolimus, micofenolato de mofetilo (MMF) y esteroides.
En el postrasplante inmediato el paciente presenta diuresis eficaz sin necesidad de diálisis. Como complicaciones desarrolla diabetes mellitus postrasplante y un hematoma del lecho quirúrgico con anemización, que requiere la transfusión de 5 concentrados de hematíes. Al alta, se observan los siguientes valores: creatinina plasmática (Crp): 1,56mg/dl; hemoglobina (Hb): 8,2g/dl; hematocrito: 25,5%; leucocitos: 11.300/μL; plaquetas: 291.000/μL. Como tratamiento inmunosupresor recibe prednisona 25mg/día, tacrolimus 5,5mg/día y MMF 2g/día. Asimismo, se le prescribe valganciclovir y trimetropim-sulfametoxazol como profilaxis. El paciente evoluciona sin síntomas, con reducción de las cifras de Crp hasta 1,2mg/dl en los primeros 15 días del trasplante. Mantiene su Hb en torno a 8-9g/dl con incremento progresivo de los requerimientos de eritropoyetina y con linfopenia fluctuante, pero sin otras anomalías hematológicas.
A los 56 días del trasplante (26/11/2014), por un incremento de la proteinuria de hasta 1,2g/día sin deterioro de la función renal, se realiza una biopsia del injerto con hallazgos compatibles con toxicidad tubular leve por anticalcineurínicos, esclerosis segmentaria de un glomérulo, fibrosis intersticial con atrofia tubular leve sin inflamación, así como linfocitos aislados en la íntima arterial. La inmunofluorescencia reveló positividad leve-moderada para IgM y C3 y la tinción de C4d resultó negativa. El paciente, asintomático, no mostraba deterioro de función renal (Crp: 1-1,2mg/dl), con niveles óptimos de inmunosupresión, anticuerpos anti-HLA clase i y ii del 0%, sin alteraciones ecográficas y estudios virológicos negativos (CMV/BK). Se decide mantener un control estrecho, durante el cual se observa una reducción progresiva de la proteinuria.
El 2/12/2014, a los 64 días de trasplantado, el paciente comienza con hipertermia sin focalidad, mal estado general, astenia, hiporexia y reducción del peso corporal, acompañado de una anemización con Hb de hasta 7,1g/dl y hematocrito del 20,6%, por lo cual se le hospitaliza. En las pruebas complementarias destacan: ausencia de leucocitopenia y trombocitopenia, niveles normales de procalcitonina (0,15ng/ml); elevación de la LDH: 321-397 U/l y de la proteína C reactiva (7,17mg/l); proteínas totales: 5,7g/dl; incremento de la bilirrubina total (1,62mg/dl) a expensas de la indirecta (0,98mg/dl); incremento de la ferritina (1.528,60ng/ml), así como Na: 130 mEq/l, Mg: 1,02mg/dl y K: 3,4 mEq/l en el contexto de su hiperaldosteronismo primario. Desde el punto de vista de la función renal, la creatinina plasmática no supera 1,05mg/dl.
Durante este primer ingreso la serología completa de los siguientes agentes patógenos: VEB, CMV, herpesvirus, virus hepatotropos, rubeola, varicela-zóster, parvovirus B19, Micoplasma pneumoniae, Coxiella burnetti, Rickettsia tiphy, Bartonella henselae, Toxoplasma gondii, leishmania, micobacterias y hongos, así como la PCR en sangre del parvovirus B19 y del CMV arrojaron resultados negativos. Clínicamente, destaca la fiebre solo el primer día del ingreso, manteniéndose posteriormente afebril. Recibe tratamiento con quinolonas y cefalosporinas de tercera generación, que se suspenden al alta.
La anemia normocítica, normocrómica e hiporregenerativa con patrón de sobrecarga férrica se relaciona con las transfusiones hemáticas y una toxicidad por fármacos (valganciclovir y trimetropim-sulfametoxazol), motivo por el que se decide su suspensión.
Al alta, se solicita una analítica que constata una serología sugestiva de fiebre Q aguda, con Ac IgM positivos por IFI de Coxiella burnetii, por lo que se inició tratamiento con doxiciclina durante 10 días. Al persistir la fiebre y la anemia, se decide, a los 4 meses del trasplante, su ingreso para descartar fiebre Q crónica.
Durante este segundo ingreso las pruebas de imagen realizadas (Rx de tórax, ecografía abdominal, TAC de abdomen, PET-TAC, ecocardiograma, gastroscopia y colonoscopia) no revelaron anomalías significativas. Los marcadores tumorales y los estudios serológicos (incluyendo nueva determinación de anticuerpos [IFI] para el parvovirus B19 y para Coxiella burnetii), así como los cultivos para tuberculosis y virus (HSV-1, HSV-2, VVZ, CMV, VEB, VHH-6, VHH-7, VHH-8 y ARN de enterovirus) resultaron negativos en todos los casos. Se descarta, por tanto, el diagnóstico de fiebre Q como origen del cuadro clínico. Se trató de un falso positivo, al no haber seroconversión en la segunda muestra y persistir la fiebre a pesar del tratamiento.
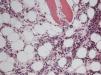
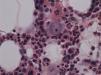
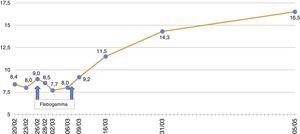
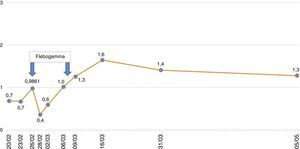
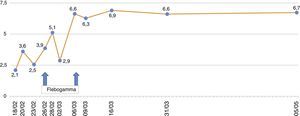
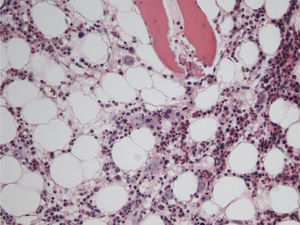
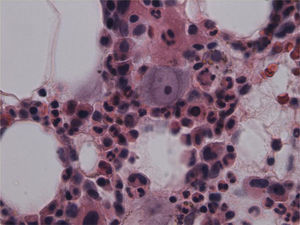
El paciente se mantiene febril con marcado deterioro de su estado general, anemia y linfopenia (figs. 1–3), por lo que se decide realizar el 23/2/2015 una biopsia de médula ósea en la que se observa una médula hipocelular con intensa disminución de la serie eritroide y presencia de eritroblastos gigantes, con inclusiones nucleares escasamente eosinófilas que determinan aumento del tamaño celular. Todo ello sugestivo de infección por parvovirus B19 (figs. 4 y 5), que se confirma mediante PCR con resultado positivo en dicho tejido. Simultáneamente se decide realizar una nueva determinación de PCR en sangre para parvovirus B19, que esta vez sí resulta positiva.
Tras la confirmación de la infección por parvovirus B19 se interrumpe el MMF y se inicia tratamiento con inmunoglobulina intravenosa diaria de 0,5g/kg/dosis (10 dosis) con adecuada tolerancia, desaparición de la fiebre y normalización de las cifras de Hb y serie blanca, tras lo cual recibe el alta hospitalaria en marzo de 2015.
Finalizado el tratamiento y tras comprobar que la Hb se mantiene estable y el paciente permanece afebril, se decide reintroducir el MMF a dosis bajas. Sin embargo, 6 meses después del alta, presenta un deterioro leve de la función renal: Crp de hasta 1,55mg/dl y proteinuria de 2,1g/24h (previas 0,6-0,8g/24h). Ante la sospecha de un evento inmunológico derivado de la disminución de la inmunosupresión con el fin de controlar la replicación del virus, se decide realizar una segunda biopsia renal en noviembre de 2015, en la que se aprecia tubulitis leve sugestiva de rechazo agudo borderline, fibrosis intersticial y atrofia tubular moderada, así como zonas de vacuolización isométrica. En la pared de las arterias existen células inflamatorias en su mayoría intraparietales y escasas de ellas subendoteliales. La tinción con C4d y la inmunofluorescencia resultaron negativas.
Tras comprobar la estabilización de la carga viral del parvovirus, se decide optimizar la inmunosupresión aumentando la dosis de MMF de 500 a 750mg/24h y de tacrolimus (para mantener niveles en torno a 7-8ng/dl), tras lo cual se produjo una reducción de la proteinuria y una estabilización de la función renal con Crp en torno a 1,48-1,55mg/dl. Se descartó la posibilidad de administrar terapia antirrechazo, ya que podría conllevar un aumento en la replicación del parvovirus B199.
Al año de finalizar el tratamiento, el paciente continúa afebril con incremento del apetito y aumento de su peso corporal. Desde el punto de vista analítico, presenta cifras de Hb de 15,2g/dl sin requerimiento de eritropoyetina, con estabilidad de la función renal con proteinuria inferior a un 1 g/día (controlada con doble bloqueo del SRAA). Los anticuerpos anti-HLA clase i y ii continúan negativos.
En cuanto a la PCR en plasma para el parvovirus B19, el laboratorio de nuestro hospital valida la técnica cuantitativa para el parvovirus B19. No disponemos de la carga viral en el momento del diagnóstico, y la primera determinación cuantitativa es de septiembre del año 2015 (7 meses aproximadamente después de terminar el tratamiento) con<50 copias/ml. Inferimos que, aunque no logramos eliminar completamente el virus, probablemente la carga viral antes del tratamiento era mucho mayor, dada la mejoría observada tanto clínica como analítica. La carga viral actual se mantiene por debajo de 100 copias/ml, y se realiza un seguimiento clínico y analítico exhaustivo que incluye determinaciones periódicas con PCR con el fin de detectar una posible recaída.
DiscusiónLas infecciones virales predominan en el primer año postrasplante, cuando la inmunosupresión alcanza su máximo estado10. La infección por parvovirus en la población trasplantada es poco frecuente, y la sintomatología puede ser muy sutil: la anemia es la manifestación predominante11.
A nuestro paciente se le diagnostica una infección por parvovirus B19 a los 142 días de trasplantado. La anemia fue el hallazgo inicial, que posteriormente empeora; a esto se suma hipertermia, con deterioro progresivo de su estado general, astenia, hiporexia y reducción de peso.
Es posible que la infección por parvovirus proceda del donante, del que no se dispone de serología ni de carga viral, por lo que no podemos afirmar taxativamente la transmisión por esta vía. Otra posible fuente de contagio sería la de las transfusiones en el postrasplante inmediato. Pudiera tratarse de una reactivación del virus provocada por la inmunosupresión, pero, al no disponer del estado serológico pretrasplante del receptor, no podemos asegurarlo. Por todo ello, teniendo en cuenta que en el momento del diagnóstico se produjo una epidemia de parvovirus B19 en la población, cabe sospechar que nuestro paciente ha podido adquirir la infección en el contexto de ese brote epidemiológico.
El porqué de la anemiaEl parvovirus B19 tiene un efecto lítico sobre el pronormoblasto (célula progenitora eritroide)8,9. La infección de la célula se realiza a través del antígeno P (globósido Gb4), receptor presente en las células eritroides y en otras, entre las que se incluyen células del endotelio, plaquetas, sinoviocitos, células del músculo liso y miocitos fetales. Aun cuando se ha demostrado la necesidad del Ag P para que el virus se una a la célula, se necesita de un correceptor (α5β1) para que la infección sea exitosa y que actúe como integrina. Las células eritroides contienen en gran cantidad ambas moléculas en su superficie9.
La anemia se caracteriza por ser normocítica, normocrómica severa, arregenerativa (con reticulopenia), que no responde a las transfusiones sanguíneas ni a los agentes estimulantes de eritropoyesis4. También la leucocitopenia, trombocitopenia y el síndrome hemofagocítico reactivo se han relacionado con la infección por parvovirus B1912.
En nuestro paciente, la anemia normocítica y normocrómica fue la principal manifestación durante toda su evolución, con cifras de Hb de hasta 6,7g/dl, con nula respuesta a los agentes estimulantes de la eritropoyesis, por lo que fue transfundido en varias ocasiones.
DiagnósticoEl diagnóstico de la infección por parvovirus B19 se realiza por la presencia de anemia persistente, generalmente reticulocitopenia, con presencia de proeritroblastos gigantes con inclusiones virales eosinofílicas prominentes en la médula ósea, IgM/IgG séricas antiparvovirus y PCR anti-ADN parvovirus positiva13.
En el trasplantado renal el signo predominante es la presencia de anemia aplásica aguda o crónica1. En un estudio con 98 pacientes las principales manifestaciones clínicas asociadas a la infección por el parvovirus B19 fueron la anemia con disnea y astenia asociadas en el 98% de los casos, y la fiebre en el 54,9%14. Las publicaciones acerca de la relación entre la disfunción crónica del injerto y la infección activa por el parvovirus B19 son divergentes. Algunos autores7,15 afirman tal relación, mientras otros no la contemplan5.
La serología para diagnosticar una infección aguda por parvovirus B19 (IgM) tiene una sensibilidad y una especificidad del 89 y 99% respectivamente en inmunocompetentes. Este hecho no se confirma en pacientes trasplantados por su estado de inmunosupresión, en quienes el método más fiable es la PCR en sangre periférica o médula ósea.
En las determinaciones de la PCR para el parvovirus B19 es importante la elección del tipo de test diagnóstico para evitar falsos negativos. Algunas técnicas son sensibles para el genotipo 1, pero no adecuadas para la detección de genotipos 2 o 3. Se hace necesario pues disponer de métodos que detecten los 3genotipos.
Los inhibidores en las muestras de sangre pueden ser también causa de falso negativo. Un control interno de inhibidores debe ser incluido en el análisis de muestras, para detectar su presencia y estar más seguros de que el resultado negativo se debe a la falta de diana detectable y no a los inhibidores presentes en la muestra.
En nuestro paciente la PCR en sangre para parvovirus B19 resultó positiva por primera vez a los 4 meses y 19 días del trasplante, con una determinación previa negativa a los 73 días. La técnica de PCR empleada en nuestro hospital es LightMix® Kit parvovirus B19, capaz de detectar los 3tipos de parvovirus. El hecho de que el primer resultado fuera negativo se podría justificar por la posibilidad de una viremia intermitente o de un bajo nivel de viremia en el momento de la determinación.
En aquellos pacientes en los que la PCR en sangre resulta negativa pero persiste sospecha clínica, como en el caso presentado, el diagnóstico definitivo de la infección por el parvovirus B19 se realiza mediante punción-aspiración de médula ósea16. En ella se demuestra una aplasia pura de células rojas con la característica «parada» medular en la fase de proeritroblastos gigantes y la demostración, mediante técnicas de biología molecular, del virus en la médula3.
TratamientoNo se dispone en la actualidad de fármacos antivirales efectivos frente al parvovirus B19. En la anemia asociada a la infección por este virus pueden considerarse diferentes opciones terapéuticas: disminuir la inmunosupresión (reducción/retirada de fármacos); cambiar de inmunosupresor (sustituir tacrolimus por ciclosporina —algunos autores han descrito el defectuoso aclaramiento del virus en los pacientes tratados con tacrolimus—17 o, con el objetivo de aportar anticuerpos neutralizantes del virus18, administración de IGIV a dosis de 0,4-0,5g/kg, de 2 a 10 días13 con una dosis acumulada que suele oscilar entre 2 y 5g/kg)3. La anemia se corrige en más de un 90% con solo un ciclo de tratamiento, pero el riesgo de recurrencia oscila entre el 23 y el 33%19.
Como se ha comentado, nuestro paciente fue tratado mediante la modificación de la inmunosupresión, suspendiéndose temporalmente el MMF junto a la administración de IGIV (flebogamma) diaria durante 10 días, con buena evolución clínica y analítica, recuperación progresiva de las cifras de Hb, linfocitos y leucocitos y suspensión de la EPO (figs. 1–3). A pesar de que se describen reacciones adversas de la IGIV20, nuestro paciente no presentó ninguna de estas alteraciones, con excelente tolerancia al fármaco.
Aunque se obtenga una buena respuesta terapéutica inicial, se recomienda seguimiento exhaustivo del paciente ante la posibilidad de recaídas y reaparición de la anemia, lo que obligaría a tratarlas con un nuevo ciclo de inmunoglobulinas cada 3meses para evitarlas21.
La posibilidad de tratamiento de estos pacientes con inhibidores de m-TOR podría ser una opción prometedora, pero no existen publicaciones actuales que avalen su uso. En el caso de nuestro paciente, no lo hemos empleado debido a la proteinuria postrasplante observada, que ha llegado a alcanzar los 2g/24h. Por otro lado, desconocemos con exactitud la enfermedad renal de base que lo llevó a la hemodiálisis, por lo que no descartamos la posibilidad de una glomeruloesclerosis segmentaria focal. Asimismo, el informe histológico en la primera biopsia del injerto revela la presencia de un glomérulo con esclerosis segmentaria y una positividad leve-moderada para IgM y C3 en 7 glomérulos, lo que nos ha llevado a no emplear los inhibidores de m-TOR, dado que se ha descrito glomeruloesclerosis segmentaria focal asociada a uso de mTOR en pacientes trasplantados.
Se desconoce el impacto de esta infección en la supervivencia del paciente o en su morbilidad a largo plazo22. No existen estrategias específicas que hayan demostrado la utilidad en la prevención de la infección por el parvovirus B1920.
La relativa baja incidencia de la infección por este virus y los efectos adversos de las medidas terapéuticas hacen inviable el screening donante-receptor frente a este virus y el desarrollo de vacunas frente al parvovirus B19 está aún en investigación20.
ConclusiónSe describe un paciente trasplantado renal con anemia refractaria a la EPO en primer lugar y una posterior hipertermia con diagnóstico de infección por parvovirus B19. Las determinaciones serológicas de IgM/IgG antiparvovirus que se realizaron resultaron siempre negativas, debido al estado de inmunodepresión que presentaba. La sospecha de una infección aguda por fiebre Q retrasó el diagnóstico certero. Tras excluir esta posibilidad, dado que no hubo mejoría clínica con el tratamiento y no se produjo seroconversión, se realizó un aspirado de médula ósea que fue determinante para el diagnóstico de infección por parvovirus B19, ya que la primera PCR en sangre no mostró resultados positivos.
Nuestro paciente fue estudiado exhaustivamente y se descartaron procesos oncoproliferativos y otras infecciones, con desaparición de la sintomatología tras el ajuste del tratamiento inmunosupresor y el inicio de las inmunoglobulinas IV (IGIV).
Conflictos de interésLos autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este manuscrito.