La anemia en el receptor de trasplante renal ha recibido una atención limitada en la literatura, a pesar de la alta prevalencia reportada del 30 al 40%; es un proceso multifactorial que puede relacionarse con pérdidas hemáticas, déficit de hierro y/o folatos, procesos inflamatorios crónicos, factores relacionados al trasplante renal como fármacos inmunosupresores (antimetabolitos, globulina antitimocito), profilaxis postrasplante (valganciclovir, trimetoprim), infecciones asociadas a la inmunosupresión como parvovirus B19 (PV-B19), virus de Epstein-Barr o citomegalovirus; y finalmente la disfunción crónica y la intolerancia al injerto.
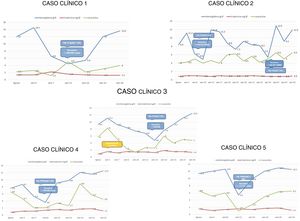
Contamos con 5 casos de anemia en receptores de trasplante renal de donante vivo, detectada en el primer año de seguimiento, asociada a infección por PV-B19. El promedio de edad de presentación fue de 27 años, la mayoría de sexo femenino, la terapia de inducción utilizada con más frecuencia fue timoglobulina (n=4; 80%). El método diagnóstico utilizado en todos los casos fue PCR: la hemoglobina promedio al momento del diagnóstico fue de 4,9g/dl, el tiempo promedio de presentación fue a las 9 semanas postrasplante; el principal síntoma fue cor anémico; solo en el 60% de los casos los pacientes desarrollaron deterioro discreto de la función renal, sin embargo, en 2 casos se detectaron niveles tóxicos del inhibidor de calcineurina y en una infección de vías urinarias; con regreso de la creatinina a su nivel basal una vez controlados todos los factores. Se observó una recaída, 6 meses después, asociado a la administración incompleta de la terapia con inmunoglobulina, debido a una mala tolerancia del paciente a la misma. En el 80% de los casos se modificó la inmunosupresión de tacrolimus a ciclosporina (fig. 1).
En el seguimiento del trasplantado con función renal estable y presentación súbita de anemia, se sugiere protocolo de estudio mediante la determinación de cinética de hierro, cuenta de reticulocitos, sangre oculta en heces, en algunas ocasiones aspirado de médula ósea, y de PCR para PV-B19. La anemia es aplásica, normocítica normocrómica, severa, arregenerativa (reticulopenia) que no responde a transfusiones.
La respuesta inmune a la infección por PV-B19, se ve influida por las terapias inmunosupresoras, la terapia de inducción con anticuerpos policlonales presenta mayor riesgo de desarrollo de infecciones virales en el postrasplante inmediato, sin embargo, esto no es una norma. En 2 casos de esta serie, se observó incremento de creatinina, asociado con niveles elevados del inhibidor de calcineurina, lo cual se traduce en sobreinmunosupresión, como posible factor de riesgo. Es factible un mejor control de la infección, al ajustar la terapia inmunosupresora, con el cambio de tacrolimus a ciclosporina, en búsqueda de una menor potencia inmunosupresora y el retiro o la disminución de antiproliferativo (micofenolato, azatioprina) es otra opción terapéutica1,2.
La utilización de eritropoyetina (EPO) es sugerida de manera inicial, sin embargo, puede causar resistencia del virus al uso de inmunoglobulina; se ha sugerido que el tratamiento con EPO facilita la infección viral al estimular la replicación de las células progenitoras eritroides en la médula ósea, las cuales constituyen las únicas líneas celulares de reactivación y replicación viral3.
Con respecto al diagnóstico la determinación de IgM en pacientes sintomáticos no es el estudio de elección, por el riesgo de falsos negativos debido a la unión de los anticuerpos a las partículas virales, por tanto, es preferible realizar PCR. Aunado al establecimiento del diagnóstico, debe mantenerse la estabilidad hemodinámica mediante la trasfusión de PG irradiados y con filtro de tercera generación, y toma de muestra para PV-B19, independientemente de las transfusiones, ya que no alteran el resultado4,5.
Mediante biología molecular se ha detectado ADN viral en sangre del 20-30% de los pacientes trasplantados, si esta se acompaña de anemia leve, no es indicativo de tratamiento con inmunoglobulina, ya que la anemia puede remitir, al controlar otros factores de riesgo para el desarrollo de anemia2.
Es requerida la asociación de puntos de corte, entre un cierto número de copias y el descenso de hemoglobina. Aún se desconoce si la persistencia de la viremia está asociada a la recurrencia clínica, la sobrevida del paciente o en su morbilidad a largo plazo6.
La dosis sugerida inmunoglobulina intravenosa (IGIV) es de 0,4-0,5g/kg/día por al menos 5 días, con una dosis acumulada entre 2 y 5g/kg, lográndose la remisión de la anemia >90% de los casos con un solo ciclo, dosis menores presentan alta tasa de recaída7.
Las estrategias de detección y manejo mencionadas en este documento han presentado buenos resultados con recuperación hematológica y función renal adecuada, a 2 años de seguimiento en nuestros pacientes. En síntesis, la administración de inmunoglobulina, el cambio de tacrolimus a ciclosporina, la disminución o suspensión de micofenolato, son las terapias reportadas con evidencia de efectividad, sin embargo, las decisiones deben individualizarse de acuerdo con la experiencia de cada centro y la evolución de cada caso4,7,8.