La clasificación actual de la glomerulonefritis membranoprolifertiva (GnMP) está basada en los hallazgos de la inmunofluorescencia, con implicaciones etiológicas y terapéuticas1.
La GnMP idiopática es una entidad poco frecuente2. Por ello, las recomendaciones en el tratamiento se basan en series de casos o ensayos clínicos no randomizados. La terapia actual está compuesta por corticoides y antiproliferativos (micofenolato, ciclofosfamida), anticuerpos monoclonales (rituximab, bortezomib) o plasmaféresis3-5.
Se ha demostrado peor supervivencia del injerto renal y mayor riesgo de recidiva en el trasplante renal en pacientes con GnMP en comparación con otras glomerulonefritis2.
Presentamos el caso de un varón de 66 años con antecedente de hipertensión arterial y diabetes mellitus que debuta en 2012 con fracaso renal (creatinina 1,5 mg/dL, filtrado glomerular [FG] 50 mL/min) asociado con síndrome nefrótico (proteinuria > 15 g/24 h, hipoalbuminemia y dislipemia), con hematuria microscópica, sin cilindros. El estudio inicial incluyó anticuerpo anticitoplasma de neutrófilos (ANCA), anticuerpo antinuclear (ANA), factor reumatoide, proteinograma en suero y orina: negativos, C3, C4 normales.
Se realizó una biopsia renal compatible con GnMP tipo 1. La inmunofluorescencia tenía depósitos de inmunoglobulina G (IgG) (3+), C3 (3+) e inmunoglobulina M (IgM) (+) mesangiales y en las paredes capilares. Se descartaron neoplasias o infecciones como causa de la lesión glomerular (fig. 1).
Se inició un tratamiento con inhibidores de la enzima convertidora angiotensina (IECA) asociado con micofenolato y esteroides, sin respuesta después de tres meses. Ante el deterioro progresivo de la función renal, se decidió cambiar a ciclofosfamida oral vinculada con esteroides, sin obtener respuesta tras cuatro meses de tratamiento, por lo que se suspendió. En el 2014, el paciente inició diálisis peritoneal.
En 2016, recibió el primer injerto renal de donante cadáver, con cinco incompatibilidades antígenos leucocitarios humanos (HLA). Se realizó una inducción con timoglobulina (6 mg/kg), micofenolato, prednisona y tacrolimus. El postrasplante cursó con lenta recuperación de la función renal hasta creatinina 1 mg/dL (FG > 70 mL/min) y proteinuria en torno 1,5 g/24 h, en tratamiento con IECA. A los tres meses del trasplante presentó infección por citomegalovirus, tratada con valganciclovir con buena respuesta.
A los seis meses del trasplante, el paciente presentó la reaparición del síndrome nefrótico, con proteinuria de 12 g/día e hipoalbuminemia, con función renal estable. El estudio inmunológico y los anticuerpos HLA fueron negativos. Se realizó una biopsia del injerto renal, compatible con glomerulonefritis proliferativa difusa endocapilar mediada por inmunocomplejos y depósitos de C3. La inmunofluorescencia tenía IgG (3+) y C3 (2+) con patrón granular difuso subepitelial y mesangial. El anti-C4d fue negativo.
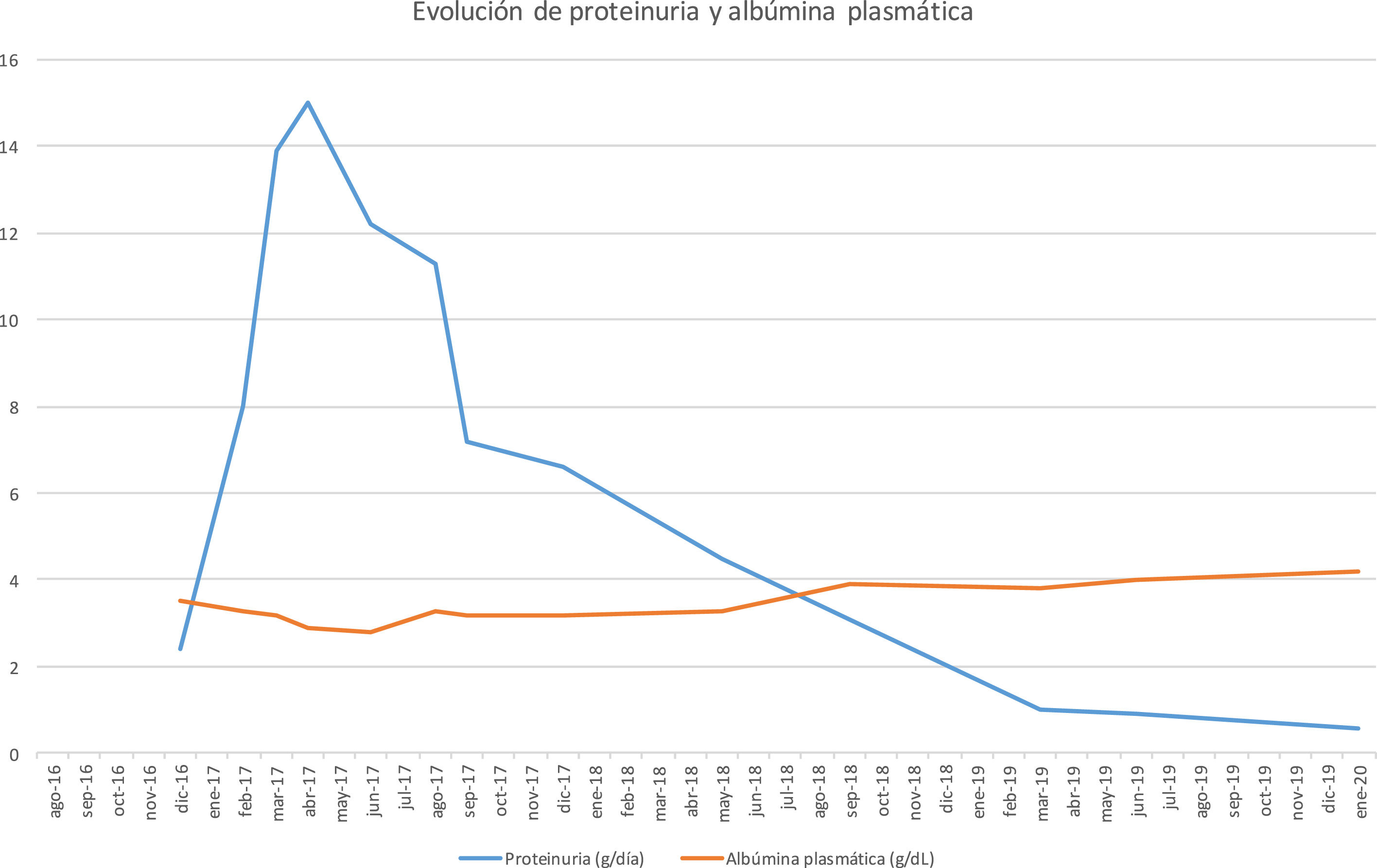
Como tratamiento de recidiva de GnMP, la terapia inicial incluyó el aumento de la dosis de micofenolato a 2 g/día y de prednisona a 50 mg/día. El paciente presentó una leve reactivación de carga viral de citomegalovirus. A pesar del tratamiento, no hubo mejoría del síndrome nefrótico, que llegó hasta 17 g/24 h y albúmina 2 g/dL. La evolución de la proteinuria y albúmina plasmática tras el trasplante, se muestra en la figura 1.
Dado el ciclo previo de ciclofosfamida sin respuesta, se decidió administrar un tratamiento con rituximab (375 mg/m2). Recibió una dosis de 1 g, sin complicaciones. Se monitorizaron niveles de linfocitos CD19 cuatrimestralmente, con valores suprimidos durante el primer año. Tras la aplicación de rituximab, el paciente presentó una resolución progresiva de la proteinuria a partir del primer mes, resolviendo el síndrome nefrótico un año tras la administración. A partir del 2019, el individuo ha desarrollado carcinoma espinocelular y epidermoides cutáneos, por lo que se ha cambiado el micofenolato por un inhibidor mammalian target of rapamycin (m-TOR), con reducción de dosis de tacrolimus, sin repercusión en la proteinuria. Dos años tras rituximab, la proteinuria ha continuado descendiendo (< 1 g/día) y la función renal está estable.
La recidiva post trasplante de la GnMP es muy frecuente, llegando en algunas series hasta el 50% dentro de los primeros 24 meses6. Actualmente, el tratamiento óptimo para la recidiva no está claro.
Se ha utilizado rituximab (anticuerpo monoclonal anti CD20) en series de casos, consiguiendo la remisión total o parcial, si bien la dosis no está clara7.
Otros autores han empleado bortezomib ante la presencia de GnMP con depósito de cadenas kappa, sin diagnóstico previo de disproteinemia, con buena respuesta clínica8.
En nuestro caso, se administró una dosis única de 1 g, monitorizando periódicamente los valores de linfocitos CD19. Dado que se mantuvieron abolidos hasta aproximadamente un año, no se plantearon nuevas dosis. En conclusión, en nuestro caso, el rituximab ha sido eficaz para conseguir la remisión de la recidiva de la GnMP en el trasplante. La respuesta total al tratamiento con rituximab no es inmediata, con efecto más allá del año tras la administración. El seguimiento de los valores de linfocitos CD19 puede ser útil para minimizar la dosis ingerida, siendo especialmente útil en pacientes trasplantados, dada la carga de inmunosupresión acumulada con la aparición de efectos indeseados, como tumores o infecciones.
Conflicto de interesesLos autores manifiestan no tener conflicto de intereses.