La vía de Notch regula procesos importantes en el riñón implicados en el desarrollo embrionario y en situaciones de agresión tisular. Así, en una gran variedad de nefropatías crónicas humanas se ha descrito una activación local de este sistema, sugiriendo que algunos de sus componentes podrían ser biomarcadores de daño renal. Los estudios realizados en modelos experimentales, modulando genéticamente componentes de la vía Notch o mediante su bloqueo farmacológico con inhibidores de la γ-secretasa, han demostrado la participación de esta vía en la regeneración renal, en la apoptosis de podocitos, en la proliferación y activación de fibroblastos y en la transición epitelio-mesenquimal de las células tubuloepiteliales. Estudios recientes sugieren una interacción entre las vías Notch y NF-κB, la cual podría jugar un papel relevante en el proceso inflamatorio renal. Por otra parte, en los últimos años se han descrito miRNA que son capaces de regular componentes de la vía Notch y modular sus respuestas. Todos estos datos indican que el bloqueo de la vía de señalización Notch podría representar una nueva opción terapéutica para la enfermedad renal.
Notch pathway regulates key processes in the kidney, involved in embryonic development and tissue damage. In many human chronic renal diseases a local activation of Notch pathway has been described, suggesting that several components of Notch pathway could be considered as biomarkers of renal damage. Experimental studies by genetic modulation of Notch components or pharmacological approaches by γ-secretase inhibitors have demonstrated the role of this pathway in renal regeneration renal, podocyte apoptosis, proliferation and fibroblasts activation, and induction of epithelial to mesenchymal transition of tubular epithelial cells. Recent studies suggest an interaction between Notch and NF-κB pathway involved in the regulation of renal inflammatory process. On the other hand, there are some miRNAs that could regulate Notch components and down-stream responses. All these data suggest that Notch blockade could be a novel therapeutic option for renal diseases.
La vía de señalización Notch es un mecanismo de comunicación intercelular utilizado por organismos pluricelulares para determinar su función y destino específicos durante la formación de estructuras complejas. La ruta Notch está conservada filogenéticamente y regula múltiples procesos celulares, como proliferación, diferenciación y muerte celular, control del sistema inmune y autorrenovación de células madre1-3. Durante mucho años se ha investigado sobre los complejos mecanismos implicados en el desarrollo embrionario, donde la vía Notch ha demostrado jugar un papel clave en este proceso en diversos organismos. Esta ruta participa en la formación de órganos, como el páncreas, y en el desarrollo del sistema cardiovascular, regulando la diferenciación de las células endoteliales durante la formación del árbol vascular funcional, así como la especificación arteriovenosa1. Además, regula el sistema hematopoyético, siendo necesaria la expresión de los ligandos canónicos tipo-Delta para el establecimiento de la hematopoyesis definitiva2. Por otra parte, la vía de señalización de Notch está implicada en el mantenimiento de células madre neuronales y en la neurogénesis en el cerebro embrionario y adulto1. En el riñón, esta vía se activa durante la nefrogénesis, inhibiéndose en la etapa neonatal y adulta, y reactivándose en situaciones de daño renal4.
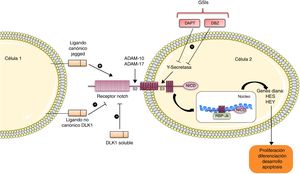
La familia Notch comprende una serie de receptores y ligandos. Los receptores Notch 1/2/3/4 son proteínas transmembrana tipoi formadas por dos subunidades asociadas no covalentemente. Los ligandos canónicos son Jagged 1/2 y tipo-Delta 1/2/3/45. El ligando más relevante es Jagged-1, el cual presenta en su porción extracelular un dominio DSL implicado en la unión al receptor, un dominio rico en cisteína que regula la especificidad de esa unión y repeticiones tipo EGF que la estabilizan5. Esta vía se activa tras la unión del ligando al receptor Notch que expone el dominio de corte S2 extracelular promoviendo dos cortes proteolíticos sucesivos mediados por las metaloproteinasas/disintegrinas de la familia de las ADAM: ADAM-10 y ADAM-17. Estas disintegrinas generan una forma activada del receptor que permanece unida a la membrana, sobre la que actúa la enzima γ-secretasa, catalizando el segundo corte a nivel de la cara interna de la membrana plasmática en el dominio de corte S35. Este corte libera el dominio intracelular de Notch (NICD), que migra hacia el núcleo donde se asocia con RBP-Jκ dando lugar a su unión al DNA (GTGGGAA) y activando la transcripción de genes diana efectores de la vía, entre los cuales se encuentran Hes 1/2/3/4/5/7 y las proteínas represoras HERP o HEY 1/2/3, que forman parte de la señalización en procesos como diferenciación, apoptosis y proliferación5 (fig. 1).
Además, existen ligandos no canónicos que carecen del dominio DSL de unión al receptor, y que se subdividen en tres subgrupos: los ligandos transmembrana, como son DLK1 y DLK2, DNER y Jedi; los anclados a GPI, como F3/contactina1, y los secretados, como OSM11 y EGFL7. Existe bibliografía previa que describe la controversia acerca de los efectos de los ligandos en la vía de Notch, ya que algunos de ellos activan la vía, mientras que otros la inhiben6.
Mutaciones en receptores y ligandos de Notch conllevan anomalías en muchos tejidos, incluyendo vasos, corazón, riñón y células hematopoyéticas. Estas alteraciones dan lugar a diversas patologías, siendo las más estudiadas el síndrome de Alagille y la arteriopatía autosómica-dominante, con infartos subcorticales y leucoencefalopatía, que presentan severidad variable, producidas por mutaciones en el receptor Notch-3 y el ligando Jagged-1, respectivamente7. Además de las anteriores, también son conocidos la valvulopatía aórtica bicúspide, el síndrome del corazón izquierdo hipoplásico y el síndrome aórtico agudo, ocasionados por mutación del receptor Notch-11. Por otra parte, mutaciones de pérdida de función en Notch-1 y RBP-Jκ dan lugar al síndrome Adams-Oliver, caracterizado por malformaciones de las extremidades y desarrollo anormal de la piel1.
Papel de la vía de Notch en el daño renalDurante la embriogénesis, Jagged-1 se expresa en túbulos colectores, en agregados pre-tubulares y en células endoteliales del glomérulo en formación, activando los receptores Notch-1 y Notch-2, y controlando a su vez el patrón celular en la glomerulogénesis8. En un estudio realizado por el grupo de Susztak et al. se describió que los componentes de la vía Notch se re-expresan en un amplio rango de enfermedades renales, como glomerulonefritis de cambios mínimos, nefropatía membranosa, nefritis lúpica, nefroesclerosis hipertensiva, glomerulonefritis rápidamente progresiva, nefropatía por IgA, nefropatía diabética y glomeruloesclerosis focal segmentaria. Observaron que la expresión de Notch-1 en podocitos se correlaciona con albuminuria y glomeruloesclerosis, mientras que el aumento de NICD localizado en túbulos se asocia con fibrosis tubulointersticial8. Estos estudios han sugerido que algunos componentes de la vía, como Jagged-1 o Notch-1, podrían ser biomarcadores de daño renal. Sin embargo, nuestro grupo ha observado que en biopsias de pacientes con nefropatía hipertensiva la vía Notch-1/Jagged-1 no está activada, aunque hemos confirmado cómo en patologías renales progresivas sí se activa y se correlaciona con la fibrosis tubulointersticial9.
Estos datos sugieren que son necesarios más estudios en patologías renales específicas, así como en diferentes estadios del daño, para definir si los componentes de Notch podrían ser o no catalogados como biomarcadores de daño renal.
Bloqueo de Notch como diana terapéuticaEstudios preclínicos sugieren que el bloqueo de Notch mediante inhibidores farmacológicos o ligandos solubles de Notch mejora el daño renal experimental10-17, aunque los mecanismos moleculares implicados no están del todo esclarecidos.
Comprender la intrincada regulación del sistema Notch en el riñón dañado es importante, ya que su señalización podría participar tanto en la regeneración como en la progresión del daño renal, al regular la proliferación celular. En riñones adultos existe una población de células residentes con actividad progenitora que expresan miembros de la familia Notch10. En un modelo de daño renal nefrotóxico inducido por ácido fólico, la inhibición de Notch no modificó la función renal en la fase aguda, pero mejoró las lesiones renales y disminuyó la fibrosis en la fase tardía11. Resultados similares se han descrito en otros modelos de daño renal agudo donde la inhibición de Notch no consigue revertir el daño12. En un modelo de necrosis tubular aguda inducido por isquemia-reperfusión, el tratamiento con el ligando tipo Delta-4 facilitó la recuperación renal asociado a un incremento de la proliferación celular13. Cabe destacar que la activación de Notch fue detectada únicamente en células proliferativas. En un modelo de glomeruloesclerosis focal segmentaria inducida por adriamicina la inhibición de Notch redujo la pérdida de podocitos y mejoró la proteinuria durante las fases iniciales de daño glomerular, pero su inhibición en las fases regenerativas disminuyó la proliferación de progenitores celulares y empeoró la proteinuria y la glomeruloesclerosis14. En podocitos en cultivo, la inhibición de Notch modula la muerte celular por apoptosis15. Además, la activación de Notch específica en el podocito in vivo daña severamente la barrera de filtración glomerular16, y, por el contrario, la deleción génica específica en podocitos del coactivador RBP-Jκ, o el bloqueo farmacológico mediante la inhibición de la γ-secretasa, revierte el daño glomerular y restablece la barrera de filtración glomerular16. Estos datos sugieren que la inhibición específica de Notch en podocitos podría ser una buena diana terapéutica para enfermedades que cursan con proteinuria, caracterizada por pérdida de podocitos por apoptosis. Por otro lado, la expresión específica en el túbulo de Notch induce la diferenciación epitelial, la fibrosis intersticial y la muerte de los animales modificados genéticamente11. Un estudio reciente ha demostrado que la sobreexpresión tubular de PGC-1α, un gen regulado por Notch, modula el daño renal regulando fibrosis, disfunción mitocondrial y oxidación lipídica, sugiriendo que PGC-1α podría ser un mediador clave de las acciones deletéreas de Notch en el riñón18.
Existen evidencias preclínicas que sugieren que la vía Notch regula procesos inflamatorios. Así, en artritis reumatoide experimental se observó que el tratamiento con el inhibidor de la γ-secretasa DAPT disminuía el daño tisular, la infiltración de neutrófilos, la activación de NF-κB y los niveles de moléculas de adhesión como ICAM-1 y citoquinas proinflamatorias19. También se ha descrito que la inhibición de Notch disminuyó la respuesta inmune Th17 en un modelo de asma alérgica20. Recientemente nuestro grupo ha observado que el tratamiento con DAPT disminuye la presencia de células inflamatorias en el riñón y reduce los niveles renales de citoquinas proinflamatorias en un modelo de obstrucción unilateral del uréter (UUO) así como en un modelo experimental de administración intrarrenal de Gremlin (datos no publicados). Actualmente estos inhibidores están siendo estudiados en ensayos clínicos para el tratamiento de varias enfermedades, como son la leucemia y el Alzheimer16 (NCT00594568, NCT00762411, NCT01193868), donde la inflamación también juega un papel importante. Estos datos sugieren que los efectos beneficiosos renales del bloqueo de Notch pueden atribuirse además a sus efectos antiinflamatorios. Sin embargo, estos inhibidores también pueden presentar ciertos riesgos. Se han descrito efectos secundarios en estos estudios in vivo, como toxicidad intestinal, lo cual refleja el control que tiene Notch en el desarrollo de células secretoras frente a células absorbentes dentro de las criptas intestinales1. La coadministración de glucocorticoides mejora algunos de los efectos secundarios de un GSI en un modelo preclínico de ratón de leucemia linfoblástica aguda21, pero no está claro qué combinación de dosis podría ser tolerada en pacientes.
En los últimos 10 años se está haciendo énfasis en una manera diferente de interferir en la ruta Notch, utilizando antagonistas naturales. Además de los ligandos canónicos, esta vía posee también ligandos no canónicos, entre los que destacamos DLK1. Este ligando posee un sitio de corte por la enzima ADAM17/TACE, que libera la porción extracelular y da lugar a una forma soluble de DLK1. Ambas formas, soluble y anclada a membrana, tienen un dominio extracelular con seis repeticiones de tipo EGF mediante el cual actúa como inhibidor endógeno funcional22. Este efecto antagonista de Notch se ha demostrado en células endoteliales, donde la sobreactivación de DLK1 inhibe el proceso de la angiogénesis23. En estudios no publicados, en un modelo experimental de daño renal por UUO en ratones deficientes para el gen de DLK1 hemos observado un aumento en la respuesta inflamatoria asociado a una mayor activación de la vía Notch-1, lo que sugiere que DLK1 podría actuar como un antagonista endógeno de Notch regulando la respuesta inflamatoria renal.
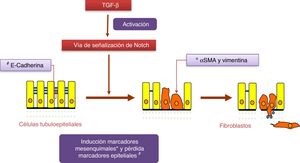
Notch y TGF-β: efectos en la fibrosis renal y en la transición epitelio-mesenquimalEl factor de crecimiento transformante (TGF-β) es considerada la principal citoquina pro-fibrogénica24. TGF-β estimula directamente la transcripción de un gran número de genes de matriz extracelular, inhibe la producción de colagenasas e induce transición epitelio-mesenquimal (TEM) (fig. 2), proceso este último que está implicado en el daño tubular y en el aumento de miofibroblastos. TGF-β induce sus respuestas mediante la activación de proteínas Smad, su vía canónica, o por la ruta no canónica que utiliza otras vías de señalización intracelulares, entre las que destaca la cascada de las proteínas MAPK25. La expresión génica de TGF-β está aumentada en patologías renales y se regula por factores claves en la progresión del daño, como son la angiotensinaii (AngII), el estrés mecánico y elevadas concentraciones de glucosa25.
Recientemente se ha descrito un solapamiento entre las vías de señalización de TGF-β y Notch26. Además, ambas vías participan en el control de la diferenciación celular durante el desarrollo, y en la TEM en embriogénesis y cáncer27. Estudios con células tubuloepiteliales en cultivo han demostrado que la expresión de Jagged-1 es dependiente de TGF-β18, y que la inhibición de la ruta Notch restaura los cambios inducidos por TGF-β en marcadores de TEM26,28. La contribución de la TEM a la fibrosis renal es controvertido24. En la actualidad es comúnmente aceptado que el proceso de TEM de las células tubulares contribuye al daño renal, ya que estas células pierden sus características de epitelio polarizado y por tanto su funcionalidad, aunque su contribución al aumento del número de miofibroblastos en el riñón dañado es controvertido24. Por otro lado, no existen estudios que demuestren que la vía Notch regula directamente componentes de la matriz extracelular (MEC), como colágenos, proteínas claves en fibrosis. Los estudios en modelos experimentales sugieren que la disminución en la acumulación de MEC observada al bloquear Notch es debida a sus efectos inhibitorios sobre la proliferación celular, en concreto de los fibroblastos renales activados12.
Notch y Gremlin: nuevas dianas terapéuticas anti-inflamatorias en patología renalGremlin se ha identificado como un gen implicado en desarrollo que se induce de novo en condiciones patológicas, incluido el daño renal29. Gremlin pertenece a la superfamilia de nudo de cisteína y actúa como antagonista de las proteínas morfogenéticas de hueso (BMP) en la unión de estas a sus receptores y bloqueando su señalización posterior, regulando a través de este mecanismo procesos de desarrollo embrionario y cáncer30.
Diversos grupos de investigación, incluido el nuestro, han sugerido que Gremlin podría ser una potencial diana terapéutica29. Se ha sugerido que Gremlin regula procesos fibróticos en diferentes patologías, incluyendo fibrosis hepática, miocárdica e hipertensión pulmonar idiopática29. En algunas patologías los efectos de Gremlin en fibrosis se han asociado a sus propiedades como antagonista de las BMP, al observar que además regula la ruta Smad1/531. Sin embargo, en células tubuloepiteliales en cultivo hemos descrito que Gremlin activa la vía Smad por un mecanismo independiente de las BMP, regulando el proceso de TEM32. En células endoteliales se ha descrito que Gremlin se une al receptor tipo2 del factor de crecimiento endotelial vascular (VEGFR2) regulando angiogénesis33. Recientemente hemos descrito una nueva función de Gremlin en el riñón, al ser capaz de activar la ruta del NF-κB y regular la respuesta inflamatoria renal aguda, por un proceso independiente de su acción sobre las BMP, y mediado por la unión al receptor VEGFR234. Utilizando un ratón transgénico que sobreexpresa Gremlin de forma específica en la célula tubular hemos observado que existe una mayor susceptibilidad al daño renal diabético causado por la administración de estreptozotocina, aumentando la respuesta inflamatoria y la producción de quimioquinas como MCP-135. En pacientes con glomerulonefritis crescente hemos observado expresión de Gremlin en células infiltrantes (datos no publicados). Todo esto demuestra que Gremlin es una citoquina proinflamatoria, ampliando su rol como mediador de fibrosis.
Mediante estudios in silico se ha demostrado que los genes Jagged-1 y Hes-1 tienen similitudes significativas con Gremlin, en términos de estructura del promotor y de elementos de unión de microRNA36. TGF-β1 in vitro incrementa la expresión de Gremlin, incluyendo células mesangiales, células tubuloepiteliales y fibroblastos37, y también activa la vía Notch26,28,38. Además, en biopsias renales de pacientes con nefropatía diabética hemos descrito inducción de la expresión de Gremlin asociada a la activación de Notch, demostrado por inmunohistoquímica en secciones seriadas la colocalización con Gremlin, Jagged y Hes36. En estudios no publicados hemos demostrado que Gremlin activa la vía Notch en el riñón y a través de esta ruta regula el proceso inflamatorio. Estos resultados sugieren que la vía Notch podría regular procesos inflamatorios renales.
La vía Notch no participa en el daño renal mediado por angiotensina iiLa Ang II participa de forma activa en la progresión del daño renal, al ser capaz de regular diversos procesos patológicos, como inflamación y fibrosis. Los fármacos que bloquean las acciones de AngII, como los inhibidores de la enzima convertidora de la angiotensina (IECA) y los antagonistas de los receptores de la AngII (ARAII), son una de las mejores estrategias terapéuticas para el tratamiento de las enfermedades renales progresivas, debido a sus acciones más allá del control de la presión sanguínea, presentando efectos órgano-protectores39. En estudios in vitro —en diversos tipos celulares, incluidos podocitos, células tubuloepiteliales y fibroblastos— e in vivo —en varios modelos experimentales— hemos descrito que la ruta Notch no está activada en respuesta a AngII38. Estudios in vitro claramente demuestran que aunque TGF-β activa la vía Notch en células renales40, la AngII no regula este sistema en el riñón, demostrando una diferencia clave entre los mecanismos activados por ambos factores.
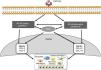
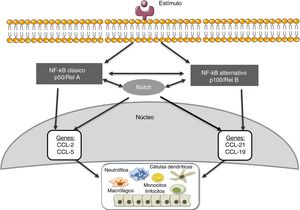
Notch y otras rutas de señalización: NF-κBEl factor de transcripción nuclear kappaB (NF-κB) juega un papel esencial en inflamación, inmunidad, apoptosis, proliferación y diferenciación celular41. Existen dos vías principales de activación: la clásica y la alternativa (fig. 3). La activación de la vía clásica se produce por una gran variedad de estímulos como, por ejemplo, citoquinas, altas concentraciones de glucosa y productos de glucosilación avanzada41. La activación de la vía clásica comienza con la activación del complejo IKK, constituido por dos subunidades catalíticas IKKα e IKKβ, y la subunidad regulatoria IKKγ/NEMO41, que inducen la fosforilación de la subunidad inhibitoria IκBα, marcándola para ser reconocida por el complejo ubiquitina-ligasa, dando lugar a su poliubiquitinación y posterior degradación por el proteasoma 26S41. Además, se induce la fosforilación de la subunidad RelA/p65 y la translocación al núcleo del complejo RelA/p50, para unirse al DNA y activar la transcripción de diferentes genes diana, incluidos genes implicados en la respuesta inmune e inflamatoria o en el remodelado tisular. La vía alternativa de NF-κB es una manifestación más tardía en respuesta a un número de estímulos menor. Este proceso comienza con la activación de la quinasa NIK y el reclutamiento de IKKα para formar el complejo dimérico IKKα/IKKα que se fosforila y causa la degradación, a través del proteasoma, de la subunidad p100 perteneciente al complejo NF-κB2 formado por p100/p5241. Esta degradación permite la formación de los complejos RelB/p52 que se liberan y migran al núcleo para unirse al DNA, y se activan genes diana de NF-κB2, como el factor quimiotáctico de linfocitosT, CCL2141.
Diversos estudios sugieren interacciones entre las rutas de Notch y NF-κB. La mayor parte de los estudios se han realizado en células hematopoyéticas y tumorales. Estos estudios muestran que Notch regula la transcripción de componentes de la ruta NF-κB42. En células endoteliales, Jagged-1 promueve la translocación nuclear de NICD, su interacción física con NF-κB y la transactivación de genes diana, incluyendo moléculas de adhesión43. Por otro lado, la sobreexpresión de p52/RelB aumenta la activación de Notch y los niveles de Hes44. Además, se ha observado que la activación del promotor de NF-κB2 a través de la vía Notch juega un papel importante en el desarrollo de la artritis reumatoide45. En otras patologías, como la aterosclerosis, se ha descrito una regulación positiva entre las vías Notch y NF-κB46. Recientemente hemos observado que el bloqueo de la vía Notch con el inhibidor DAPT impide la activación de NF-κB causada por Gremlin en el riñón (datos no publicados). Las actuales estrategias para bloquear NF-κB están todavía muy lejos de poder ser usadas en la clínica; el uso de inhibidores de Notch, al inhibir también la ruta NF-κB, podría ser una buena opción terapéutica en la enfermedad inflamatoria renal.
Relación entre RNA no codificantes y la vía NotchLos RNA no codificantes (ncRNA) constituyen una familia muy heterogénea de tránscritos reguladores de la expresión génica, los cuales, una vez que se transcriben desde el DNA, no se traducen en proteínas47. Dependiendo de su longitud se pueden catalogar en miRNA, cuando tienen entre 18 y 24 nucleótidos, y RNA no codificantes largos (lncRNA), si están formados por más de 200 nucleótidos. Además, según su función o localización subcelular, se pueden clasificar como RNA ribosomal (rRNA), RNA de transferencia (tRNA), RNA pequeño nuclear (snRNA), RNA pequeño nucleolar (snoRNA), RNA asociado a Piwi (piRNA) o RNA pequeño de interferencia (siRNA). Sin embargo, no es fácil hacer una separación estricta de la familia de los RNA no codificantes, ya que muchos de ellos comparten funciones múltiples47.
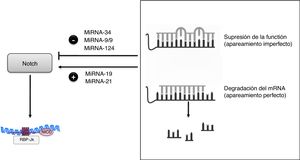
El descubrimiento de los miRNA ha provocado un cambio revolucionario en nuestro entendimiento sobre la regulación génica post-transcripcional. Los miRNA son reguladores muy precisos de la expresión génica, y se estima que más del 90% de los genes en mamíferos podrían estar bajo el control de estas moléculas. En la actualidad se han descrito más de 2.600miRNA en humanos que son capaces de regular la expresión génica a través de la supresión de la función o degradación de RNA mensajeros48. Su mecanismo de acción se basa en el apareamiento —generalmente imperfecto en el caso de los animales y perfecto en el de plantas— con secuencias complementarias, en su mayoría presentes en la región 3¿ no traducida (3¿ UTR), de sus mRNA diana (fig. 4). Esta característica tan peculiar hace que un miRNA pueda regular cientos de mRNA y que un mRNA pueda ser regulado por varios miRNA. Estos mediadores biológicos se han convertido en reguladores específicos de prácticamente todos los procesos celulares y actúan como mecanismos de control de procesos tanto fisiológicos como patológicos. Alteraciones en la expresión y/o función de los miRNA se han asociado con procesos de desarrollo, envejecimiento y muerte celular, así como con la fisiopatología de enfermedades humanas tales como inflamación y fibrosis. A pesar de que existe redundancia tanto en las dianas afectadas por los miRNA como limitaciones en la especificidad de cada uno de ellos, se ha generado un considerable esfuerzo para utilizar los miRNA como herramientas terapéuticas, de modo que varias empresas biotecnológicas operan con esta finalidad primordial. Desde el punto de vista clínico, la presencia de determinados miRNA en sangre y orina ha permitido proponer a estos miRNA como nuevos biomarcadores diagnósticos tempranos de enfermedades, incluidas las renales48, lo que supondría una mejora valiosa en este campo.
En concreto, en el riñón los miRNA se han relacionado con el desarrollo, la homeostasis y la función fisiológica renal, y pueden funcionar como reguladores negativos de la expresión génica en diversas etapas de la enfermedad renal49. Así, la familia de miRNA-34c interacciona directamente con el extremo 3¿ UTR de Notch-1 y Jagged-1 (fig. 4)50. En la nefropatía diabética experimental, la sobreexpresión de miRNA-34 inhibió la activación de Notch en podocitos, reduciendo el daño glomerular y la acumulación de matriz extracelular50. La relación de los miRNA con la señalización mediada por Notch se ha descrito también en otros tejidos, como el neuronal51, donde miR-9/9* disminuye la actividad Notch mediante la señalización de Notch-2 y Hes-1, al igual que en células gástricas, donde miR-124 regula negativamente la señalización de Notch-1 a través de Jagged-152.
Por otra parte, los miRNA también pueden actuar como reguladores positivos de la vía Notch. Se ha descrito que un aumento en la expresión de miR-19a53 en células renales y miR-2154 en células madre del cáncer pancreáticas inducen la señalización mediada por Notch, incrementando en ambos casos el proceso de TEM. Estos resultados sugieren que la inhibición de ambos miRNA podría ser beneficiosa para el tratamiento del carcinoma renal y pancreático. De hecho, miR-19a se ha identificado como un miRNA oncogénico en cáncer gástrico y de vejiga, así como en glioma53. Por su parte, la inhibición de miR-21 suprime la formación de tumores, la metástasis y la resistencia a la quimioterapia en líneas celulares54.
El principal problema de estas estrategias de regulación génica basadas en el uso de los miRNA es la especificidad de órgano y la biodisponibilidad de los productos administrados. Si se pretende usar los miRNA como terapia para enfermedades renales, es necesario asegurarse de que el compuesto llega en suficiente cantidad a su diana sin que se acumule en exceso en otros órganos y sistemas, siendo además eliminado de forma eficaz por el organismo. Además, los miRNA son muy sensibles a la degradación por las endonucleasas presentes en el torrente sanguíneo, presentan carácter hidrofílico, inducen la respuesta inmune innata y podrían ser fácilmente eliminados por filtración renal debido a su bajo peso molecular. Estrategias basadas en la nanotecnología han logrado vencer estos obstáculos y han arrojado resultados esperanzadores dentro del campo terapéutico debido a que aumentan la eficacia y/o la tolerancia del organismo a determinados fármacos, incluyendo los miRNA55. Por último, los avances llevados a cabo en relación con los sistemas de liberación de los miRNA no solo han logrado aumentar la eficacia de estos novedosos agentes terapéuticos, sino que han conseguido también disminuir sus efectos secundarios55.
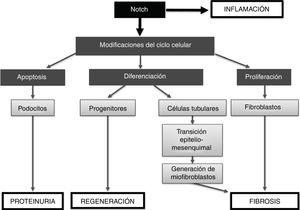
En resumen, la vía de señalización de Notch regula procesos implicados en desarrollo embrionario, homeostasis y daño tisular (fig. 5). La activación de Notch por factores implicados en el daño renal puede contribuir a la progresión del daño, al ser capaz de: 1)activar la apoptosis de los podocitos, contribuyendo a la proteinuria; 2)participar en el proceso inflamatorio renal, al activar vías de señalización como NF-κB, y 3)promover la fibrosis renal, al activar las células tubuloepiteliales, que contribuyen a la TEM, y aumentar eventualmente el número de miofibroblastos, así como activar directamente a los fibroblastos renales, induciendo su proliferación y aumentando la producción de proteínas de matriz extracelular (fig. 5). Por otro lado, en algunas situaciones patológicas concretas podría contribuir a la regeneración renal al modular procesos de diferenciación (progenitores). Los estudios preclínicos discutidos aquí muestran que la inhibición de Notch podría ser una nueva opción terapéutica para la enfermedad renal.
Conceptos clave- •
La vía Notch participa en el desarrollo embrionario del riñón y se reactiva en situaciones patológicas de daño renal, como se ha demostrado en un gran número de nefropatías humanas.
- •
En estudios preclínicos, mediante abordajes genéticos y farmacológicos se ha demostrado que el bloqueo de Notch mejora la proteinuria y las lesiones renales al inhibir la proliferación de los fibroblastos y la inflamación renal.
- •
La activación de Notch induce apoptosis en los podocitos, pudiendo por ello contribuir a la proteinuria.
- •
La activación de Notch contribuye a la fibrosis renal, al inducir la proliferación de los fibroblastos renales y promover el proceso de transición fenotípica de epitelio a mesénquima en las células tubuloepiteliales.
- •
La interacción entre la vía Notch y NF-κB juega un papel relevante en procesos inflamatorios tisulares, incluido en el tejido renal.
- •
Se han descrito miRNA que son capaces de regular la expresión génica de los componentes de la vía Notch, como miRNA-34c, que regula Notch-1/Jagged-1, o miR-19a, que regula el proceso de TEM.
- •
El bloqueo farmacológico de Notch, mediante el empleo de inhibidores de la γ-secretasa, está dando resultados beneficiosos en patologías inflamatorias humanas, por lo que podría ser una opción terapéutica a evaluar en las enfermedades inflamatorias renales.
En algunos casos se ha conservado la correspondiente abreviatura en inglés debido a su frecuente utilización en el lenguaje científico.
| ADAM | A Disintegrin And Metalloproteinase |
| Ang II | Angiotensinaii |
| ARAII | Antagonistas de los receptores tipoi de Ang II |
| BMP | Proteína morfogenética del hueso |
| DLK | Epidermal growth factor-like protein Delta-like |
| DNER | Delta/Notch-like EGF-related receptor |
| DSL | Dominio Delta-Serrate-Lag-2 |
| EGF | Factor de crecimiento epidérmico |
| EGFL7 | Ligando secretado homólogo al factor de crecimiento epidérmico |
| GPI | Glucosilfosfatidilinositol |
| GSI | Inhibidores de γ-secretasa |
| HERP o HEY | Proteínas represoras relacionadas a Hes |
| Hes | Hairy/Enhancer of split |
| ICAM-1 | Molécula de adhesión intercelular-1 |
| IECA | Inhibidores de la enzima convertidora de angiotensina |
| IκB | Inhibitor-kappa B |
| IKK | Quinasa de IκB |
| MAPK | Proteínas quinasas activadas por mitógeno |
| MCP | Proteína quimioatrayente de monocitos |
| MEC | Matriz extracelular |
| miRNA | Micro ácido ribonucleico (microRNA) |
| NF-κB | Factor nuclear-κB |
| NICD | Dominio intracelular de Notch activo |
| OSM11 | Oncostatin M |
| PGC-1α | Peroxisomal proliferation g-coactivator |
| RBP-Jκ | Recombination Signal-Binding Protein 1 for J-Kappa |
| SLN | Secuencia de localización nuclear |
| TACE | Enzima de conversión del TNF-α (también denominada ADAM-17) |
| TEM | Transición epitelio-mesenquimal |
| TGF-β | Factor de crecimiento transformante-β |
| TNF-α | Factor de necrosis tumoral-α |
| VEGFR2 | Vascular endotelial growth factor receptor-2 |
Los estudios no publicados de este trabajo fueron financiados por la Sociedad Española de Nefrología, el Instituto de Salud CarlosIII y Fondos FEDER European Union (ISCIII-RETIC RD16/0009, Redinren), y los proyectos de Chile: PAI 82140017 y FONDECYT 1160465.
Conflicto de interesesLos autores declaran que no tienen conflictos de intereses potenciales relacionados con los contenidos de este artículo.