Osteoporosis (OP) y enfermedad renal crónica (ERC) influyen de manera independiente en la salud ósea y cardiovascular. Un número significativo de pacientes con ERC, especialmente desde estadios 3a a 5D, presentan una disminución significativa de la densidad mineral ósea condicionando un alto riesgo de fractura y un incremento importante de la morbimortalidad asociada. Independientemente de la OP clásica asociada a edad y/o sexo, las propiedades mecánicas del hueso se encuentran afectadas adicionalmente por factores intrínsecos a la ERC («OP urémica»). En la primera parte de esta revisión, analizaremos conceptos generales sobre densidad mineral ósea, OP y fracturas, en gran parte infravalorados hasta ahora por los nefrólogos debido a la falta de evidencias y a las dificultades diagnósticas en el contexto de la ERC. Actualmente se ha demostrado que una densidad mineral ósea disminuida es realmente predictiva del riesgo de fracturas en pacientes con ERC, aunque no permite distinguir entre las causas que la originan (hiperparatiroidismo, enfermedad adinámica del hueso y/o osteoporosis senil, etc.). Por ello, en la segunda parte analizaremos las implicaciones terapéuticas en distintos estadios de la ERC. En cualquier caso, la valoración individualizada de los factores mayores y menores del riesgo de fractura, la cuantificación de dicho riesgo (i.e. con el uso de herramientas como el FRAX®) y las indicaciones potenciales de densitometría en pacientes con ERC podrían constituir un primer paso importante en espera de nuevas guías clínicas basadas en estudios aleatorizados que no excluyan a pacientes con ERC, evitando mientras tanto nihilismo terapéutico en un área de creciente importancia.
Osteoporosis (OP) and chronic kidney disease (CKD) independently influence bone and cardiovascular health. A considerable number of patients with CKD, especially those with stages 3a to 5D, have a significantly reduced bone mineral density leading to a high risk of fracture and a significant increase in associated morbidity and mortality. Independently of classic OP related to age and/or gender, the mechanical properties of bone are also affected by inherent risk factors for CKD (“uraemic OP”). In the first part of this review, we will analyse the general concepts regarding bone mineral density, OP and fractures, which have been largely undervalued until now by nephrologists due to the lack of evidence and diagnostic difficulties in the context of CKD. It has now been proven that a reduced bone mineral density is highly predictive of fracture risk in CKD patients, although it does not allow a distinction to be made between the causes which generate it (hyperparathyroidism, adynamic bone disease and/or senile osteoporosis, etc.). Therefore, in the second part, we will analyse the therapeutic indications in different CKD stages. In any case, the individual assessment of factors which represent a higher or lower risk of fracture, the quantification of this risk (i.e. using tools such as FRAX®) and the potential indications for densitometry in patients with CKD could represent an important first step pending new clinical guidelines based on randomised studies which do not exclude CKD patients, all the while avoiding therapeutic nihilism in an area of growing importance.
La osteoporosis (OP) es el desorden esquelético más frecuente en la población general1 y define una disminución en la resistencia mecánica global del hueso relacionada con un riesgo aumentado de padecer fracturas de bajo impacto y sus consecuencias deletéreas2–4. La resistencia del hueso viene determinada no solo por la densidad mineral ósea (DMO) sino también por la calidad del hueso2–4 (fig. 1); sin embargo, la OP normalmente se diagnostica por la existencia de una DMO medida por «Dual-energy X-ray Absortiometry» (DEXA) por debajo de un límite predeterminado y arbitrario (T-score≤-2,5 desviaciones estándar) que, sin embargo, no tiene en cuenta la calidad del hueso2,5. Es importante resaltar que el valor de DMO es un importante factor de riesgo de fractura y que una gran parte de fracturas en la población general ocurren ya en personas con osteopenia6, por lo que es también fundamental valorar otros factores de riesgo no densitométricos (tabla 1)7–10.
Relación entre Chronic Kidney Disease - Mineral and Bone Disorder (CKD-MBD), osteodistrofia renal (alteración ósea secundaria a la presencia de enfermedad renal crónica [ERC]) y OP (relacionada con la uremia o la edad y sexo de los pacientes, entre otros factores). La resistencia ósea viene determinada no solo por la densidad mineral ósea sino también por la calidad del hueso, expresado por sus determinantes94,151. Aunque algunos autores utilizan el término OP «urémica»17, no debemos olvidar a la ERC no terminal, pudiendo integrarse dentro del complejo CKD-MBD al poder condicionar su empeoramiento. Adaptada de Moe151 y West et al.94.
Factores de riesgo de fractura
| Factores de riesgo mayores (RR≥2) | DMO ≤ -2,5 |
| Fractura previa (cadera, columna, muñeca) | |
| Edad ≥ 65 años | |
| IMC ≤ 20 kg/m2 | |
| Antecedente de fractura de cadera en familiar de primer grado | |
| Tratamiento con corticoides (≥5mg/día de prednisona o su equivalente durante ≥3 meses) | |
| Fallo ovárico precoz sin tratamiento | |
| Caídas en el último año (≥ 2) | |
| Hiperparatiroidismo | |
| Trastorno de conducta alimentaria | |
| Malnutrición crónica o síndromes de malabsorción | |
| Factores de riesgo menores | Sexo femenino |
| Menopausia precoz (40-45 años) | |
| Fumador actual | |
| Consumo de ≥3 unidades de alcohol/día | |
| Diabetes mellitus tipo 1 | |
| Artritis reumatoide | |
| Hipertiroidismo |
La DMO medida como T-score (número de desviaciones estándar de la DMO con respecto a mujeres de 20 a 29 años) incrementa exponencialmente el riesgo de fractura146. Osteopenia (T entre -1 y -2,5): multiplica por 2 el riesgo de fractura (x2); osteoporosis (T ≤ -2,5): x 4; osteoporosis establecida (T ≤ -2,5 y fractura); osteoporosis grave (T < -3,5). Se recomienda utilizar el índice Z con fines diagnósticos (i.e. ≤ -2) en la valoración de la DMO en mujeres premenopáusicas y hombres menores de 50 años101. El valor Z indica la relación con el valor «esperado» para la edad del paciente. En ausencia de medición de DMO, esta podría indicarse por la presencia de un factor de riesgo mayor (que no sea la edad) o 2 menores o bien, según distintas guías, 2 mayores o uno mayor + 2 menores. Otros factores de riesgo de trascendencia nefrológica serían (entre otros y por distintos mecanismos): el uso de diuréticos de asa, uso crónico de heparina o anticoagulantes, inhibidores de la bomba de protones, antihistamínicos, inhibidores de la recaptación de serotonina, así como bloqueantes hormonales de estrógenos y testosterona, antiepilépticos, inhibidores de la aromatasa, etc.147-150. Dado que en la ERC las fracturas se asocian a una edad más temprana, las guías españolas de la SEN 2011 sugirieron poder realizar densitometrías, además de los pacientes trasplantados, a mujeres mayores de 50 años y hombres > 65 años con ERC (a diferencia de la indicación habitual en mujeres > 65 años y hombres > 70 años)101.
DMO: densidad mineral ósea; IMC: índice de masa corporal; RR: riesgo relativo.
Por otra parte, se sabe que la enfermedad renal crónica (ERC) tiene un importante impacto en la salud ósea, como queda reflejado en el concepto clásico de «osteodistrofia renal» (ODR)11,12. Actualmente se considera que el término ODR debería ser usado exclusivamente para definir las lesiones histológicas observadas en la biopsia ósea en pacientes con ERC (uno de los componentes del complejo «Chronic Kidney Disease-Mineral and Bone Disorder» (CKD-MBD)13, abarcando anormalidades en la tasa de recambio, mineralización y volumen óseo («Turnover, Mineralization, Volume»)8,11,12. La ODR incluye enfermedades de alto remodelado como la osteítis fibrosa (reflejo del hiperparatiroidismo secundario), de bajo remodelado (como la osteomalacia o la enfermedad ósea adinámica [EOA]) y las formas mixtas, entre otras. Por otra parte, en la OP existe una disminución de la masa ósea y alteración de la microarquitectura sin un defecto específico en la mineralización, celularidad o el recambio óseo14,15. Por lo tanto, a pesar de que la OP y la EOA tienen algunas características clínicas comunes, su patogénesis, histopatología y tratamiento son distintos14,16.
Cada día es mayor la evidencia de que el paciente con ERC presenta un riesgo de fractura (y mortalidad asociada) más elevado que la población general, probablemente porque las propiedades mecánicas del hueso están adicionalmente afectadas por «factores urémicos intrínsecos» específicos de la ERC. Por ello se ha descrito un nuevo concepto, «OP urémica»17, que enfatiza la existencia de una relación particularmente compleja entre DMO, riesgo de fractura y mortalidad en el paciente con ERC, dado que estos pacientes están también expuestos a la OP «clásica» relacionada con la edad o sexo incluso antes del diagnóstico de ERC17. Por ello, los nefrólogos deberíamos por un lado conocer mejor los factores de riesgo de OP y fractura y, por otro, enfatizar los criterios diagnósticos de la OP clásica. Por otra parte, deberíamos resaltar la importancia de la ERC en el diagnóstico diferencial de los pacientes con OP dadas las implicaciones terapéuticas que serán analizadas en la segunda parte de esta revisión18. De hecho, es probable que el hiperparatiroidismo secundario característico de la ERC no sea actualmente el principal responsable de la aparición de fracturas17,19, y que la pérdida de DMO relacionada con el envejecimiento poblacional, alteración de las hormonas sexuales y otras causas secundarias debieran considerarse independientemente a la pérdida asociada a la propia ERC u ODR17,19–21.
Por todo ello, en esta primera parte analizaremos de modo extenso la valoración del riesgo de fractura en la población general y en la ERC, así como las posibles indicaciones de la DEXA dadas sus implicaciones diagnósticas en la ERC. Los parámetros bioquímicos (biomarcadores) y la consideración (infrecuente y a veces limitante) de la biopsia ósea serán también analizados.
Conceptos generales de osteoporosis, factores de riesgo y consecuencias clínicasLas fracturas osteoporóticas o por fragilidad (espontáneas o provocadas por traumatismos mínimos [como una caída desde la propia altura]) constituyen un importante problema de salud pública por su elevada prevalencia, morbimortalidad y el consumo creciente de recursos22–25. Por ello, diversas agencias25 recomiendan evaluar individualmente la presencia de factores de riesgo de fractura (tabla 1) y desaconsejan el cribado densitométrico poblacional3,26–29. La evaluación de factores de riesgo debería realizarse en cualquier situación de sospecha clínica y, por ello, quizá también debería evaluarse idealmente en todos los pacientes con ERC independientemente de la edad. Por otra parte, la cuantificación del riesgo de fractura en la población general se puede realizar utilizando distintas escalas, siendo la más conocida el Fracture Risk Assessment Tool (FRAX®) (www.shef.ac.uk/FRAX®) (fig. 2). El algoritmo de FRAX® calcula la probabilidad de fractura mayor osteoporótica (clínica vertebral, antebrazo, cadera o húmero) y/o de cadera a los 10 años (sin tratamiento actual o previo). Está traducida y validada por países, recomendándose solo como herramienta orientativa dado que tiene importantes limitaciones (fig. 2)10,30.
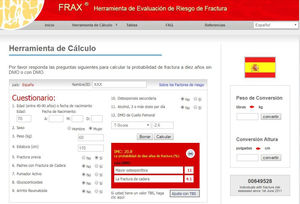
Ejemplo de cálculo por Fracture Risk Assessment Tool (FRAX®): para España (http://www.shef.ac.uk/FRAX®/tool.aspx?country=4). El algoritmo de FRAX® calcula la probabilidad de fractura mayor osteoporótica de modo país específico. Además de los factores obvios mostrados, se incluyen en la valoración la administración previa o actual de corticosteroides durante más de 3 meses (5mg o más de prednisolona o equivalente), OP concomitante con artritis reumatoide, OP secundaria a trastornos estrechamente ligados a ella (diabetes tipo 1, osteogénesis imperfecta en adultos, hipertiroidismo crónico no tratado, hipogonadismo o menopausia prematura, malnutrición crónica, malabsorción y enfermedad crónica del hígado), ingestión de más de tres unidades de alcohol al día y finalmente, de modo opcional, la DMO del cuello del fémur. Al introducir los valores de DMO en el cálculo pueden también introducirse posteriormente valores de Trabecular Bone Score si se dispone de ellos. Entre las carencias de FRAX® destaca que incluye variables dicotómicas (sí/no) y que no se tienen en cuenta, por ejemplo, el número de fracturas previas, la dosis de corticoides, no diferencia fractura vertebral de otras fracturas, no valora caídas padecidas, es incompleta la valoración de OP secundarias (donde no se tiene en cuenta la enfermedad renal o el filtrado glomerular, entre otras causas) y hay dudas sobre la representatividad de la cohorte española46,47,115. FRAX® puede tener especial importancia en centros que no disponen de la posibilidad de medir la DMO mediante DEXA para plantear una potencial derivación de pacientes para su realización.
FRAX® no incluye en su algoritmo a la ERC, por lo que se supone que el uso de esta escala subestimaría el riego de fractura en nuestros pacientes, especialmente en ERC avanzada31,32. De hecho llama la atención que, en una guía reciente americana, solo la ERC terminal aparece entre las enfermedades que causan o contribuyen a la OP y fracturas33. De todos modos, aunque FRAX® no incluye ajustes para el filtrado glomerular estimado (FGe), creemos que los nefrólogos podrían usar inicialmente esta herramienta teniendo en cuenta que el valor absoluto obtenido probablemente infraestima el riesgo real de fractura. De hecho, la presencia de ERC no solo es un importante factor independiente de fractura, sino que además aumenta la frecuencia de caídas por debilidad muscular-sarcopenia o mioneuropatía34–40. El uso de FRAX® en pacientes con ERC o trasplantados ha demostrado que es capaz de discriminar y predecir fracturas41–43. Por ejemplo, Jamal et al.41 describieron que la capacidad discriminativa de la DMO en cuello femoral era similar al FRAX® para fracturas vertebrales morfométricas y cualquier fractura, siendo FRAX® incluso superior para fracturas clínicas no vertebrales (0,66; [0,60-0,73]). Comparado con FRAX®, el área bajo la curva para la edad fue menor en todo tipo de fractura, pero los mejores resultados se observaron con FRAX®+DMO41. Asimismo, Naylor et al.42 analizaron 320 pacientes (67±10 años, 71% mujeres) que presentaban un FGe<60ml/min/1,73m2 y 1787 con un FGe≥60ml/min/1,73m2. El riesgo observado de fractura clínica mayor por OP fue del 5,3% (3,3-8,6%) en pacientes con un FGe<60ml/min/1,73m2 (comparable al calculado por FRAX® [6,4% con DMO y 8,2% sin DMO]). No se observaron diferencias de predicción significativas en individuos con FGe > o < a 60ml/min/1,73m2. En este estudio, FRAX®+DMO, FRAX® sin DMO y la DMO de cuello femoral predijeron fracturas con un área bajo la curva de 0,65-0,7142. FRAX® ha sido también valorado como predictor de fractura en pacientes trasplantados renales43 y, recientemente, como predictor de mortalidad en pacientes japoneses en diálisis44. En cualquier caso, se necesitan estudios adicionales para el uso rutinario de FRAX®, especialmente en estadios 4-5D, puesto que en estos estadios la presencia de alteraciones significativas del metabolismo mineral (i.e. hiperparatiroidismo secundario severo) o su tratamiento (vitamina D, captores de fósforo) pueden ser tan importantes que el uso de FRAX® o los criterios para el diagnóstico, pronóstico o tratamiento de OP podrían no ser tan precisos o adecuados.
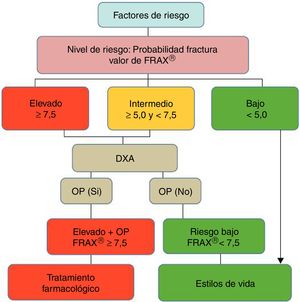
Tras la cuantificación del riesgo de fractura con FRAX® (en ausencia de medida de la DMO) el paciente se clasifica como de riesgo bajo, intermedio o alto (fig. 3). Los pacientes de bajo riesgo deben simplemente recibir consejos generales (dieta, ejercicio y reevaluación a los 5 años) mientras que, dependiendo de cada país y recursos disponibles, los pacientes con riesgo intermedio suelen ser evaluados por densitometría para recalcular FRAX® (incluyendo en esta ocasión los datos de la DMO). En la población general, la reevaluación del riesgo por encima de un determinado umbral (i.e. > 10% para fracturas mayores y/o > 3% para fractura de cadera, según países y autores) aconsejaría una intervención terapéutica activa al igual que los pacientes con FRAX® de alto riesgo (fig. 3). Dado que FRAX® parece infraestimar el riesgo de fractura en la cohorte española45, nuevos estudios han reevaluado su utilidad en nuestra población general46,47, aconsejándose ahora la práctica de densitometría/tratamiento en pacientes con un riesgo de fractura osteoporótica mayor a 10 años >7,5% (fig. 4).
Cálculo de probabilidad de fractura con ayuda de FRAX® (fracture probability según los factores de riesgo [CRF]). Los niveles de riesgo de fractura altos (high), intermedios (intermediate) y bajos (low) son variables según guías y países. En Estados Unidos y Reino Unido se considera que un riesgo de fractura mayor osteoporótica a los 10 años ≥ 20% o un riesgo de fractura de cadera ≥ 3% es elevado, 10-20% como riesgo intermedio (aconsejaría densitometría [BMD, bone mineral density] y recálculo) y < 10% como riesgo bajo (cifras basadas en coste-efectividad). Algunas guías (ver fig. 4) recomiendan recalcular FRAX (reassess probability) con DMO tanto para los pacientes con riesgo intermedio como elevado para tartar (treat) (la DMO también servirá para valorar la respuesta al tratamiento)26.
Diagrama de decisiones de acuerdo con la opción más coste-efectiva en la cohorte española FRIDEX de mujeres españolas (población general) que no recibieron tratamiento durante los 10 años de seguimiento47. DXA o DEXA: Dual-Energy X-ray absorptiometry; OP: osteoporosis.
Por último, creemos importante destacar el que cada vez más estudios reconocen estrechas interconexiones entre enfermedad vascular y patología ósea48. En la población general y en los pacientes con ERC existe una importante relación inversa entre morbimortalidad cardiovascular y DMO49,50, así como una relación inversa similar entre DMO y calcificación vascular48,51–54. Esta presencia de calcificación paradójica vascular en el contexto de decalcificación ósea se describe en distintas patologías55. También se ha descrito la asociación de calcificaciones vasculares con mayor prevalencia de fracturas vertebrales56,57. Más aún, el valor pronóstico de estas calcificaciones ha sido demostrado usando una radiografía simple de perfil lumbar (índice de Kauppila) o de manos y pelvis (índice de Adragao)8,58. Por ello, la extensión de la radiografía lumbar de perfil (sugerida para valoración de calcificaciones aórticas) a la región torácica podría ser útil para la detección de fracturas vertebrales asintomáticas (tabla 1).
Epidemiología de las fracturas en la enfermedad renal crónicaA cualquier edad, los pacientes con ERC estadios 1-5, en diálisis o trasplantados, presentan un riesgo muy superior de padecer una fractura comparados con individuos de la misma edad y sexo24,37,59–62. Más allá de la conocida OP asociada a los pacientes con trasplante renal o tratados con corticoides, es cada vez más conocido que los pacientes con ERC estadios 3a-5D muestran una disminución en la DMO y una reducción en las propiedades mecánicas del hueso63–68. En una cohorte canadiense de 679.114 adultos ≥40 años, la incidencia cumulativa de fracturas periféricas y axiales se incrementó de modo gradual y significativo en adultos con el descenso del FGe en ambos sexos y grupos de edad (40-65/>65 años)37. En estadio 5, hasta un 10% de mujeres y 5% de hombres experimentaron al menos una fractura tras tres años de seguimiento, describiéndose asociaciones similares para caídas con hospitalización37. En otro estudio reciente (n=10.955), tanto el FGe como la albuminuria fueron factores significativos de riesgo de fractura69. Todos estos datos pudieran estar infraestimados puesto que el riesgo aumenta incluso en pacientes con función renal relativamente preservada si se usa cistatina C como marcador subrogado de función renal70,71. Además, el riesgo de fractura parece aumentar incluso tras deterioro agudo de función renal que precisó diálisis a pesar de una recuperación casi completa de función renal72. Por último, cabe resaltar que varios estudios longitudinales han confirmado la existencia de una relación independiente entre alteración de la función renal y pérdida acelerada de DMO con la edad35,73–76.
En pacientes en diálisis, varios estudios han demostrado también un aumento de la incidencia de fracturas, especialmente de cadera64–68,77–80. En una cohorte internacional (n=34.579), Tentori et al. describieron que el 3% de los participantes presentaron una fractura, aunque esta incidencia era muy variable entre distintos países (12/1000 pacientes-año en Japón-40/1000 pacientes-año en Bélgica y Suecia)64. En este estudio, España presentó la segunda incidencia global más baja de fracturas, pero similar incidencia de fracturas de cadera que otros países de nuestro entorno, planteándose que otras fracturas (como las vertebrales) hubieran podido ser infraestimadas. En cualquier caso, en todos los países las fracturas fueron más frecuentes en el grupo de pacientes en diálisis vs. la población general64, siendo siempre mucho más frecuentes las fracturas no vertebrales que las vertebrales59–62. Como factores predictivos se han descrito la edad, sexo femenino, hipoalbuminemia, trasplante renal previo, diabetes, enfermedad cardiovascular o demencia77,78,81. También la toma de inhibidores selectivos de la serotonina, narcóticos y opiáceos, benzodiacepinas, antiepilépticos (entre otros) y, por supuesto, corticoides21,77,78,81. Finalmente, en un registro danés que recoge casi todos los tipos de fractura79,82, se describe que el riesgo fue 3 veces superior en pacientes en diálisis (dos veces superior en trasplantados) respecto sujetos sanos79, cifra inferior a estudios previos65–68,83. Es importante subrayar que todas estas fracturas se presentan a una edad más temprana (aproximadamente 10 años antes) y se asocian a un incremento significativo de la morbimortalidad64. Por ejemplo, la mortalidad (no ajustada) es 3,7 veces mayor y la tasa de muerte/rehospitalización es 4 veces mayor en aquellos pacientes en diálisis con fracturas comparado con los pacientes que no las presentan42,63,64,77,78,84.
Las fracturas vertebrales son la consecuencia más común de la OP y también constituyen un factor de riesgo importante de otras fracturas y morbimortalidad3,56,82,85,86. Frecuentemente pasan inadvertidas como una lumbalgia aguda, otras veces son silentes, insidiosas y progresivas, diagnosticándose casualmente por la pérdida de altura del cuerpo vertebral (fractura vertebral morfométrica) (fig. 5). Más de 2/3 de las fracturas vertebrales permanecen sin diagnosticar en la población general86 y se encuentran en más del 25% de pacientes analizados en algún estudio pretrasplante87. Además, el uso combinado de la DMO con la detección de fracturas vertebrales parece mejorar la valoración del riesgo vital. En este sentido, la clasificación de Genant (fig. 5)85, poco usada por nefrólogos88,89, ha demostrado ser útil para la población general y parece tener utilidad pronóstica en pacientes con ERC89 o en diálisis88. Actualmente, la valoración de la morfometría vertebral («Vertebral Fracture Assessment» o «Lateral Vertebral Adquisition») puede calcularse tras la adquisición de imágenes de columna dorso-lumbar lateral con el densitómetro90, técnica que también se ha usado en pacientes con ERC91. Finalmente, es importante resaltar que el riesgo de fractura vertebral no parece claramente mayor en pacientes con ERC56, ni en distintos estadios de ERC prediálisis92, quizá debido a las diferentes propiedades mecánicas de elasticidad ósea y las fuerzas aplicadas (verticales o paralelas) en los diferentes tipos de hueso (cortical vs. trabecular) de estos pacientes17. Rodríguez-García et al., en una población española sobre 193 pacientes en diálisis, encontraron que la prevalencia de fracturas vertebrales era del 26,5% vs. 24,1% en la población general56. Por otra parte, el riesgo de fractura de cadera en la ERC sí es claramente más elevado que en la población general17, siendo 3-4 veces superior en pacientes en diálisis vs. la población general y pacientes sin diálisis78,79. Esta es, por supuesto, la consecuencia más grave de la OP ya que está asociada con un incremento de riesgo de nuevas fracturas y muerte prematura, subrayando la importante necesidad de realizar intervenciones para reducir este riesgo14,56,64,90,93.
Representación esquemática de la aproximación semicuantitativa de Genant para la medición visual de deformidades vertebrales. Normal = 0; leve = 1; moderada = 2; severa o grave = 3; dudosa = 0,5. El diagnóstico de fractura vertebral es frecuentemente casual (fractura morfométrica) aunque puede ser clínico. Se basa en la pérdida de altura del cuerpo vertebral superior al 20% en cualquiera de los segmentos vertebrales. El cálculo se realiza según la fórmula ([altura posterior el cuerpo vertebral– altura menor]/altura posterior) x100115,152.
En la práctica clínica habitual, el diagnóstico de OP se basa en la medida de la DMO por DEXA2,14,94. DEXA sigue siendo el «patrón oro» aunque tiene una amplia variabilidad y no tiene en cuenta la calidad ósea95. A pesar de las características diferenciales de la fragilidad ósea en pacientes con ERC, la medición de la DMO probablemente debería seguir las mismas indicaciones que para la población general, especialmente para pacientes que presenten riesgo intermedio o alto de fracturas (tabla 1, figs. 2-4)27. Obviamente, como mencionan las guías actuales, la DMO debería realizarse solo cuando su resultado pueda impactar decisiones terapéuticas96.
La medición de la DMO por DEXA, o menos frecuentemente por tomografía computarizada (TC), es una herramienta útil para la evaluación de la fragilidad ósea también en pacientes con ERC27,97. Sin embargo, la relación entre fractura ósea y DMO en estos pacientes es más compleja. De este modo, debemos tener en cuenta ciertas particularidades anatómicas e histológicas al interpretar los resultados en pacientes con ERC puesto que en estos se suele afectar preferentemente el hueso cortical94,98. La DEXA no puede distinguir entre ellos (siendo la localización la que nos indicará mayor afectación cortical –radio, fémur– o trabecular –lumbar–). Además, la DEXA puede sobrestimar la DMO en columna, especialmente en pacientes con ERC, por el aumento de calcificaciones aórticas y la elevada prevalencia de artrosis lumbar14,27.
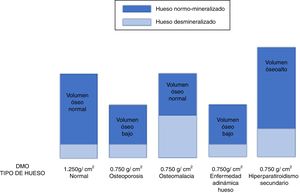
Es muy importante tener en cuenta que en el paciente con ERC las diferentes formas de ODR pueden mostrar una disminución similar de la DMO8. Así, pacientes con una ODR de alto recambio o bajo recambio pueden mostrar las mismas medidas densitométricas por DEXA que una OP clásica «senil» (fig. 6). Por ello, las guías KDIGO 200913 afirmaban que «en pacientes con ERC estadios 3-5D con evidencia de CKD-MBD, sugerimos que el estudio de la DMO no se realice de modo rutinario porque la DMO no predice el riesgo de fractura como en la población general, y la DMO no predice el tipo de ODR»13. De hecho, esta sugerencia se basaba en que la disminución de la DMO podía ser esencialmente consecuencia de la alteración del metabolismo calcio-fósforo asociado a la ERC (p. ej. hiperparatiroidismo) y que se consideraba que el control del fósforo y PTH era más seguro y apropiado para el control de la ODR que la terapia antirresortiva, especialmente en pacientes con FGe <30ml/min/1,73m213,96. Por otra parte, el diagnóstico de «OP» en un individuo, sin tener en cuenta la potencial coexistencia de ERC, llevaría implícito un manejo clínico diferente, induciendo al uso de agentes antirresortivos que podrían condicionar la aparición o el empeoramiento de una EOA13,99.
En la imagen puede apreciarse cómo distintas patologías (osteoporosis senil o por hipogonadismo, osteomalacia, enfermedad adinámica del hueso e hiperparatiroidismo secundario) pueden mostrar el mismo resultado disminuido en la medición de la densidad mineral ósea (en este ejemplo DMO=0,750g/cm2) aunque condicionado por una composición ósea (y eventual tratamiento) completamente distintos112,133.
No obstante, ahora se han confirmado observaciones previas que demuestran que observar una DMO disminuida es más común en pacientes con ERC estadios 3-4 y, como se ha mencionado con anterioridad, varios estudios longitudinales han confirmado también la existencia de una relación independiente entre alteración de la función renal y pérdida de DMO acelerada con la edad35,73–76. Además, en pacientes en diálisis, la relación entre DMO y el riesgo de fractura no había sido claramente demostrado, con distintos estudios mostrando asociaciones diversas o ausencia de relación27. Sin embargo, un metanálisis y revisión sistemática reciente de 13 estudios publicados sobre la potencial asociación entre DEXA y fracturas en pacientes con ERC (prediálisis y diálisis)100 mostró que la DMO fue significativamente menor en el cuello femoral, columna lumbar, tercio distal de radio y radio ultradistal en pacientes con fracturas, independientemente de la diálisis. A pesar de que este metanálisis tenía claras limitaciones, sí sugería que la DMO podría discriminar el riesgo de fractura en pacientes con ERC100. Por otra parte, tal y como recomendó la International Society for Clinical Densitometry en 2015 para pacientes con hiperparatiroidismo, el 1/3 distal del radio podría ser más representativo de cambios en el hueso cortical101. Varios estudios demuestran que esta medición es predictiva del riesgo de fractura en pacientes con ERC 3-5D101–103, recomendándose su medición evitando el brazo con fístula A-V funcionante104. Además, al menos 5 estudios de cohortes prospectivos con DEXA e incidencia de fracturas en adultos con ERC estadios 3a-5D confirman ahora una buena capacidad predictiva de la DMO en pacientes con ERC42,102,105–107.
El primer estudio que demuestra esta capacidad fue realizado en 485 pacientes japoneses en hemodiálisis, mostrando que una DMO basal (cuello femoral y total de cadera) estaba independientemente asociada a un aumento de la incidencia de cualquier tipo de fractura (HR 0,65 [95% IC=0,47-0,90])105. Otros autores102 valoraron que la DMO medida por DEXA (total de cadera, columna lumbar, ultradistal y tercio distal de radio) y la TC cuantitativa periférica de alta resolución (HRqQCT por su acrónimo inglés) en el radio podían predecir fracturas en adultos con ERC estadios 3-5 no en diálisis102. Por otra parte, Yencheck et al. evaluaron la asociación de DMO por DEXA con fracturas en un estudio prospectivo en 2.754 individuos añosos (media 73,6 años) no institucionalizados106, confirmando la asociación de una DMO disminuida en cuello femoral con un riesgo superior de fractura, independientemente de la presencia o no de ERC106. Finalmente, sobre 1.426 participantes ≥40 años (media 67 años), Naylor et al.107, demostraron recientemente que, más allá de la DMO, los individuos con ERC y un índice de hueso trabecular (TBS por su acrónimo inglés) de columna lumbar por DEXA menor que la mediana (<1,277) triplicaba la probabilidad de fractura a los 5 años. TBS es un análisis de textura de la imagen de la DEXA que correlaciona con la microarquitectura del hueso108,109. Los autores demostraron además que la asociación entre TBS y fractura fue independiente de la DMO y otros factores de riesgo. Sin embargo, esta muestra era escasa en pacientes con ERC (especialmente avanzada) por lo que se necesitaría validación ulterior24,31. En pacientes trasplantados se han descrito hallazgos similares110.
Como se ha mencionado, el uso de TC cuantitativo sí puede distinguir entre hueso cortical y trabecular. De este modo se ha descrito en el TC cuantitativo que la DMO lumbar cortical es el mejor predictor de fracturas vertebrales en pacientes en diálisis111. El TC cuantitativo de cadera fue superior a DEXA para identificar prospectivamente más pérdida ósea97. Se ha visto también que la disminución de la DMO cortical por TC en área radial aumentaba 16 veces el riesgo de fracturas35 y, recientemente, que la medición por HRpQTC también permitía la visualización de detalles ultraestructurales que podrían mejorar su valor predictivo31,63,112–114. Sin embargo, en otras cohortes no se ha demostrado mejor rendimiento que la DEXA102. Por supuesto, el HRpQTC tampoco proporciona información sobre recambio óseo y mineralización como la biopsia ósea, es caro y escasamente disponible63.
Otras pruebas que se utilizan como cribado poblacional por su portabilidad son el DEXA periférico (antebrazo, dedo o talón) y la densitometría ósea cuantitativa por ultrasonidos (QUS por su acrónimo inglés), habitualmente en el calcáneo. Sus resultados no son equivalentes a DEXA, son técnicas con menor precisión y exactitud, su utilidad es limitada y resultados anormales deberían confirmarse con DEXA central33. En investigación se han utilizado otras técnicas no invasivas para evaluar también la calidad del hueso como la resonancia magnética y distintos métodos espectroscópicos63. Subrayamos el desarrollo de la técnica de microindentación ósea que permite determinar directamente, mediante un impacto microscópico, la resistencia mecánica del hueso a su penetración115–118.
Parámetros bioquímicos y riesgo de fracturaUna revisión detallada de la utilidad de biomarcadores de remodelado óseo en el diagnóstico y manejo terapéutico de la ODR y/o pacientes con OP, está más allá de los objetivos de esta revisión, por lo que remitimos al lector a las guías generales y otras revisiones recientemente publicadas8,13,27,96,119. De todos modos, es necesario recordar que en ausencia de biopsia ósea, y a pesar de diversas controversias, la PTH intacta y/o la fosfatasa alcalina ósea son los mejores biomarcadores subrogados (aunque subóptimos) del patrón histológico en la ERC112. La PTH intacta (curva en U o J invertida) y la fosfatasa alcalina (relación lineal) también se asocian claramente con la supervivencia de estos pacientes120,121, describiéndose la menor mortalidad en pacientes en diálisis con PTH entre 150-300 pg/ml (2X-5X el límite superior de la normalidad)120,122,123, o aproximadamente 400 pg/ml en un estudio reciente124.
Existe un cierto consenso en que la mejor sensibilidad y especificidad de la PTH en pacientes en diálisis es en el rango bajo de los niveles de PTH, asociándose a EOA (i.e. niveles de PTH inferiores a 2X el límite bajo de la normalidad)16 o bien en niveles muy altos de PTH (9X el límite superior de la normalidad), donde se asocia a osteítis fibrosa secundaria al hiperparatiroidismo. Tanto los niveles bajos como elevados de PTH se han asociado a disminución de la DMO y una alta incidencia de fracturas77,83,125–127. Así, Atsumi et al. describieron que los pacientes japoneses con PTH en el tercil menor tenían un riesgo 2,4 veces mayor de fractura vertebral que los del tercil medio y 1,6 mayor que los del tercil más alto127. Por el contrario, en el estudio DOPPS, eran niveles > 900 pg/ml los que se asociaban con la mayor prevalencia de fracturas128. La variabilidad de la asociación de la DMO-fractura con otros parámetros se evidencia al observar que esta fue menos pronunciada en pacientes con PTH > 65 pg/ml en comparación a una PTH < 65 pg/ml106. Por otra parte, en otra muestra de pacientes japoneses en hemodiálisis, se observó que tanto niveles de PTH inferiores como superiores a los clásicos 150-300 pg/ml se asociaban a fracturas incidentes (HR 3,47 y 5,88, respectivamente)105. En este mismo estudio, la elevación de fosfatasa alcalina ósea también se asoció a fracturas incidentes.
Por otra parte, en pacientes en estadios 1-3 y posiblemente 4, no existen datos claros que sugieran que los biomarcadores (como aumentos moderados de PTH) se asocien a un descenso de la resistencia ósea o aumento de fracturas por lo que, en ausencia de anormalidades metabólicas claras y persistentes, la primera causa de fractura en estos pacientes podría ser la OP «clásica»94 para la cual tendríamos la posibilidad de nuevas intervenciones terapéuticas24,63,96.
Existe poca información sobre los niveles plasmáticos de vitamina D (calcidiol [25OH-vitamin D]), histología ósea y riesgo de fractura en pacientes con ERC127. Se han correlacionado niveles bajos de calcidiol (< 20 ng/ml) con la tasa de formación ósea, velocidad de síntesis de osteoide, mineralización y parámetros estáticos histomorfométricos en pacientes en diálisis129. En otras poblaciones con ERC, tanto en diálisis como no, se describe una correlación entre niveles de vitamina D y DMO lumbar o radial40,130–133; sin embargo, otros estudios no muestran dicha asociación134. En el estudio de Ambrus et al., tanto los niveles disminuidos de calcidiol como niveles bajos de PTH eran, entre otros, factores predictores independientes de riesgo de fractura132. Por todo ello, la medición de los niveles de calcidiol podría ayudar a la correcta suplementación de estos pacientes18,135,136.
En general, la utilidad clínica de otros biomarcadores (propéptidos, telopéptidos, etc.) en pacientes con ERC y/o su relación con predicción de pérdida de masa ósea o respuesta al tratamiento9 es escasa y sin claros beneficios para la práctica clínica diaria27. La mayoría de los biomarcadores tienen excreción renal94, por lo que con la ERC pueden elevarse de manera independiente y, por otro lado, algunos están significativamente influidos por la hemodiálisis137. Algunas publicaciones recientes, pendientes de confirmación, muestran potencial utilidad predictiva de algunos nuevos marcadores como FGF-23 o esclerostina97,138–141. FGF23 podría ser un marcador de mineralización ósea (inversamente relacionado con acumulación de osteoide)142 al regular la fosfatasa alcalina no tejido-específica, independientemente de Klotho, a través del receptor FGFR3140 y el exceso de FGF23 presente en la ERC (asociado negativamente con la DMO)143 podría contribuir a la pérdida ósea a través de la estimulación de Dkk1 por un mecanismo klotho-dependiente144. En cualquier caso, es evidente que la utilidad de todos estos biomarcadores en el contexto de la ERC y/o la OP es aún muy deficiente.
Biopsia óseaEl doble marcaje con tetraciclinas continúa siendo el «patrón oro» para evaluar el recambio óseo y otras dimensiones de la ODR112,145,146, aunque su uso es infrecuente por las dificultades logísticas que conlleva. Sin embargo, no existe hasta ahora evidencia de asociación entre fracturas, tipo de ODR o variables histomorfométricas27,63 por lo que se hacen necesarios estudios prospectivos diseñados para comparar DEXA, HRpQCT e histomorfometría63. Nuevas perspectivas en la evaluación de hueso cortical y técnicas inmunohistoquímicas podrían revalidar la necesidad de biopsias óseas en el contexto nefrorreumatológico145, además de ayudar a distinguir entre OP y formas «clásicas» de ODR (especialmente EOA). De este modo se ha descrito recientemente que la DMO femoral se asocia con la porosidad cortical146, o que el grado de ERC se asocia a corticales más delgadas que pueden contribuir a su alta tasa de fractura147. Por otra parte, aunque no se ha demostrado definitivamente que la administración de un agente antirresortivo sea causa de EOA96 o que su administración a un paciente con EOA sea dañino para la resistencia ósea, parecía razonable hasta la publicación de las nuevas guías96, excluir EOA antes de iniciar estas medicaciones, especialmente en pacientes con FGe<30ml/min/1,73m213,14,94.
Por el contrario, la aparición del concepto de «OP urémica» lleva a algunos autores a aventurar la posibilidad de un cambio de paradigma sobre el patrón oro histológico17,24. De hecho, se razona que el remodelado óseo y la velocidad de mineralización quizá no son los factores más determinantes de fractura ya que la relación de estos factores y las propiedades químicas del hueso son aún muy desconocidas17. Ya hemos comentado que no es evidente que las alteraciones del metabolismo mineral sean determinantes importantes de fracturas en pacientes con ERC82, que el papel de la PTH (en sus dos extremos) es controvertido o marginal y tampoco se ha descrito relación de los niveles de calcio y fósforo con el riesgo de fractura83,125. Estos datos sugieren que la prevención de fracturas en el paciente con ERC debe tener en cuenta otros factores comunes con la población general y no estrictamente relacionados con los objetivos clásicos de nuestra intervención3,24,82. Por el contrario, debemos recordar, desde el punto de vista práctico, que la biopsia ósea fue recomendada en las guías KDIGO 2009 antes de iniciar tratamiento antirresortivo en pacientes con FGe<30ml/min/1,73m2, pero las dificultades logísticas que supone (práctica de biopsia y diagnóstico externo), podrían limitar tratamientos necesarios en pacientes con ERC24. Estos aspectos y sus repercusiones terapéuticas serán discutidos en la segunda parte de esta revisión18.
ConclusiónLos pacientes con ERC presentan un riesgo más elevado de sufrir fracturas óseas que la población general, incluso más evidente en fracturas no vertebrales que vertebrales. Dada la asociación entre fracturas y aumento de morbimortalidad, creemos que los nefrólogos deberían evaluar otros factores de riesgo y cuantificar el riesgo de fractura (especialmente en pacientes con ERC leve-moderada) con métodos y herramientas similares a los utilizados en la población general (i.e. FRAX®, DMO). De hecho, se ha demostrado en varios estudios su capacidad predictiva, aun en presencia de ERC. Por ello, las nuevas guías KDIGO 2017 sugieren la evaluación de la DMO en los pacientes con ERC 3a-5D con evidencia de CKD-MBD y/o factores de riesgo de OP para valorar el riesgo de fractura si sus resultados pueden impactar decisiones terapéuticas (evidencia 2B)96. Ello podría implicar intervenciones adicionales para reducir las caídas y usar medicamentos para la OP ante una DMO baja o disminución progresiva de la misma. Por ello, creemos que al menos en grupos seleccionados de pacientes con factores asociados a un elevado riesgo de fractura, ausencia de alteraciones bioquímicas severas y/o determinaciones sucesivas (i.e. bianuales) que evidencien una pérdida ósea franca101, debería considerarse de forma individualizada el potencial tratamiento de la OP y evitar nihilismo terapéutico. La disponibilidad de biopsia ósea no debiera ser siempre un factor limitante24,96. Finalmente, enfatizamos que el nefrólogo debería prestar mucha atención a la información emergente en esta área, relativamente nueva, mientras se realizan estudios prospectivos que no deberían excluir sistemáticamente a los pacientes con ERC.
Conceptos clave- •
La OP y la ERC influyen de manera independiente en la salud ósea y cardiovascular.
- •
Los pacientes con ERC pueden presentar también OP «clásica», como la asociada a edad y/o sexo.
- •
Un número significativo de pacientes con ERC presentan una disminución significativa de la DMO.
- •
La disminución de la DMO condiciona no solo un alto riesgo de fractura sino también un incremento importante de la morbimortalidad asociada.
- •
Se ha demostrado que una DMO disminuida es también predictiva del riesgo de fractura en pacientes con ERC aunque, especialmente en estadios 4-5D, podría subestimar el riesgo de fractura.
- •
La DMO por sí sola no permite distinguir entre las causas que la originan (hiperparatiroidismo, enfermedad adinámica del hueso y/u osteoporosis senil, etc.).
- •
En los pacientes con ERC (especialmente leve-moderada) deberían valorarse los factores de riesgo de fractura y posiblemente cuantificar este riesgo (i.e. con FRAX®) de modo similar a la población general.
- •
Las guías KDIGO 2017 sugieren la evaluación de la DMO en los pacientes con ERC con evidencia de CKD-MBD y/o factores de riesgo de OP para valorar el riesgo de fractura si sus resultados pueden impactar decisiones terapéuticas.
- •
Al menos en grupos seleccionados de pacientes y de forma individualizada (i.e. con factores asociados a un elevado riesgo de fractura y en ausencia de alteraciones bioquímicas severas y persistentes), debería considerarse el potencial tratamiento de la OP, con biopsia ósea previa o no.
- •
Las nuevas guías orientan a evitar el nihilismo terapéutico por la reconocida importancia de las fracturas y sus complicaciones en la ERC.
Los autores declaran no tener ningún conflicto de intereses.
La presente revisión incluye autores que pertenecen a la Red Nacional RedinRen (RD06/0016/0001 y RD12/0021/0033), la Red de Biobancos Nacional Española (RD09/0076/00064) y al Grupo Catalán de Investigación AGAUR (2009 SGR-1116), así como colaboradores de la Fundación Iñigo Álvarez de Toledo (FRIAT). Queremos agradecer también al Sr. Ricardo Pellejero su importante labor de asistencia bibliográfica.












![Relación entre Chronic Kidney Disease - Mineral and Bone Disorder (CKD-MBD), osteodistrofia renal (alteración ósea secundaria a la presencia de enfermedad renal crónica [ERC]) y OP (relacionada con la uremia o la edad y sexo de los pacientes, entre otros factores). La resistencia ósea viene determinada no solo por la densidad mineral ósea sino también por la calidad del hueso, expresado por sus determinantes94,151. Aunque algunos autores utilizan el término OP «urémica»17, no debemos olvidar a la ERC no terminal, pudiendo integrarse dentro del complejo CKD-MBD al poder condicionar su empeoramiento. Adaptada de Moe151 y West et al.94.](https://static.elsevier.es/multimedia/02116995/0000003800000005/v1_201810110611/S0211699518300444/v1_201810110611/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w94GCRvdQBB6xyQjMrWMzrts=)
![Cálculo de probabilidad de fractura con ayuda de FRAX® (fracture probability según los factores de riesgo [CRF]). Los niveles de riesgo de fractura altos (high), intermedios (intermediate) y bajos (low) son variables según guías y países. En Estados Unidos y Reino Unido se considera que un riesgo de fractura mayor osteoporótica a los 10 años ≥ 20% o un riesgo de fractura de cadera ≥ 3% es elevado, 10-20% como riesgo intermedio (aconsejaría densitometría [BMD, bone mineral density] y recálculo) y < 10% como riesgo bajo (cifras basadas en coste-efectividad). Algunas guías (ver fig. 4) recomiendan recalcular FRAX (reassess probability) con DMO tanto para los pacientes con riesgo intermedio como elevado para tartar (treat) (la DMO también servirá para valorar la respuesta al tratamiento)26.](https://static.elsevier.es/multimedia/02116995/0000003800000005/v1_201810110611/S0211699518300444/v1_201810110611/es/main.assets/thumbnail/gr3.jpeg?xkr=ue/ImdikoIMrsJoerZ+w94GCRvdQBB6xyQjMrWMzrts=)
![Representación esquemática de la aproximación semicuantitativa de Genant para la medición visual de deformidades vertebrales. Normal = 0; leve = 1; moderada = 2; severa o grave = 3; dudosa = 0,5. El diagnóstico de fractura vertebral es frecuentemente casual (fractura morfométrica) aunque puede ser clínico. Se basa en la pérdida de altura del cuerpo vertebral superior al 20% en cualquiera de los segmentos vertebrales. El cálculo se realiza según la fórmula ([altura posterior el cuerpo vertebral– altura menor]/altura posterior) x100115,152.](https://static.elsevier.es/multimedia/02116995/0000003800000005/v1_201810110611/S0211699518300444/v1_201810110611/es/main.assets/thumbnail/gr5.jpeg?xkr=ue/ImdikoIMrsJoerZ+w94GCRvdQBB6xyQjMrWMzrts=)