Introducción: Aunque el cinacalcet ha mejorado el control del hiperparatiroidismo secundario en hemodiálisis, todavía un 50% de los pacientes no alcanzan las cifras de PTH recomendadas por las guías K/DOQI. El objetivo de este estudio fue analizar la eficacia del tratamiento del hiperparatiroidismo secundario con cinacalcet en pacientes no seleccionados en hemodiálisis crónica, de acuerdo con los objetivos marcados por las guías K/DOQI y KDIGO. Además, investigamos qué factores pueden influir en el grado de respuesta del hiperparatiroidismo secundario a cinacalcet. Material y métodos: Recogimos retrospectivamente la evolución de 74 pacientes en hemodiálisis con hiperparatiroidismo secundario que fueron tratados con cinacalcet durante al menos 6 meses. Resultados: De acuerdo con las guías K/DOQI, la proporción de pacientes con PTHi >300 pg/ml se redujo al 50%, la presencia de hiperfosforemia descendió del 38,4 al 23,3% y el producto Ca x P >55 mg2/dl2 bajó de 37,8 a 15,1%. La prevalencia de hipocalcemia aumentó de 2,7 al 12,3%. Con respecto a las guías KDIGO, la proporción con PTHi >600 pg/ml se redujo desde 41,1 al 16,4% y la de hiperfosforemia del 68,5 al 52,1%; pero al considerar a pacientes con PTHi inicial >600 pg/ml, la prevalencia de P >4,5 mg/dl descendió de 83,3 del 55,2%. Observamos un incremento de la dosis de carbonato cálcico (basal 0,61 ± 1,53 g de calcio elemento/ día frente a final 0,95 ± 1,98 g de calcio elemento/día; p = 0,03), debido más a la hipocalcemia que a la necesidad de quelar el fósforo. Encontramos menores descensos de la PTHi entre los pacientes que tenían prescrito inicialmente más sevelamer, y al final del seguimiento presentan mayores niveles séricos de PTHi (no sevelamer: 312 ± 245 pg/ml; sevelamer <6,4 g/día: 510 ± 490 pg/ml; sevelamer >6,4 g/día: 526 ± 393 pg/ml; p = 0,04) y de fósforo (no sevela mer: 4,5 ± 1,2 mg/dl; sevelamer <6,4 g/día: 4,2 ± 1,5 mg/dl; sevelamer >6,4 g/día: 5,7 ± 0,9 mg/dl; p = 0,01). El tratamiento asociado con paricalcitol no mostró ninguna influencia en el grado de respuesta. Los pacientes que alcanzaron los objetivos de PTH mostraron ya a los 3 meses de tratamiento un mayor descenso en los niveles séricos de PTHi (159 ± 84 frente a 630 ± 377 pg/ml; p <0,001), con dosis significativamente menores de cinacalcet (33,8 ± 22,5 frente a 51,1 ± 25,1 mg/día; p = 0,003). Con análisis multivariante, el grado de reducción de la PTHi dependió de sus cifras séricas iniciales y de la dosis inicial de sevelamer. Conclusiones: Cinacalcet mejora el control del hiperparatiroidismo secundario, si bien la respuesta es menor en los casos de mayor gravedad, representados por niveles más altos de PTH y mayores dosis iniciales de sevelamer. Por el contrario, un descenso importante de PTH a los 3 meses con dosis relativamente bajas de cinacalcet sería un marcador pronóstico de buena respuesta.
Introduction: Although cinacalcet has improved the control of secondary hyperparathyroidism in haemodialysis, 50% of patients still do not reach the PTH figures recommended by the K/DOQI guidelines. The objective of this study was to analyse the efficacy of treatment of secondary hyperparathyroidism with cinacalcet in unselected patients on chronic haemodialysis, according to the objectives set by the K/DOQI and KDIGO guidelines. Furthermore, we investigate what factors may influence the degree of secondary hyperparathyroidism response to cinacalcet. Material and methods: We retrospectively collected the evolution of 74 patients on haemodialysis with secondary hyperparathyroidism that were treated with cinacalcet for at least six months. Results: In accordance with K/DOQI guidelines, the proportion of patients with iPTH > 300pg/ml was reduced to 50%, the presence of hyperphosphataemia fell from 38.4 to 23.3% and the Ca x P product > 55mg2/dl2 fell from 37.8 to 15.1%. The prevalence of hypocalcaemia increased from 2.7 to 12.3%. With regard to the KDIGO guidelines, the proportion with iPTH > 600 pg/ml was reduced from 41.1 to 16.4% and that of hyperphosphataemia from 68.5 to 52.1%. However, when considering patients with initial iPTH > 600pg/ml, the prevalence of P > 4.5mg/dl fell from 83.3 to 55.2%. We observed an increase in the dose of calcium carbonate (baseline 0.61 ± 1.53g of elemental calcium/day versus final 0.95 ± 1.98g of elemental calcium/day; p = 0.03), due more to the hypocalcaemia than to the need to bind the phosphorus. We found smaller decreases in iPTH between the patients that had initially been prescribed more sevelamer, and at the end of follow-up they showed higher serum iPTH levels (no sevelamer: 312 ± 245pg/ml; sevelamer <_6.4g/ day: 510 ± 490pg/ml; sevelamer >6.4g/day: 526 ± 393pg/ml; p = 0.04) and phosphorus levels (no sevelamer: 4.5 ± 1.2mg/dl; sevelamer <_6.4g/ day: 4.2 ± 1.5mg/dl; sevelamer >6.4 g/ day: 5.7 ± 0.9mg/dl; p = 0.01). The treatment associated with paricalcitol did not show any effect on the degree of response. The patients that achieved the PTH objectives already showed a major decrease in the serum iPTH levels after 3 months of treatment (159 ± 84 versus 630 ± 377pg/ml; p < 0.001) with significantly lower doses of cinacalcet (33.8 ± 22.5 versus 51.1 ± 25.1mg/day; p = 0.003). With multivariate analysis, the degree of reduction in iPTH depended on its initial serum readings and on the initial sevelamer dose. Conclusions: Cinacalcet improves control of secondary hyperparathyroidism, although the response is lower in more severe cases, respresented by higher levels of PTH and higher initial doses of sevelamer. On the other hand, a significant decrease in PTH at 3 months with a relatively low dose of cinacalcet would be a prognostic marker for good response.
INTRODUCCIÓN
En los últimos años se han introducido nuevos fármacos en la práctica clínica diaria que han ido mejorando el grado de control del hiperparatiroidismo secundario (HPTS), tales como el calcitriol, los activadores selectivos del receptor de la vitamina D (paricalcitol) y los nuevos captores de fósforo libres de calcio, como sevelamer y carbonato de lantano. A pesar de este arsenal terapéutico, conseguir los objetivos marcados por las guías K/DOQI continúa siendo una tarea difícil en un importante porcentaje de pacientes. Cinacalcet es un agente calcimimetico oral que actúa sobre el receptor sensible al calcio, que es el principal regulador de la síntesis y liberación de la parathormona (PTH). La activación de dicho receptor produce una disminución de las concentraciones de PTH y de calcio, y en algunos casos también de fósforo, lo que permite alcanzar los objetivos marcados por las guías1-3.
Lindberg1 demostró la eficacia de cinacalcet en el tratamiento del HPTS al conseguir reducir las cifras de PTH intacta (PTHi) en un 36-40% de promedio y también el producto calcio-fósforo en un 50-73%. Sin embargo, se ha analizado poco que factores son los que influyen en la intensidad de la respuesta a cinacalcet. El grado de control obtenido depende de las cifras de PTH previas2,4, de forma que los pacientes con PTH más elevadas tienden a alcanzar con menor frecuencia las cifras de las guías (50% con PTH >800 pg/ml frente a 70- 73% con PTH <800 pg/ml). Asimismo, la asociación de paricalcitol logra incrementar el porcentaje de pacientes con control de la PTH hasta el 62% y del producto calcio-fósforo hasta el 83%4.
Nuestro objetivo en este trabajo ha sido mostrar la eficacia de cinacalcet en el control del HPTS en una población no seleccionada de pacientes en hemodiálisis, más parecida a la práctica real, comparando los resultados alcanzados con los objetivos propuestos por las guías K/DOQI5 y las recientemente publicadas guías KDIGO6. En segundo lugar, nos propusimos analizar qué factores pueden influir en el grado de respuesta de la PTH a cinacalcet.
PACIENTES Y MÉTODOS
Se trata de un estudio retrospectivo en el que recogimos a todos los pacientes que, llevando más de 3 meses en hemodiálisis, hubieran recibido tratamiento con cinacalcet para el HPTS durante al menos seis meses. Los pacientes incluidos no eran coincidentes en el tiempo y fueron tratados con cinacalcet entre abril de 2005 y abril de 2008.
Como parámetros analíticos incluimos calcio total, fósforo y PTHi sérica (quimioluminiscencia con anticuerpos monoclonales selectivos, Beckman-Izasa) antes del tratamiento con cinacalcet (basal o B), a los 3, 6 y 9 meses, y al final del seguimiento (final o F), así como hemoglobina, hematocrito y bioquímica sérica habitual antes y al final del tratamiento con cinacalcet. Todos los pacientes fueron dializados con un bano de calcio con 1,5 mmol/l, con 3 sesiones semanales de 3-4 horas de duración. Recogimos dosis administrada de cinacalcet inicial, dosis máxima y dosis al final del seguimiento, que fue la del último control realizado o cuando se suspendió. También se recogió la dosis inicial y final de captores del fósforo (carbonato cálcico y sevelamer; no hubo pacientes con acetato cálcico) y de paricalcitol. Ningún paciente recibía tratamiento con calcitriol oral/i.v. ni con otros captores del fósforo en el periodo de estudio considerado.
El análisis de los datos fue realizado con el paquete estadístico SPSS. Para la comparación de medias empleamos la t de Student para datos pareados y no pareados, y cuando las variables no seguían una distribución normal utilizamos el test de Wilcoxon para muestras pareadas y el test de Mann-Whitney para muestras no pareadas. Para la comparación de grupos realizamos el análisis de la varianza, y en caso de distribuciones no normales, el test de Kruskall- Wallis. Empleamos como técnica de análisis multivariante el análisis de regresión lineal, comprobando que los residuos siguen una distribución normal para comprobar que los datos seguían una distribución normal multivariante. Se considero que existía significación estadística cuando p <0,05.
RESULTADOS
El estudio incluyó a 74 pacientes, con edad 61,7 ± 13,6 años (27-82 años); 42 eran varones (56,8%). El tiempo medio en hemodiálisis fue de 58,3 ± 57,7 meses, y el tiempo de seguimiento del tratamiento con cinacalcet fue de 15 ± 7 meses (6- 34 meses).
Eficacia de cinacalcet en el control del hiperparatiroidismo secundario
La dosis de inicio fue de 30 mg/día de cinacalcet, salvo en un paciente que recibió 30 mg/48 h. Tras cinacalcet, la PTHi descendió de manera significativa respecto a valores basales (647± 329 pg/ml): un 22% a los 3 meses (506 ± 418 pg/ml; p = 0,005), un 28% a los 6 meses (466 ± 361 pg/ml; p = 0,001), un 45% a los 9 meses (362 ± 360 pg/ml; p <0,001) y un 36% al final del seguimiento (403 ± 361 pg/ml; p <0,001). El calcio descendió respecto al basal (9,7 ± 0,8 mg/dl) a los 3 meses (8,9 ± 0,9 mg/dl; p <0,001), a los 6 meses (9,1 ± 0,8 mg/dl; p <0,001), a los 9 meses (9,2 ± 1,0 mg/dl; p <0,001) y en el momento final (9,1 ± 0,8 mg/dl; p <0,001). También descendieron significativamente la fosfatasa alcalina y el fósforo desde valores iniciales (5,3 ± 1,4 mg/dl) a los 3 meses (4,8 ± 1,6 mg/dl; p = 0,011), a los 6 meses (4,7 ± 1,6 mg/dl; p = 0,006), a los 9 meses (4,7 ± 1,7 mg/dl; p = 0,014) y al final del seguimiento (4,6 ± 1,5 mg/dl; p = 0,003).
Al final del seguimiento, la dosis de cinacalcet empleada fue: 30 mg/48 h en 20,3%, 30 mg/día en 43,2%, 60 mg/día en 21,6% y 90 mg/día en 13,9%. La dosis máxima empleada fue: un paciente 110 mg/día, 90 mg/día en 24,3%, 60 mg/día en 31,1%, 30 mg/día en 41,9% y un paciente permaneció con 30 mg/48 h. Tras cinacalcet, la dosis de carbonato cálcico aumentó significativamente (B 0,61 ± 1,53 g de calcio elemento/día; F 0,95 ± 1,98 g de calcio elemento/día; p = 0,03), mientras que no se modificaron globalmente las dosis de paricalcitol (B 1,7 ± 4,8 mg/semana frente a F 2,5 ± 4,9 mg/semana; p = NS) ni de sevelamer (B 2,7 ± 3,7 g/día frente a F 2,1 ± 3,7 g/día; p = NS).
Objetivos de control alcanzados según las guías K/DOQI y KDIGO
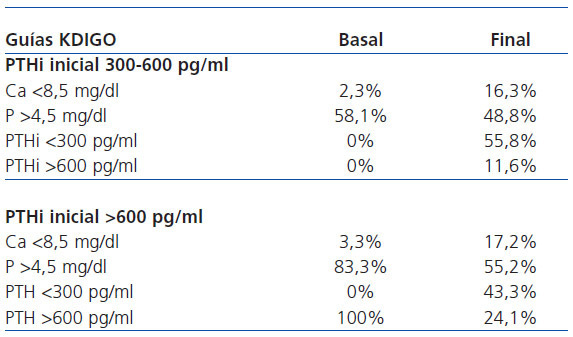
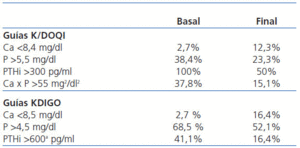
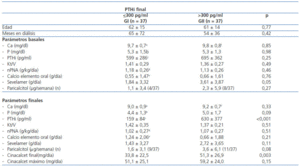
En comparación con las recomendaciones de las guías K/DOQI, antes del tratamiento con cinacalcet el 38,4% tenía un P >5,5 mg/dl, que descendió al 23,3%. La prevalencia de hipocalcemia con Ca <8,4 mg/dl aumentó, pasando de un 2,7 a un 12,3% tras cinacalcet. El porcentaje de pacientes con PTH >300 pg/ml se redujo del 100 al 50%, y el de pacientes con producto Ca x P >55 mg2/dl2 bajó de un 37,8 a un 15,1% (tabla 1).
De acuerdo con las guías KDIGO (tabla 1), tras cinacalcet descendió el número de pacientes con P >4,5 mg/dl del 68,5 al 52,1% y aumentó la prevalencia de pacientes con Ca <8,5 mg/dl, que pasó del 2,7 al 16,4%. Asimismo, el porcentaje de pacientes con PTHi >600 pg/ml descendió del 41,1 al 16,2% (las guías KDIGO recomiendan mantener sus niveles entre 2 y 9 veces los límites normales según la técnica utilizada, y consideran como objetivo conseguir PTHi <600 pg/ml, ya que por encima de estas cifras existe una mayor mortalidad por todas las causas en el estudio DOPPS).
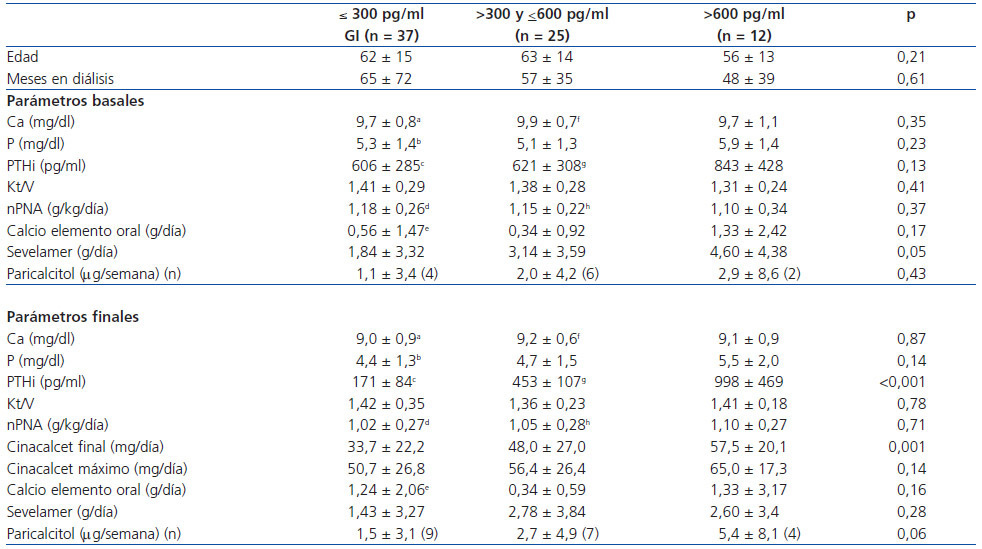
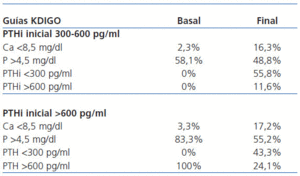
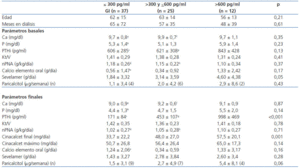
Los objetivos conseguidos en el grado de control de diferentes parámetros del metabolismo óseo-mineral dependen de la cifra de partida de la PTHi (tabla 2). Cuando partían de una PTHi >600 pg/ml, el porcentaje de pacientes con P >4,5 mg/dl pasó del 83,3 al 55,2%. Cuando la PTHi estaba inicialmente en 300-600 pg/ml, la prevalencia de pacientes con P >4,5 mg/dl descendió del 58,1 al 48,8%. En ambos casos aumentó la prevalencia de hipocalcemia. En el grupo que basalmente tenían una PTHi de 300-600 pg/ml, observamos que el 55,8% alcanzó una PTHi <300 pg/ml, y en el grupo con PTHi inicial >600 pg/ml lo alcanzaron el 43,3%, permaneciendo con una PTHi >600 pg/ml el 24,1% (tabla 2).
Factores que influyen en el grado de respuesta a cinacalcet
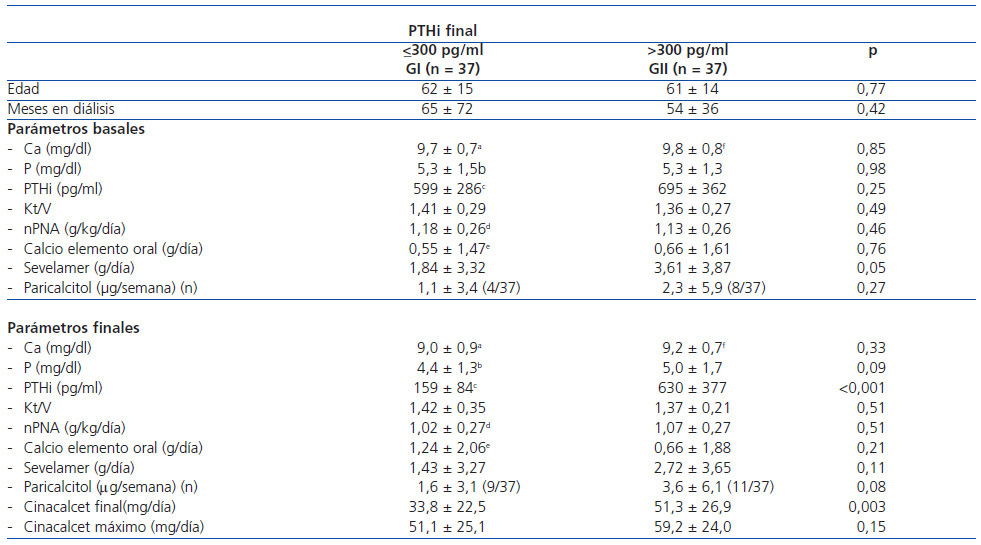
Para analizar qué factores pueden predecir basalmente el grado de respuesta a cinacalcet, dividimos la población según los niveles de PTHi alcanzados al final del seguimiento. Empleamos como punto de corte los niveles objetivo para la PTH marcados por las guías K/DOQI, por lo que hay dos grupos según la PTHi final: según sea ≤300 pg/ml o >300 pg/ml, como se muestra en la tabla 3. Además, también se consideran las cifras objetivo sugeridas por el estudio DOPPS y las guías KDIGO, separando así 3 grupos, como se muestra en la tabla 4. No encontramos diferencias entre los grupos en cuanto a la edad, el tiempo en diálisis ni la proporción de sexos ni de diabéticos.
Al comparar los niveles de PTHi inicial, no observamos diferencias entre los grupos, aunque con los criterios KDIGO los pacientes con niveles finales de PTHi >600 pg/ml mostraron inicialmente niveles séricos de PTHi algo más elevados, pero sin alcanzar diferencias significativas (tabla 4). Tampoco hallamos diferencias en los niveles iniciales de calcio, albúmina, PCRhs, ferritina o hemoglobina/hematocrito. Entre los pacientes con PTHi final >600 pg/ml, el fósforo fue algo más elevado y el Kt/V y la ingesta proteica (nPNA) fueron algo inferiores a los grupos con PTHi final más controlada, aunque esta diferencia no llegó a ser significativa.
En cuanto al tratamiento, la dosis inicial de calcio elemento oral (en forma de carbonato cálcico) o de paricalcitol no fue diferente según la PTHi final alcanzada. Sin embargo, si observamos que la dosis inicial de sevelamer era superior en el grupo con peor control final con criterios K/DOQI (PTHi ≤300 pg/ml 1,84 ± 3,32 g/día frente a PTHi >300 pg/ml 3,61 ± 3,87 g/día; p = 0,05) y también al considerar diferentes grados de control final (PTHi ≤300 pg/ml 1,84 ± 3,32; PTHi >300 pg/ml y ≤600 pg/ml 3,14 ± 3,59; PTHi >600 pg/ml 4,60 ± 4,38 g/día; p = 0,05).
Tras el tratamiento con cinacalcet, el fósforo tendió a ser algo más bajo entre los que consiguieron mejor control final de la PTH (PTHi ≤300 pg/ml 4,4 ± 1,3 mg/dl; PTHi >300 pg/ml y ≤600 pg/ml 4,7 ± 1,5 mg/dl; PTHi >600 pg/ml 5,5 ± 2,0; p = 0,14), sin diferencias en las cifras finales de calcio o del resto de parametros bioquímicos, ni en Kt/V o nPNA. Al final del seguimiento, los que no alcanzaron los objetivos de PTH de K/DOQI recibían mayor dosis final de cinacalcet (PTHi ≤300 pg/ml 33,8 ± 22,5 mg/día; PTHi >300 pg/ml 51,1 ± 25,1 mg/día; p = 0,003), sin observar diferencias significativas en la dosis final de calcio oral, de sevelamer (PTHi ≤300 pg/ml 1,43 ± 3,27 g/dia; PTHi >300 pg/ml 2,72 ± 3,65 g/día; p = NS) o paricalcitol (PTHi ≤300 pg/ml 1,5 ± 3,1 mcg/semana; PTHi >300 pg/ml 3,6 ± 6,1 μg/semana, p = 0,08). Al considerar 3 grados diferentes de control final de PTHi (tabla 4), los resultados fueron similares.
Al comparar la evolución dentro del grupo con PTHi final ≤300 pg/ml, observamos un descenso del calcio (basal 9,7 ± 0,7; final 9,0 ¿} 0,9; p <0,001) y del fósforo (basal 5,3 ± 1,5; final 4,4 ¿± 1,3; p <0,002). Se incrementó la dosis de calcio oral (basal 0,55 ± 1,47; final 1,24 ¿± 2,06 g/día; p = 0,017), sin cambios en la dosis de sevelamer ni de paricalcitol. El grado de ingesta proteica (nPNA) descendió al final del seguimiento (basal 1,18 ± 0,26 g/día; final 1,02 ± 0,27 g/día; p <0,001). En el grupo con PTHi final >300 pg/ml, sólo descendieron significativamente los niveles de calcio (basal 9,8 ± 0,8; final 9,2 ± 0,7; p <0,003), sin cambios en PTHi (basal 695 ± 362; final 630 ± 377; p = NS), fósforo ni demás tratamientos (tabla 3). Al considerar 3 grupos finales de control de PTH, observamos reducción también del calcio y nPNA en aquellos con PTHi en 300-600 pg/ml, sin encontrar cambio alguno en aquellos con PTHi final >600 pg/ml (tabla 4).
Al considerar los momentos intermedios en el seguimiento, observamos que los niveles de calcio y de fósforo a los 3, 6 y 9 meses fueron similares entre los grupos con PTHi ≤300 pg/ml y >300 pg/ml; mientras que los niveles séricos de PTH fueron inferiores en el grupo con PTHi final ≤300 pg/ml desde el tercer mes, reduciéndose un 32% los niveles de PTHi a los 3 meses y un 72% al final de seguimiento, sin cambios significativos en el otro grupo.
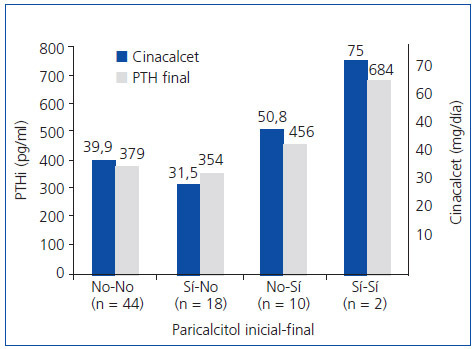
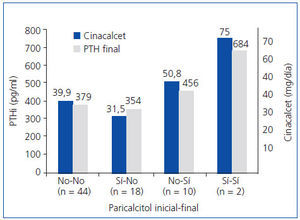
Al analizar la influencia del paricalcitol en el grado de respuesta de la PTH a cinacalcet, no logramos encontrar una clara influencia. El 59,5% (44/74) de los pacientes fueron manejados sin necesidad de paricalcitol. El 24,3% (18/74) iniciaron tratamiento con paricalcitol, que fue retirado durante el seguimiento. El 13,5% (10/74) precisó añadir paricalcitol durante el tratamiento y en el 2,7% (2/74) se mantuvo el tratamiento con paricalcitol que tenía en el momento basal. En la figura 1 se muestran los niveles séricos finales de PTHi y la dosis final de cinacalcet administrada en cada grupo; asimismo, se puede observar cómo los pacientes en los que se añadió paricalcitol o se mantuvo su administración durante el tratamiento con cinacalcet eran los que mayores cifras finales de PTHi mostraron y los que recibieron mayor dosis final de cinacalcet. Por tanto, parece que paricalcitol se añadió fundamentalmente como apoyo al tratamiento con cinacalcet cuando la PTH no descendió lo deseado. Realizamos un análisis multivariante mediante regresión lineal múltiple para buscar qué parámetros basales podrían predecir el grado de respuesta a cinacalcet. Como variables predictoras de las cifras de PTHi final se introdujeron la PTHi, el calcio, el fósforo, la urea y la creatinina, y tomar calcio oral (carbonato cálcico), sevelamer o paricalcitol en el momento basal. Solamente el tomar sevelamer fue un predictor de los niveles finales de PTHi (r = 0,29; p = 0,018). Cuando buscamos predictores del grado de variación de la PTHi (basal-final), encontramos que las variables predictoras fueron sevelamer y PTHi basal (r = 0,59; p <0,001).
Captores de fósforo
La dosis de carbonato cálcico aumentó globalmente durante el tratamiento con cinacalcet de 0,61 ± 1,53 a 0,95 ± 1,97 g/día de calcio elemento (p = 0,03). Antes de cinacalcet, el 23% tomaba carbonato cálcico y un 13,5% tenía prescrito más de 1,5 g de calcio elemento, mientras que al final del seguimiento ascendieron estos porcentajes al 33,8 y al 20,3%, respectivamente (no significativo). Entre los que no lo tomaban al principio, un 19,3% lo precisaron al final, siendo la dosis media final de este grupo de 0,43 ± 1,08 g/día de calcio elemento. Entre los que lo tomaban desde el principio, la dosis media de calcio elemento no se modifico significativamente a lo largo del tiempo (basal 2,65 ± 2,22 frente a final 2,71 ± 3,10 g/día), observando que en el 17,6% fue suspendido al final del seguimiento. La dosis de calcio oral se incrementó significativamente entre los pacientes que al final consiguieron una PTHi <300 pg/ml, sin encontrar por el contrario modificaciones en los grupos con peor control final de la PTH (tablas 3 y 4).
En cuanto a sevelamer, globalmente no encontramos cambios en la dosificación empleada (basal 2,72 ± 6,69 frente a final 2,08 ± 3,50). Pero al considerar solamente los que lo tomaban desde el principio, observamos una reducción significativa de la dosis desde 6,30 ± 2,97 a 4,03 ± 3,77 g/día (p = 0,002). Al inicio del tratamiento con cinacalcet, un 43,2% tomaba sevelamer y al final del seguimiento un 35,1% (no significativo). Considerando los niveles finales de PTHi alcanzados, encontramos que descendió significativamente la dosis de sevelamer entre los que tuvieron PTHi final < 300 pg/ml (basal 6,18 ± 3,20 g/día; final 3,78 ± 4,83 g/día; n = 11; p = 0,038) y entre 301-600 pg/ml (basal 6,03 ± 2,63 g/día; final 4,31 ± 3,18 g/día; n = 13; p = 0,032), pero no los que tuvieron PTH final >600 pg/ml (basal 6,90 ± 3,47 g/día; final 3,90 ± 3,51 g/día; n = 8).
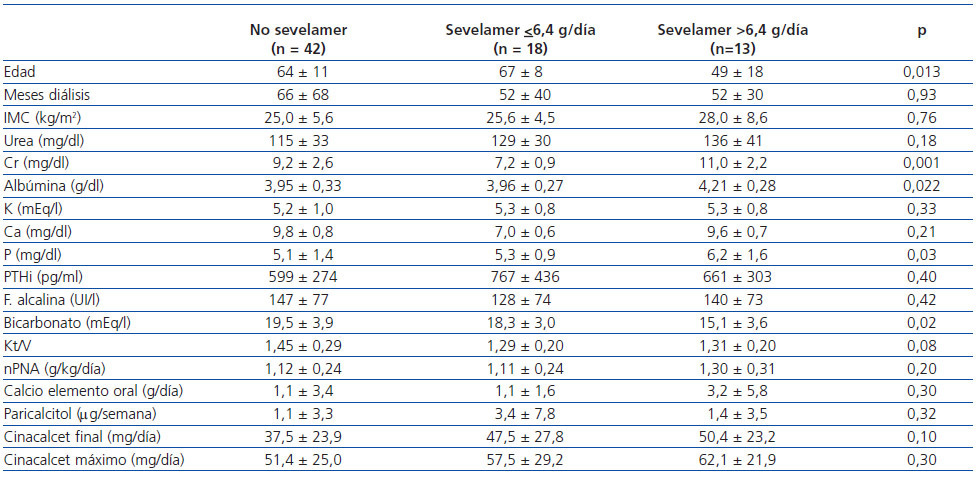
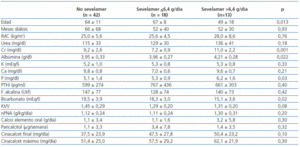
Para intentar aclarar por qué tomar sevelamer se mostró como predictor de una mala respuesta a cinacalcet, analizamos las características de estos pacientes dividiendo a la población en dos grupos: tomadores y no tomadores de sevelamer. A su vez, se dividió a estos últimos en dos grupos según la mediana de la dosis de sevelamer prescrita: dosis ≤6,4 g/día o >6,4 g/día. Las características de las 3 poblaciones antes de iniciar tratamiento con cinacalcet se muestran en la tabla 5. No había diferencias en los niveles de PTHi ni de calcio, pero los pacientes con más dosis de sevelamer si presentaron niveles séricos superiores de fósforo, creatinina y albumina, menores de bicarbonato y mayor ingesta proteica estimada (nPNA); además, eran más jóvenes con carácter significativo y requirieron dosis más altas de cinacalcet (no significativo).
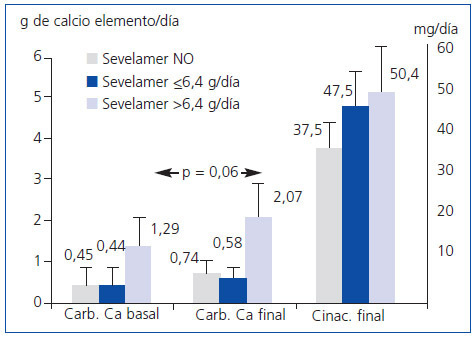
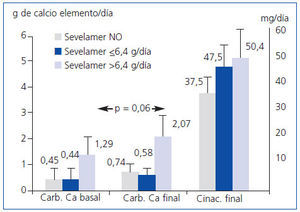
Entre los que no tomaban sevelamer inicialmente, el 61,9% alcanzó PTHi < 300 pg/ml al final del seguimiento, mientras que sólo el 34,4% lo hizo cuando estaba bajo tratamiento con sevelamer (p = 0,019). Sin embargo, no hubo diferencias cuando se compararon tomar o no tomar inicialmente carbonato cálcico. Los pacientes que tomaban en un principio sevelamer mostraron al final del seguimiento niveles séricos más elevados de PTHi (no sevelamer: 312 ± 245 pg/ml; sevelamer ≤6,4 g/día: 510 ± 490 pg/ml; sevelamer >6,4 g/día: 526 ± 393 pg/ml; p = 0,04) y de fósforo (no sevelamer: 4,5 ± 1,2 mg/dl; sevelamer ≤6,4 g/día: 4,2 ± 1,5 mg/dl; sevelamer >6,4 g/día: 5,7 ± 0,9 mg/dl; p = 0,01), sin diferencias en los niveles séricos de calcio. La dosis de carbonato cálcico prescrita ascendió tras el tratamiento con cinacalcet en las 3 poblaciones, aunque no con carácter significativo (no sevelamer: basal 0,45 ± 1,36 frente a final 0,74 ± 1,78 g de calcio/día; sevelamer ≤6,4 g/día: basal 0,44 ± 1,04 frente a final 0,58 ± 0,73 g de calcio elemento/día; sevelamer >6,4 g/día: basal 1,29 ± 2,30 frente a final 2,07 ± 3,1 g de calcio elemento/día; test de Wilcoxon no significativo para comparaciones pareadas dentro de cada grupo). El grupo con mayor sevelamer inicial tenia prescrito al final mayores dosis de calcio elemento, aunque no llegó a ser significativa la diferencia (figura 2).
DISCUSIÓN
Alcanzar los objetivos marcados por las guías de tratamiento del HPTS en hemodiálisis se ha facilitado con la inclusión del cinacalcet en el arsenal terapéutico, ya que permite reducir los niveles séricos de PTH y con frecuencia también los de fósforo y el producto calcio-fósforo de manera importante2,7. En nuestra serie hemos conseguido reducir la prevalencia de PTHi >300 pg/ml al 50% y el número de pacientes con producto Ca x P >55 mg2/dl2 al 15,1%. El desarrollo de hipocalcemia fue significativo, ascendiendo del 2,7 al 12,3%, aunque en ningún momento supuso sintomatología en ningún paciente. Su desarrollo fue independiente del grado de HPTS basal y del grado de control final, y supuso un incremento de la prescripción de carbonato cálcico, pasando del 23 al 33,8% al final del seguimiento. Inicialmente, sólo el 13,5% de los pacientes tenían prescrito más de 1,5 g de calcio elemento, mientras que al final se incrementó al 20,3%, debido más a la intención de mantener las cifras séricas de calcio que por la necesidad de quelar el fósforo.
Algunos autores también han encontrado un incremento de las necesidades de sales de calcio del 48 al 74% de los pacientes2,3, mientras que otros no lo han hecho7. El desarrollo de la hipo- calcemia tras el tratamiento con cinacalcet se cree que es secundario a la frenación de la resorción ósea y a un incremento de la mineralización ósea, objetivada con incrementos transitorios de la fosfatasa alcalina ósea sérica, con un comportamiento que recuerda al del síndrome del «hueso hambriento» que aparece tras la paratiroidectomía8-10. Cuando se realizan biopsias óseas seriadas, se observa una reducción del grado de fibrosis ósea, una mejor mineralización y una reducción del turnover óseo, con cambios histológicos que se relacionan en intensidad con los cambios de los marcadores óseos séricos10.
La eficacia del empleo de análogos de la vitamina D o de activadores selectivos del receptor de la vitamina D asociados a cinacalcet en el tratamiento del HPTS es un tema controvertido. En principio, la reducción provocada en los niveles de calcio y fósforo por cinacalcet permite añadir estos fármacos al tratamiento, posibilitando potenciar la frenación de la síntesis/liberación de PTH por mecanismos diferentes2,7,11. Sin embargo, también podría empeorar el control del fósforo y dar lugar a reducciones inferiores de la PTH de lo que cabría esperar si no se emplearan estos derivados de la vitamina D11. En nuestro estudio no podemos sacar conclusiones de la utilidad de la asociación de paricalcitol a cinacalcet por el propio diseño del estudio y por el pequeño número de pacientes en tratamiento con paricalcitol. Nuestros datos muestran que se retiró en aquellos que lo tenían y que respondieron bien a cinacalcet, y que se añadió en aquellos en los que no se obtuvo buena respuesta, datos también observados por otros autores2,7. En este sentido, al final del tratamiento, los pacientes que estaban bajo tratamiento con paricalcitol eran los que mayor «resistencia» mostraron al cinacalcet.
El grado de reducción de las cifras de PTH a los 3 meses de tratamiento pareció tener un carácter pronóstico: estos pacientes mostraron al final del seguimiento mayores reducciones en las cifras de PTH y necesidad de dosis más bajas de cinacalcet (el 78% de los pacientes con dosis inferiores o iguales a 30 mg/día). En los pacientes que no mostraron tales descensos a los 3 meses de tratamiento, las dosis finales empleadas de cinacalcet fueron más altas (50% de los pacientes con dosis mayores o iguales a 60 mg/día), y el grado de control final conseguido de la PTH fue claramente peor.
En nuestro análisis hemos encontrado que el descenso observado en los niveles séricos de PTH se relaciona con las cifras de partida, como otros autores también han senalado2. Pero igualmente observamos que la respuesta fue peor en los que tenían prescrito sevelamer al iniciar el tratamiento con cinacalcet. Como se refleja en la tabla 5, los pacientes que tomaban sevelamer eran más jovenes, tenían un mayor índice de masa corporal, tenían niveles séricos iniciales más elevados de fósforo, creatinina y albumina, y una mayor ingesta proteica (estimada como nPNA). Todos estos parámetros se podrían traducir en un mejor estado nutricional y una mayor ingesta alimentaria de fósforo, que constituye un factor reconocido que dificulta el control del HPTS. Al final del seguimiento, los niveles de fósforo descendieron en los 3 grupos (datos no mostrados), pero siguieron siendo más elevados en la población que al final mantenía los niveles más elevados de PTH, con también mayores dosis de sevelamer y a pesar del incremento observado en las dosis de carbonato cálcico.
Algunos estudios encuentran que el control del fósforo puede ser igual con quelantes con calcio que con sevelamer, pero que las cifras de PTH suelen mantenerse más elevadas que con quelantes con calcio, achacando este hallazgo a que el calcio se mantiene más alto que con sevelamer12,13, aunque hay incluso estudios que encuentran cifras similares con ambos quelantes14. En nuestro caso no hemos observado grandes diferencias en los niveles de calcio alcanzados en ningún grupo, por lo que podría pensarse en atribuir en general el peor control de la PTH en pacientes tomadores de sevelamer a un mal cumplimiento de la toma de la medicación quelante del fósforo y a la excesiva ingesta de fósforo.
En el análisis multivariante, sólo el tomar sevelamer mostró carácter predictivo junto con los niveles iniciales de PTH sobre el grado de respuesta, sin influir los niveles de fósforo o calcio de partida, o la dosis de quelantes con calcio. Por tanto, en aquellos pacientes que tengan prescrito más sevelamer, al iniciar el cinacalcet, sería recomendable emplear una monitorización más estrecha de sus niveles de calcio, fósforo y PTHi, y ser conscientes de que serán necesarias dosis más elevadas de cinacalcet para conseguir las mismas cifras objetivo de PTHi. De hecho, algunos autores, al revisar las dosis empleadas en función de la gravedad del HPTS, encuentran que las dosis empleadas en casos con HPTS grave no controlado no eran muy diferentes a las de pacientes mejor «respondedores», recomendando entonces que se debería ser mas consciente de que precisaran dosis más elevadas y perseguir este objetivo de forma más perseverante en los casos con menor respuesta10.
El objetivo del tratamiento con cinacalcet se ha enfocado a través de las guías en reducir las cifras de PTH a unos niveles que condicionan menor riesgo de morbimortalidad, junto con la reducción del fósforo sérico y del producto calcio-fósforo. Pero desde el punto de vista práctico, se podría preguntar: ¿se debe perseguir la cifra objetivo de PTH aunque se provoque un aporte suplementario de calcio para lograr paliar la hipocalcemia que se induce? Es posible que en los pacientes con HPTS más grave o con ingestas mayores de fósforo se observe un mayor incremento de las dosis de calcio aportadas para combatir la hipocalcemia, como apuntan nuestros datos. El calcio aportado en mayores cantidades en los pacientes con hipocalcemia se postula que se depositará en el hueso, contribuyendo a reducir la matriz osteoide no mineralizada8. Pero es necesario demostrar que estos suplementos de calcio no contribuyen a incrementar las calcificaciones vasculares en los pacientes precisamente con HPT más severos. Ya hay datos publicados en la literatura que muestra que en modelos experimentales cinacalcet no provoca calcificaciones vasculares, como hace calcitriol15,16. Incluso algunos autores han encontrado que las calcificaciones coronarias17 o las calcificaciones vasculares periféricas18 se reducen tras tratamiento con cinacalcet. Pero un problema aparte puede suponer la inducción de hipocalcemias graves o demasiado rápidas en el afán por corregir la PTH con cinacalcet, que no se sabe si podrían suponer un riesgo añadido de mayor morbimortalidad dentro de la población en hemodiálisis19,20.
En resumen, en nuestra serie hemos constatado como cinacalcet constituye un pilar básico en el tratamiento del HPTS, contribuyendo a cumplir con los objetivos de control del fósforo y del producto calcio-fósforo. Más difícil es, sin embargo, el control de las cifras de PTH que permanece sin alcanzar las cifras recomendadas por las guías, especialmente en aquellos con HPTS más grave y con mayor uso de quelantes como el sevelamer. En estos pacientes, la monitorización deberá ser más estrecha, con el fin de incrementar sensiblemente las dosis de cinacalcet empleadas, persiguiendo claramente un objetivo orientado en la PTH, aunque sin perder de vista las altas cantidades de sales de calcio que podrán ser necesarias y la posible repercusión que esto puede tener sobre las calcificaciones vasculares.
Tabla 1. Grado de control alcanzado según las guías K/DOQI y KDIGO en los diferentes parámetros del metabolismo óseo-mineral
Tabla 2. Grado de control alcanzado según las guías KDIGO y los niveles iniciales de PTH
Tabla 3. Comparación de variables del metabolismo mineral-óseo, adecuación de diálisis y tratamientos recibidos según la PTH final conseguida (t de Student no pareada y pareada)
Tabla 4. Comparación de variables del metabolismo mineral-óseo, adecuación de diálisis y tratamientos recibidos según la PTH final conseguida (ANOVA mediante Kruskall-Wallis para comparación entre grupos y test de Wilcoxon para comparaciones pareadas intragrupo)
Tabla 5. Comparación de diferentes parámetros basales en pacientes según tuvieran prescrito o no sevelamer como quelante del fósforo en el momento basal (ANOVA mediante test de Kruskall-Wallis)
Figura 1. Influencia de paricalcitol sobre el grado de respuesta de la PTH a cinacalcet.
Figura 2. Dosis finales de carbonato cálcico y cinacalcet según la dosis basal de sevelamer.