Introdución: Los niveles bajos de 25 hidroxivitamina D han sido relacionados con un aumento de la morbimortalidad de origen cardiovascular en la población general y en pacientes con enfermedad renal crónica. Objetivo: Nuestro objetivo fue estudiar los niveles de 25 hidroxivitamina D en un grupo de pacientes con enfermedad renal crónica estadios 4 y 5 prediálisis, y relacionarlos con los antecedentes de enfermedad cardiovascular y con factores conocidos de riesgo cardiovascular. Material y métodos: Se trata de un estudio observacional transversal de una cohorte de 171 pacientes seguidos en la consulta prediálisis de nuestro hospital, media de edad 64,16 ± 13 años, el 59,6% hombres, el 64,3% diabéticos, el 47,3% obesos y el 46,8% con antecedentes de enfermedad cardiovascular. A todos los pacientes se les midieron los niveles séricos de 25 hidroxivitamina D y de 1-25 dihidroxivitamina D, se recogieron datos clínicos y analíticos de función renal, anemia, perfil lipídico y metabolismo óseo-mineral; también se evaluó la presión arterial mediante registro ambulatorio de 24 horas (MAPA) y se realizó estudio ecocardiográfico. Resultados: La media de los niveles de 25 hidroxivitamina D fue de 22,1 ± 13 ng/ml, sólo un 18,7% de los pacientes presentaban niveles normales, un 58,5% presentaban niveles insuficientes o bajos y un 22,8% niveles deficientes o muy bajos. Las variables que se asociaron con los niveles bajos de vitamina D fueron la edad, la diabetes, el sexo femenino, la obesidad, el filtrado glomerular y el antecedente de enfermedad cardiovascular. Dentro de los parámetros asociados a la presión arterial, la presión del pulso fur la que más se relacionó con los niveles de vitamina D. No se encontró asociación entre los niveles de 25 hidroxivitamina D con otros parámetros del metabolismo óseo mineral ni con los valores ecográficos de hipertrofia ventricular izquierda. En el análisis multivariante las variables que más se asociaron al déficit de 25 hidroxivitamina D fueron el sexo femenino, el antecedente de enfermedad cardiovascular, el filtrado glomerular y la presión del pulso del MAPA. Conclusiones: Nuestro estudio confirma una alta prevalencia de insuficiencia y deficiencia de 25 hidroxivitamina D en la población con enfermedad renal crónica avanzada; este déficit se asocia con la presencia de factores de riesgo cardiovascular y con el antecedente de enfermedad cardiovascular. Sin embargo, no se encontró ninguna asociación con uno de los principales predictores de eventos cardiovasculares como es la hipertrofia ventricular izquierda.
Background: Decreased 25 hydroxyvitamin D serum levels have been related to an increase in cardiovascular morbility and mortality in both general population and chronic kidney disease patients. The aim of this study was to evaluate the relationship between 25 hydroxyvitamin D serum level, cardiovascular risk factors and previous established cardiovascular disease in a group of patients with advanced chronic kidney disease. Objective: Our aim was to study 25 hydroxyvitamin D levels in a group of patients with stage 4 and 5 chronic kidney disease on predialysis, and link them to history of cardiovascular disease and its known risk factors. Material and methods: We performed a cross-sectional observational study in a cohort of 171 stage 4 and 5 chronic kidney disease outpatients seen in our predialysis clinic, mean age 64.16 ± 13 years, 59.6% were men, 64.3% had diabetes, 47.3% had obesity, 46.8% had previous cardiovascular disease. 25 hydroxyvitamin D and 1-25 dihydroxyvitamin D were measured, we also determined other routine biochemical parameters. All subjects underwent an echocardiogram and 24 hours ambulatory blood pressure monitoring was also performed. Results: Mean 25 hydroxyvitamin D levels were 22.1 ± 13 ng/mL, only 18.7% of the patients had adequate levels, levels were insufficient in 58.5% of the patients and deficient in 22.8% of them. Low 25 hydroxyvitamin D levels were significantly related with age, diabetes, female gender, obesity, MDRD glomerular filtration rate and previous cardiovascular disease. Pulse pressure was the Ambulatory Blood Pressure Monitoring parameter that was better correlated with 25 hydroxyvitamin D levels. We could not find any association between vitamin D levels and other bone and mineral metabolism parameters. No relationship was seen between low vitamin D levels and left ventricular hypertrophy. On multivariate analysis lower levels of 25 hydroxyvitamin D were independently associated with female gender, previous cardiovascular disease, MDRD4-GFR and higher pulse pressure. Conclusions: Our study confirm a high prevalence of 25 hydroxyvitamin D insufficiency and deficiency in advanced chronic kidney disease patients, this was associated with the presence of cardiovascular risk markers and previous established cardiovascular disease. However we could not see any relationship with left ventricular hypertrophy which is a known predictor of future cardiovascular events in this population.
INTRODUCCIÓN
En los ultimos años se ha desarrollado un creciente interés por las acciones de la vitamina D más allá de sus efectos sobre el metabolismo óseo-mineral. En el cuerpo humano existe una amplia distribución de los receptores de la vitamina D no sólo en el intestino, el riñón y el hueso sino también en el cerebro, el corazón, el músculo esquelético, el músculo liso vascular, el páncreas, los linfocitos y los monocitos, cuya activación puede explicar en parte sus efectos sobre la inmunidad, el cáncer o sus efectos cardiovasculares1,2.
Los niveles bajos de 25hidroxivitamina D (25[(OH]D) se han relacionado en la población general con la presencia de hipertensión arterial, hipertrofia ventricular izquierda y mortalidad de origen cardiovascular3-7.
La enfermedad cardiovascular es la principal causa de morbimortalidad en los pacientes con enfermedad renal crónica8. Diversas anormalidades del metabolismo óseo-mineral frecuentes en estos pacientes, como el elevado producto calcio-fósforo, el hiperparatiroidismo y el déficit de vitamina D han sido relacionadas con los eventos cardiovasculares9,10. Se ha demostrado en diferentes estudios que los pacientes con enfermedad renal crónica tanto en diálisis como prediálisis presentan una alta prevalencia de deficiencia e insuficiencia de 25(OH)D. Recientes trabajos han sugerido una relación inversa entre los niveles de 25(OH)D y la mortalidad global y de origen cardiovascular en la población con enfermedad renal crónica11,12 .
En el presente estudio tratamos de evaluar la relación entre los niveles de vitamina D, la hipertensión arterial evaluada mediante registro ambulatorio de 24 horas (MAPA), los parámetros ecocardiográficos de hipertrofia ventricular izquierda y la enfermedad cardiovascular en una cohorte de pacientes con enfermedad renal crónica estadios 4 y 5 seguidos en la consulta de prediálisis.
MATERIAL Y MÉTODOS
Se trata de un estudio observacional, transversal de una cohorte de pacientes con enfermedad renal crónica estadios 4 y 5 no en diálisis seguidos en la consulta de enfermedad rernal crónica avanzada (ERCA) de nuestro hospital durante los años 2008 y 2009.
Pacientes
Fueron estudiados 171 pacientes, el 59,6% hombres, con una media de edad de 64,16 ± 13 años (21-91); el 64,3% eran diabéticos; la media del filtrado glomerular (FG) por MDRD4 era de 20,5 ± 6 ml/min/1,73 m2 (10-30), un 76% estaban en estadio 4 y un 24% estaban en estadio 5, con un índice de masa corporal (IMC) medio de 30 ± 6 kg/cm2 (18-49) (un 47,3% con IMC >30 kg/cm2). Un 26% presentaban antecedentes de cardiopatía isquémica, un 13,5% de accidente cerebrovascular y un 24% de isquemia de miembros inferiores.
Análisis de laboratorio
A todos los pacientes se les midieron los niveles séricos de 25(OH)D2 + D3 mediante inmunoanálisis por quimiluminiscencia (LIASON® 25 OH Vitamin D TOTAL Assay. DiaSorin Inc.) y de 1,25 dihidroxi vitamina D3 por radioinmunoanálsis (RIA INCSTAR Corporation). Se consideró deficiencia o niveles muy bajos de vitamina D cuando los niveles eran inferiores a 15 ng/ml de 25(OH)D, insuficiencia o niveles bajos cuando los pacientes presentaban niveles entre 15 y 30 ng/ml, y niveles adecuados o normales cuando eran mayores de 30 ng/ml, siguiendo los criterios publicados por las guías K-DOQI13.
Los análisis bioquímicos sistemáticos incluyeron hemograma, función renal estimado por la fórmula MDRD4, albúmina, iones, perfil lipídico, calcio, fósforo, fosfatasa alcalina, PTHi, proteinuria en 24 horas, PCR y homocisteína.
Registro de presión arterial
A todos los pacientes se les realizó un registro MAPA de 24 horas mediante un monitor Spacelabs modelo 90217-5 con registros cada 20 minutos en período diurno (de 8 a 21 horas) y cada hora en período nocturno (de 22 a 7 horas) registrando, para cada período, la presión arterial sistólica (PAS) media, la presión arterial diastólica (PAD) media, la presión arterial media, la presión del pulso (PP), el porcentaje de mediciones por encima de la normalidad en cada período y el patrón de depresión nocturna.
Parámetros ecocardiográficos
Se les realizaron a todos los pacientes ecocardiograma modo M y Doppler para valorar el índice de masa ventricular izquierda según fórmula de Deveroux14 (considerándose hipertrofia venticular izquierda por encima de 110 g/m2 en mujeres y 130 g/m2 en hombres); tambien se valoraron el grosor relativo de pared posterior, la geometría del ventrículo izquierdo, la fracción de eyección según método de Teichhols15 y la función diastólica midiendo la relación de la velocidad pico de llenado transmitral precoz y tardía (E/A) considerando disfunción diastólica si E/A <1 o E/A >1,5 con TD <130 ms.
Análisis estadístico
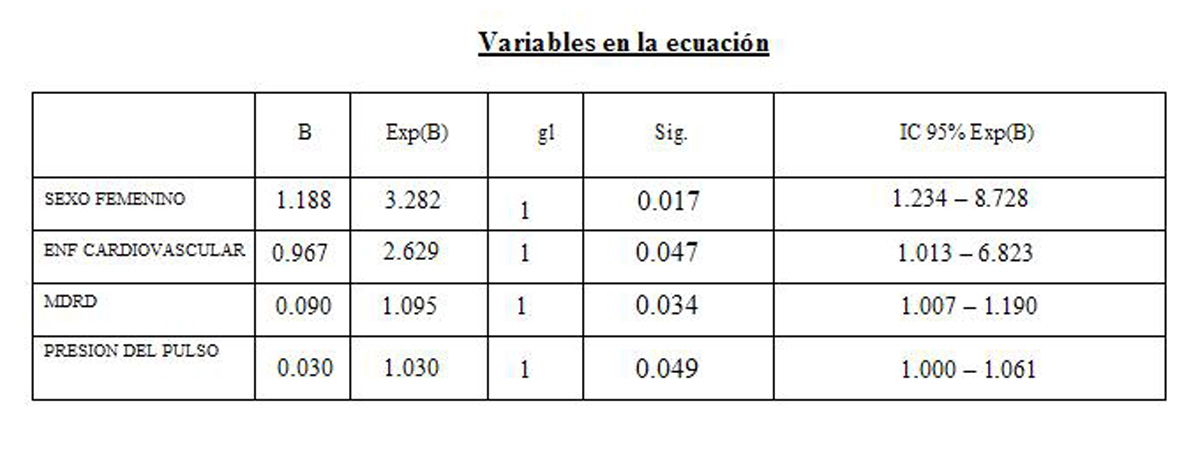
El análisis estadístico se realizó mediante SPSS 17.0. Los datos se exponen como porcentajes para variables categóricas y media con desviación estándar para variables cuantitativas, La comparación de las variables se realizó mediante las pruebas de la t de Student, de la U de Mann-Whitney o de la Chi-cuadrado según correspondiera a la naturaleza de las variables. La correlación entre variables cuantitativas en el análisis univariante se realizó mediante el coeficiente de correlación de Spearman. Se realizó análisis multivariante mediante regresión logística binaria utilizando como variable dependiente los niveles de vitamina D normales (>30 ng/ml) o bajos/muy bajos (<30 ng/ml), e introduciendo las principales variables significativas en el análisis univariante, edad, sexo, diabetes, antecedente de enfermedad cardiovascular, IMC, FG por MDRD-4, PAS en MAPA y PP en MAPA.
RESULTADOS
La media de los niveles de 25(OH)D fue de 22,1 ± 13 ng/ml (5-65), la media de 1-25 dihidroxivitamina D fue de 26,2 ± 12 pg/ml (5-91), observando una tendencia a la correlación entre ambos valores no estadísticamente significativa (r = 0,133; p = 0,08). Treinta y nueve pacientes (22,8%) presentaban deficiencia o niveles muy bajos (<15 ng/ml), 100 pacientes (58,5%) insuficiencia o niveles bajos (15-30 ng/ml) y 32 pacientes (18,7%) tenían niveles normales (>30 ng/ml) de 25(OH)D. Ninguno de los pacientes había recibido suplementos de vitamina D nativa (ergocalciferol, colecalciferol o calcifediol); un 25% de los pacientes estaba en tratamiento con metabolitos activos o análogos de la vitamina D (17% con calcitriol y 8% con paricalcitol); no se observaron difrencias significativas en los niveles de 25(OH)D o 1-25 dihidroxivitamina D entre los pacientes que tomaban vitamina D activa y los que no la tomaban (20,7 ± 9 frente a 22 ± 11; p = 0,435 para 25[OH]D y 24,2 ± 10 frente a 27,4 ± 12; p = 0,133 para 1-25 dihidroxivitamina D). El porcentaje de pacientes tratados con vitamina D activa en el grupo de pacientes con niveles bajos o muy bajos de 25(OH)D era del 26% y en el grupo de pacientes con niveles normales del 24% (no significativo, p = 0,757).
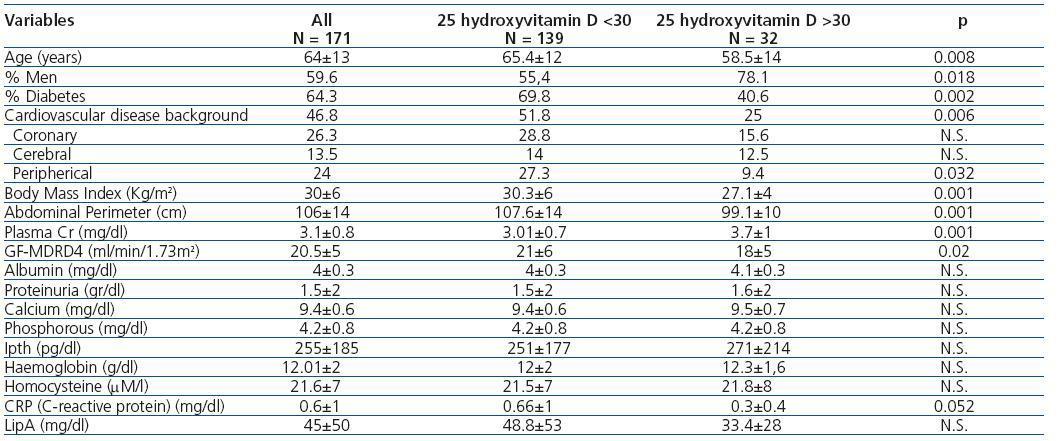
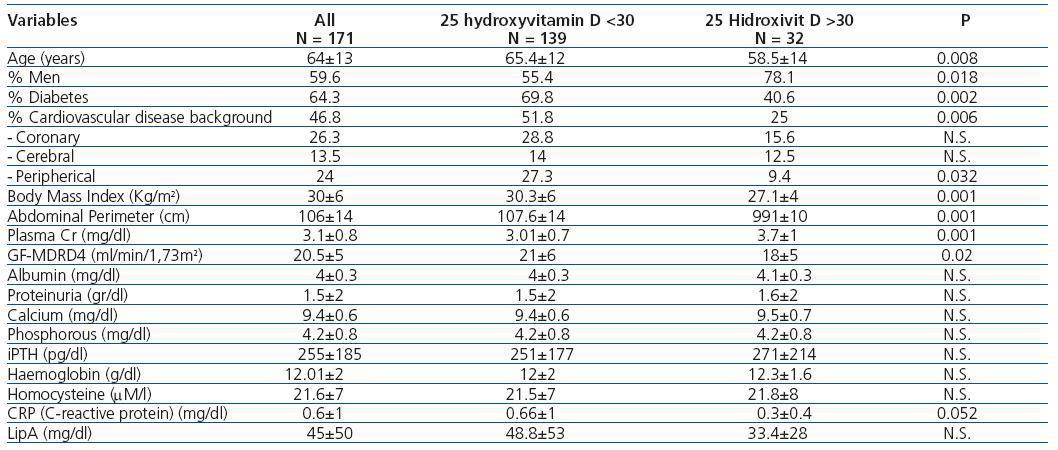
En la tabla 1 se comparan las distintas variables demográficas, clínicas y analíticas entre los pacientes con deficiencia o insuficiencia de 25(OH)D frente a los pacientes con valores normales, destacando que los pacientes con niveles inadecuados presentan mayor edad, mayor porcentaje de mujeres, mayor porcentaje de diabéticos, más antecedentes de enfermedad cardiovascular, mayor obesidad, y mejor FG. En la tabla 2 se exponen las diferencias en las variables demográficas, clínicas y analíticas entre los pacientes con 1-25 dihidroxivitamina D mayor o menor de 25 pg/ml; se eligió arbitrariamente el punto de corte en 25 pg/ml por dividir a nuestra población aproximadamente en el 50% con niveles más bajos frente al 50% con niveles más altos, Como se observa en la tabla sólo hubo diferencias significativas entre ambos grupos en el FG, la albúmina, la proteinuria y los niveles de lipoproteína A.
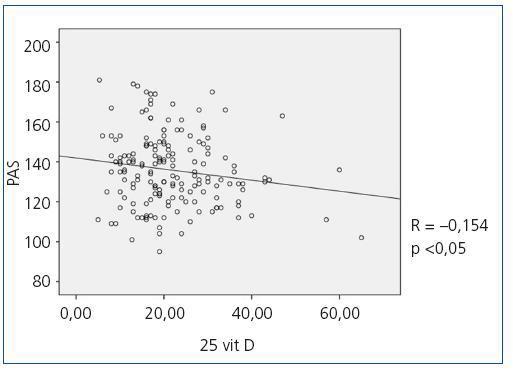
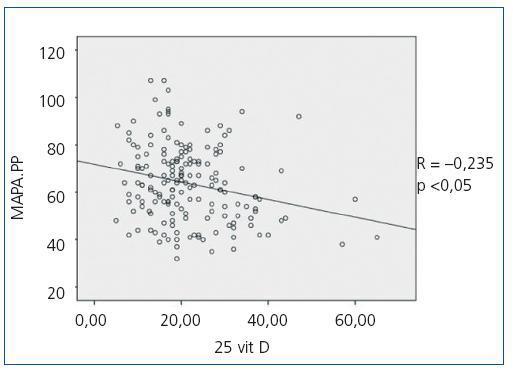
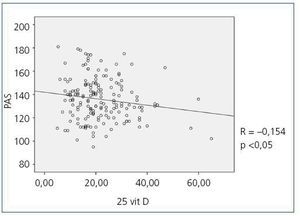
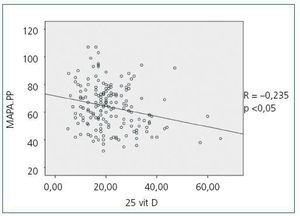
Cuando se compararon los niveles de 25(OH)D con los valores de presión arterial obtenidos con el MAPA se observó una correlación inversa estadísticamente significativa entre los niveles de 25(OH)D y la media de la PAS en todos los períodos (PAS de 24 horas r = —0,154; p <0,05, PAS diurna r = —0,150; p <0,05, PAS nocturna r = —0,155; p <0,05), es deci,r a medida que la PAS aumenta, disminuyen los niveles de 25(OH)D; en la figura 1 se observa la correlación entre 25(OH)D y la PAS de 24 horas. No se observó una correlación estadísticamente significativa entre la media de la PAD en ninguno de los períodos con los niveles de 25(OH)D. Se observó una correlación inversa estadísticamente significativa entre la PP en todos los períodos y los niveles de 25(OH)D de tal manera que a medida que aumenta la PP disminuyen los niveles de 25(OH)D, como se observa en la figura 2 para el período de 24 horas (PP 24 horas r = —0,235; p <0,005, PP diurna r = —0,231; p <0,005, PP nocturna r = —0,204; p <0,01); no se observó diferencia en los niveles de 25(OH)D con los patrones de supresión nocturna. En cuanto a los niveles de 1-25 dihidroxivitamina D, no se observaron correlaciones significativas con ninguno de los parámetros de presión arterial medidos con el MAPA.
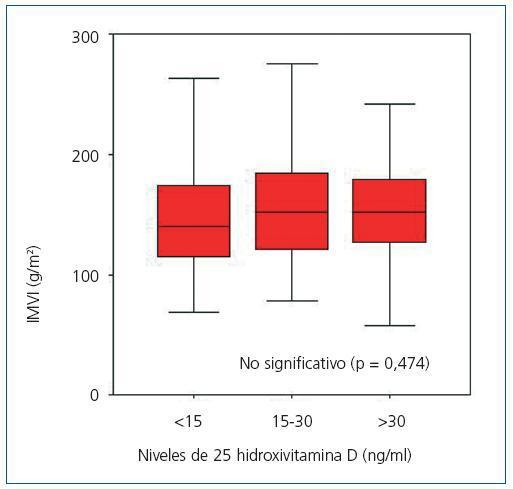
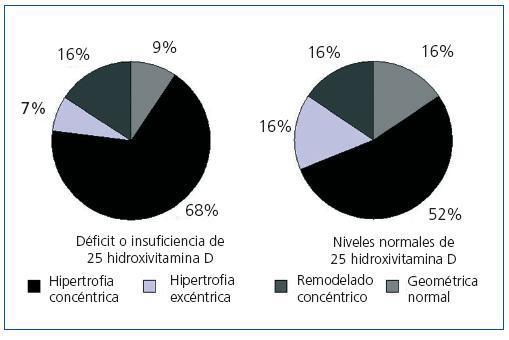
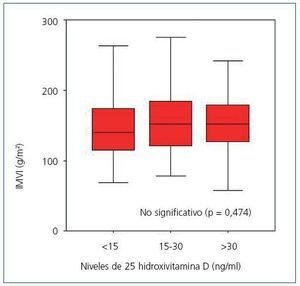
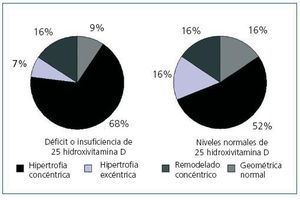
Cuando se compararon los niveles de 25(OH)D con los resultados del ecocardiograma no se encontró ninguna relación entre sus niveles con el índice de masa ventricular izquierda (figura 3): 150 g/m2 (IC 95%, 133-166) para los pacientes con niveles muy bajos, 160 g/m2 (IC 95%, 150-171) para los pacientes con niveles bajos y 152 g/m2 (IC 95%, 135-169) para los pacientes con niveles normales (p = 0,474). El porcentaje de pacientes con criterios de hipertrofia ventricular izquierda entre los pacientes con niveles bajos o muy bajos de 25(OH)D fue del 74,5% y entre los pacientes con niveles adecuados de vitamina D fue del 68,8% (no significativo, p = 0,482). Sin embargo, en la figura 4 se observa cómo los pacientes con deficiencia o insuficiencia de 25 vitamina D muestran una mayor tendencia a la hipertrofia concéntrica que los pacientes con niveles normales mientras que éstos muestran una mayor porcentaje de geometría normal o hipertrofia excéntrica. No se observaron diferencias signifivativas en la función sistólica o diastólica según los niveles de vitamina D.
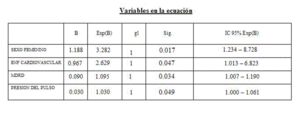
En el análisis multivariante las variables que se relacionaron con los niveles adecuados o no de 25(OH)D fueron el sexo, la PP en el MAPA, el antecedente de enfermedad cardiovascular y el FG por MDRD-4 (tabla 3).
DISCUSIÓN
Como ya han demostrado otros estudios en distintos estadios de enfermedad renal crónica16,17, en nuestro estudio encontramos una alta prevalencia de deficiencia e insuficiencia de 25(OH)D en los pacientes con insuficiencia renal avanzada; este déficit parece mayor que el encontrado en la población general18, y puede ser explicado por muchas razones. Por un lado, los pacientes con enfermedad renal crónica avanzada pueden sufrir un déficit de aporte nutricional por reducción en el consumo de alimentos que son fuente natural de vitamina D y una disminución en la absorción intestinal; además, suelen ser pacientes cuya situación de comorbilidad provoca un deterioro físico que hace que salgan menos al exterior, con lo cual disminuye su exposición a los rayos solares. También se ha sugerido que la uremia per se puede producir un déficit en la síntesis cutánea endógena17. En nuestro grupo de pacientes resulta además muy llamativa la alta prevalencia de niveles bajos o muy bajos de 25(OH)D ya que se trata de pacientes procedentes de la zona sur de la isla de Gran Canaria, que presenta una media de horas de sol en todas las estaciones del año de las mayores de Europa.
En nuestro grupo de pacientes hemos encontrado una relación entre el déficit de 25(OH)D con la edad avanzada y la presencia de diabetes, hallazgos que ya han sido descritos previamente en pacientes con y sin insuficiencia renal19-21 y que se pueden explicar en parte por la menor exposición a los rayos solares debido a la mayor inactividad de los pacientes de edad avanzada, a un menor consumo de nutrientes ricos en vitamina D en ambos grupos, y a la enteropatía autonómica diabética que podría implicar un déficit de absorción22. También hemos encontrado una relación con el IMC y el perímetro abdominal, como se ha descrito en varios estudios que relacionan los niveles de vitamina D con la obesidad en población general23-25. Asimismo, hemos hallado una mayor prevalencia de niveles bajos en el sexo femenino; esto ya ha sido encontrado en otros estudios y es difícil encontrar una explicación, pero se ha implicado diferencias hormonales entre ambos sexos en la génesis de esta diferencia3.
En nuestros resultados observamos que los pacientes con niveles adecuados de 25(OH)D tienen un mayor nivel de creatinina sérica y menor MDRD (3,7 mg/dl frente a 3 mg/dl; p <0,05 y 18 ml/min/1,73 m2 frente a 21 ml/min/1,73 m2; p <0,05); de hecho, el porcentaje de pacientes con niveles adecuados de 25(OH)D es mayor en el grupo de pacientes con ERC en estadio 5 que en el grupo de pacientes con ERC en estadio 4 (el 35 frente al 13%; p <0,005), no observando lo mismo para los niveles de 1-25 dihidroxivitamina D, que son menores conforme disminuye el FG. No encontramos explicación para este dato que parece estar en contradicción con lo publicado en la bibliografía que indica que los niveles de 25(OH)D disminuyen con el FG16.
No hemos encontrado ninguna relación entre los niveles de 25(OH)D con otros parámetros del metabolismo óseo-mineral como los niveles de PTHi, calcio, fósforo, producto calcio x fósforo o fosfatasa alcalina. En algunos estudios, sobre todo en pacientes en diálisis, se ha encontrado una correlación negativa con los niveles de PTHi26. No hemos encontrado ninguna relación con el tratamiento con vitamina D activa o análogos de la vitamina D, sin embargo tenemos que decir que la mayoría de los pacientes estaban en tratamiento con dosis bajas (1 µg semanal de calcitriol o 3 µg semanales de paricalcitol) y llevaban poco tiempo de tratamiento.
En la población general el déficit de vitamina D se ha relacionado con el desarrollo de hipertensión arterial27,28. En nuestro estudio relacionamos los niveles de 25(OH)D con los parámetros de la presión arterial medida por MAPA. Observando una débil correlación inversa de dichos niveles con la media de la PAS en todos los períodos del día y con la PP en todos los periodos del día. No observamos relación con la media de la PAD ni con el patrón de depresión nocturna. Estos datos son compatibles con los resultados de otros trabajos que relacionan el déficit de vitamina D en la enfermedad renal crónica con las calcificaciones vasculares y con un aumento en la rigidez de la pared arterial, que se refleja sobre todo en el aumento de la PP29,30. Las calcificaciones vasculares y la disminución de la distensibilidad arterial con el consiguiente incremento en la PP han sido relacionadas con el incremento en la mortalidad cardiovascular de la insuficiencia renal crónica31,32.
Son varios los estudios que relacionan el déficit de vitamina D con la enfermedad cardiovascular tanto en población general como en pacientes con enfermedad renal crónica33-35; en nuestro estudio observamos una asociación entre los niveles bajos o muy bajos de 25(OH)D y los antecedentes de enfermedad cardiovascular (un 51% de los pacientes presentan algún antecedente de enfermedad cardiovascular frente a un 25% de los pacientes con niveles normales de 25[OH]D); sin embargo, al tratarse de un estudio transversal es difícil inferir algún tipo de causalidad en esta relación, ya que los niveles bajos podrían ser consecuencia de una mayor comorbilidad en este grupo, al asociarse también con la edad avanzada, con la presencia de diabetes y con la obesidad. Se han barajado distintos mecanismos por los cuales el déficit de vitamina D puede incrementar la morbimortalidad cardiovascular; por un lado ya hemos comentado el papel que el déficit de vitamina D puede desempeñar en la pared vascular disminuyendo la distensibilidad de la misma y favoreciendo la calcificación vascular; por otra parte, debido a los efectos inmunomoduladores y antiproliferativos de la vitamina D, su déficit podría propiciar un estado proinflamatorio que ha sido reconocido ampliamente como causa de enfermedad cardiovascular en la enfermedad renal crónica36-38. Por último, la vitamina D ha sido implicada en la inhibición del sistema renina-angiotensina, siendo éste uno de los mecanismos que se ha implicado como causante de hipertensión39. También se ha implicado experimentalmente la ausencia de vitamina D con la hipertrofia de la célula muscular miocárdica40, lo cual podría favorecer la hipertrofia ventricular izquierda; es bien conocido que la hipertrofia ventricular izquierda es uno de los principales factores predictores de mortalidad cardiovascular en la enfermedad renal crónica41. Sin embargo, según nuestros conocimientos, ningún estudio ha podido relacionar el déficit de 25(OH)D con la hipertrofia ventricular izquierda en la enfermedad renal crónica. En nuestro estudio no hemos encontrado ninguna asociación entre ambos; sin embargo, esta falta de asociación puede deberse al limitado número de pacientes del estudio y la alta prevalencia de hipertrofia ventricular izquierda en el grupo estudiado (un 73,7% de los pacientes la presentaban). Por otro lado, sí parece haber una tendencia a una geometría diferente de la hipertrofia ventricular izquierda, ya que el grupo con niveles insuficientes o deficientes de 25(OH)D presenta una mayor proporción de hipertrofia concéntrica que los pacientes con niveles normales, mientras que éstos tienen una tendencia a mayor proporción de pacientes con geometría normal o hipertrofia excéntrica.
En nuestro trabajo no encontramos diferencias en el grado de proteinuria entre los pacientes con niveles normales o bajos de 25(OH)D; sin embargo, sí encontramos una mayor proteinuria entre los pacientes con niveles bajos de 1-25 dihidroxivitamina D. Se ha sugerido que los pacientes con proteinuria nefrótica deberían ser excluidos de los estudios que valoran los niveles de vitamina D por el aumento de las pérdidas urinarias de 25(OH)D y de la proteína que se une al receptor de la vitamina D42. En nuestro estudio, un 18% de los pacientes presentaban proteinuria en rango nefrótico (>3 g/24 h), decidimos no excluirlos del estudio a pesar de que esto pueda suponer una limitación del mismo, pero la exclusión no varíaba los resultados en lo que concierne a la 25(OH)D. No existe ninguna correlación entre la proteinuria y los niveles de 25(OH)D y el porcentaje de pacientes con proteinuria nefrótica no difiere significativamente entre los pacientes con niveles bajos o muy bajos y los pacientes con niveles normales de 25(OH)D (17 frente al 22%) y la media de niveles de 25 (OH)D de los pacientes con proteinuria nefrótica es similar a la del resto de pacientes (21,8 ± 9 frente a 22,6 ± 6; p = 0,518). Quizá la diferencia radica en que en el estudio de Saha42 se estudiaron 50 pacientes con síndrome nefrótico y función renal normal, por lo que la población es diferente. Sin embargo, sí coincidimos con los hallazgos de Koening43 en lo referente a la correlación inversa de la proteinuria con los niveles de 1-25 dihidroxivitamina D (r = —0,428; p <0,005). El porcentaje de pacientes con proteinuria nefrótica es mayor en los pacientes con niveles más bajos de 1-25 dihidroxivitamina D (25 frente al 13%; p <0,005).
Somos conscientes de que este estudio posee numerosas limitaciones, sobre todo el hecho de que se trate de un estudio observacional, de corte transversal, lo cual permite observar algunas asociaciones presentes pero no permite extraer conclusiones sobre su causalidad. Por otro lado, el hecho de que sea un número limitado de pacientes y con un perfil de alta prevalencia de diabetes, enfermedad cardiovascular e hipertrofia ventricular izquierda como corresponde a la población con enfermedad renal crónica avanzada en Canarias, hace difícil que se manifiesten algunas asociaciones más fuertes que a lo mejor estarían presentes si se tratara de una población mayor y con un perfil más favorable. Por ello, sería necesario hacer estudios multicéntricos con un elevado número de casos y un diseño longitudinal para estudiar mejor la asociación entre los niveles bajos de 25 (OH)D y la enfermedad cardiovascular en la enfermedad renal crónica y para la evaluación de posibles estrategias terapéuticas para corregir el déficit de vitamina D en estadios más precoces de la enfermedad renal crónica, ya que en la actualidad no existe ninguna evidencia del beneficio que dicha corrección proporciona a esta población.
En conclusión, creemos que existe una alta prevalencia de deficiencia e insuficiencia de 25(OH)D en nuestra población con enfermedad renal crónica avanzada, que este déficit es mayor en el sexo femenino y que se asocia con una mayor proporción de antecedentes de enfermedad cardiovascular y con un perfil de riesgo cardiovascular mayor, ya que se asocia con la edad avanzada, la diabetes, la obesidad y la hipertensión arterial. Sin embargo, no hemos observado en este estudio ninguna relación significativa entre los niveles de 25(OH)D y la hipertrofia ventricular izquierda.
AGRADECIMIENTOS
Queremos agradecer al Dr. José María Limiñana Cañal, de la Unidad de Investigación del Hospital Universitario Insular de Gran Canaria, su inestimable ayuda en el análisis estadístico.
Figura 1. Correlación bivariada entre la media de la presión arterial sistólica en el MAPA de 24 horas y los niveles de 25 hidroxivitamina D
Figura 2. Correlación bivariada entre la presión de pulso calculada por MAPA de 24 horas y los niveles de 25 hidroxivitamina D
Figura 3. Índice de masa ventricular izquierda según niveles de 25 hidroxivitamina D
Figura 4. Geometría del ventrículo izquierdo según niveles de 25 hidroxivitamina D mayores o menores de 30 ng/ml
Tabla 1. Variables demográficas, clínicas y analíticas según valores normales o bajos de 25 hidroxivitamina D
Tabla 2. Variables demográficas, clínicas y analíticas según valores de 1-25 hidroxivitamina D
Tabla 3. Análisis multivariante, regresión logística para niveles adecuados o no de 25 hidroxivitamina D