NOTA PRELIMINAR
El 15 de marzo de 2012 fuimos invitados a participar en un encuentro en Madrid para debatir sobre algunos aspectos relacionados con el papel de la activación de los activadores de los receptores de vitamina D (RVD) en la optimización del hiperparatiroidismo secundario (HPTS) en diálisis. Entre los participantes había posicionamientos claramente diversos derivados de su propia experiencia en el control del HPTS, desde el enfoque tradicional con activadores de los RVD (ARVD) o con activadores selectivos de los RVD (AsRVD) para algunos o con calcimiméticos (cinacalcet) para otros. Obviamente, las posiciones de expertos vienen sintetizadas en las Recomendaciones de la Sociedad Española de Nefrología para el manejo de las alteraciones del metabolismo óseo mineral en los pacientes con enfermedad renal crónica (ERC)1, por lo que aquí trasladamos son únicamente los puntos que fueron discutidos en esa reunión y el consenso alcanzado por todos los firmantes.
Entre los factores patogénicos responsables del desarrollo del HPTS durante la ERC, la deficiencia de vitamina D es un factor de riesgo conocido. La toxicidad de dosis farmacológicas de metabolitos activos de la vitamina D, en particular el calcitriol, debida principalmente a la elevación de los niveles de calcio y fósforo, motivó el desarrollo de análogos de la vitamina D con menor efecto en el balance positivo de calcio y fósforo2-6. Con mecanismo diferente, la aportación de los calcimiméticos, ocasionalmente asociados por su complementariedad a vitamina D, han contribuido asimismo a un mejor control del HPTS.
El objetivo de esta reunión fue discutir la evidencia científica de los diferentes tratamientos involucrados en el manejo del HPTS, con el fin de optimizar el tratamiento del paciente en diálisis relacionando su eficacia, seguridad y coste.
ANTECEDENTES
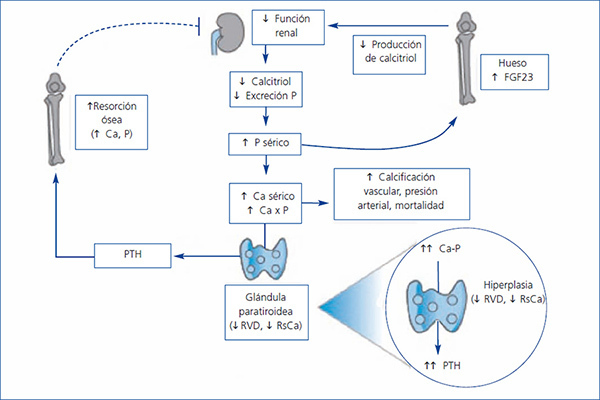
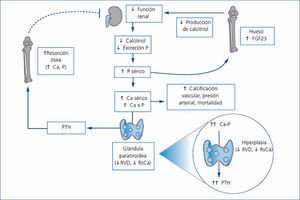
El HPTS es una consecuencia frecuente y grave de la ERC (figura 1). Se trata de un trastorno de patogénesis compleja caracterizado, como factores importantes, por una disminución de la 1,25-dihidroxivitamina D o calcitriol (el consiguiente déficit en la activación de su receptor) y por una disminución de la fosfaturia (a pesar de una disminución en la reabsorción tubular de fósforo y debido a una disminución de la carga filtrada), anomalías en las concentraciones séricas de calcio y fósforo, hiperplasia de las glándulas paratiroides, aumento de la secreción de hormona paratiroidea (PTH) y anomalías minerales y óseas sistémicas7.
Un control inadecuado del HPTS y del trastorno mineral del hueso puede fomentar la calcificación vascular y contribuir a aumentar la mortalidad cardiovascular, que es la causa más frecuente de muerte en los pacientes dializados.
En las glándulas paratiroides existen dos receptores clásicos conocidos, el RVD y el receptor sensor de calcio (RsCa), a través de los cuales se modula su función. La activación de estos receptores produce la disminución de la secreción de PTH y una inhibición de la proliferación celular.
En la actualidad disponemos de tres clases de fármacos como opciones de tratamiento para el HPTS:
Se ha demostrado en diversas publicaciones que las tres opciones son eficaces para la supresión de la PTH, pero estudios clínicos indican que los ARVD no selectivos pueden propiciar hiperfosfatemia e hipercalcemia limitantes de la dosis. Los AsRVD tienen unos menores efectos sobre la absorción de calcio en el intestino y sobre la movilización del calcio y fósforo en el hueso, provocando menos episodios de hipercalcemias e hiperfosfatemias8. Los calcimiméticos, también muy eficaces, por el contrario se asocian, con frecuencia, a hipocalcemia9.
Uno de los problemas actuales en la definición del HPTS es la diversidad de los procedimientos de determinación de la PTH. Por ello, las distintas guías refieren diferentes rangos de normalidad de la PTH en pacientes en diálisis. Sin embargo, y así lo reconocen las guías KDIGO, el juicio del control del HPTS debe plantearse no solamente por el valor absoluto de PTH en los rangos adecuados, sino por la tendencia progresiva al ascenso de sus niveles. La base histológica racional para considerar esta tendencia es la progresiva transformación de las glándulas paratiroides desarrollando hiperplasia nodular con disminución de los RVD y del calcio, y por tanto con resistencia progresiva al control del HPTS ante las diferentes opciones de tratamiento (ARVD y calcimiméticos)10.
ACTIVADORES DE LOS RECEPTORES DE VITAMINA D SELECTIVOS (ii) Y NO SELECTIVOS (i)
El RVD de las glándulas paratiroides es un receptor citosólico que actúa como factor de transcripción en la expresión de la PTH. Una vez activado el complejo RVD-activador, actúa sobre el elemento de respuesta de la vitamina D del gen en la célula paratiroidea, lo que causa una disminución de la producción de ARN de la PTH. La unión al elemento de respuesta está condicionada por la acción de elementos coactivadores y/o correpresores. Por esto, en la ERC la disminución progresiva de los niveles séricos de 1,25-dihidroxivitamina D causa un aumento de la síntesis de la PTH en las glándulas paratiroideas. La ausencia en la llegada de este estímulo inhibitorio a través del RVD hace que disminuya la población de receptores y se produzca una hiperplasia de las glándulas paratiroideas. Esta hiperplasia se produce con la finalidad de satisfacer las demandas de secreción de PTH. Esta glándula, pobre en receptores, acaba convirtiéndose en una glándula autónoma incapaz de responder a los tratamientos y en ocasiones se precisa cirugía.
La distribución del RVD es prácticamente universal, así como los múltiples genes y proteínas reguladas por la activación de este, teniendo un papel esencial en la salud cardiovascular. En el paciente con ERC, la activación del RVD podría tener efectos beneficiosos, no solo sobre las alteraciones del metabolismo mineral, sino también sobre la propia enfermedad renal11. No solo inhibe marcadores inflamatorios, sino que además modula la respuesta inmune e induce la regulación a la baja de la renina. El RVD es también importante en la estimulación del remodelado de los cardiomiocitos11.
Dentro del grupo terapéutico de las «vitaminas D y análogos», existe un gran número de moléculas. En él se encuentra el calcitriol (la forma más activa de la vitamina D) y sus precursores, como la 25OH vitamina D, pro-hormonas del calcitriol que tras administración en el organismo acaban transformándose por una u otra vía en 1,25-dihidroxivitamina D o calcitriol. Por tanto, este grupo de fármacos constituye el grupo de ARVD no selectivos, ya que actúan en el organismo de la misma manera que lo hace la propia vitamina D endógena. Uno de los grandes problemas asociados a los ARVD no selectivos es el aumento de los niveles de calcio y fósforo en sangre y el complejo manejo de su administración, lo que provoca una limitación de su dosis. Los nuevos activadores selectivos muestran en estudios experimentales una similar o superior dosis-equivalencia para suprimir la PTH con una menor actividad calcémica e hiperfosfatémica12. En comparación con los pacientes tratados con paricalcitol, mostraron una reducción más rápida de la PTH con unos menores episodios de hipercalcemia y/o elevaciones del producto calcio x fósforo (18 % frente a 38 %, p = 0,008)13. Este aumento de calcio y fósforo está asociado a calcificación vascular, lo que supondría un aumento de la morbimortalidad de los pacientes en diálisis14.
Muchos pacientes con ERC no pueden recibir un tratamiento adecuado para el HPTS con vitamina D activa por sus riesgos de hipercalcemia, hipercalciuria, hiperfosfatemia y elevación del producto calcio x fósforo5,15,16. Asimismo, tampoco es aconsejable otra de las opciones para el control del HPTS en pacientes con ERC no en diálisis, como es el uso de calcimiméticos, ya que producen hipercalciuria, hipocalcemia y elevación del fósforo sérico17,18.
En virtud de sus estructuras químicas, los activadores no selectivos y selectivos del RVD poseen unos efectos genómicos heterogéneos que originan diferentes respuestas en la glándula paratiroidea, en el intestino y en el hueso. Los AsRVD tienen menores efectos sobre la absorción de calcio intestinal y movilización del calcio y el fósforo óseos, en comparación con los ARVD no selectivos. Con el uso de activadores específicos de RVD se ayudaría a combatir los efectos indeseables de hipercalcemia e hiperfosfatemia. Veremos que hay datos clínicos que sugieren una asociación entre los ARVD y un aumento de la supervivencia en pacientes con ERC19-25.
Efecto sobre la supervivencia
Efectivamente hay estudios que sugieren que los ARVD se asocian a una mayor supervivencia de los pacientes con ERC en hemodiálisis24, siendo este beneficio más favorable con los ARVD selectivos que con los no selectivos26.
En un estudio de cohortes históricos, Teng et al. compararon la tasa de supervivencia a los 36 meses con paricalcitol y calcitriol en casi 68 000 pacientes dializados24. Los resultados mostraron una mejora de supervivencia significativa en los pacientes que recibían paricalcitol que ya se apreciaba a los 12 meses y que aumentaba con el tiempo, resultando de igual manera cuando se analizó la supervivencia de los pacientes que cambiaban de un tratamiento a otro. La tasa de mortalidad fue un 16 % inferior en los pacientes tratados con paricalcitol. Kalantar et al. (2006), en un nuevo estudio de cohortes históricos, valoraron la supervivencia de 58 000 pacientes, demostrando que cualquier dosis de paricalcitol administrada se asociaba a un beneficio en la supervivencia (reducción de la mortalidad por cualquier causa o por causa cardiovascular), frente a los pacientes que no recibieron paricalcitol26. Lee et al. (2007), en una extensión del estudio de Kalantar et al., en el que se incluyeron nuevos datos de un análisis de subgrupos según la raza, coexistencia o no de diabetes, sexo, edad, tiempo en diálisis, niveles de albúmina sérica, consumo de proteínas, niveles de calcio, fósforo, producto calcio x fósforo, fosfatasa alcalina y PTH, observaron un aumento de la supervivencia para todos los subgrupos tratados con paricalcitol frente a los no tratados en cada uno de los estratos estudiados27. Recientemente se han publicado los resultados del estudio FARO del grupo italiano de hemodiálisis28. Dichos resultados corroboran las conclusiones de los estudios de Kalantar et al. y de Teng et al., demostrando que la activación del RVD aumenta la supervivencia en el grupo de pacientes tratados con paricalcitol frente a los pacientes tratados con calcitriol, siendo esta diferencia estadísticamente significativa. Tentori et al. obtuvieron resultados similares en otro estudio en el que compararon las muertes por cualquier causa y las muertes cardiovasculares en pacientes en hemodiálisis tratados con ARVD (calcitriol, doxercalciferol y paricalcitol), demostrando que la mortalidad fue similar en los grupos de paricalcitol y doxercalciferol, y que fue superior en el grupo de calcitriol (p < 0,001)29. Vervloet et al. analizaron los diferentes estudios observacionales que relacionaban la asociación entre el uso de ARVD y la mortalidad. Sostuvieron que, aunque todos los datos que consideran los efectos en la mortalidad de la terapia con ARVD en pacientes en hemodiálisis provienen de cohortes históricas, el análisis se debe considerar válido para la práctica clínica, puesto que en los cinco estudios observacionales existentes los métodos utilizados eran sólidos30.
Por lo tanto, el uso de ARVD se asocia a un beneficio en la supervivencia de los pacientes con ERC, independientemente de los efectos sobre la PTH, el calcio y el fósforo, pareciendo ser mejor la activación selectiva del RVD con paricalcitol, frente a la no activación o a la activación con otras moléculas como calcitriol. Los mecanismos que asocian los beneficios de supervivencia y cardiovasculares a la activación del RVD están todavía bajo investigación, pero diferentes factores pueden tener un papel importante, ya que se han identificado RVD en más de 30 tejidos diferentes en el cuerpo humano31.
Control del hiperparatiroidismo secundario y parámetros del metabolismo óseo mineral
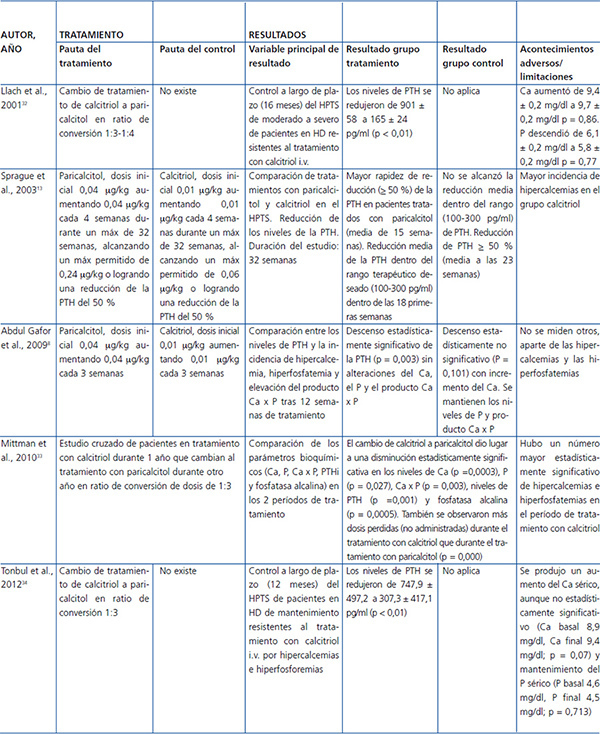
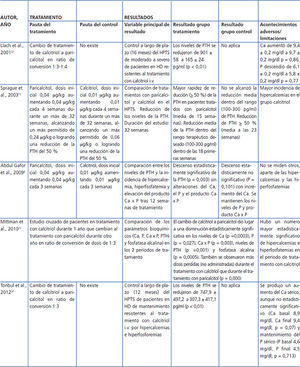
Como veremos detalladamente más adelante, entre los ARVD los activadores selectivos ejercen un menor efecto hipercalcemiante e hiperfosforemiante que calcitriol. Varios estudios han confirmado su capacidad para alcanzar una reducción de los niveles de PTH de forma más rápida y sostenida que la que producen los ARVD no selectivos, como se puede observar en la tabla 1. Llach et al., en 2001, demostraron en un estudio prospectivo en 37 pacientes resistentes al tratamiento con calcitriol (PTH > 600) que tras 16 meses de tratamiento con paricalcitol en ratio de conversión 1:3 o 1:4 hubo una bajada significativa de PTH sin cambios estadísticamente significativos en el calcio y el fósforo32. Posteriormente, en 2003, en un estudio en el que participaron 263 pacientes en diálisis, Sprage et al. mostraron que el tiempo en alcanzar los rangos de normalidad de las guías KDOQI fue en la semana 18 en el grupo de paricalcitol y en ningún momento en el grupo de calcitriol, tras un tratamiento con los fármacos de 32 semanas, mostrando además menores episodios de hipercalcemia o elevaciones del producto calcio x fósforo con respecto a los pacientes tratados con calcitriol (p = 0,008)13.
En 2009 Abdul Gafor et al., en un estudio unicéntrico de 25 pacientes, mostraron un descenso significativo de la PTH en el grupo de paricalcitol, incrementándose los niveles de calcio exclusivamente en el grupo de calcitriol8.
En 2010 Mittman et al., en 59 pacientes tratados con calcitriol durante al menos 12 meses, que completaron posteriormente otros 12 meses con paricalcitol, vieron que la conversión de calcitriol a paricalcitol mostraba una disminución del calcio, fósforo, producto calcio x fósforo y PTH, además de una reducción de la fosfatasa alcalina. Asimismo, se mostró una diferencia altamente significativa en el número de pérdidas de dosis durante los tratamientos a favor de paricalcitol33.
Por último, Tonbul et al. publicaron ese mismo año un estudio (de diseño similar al de Llach et al.) en 43 pacientes refractarios al tratamiento con calcitriol. Los resultados mostraron, al final del estudio, una bajada de la PTH, el mantenimiento del fósforo sérico y un aumento, aunque no estadísticamente significativo, del calcio sérico34.
Absorción de calcio a nivel intestinal
Como ya se ha comentado anteriormente, uno de los grandes problemas de los ARVD es el aumento de los niveles de calcio y fósforo, debido principalmente a su absorción intestinal y a su movilización desde el hueso. A diferencia del tratamiento con paricalcitol, el tratamiento con calcitriol se ha asociado a un aumento del número de RVD intestinales. Además es necesaria una dosis diez veces superior a calcitriol para producir aumentos similares de las concentraciones séricas de calcio y fósforo, siendo al mismo tiempo necesaria una dosis tres veces superior para tener el mismo efecto sobre la PTH, lo que proporciona una ventana terapéutica de seguridad superior con paricalcitol35.
Takahashi et al. (1997) demostraron que en ratas urémicas tratadas con paricalcitol se expresaba menos RVD en la membrana de las células intestinales que en las ratas urémicas tratadas con calcitriol después de 8 semanas de tratamiento35. Posteriormente, en 2002, Brown et al. demostraron que paricalcitol disminuía la expresión de las principales proteínas transportadoras de calcio en la célula intestinal (calbindina D, canal de calcio CaT1 y bomba de calcio PMCA1) en un modelo experimental frente a calcitriol, proporcionando un menor aumento de la absorción de calcio intestinal36. Años más tarde Nakane et al.37 corroboraron que paricalcitol se asociaba a una absorción de calcio inferior a calcitriol en ratas urémicas alimentadas con una dieta rica en fósforo durante 12 días, siendo menor la expresión de proteínas transportadoras en el grupo de paricalcitol37. Lund et al., en un estudio clínico y cruzado en 29 pacientes en hemodiálisis, mostraron que la absorción fraccionada de calcio intestinal fue significativamente inferior después del tratamiento con paricalcitol (0,135 +/- 0,006) frente al tratamiento con calcitriol (0,158 +/- 0,006, p = 0,022), siendo 0,023 la diferencia absoluta de absorción fraccionada de calcio. No hubo diferencias significativas en la PTH, el calcio, el fósforo o el producto calcio x fósforo38. Muy recientemente, Martínez et al. mostraron por primera vez la menor excreción urinaria de calcio en pacientes tratados con paricalcitol frente a los tratados con calcitriol, siendo la diferencia estadísticamente significativa (p = 0,047)39.
Acción en el hueso
Diferentes estudios han demostrado que paricalcitol produce una menor resorción ósea y que mejora la formación ósea (síntesis de colágeno).
En 1999, Finch et al. publicaron el primer estudio en medir los efectos de paricalcitol sobre el hueso20. En un modelo de ratas paratiroidectomizadas sometidas a una dieta pobre en calcio y fósforo, demostraron que los niveles plasmáticos de calcio de las ratas indicaban que paricalcitol era diez veces menos potente que calcitriol movilizando calcio del hueso (resorción ósea). Resultados muy similares se observan en cuanto al fósforo. Se midió además la excreción urinaria de calcio, observándose una excreción superior en las ratas tratadas con calcitriol.
Un año más tarde Balint et al. demostraron en estudios in vitro que, aunque calcitriol y paricalcitol tenían efectos similares sobre el flujo del calcio desde el hueso, en concentraciones terapéuticas, paricalcitol no parecía inhibir la actividad osteoblástica40. Slatopolsky et al., en 2003, hicieron por primera vez estudios en ratas urémicas y concluyeron que paricalcitol mejoraba la mineralización y prevenía la formación anormal de hueso, previniendo el HPTS sin aumentos de calcio sérico y mejorando los cambios histomorfométricos inducidos por la uremia y la dieta rica en fósforo (menor porosidad intracortical y menor erosión trabecular a nivel de hueso esponjoso)12.
Nakane et al., en un modelo in vitro, sugirieron que los análogos de vitamina D tienen efectos directos sobre la resorción y formación ósea, pudiendo ser paricalcitol más eficaz que la 1 alpha,25-dihydroxyvitamin D(3) y 1 alpha-hydroxyvitamin D(2) en la estimulación de la formación ósea anabólica21. Finch et al. publicaron el último de los estudios a nivel de hueso, utilizando el mismo modelo de Slatopolsky del año 2003, ratas nefrectomizadas 5/6 que fueron tratadas con placebo, paricalcitol o cinacalcet durante 6 semanas. Cinacalcet, pero no paricalcitol, mostró una reducción del volumen del hueso. Cinacalcet presentó una formación de hueso similar y superficie osteoide reducida, pero mayor resorción ósea41. Actualmente se encuentra en marcha el estudio BONAFIDE en pacientes con ERC, de un año de seguimiento, con biopsia pr- y poscinacalcet, cuyos resultados, se espera, puedan contribuir a clarificar estos efectos42.
Otros efectos pleiotrópicos
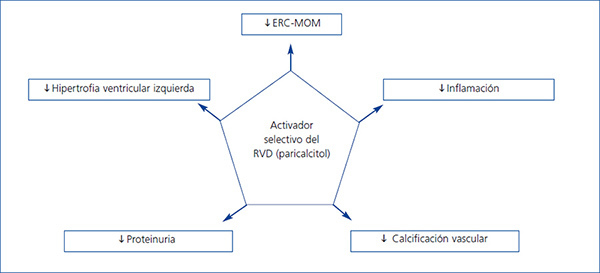
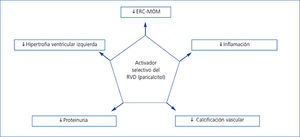
La activación del RVD es esencial para el funcionamiento normal del organismo, puesto que estos receptores están presentes en muchos órganos y afectan a numerosos procesos, sugiriendo un papel más allá de su función en el metabolismo óseo (figura 2). Dadas estas propiedades, es probable que la terapia basada en los AsRVD tenga efectos beneficiosos cardiovasculares, incluida una reducción de la incidencia de fallo cardíaco, de la ateroesclerosis y de la hipertrofia miocárdica, disminuyendo así la morbimortalidad.
Como ya se ha comentado anteriormente, se han encontrado diferencias en el control del HPTS y de los parámetros bioquímicos entre una terapia basada en ARVD selectivos o no selectivos. A continuación se muestra la acción diferencial en los distintos tejidos entre dichas terapias.
Calcificación
El aumento de la calcificación vascular se ha asociado con una menor supervivencia en pacientes en hemodiálisis crónica. La pared vascular está compuesta por células endoteliales y células del músculo liso vascular (CMLV), que expresan RVD. La presencia de RVD es necesaria para la salubridad de las CMLV.
En 2007 Mizobuchi et al., en un modelo experimental de ERC severa (nefrectomía 5/6) con dieta rica en fósforo, observaron una mayor calcificación en la aorta tratada con calcitriol y doxercalciferol en relación con las tratadas con paricalcitol, así como una menor expresión por estas células de factores procalcificantes como el Cbfα-1 y la osteocalcina tras tratamiento durante 1 mes. Los datos bioquímicos sobre los parámetros del metabolismo óseo-mineral mostraron que los tres fármacos bajaron la PTH, pero las tratadas con calcitriol mostraron niveles de calcio y fósforo séricos mayores que las tratadas con paricalcitol. Sin embargo, a pesar de hacer incrementar los niveles de fósforo y calcio en el grupo de paricalcitol, el efecto ventajoso del paricalcitol sobre los demás ARVD persistía44. En ese mismo año Cardús et al., utilizando el mismo modelo experimental, demostraron que el cociente media/luz fue significativamente mayor para las arterias de ratas tratadas con calcitriol, pero similar al de las tratadas con paricalcitol en relación con las ratas control45. Posteriormente, Noonan et al., en 2008, con el mismo modelo experimental, observaron una menor calcificación no solo aórtica, sino también cardíaca en las ratas tratadas con paricalcitol (tras 41 días de tratamiento) frente a las tratadas con doxercalciferol (1α-hidroxivitamina D2). Además, la velocidad de onda de pulso no se incrementó tras la cirugía en las ratas tratadas con paricalcitol (valores similares a los de las ratas controles e inferiores a los de las ratas tratadas con doxercalciferol)46. También en ese mismo año, López et al. constataron que, en ratas urémicas con HPTS, la administración concomitante de paricalcitol y un calcimimético ejercía un excelente control del HPTS sin inducir calcificaciones extraóseas, previniendo la mortalidad asociada con el uso de derivados de la vitamina D47. Becker et al., en un estudio de reciente publicación48 en el que se utilizó un modelo experimental de dislipemia y estrés oxidativo (ratones KO para la apolipoproteína E), tras 10 semanas de tratamiento con paricalcitol o calcitriol, vieron que produjo imágenes muy similares para los dos fármacos de calcificación aórtica a las publicadas en el año 2007 por Mizobuchi et al.44.
Hace unos meses, Guerrero et al. publicaron los resultados de un estudio in vitro con anillo aórtico e in vivo en ratas sometidas a una dieta rica en fósforo y tratadas con lipopolisacáridos (LPS) y con LPS asociado a calcitriol o paricalcitol. En él se mostraron diferencias entre ambos tratamientos con tan solo 15 días de exposición en la rata. El tratamiento con paricalcitol mostró un mayor efecto antiinflamatorio que el tratamiento con calcitriol y, a diferencia de este, paricalcitol previno la calcificación vascular49.
Muy recientemente, el mismo grupo mostró un efecto diferencial entre paricalcitol y calcitriol en la calcificación vascular, pareciendo estar mediada por la distinta regulación del bone morphogenetic protein y las vías de señalización de la Wnt/beta-catenina50.
Inflamación
Es conocido que los pacientes en hemodiálisis presentan un estado de inflamación crónica que se ha relacionado con diversas complicaciones, como la anemia o la malnutrición. Una disminución de la activación del RVD se relaciona con niveles en plasma elevados de marcadores de inflamación: proteína C reactiva (PCR) y matrix metalloproteinase.
En estudios experimentales y clínicos, los AsRVD han demostrado una capacidad potencial para modular el fenómeno inflamatorio. En un estudio piloto Alborzi et al. (2008) observaron en un ensayo doble ciego, aleatorizado y controlado con placebo en 24 pacientes una reducción de la PCR y la albuminuria en los pacientes tratados con paricalcitol en un mecanismo independiente a su efecto sobre la PTH51. Recientemente, Navarro et al. encontraron en un estudio con 25 pacientes tratados con calcitriol que, al cambiarlos a paricalcitol, mostraron una mejoría de la modulación del estadio inflamatorio con paricalcitol reduciendo PCR y factor de necrosis tumoral α y una mejora de los ratios de citocinas inflamatorias/antiinflamatorias en pacientes tratados previamente con calcitriol52. Este efecto, al igual que en el estudio de Alborzi, fue independiente de los niveles de PTH.
Hipertrofia ventricular izquierda
En la ERC, la hipertrofia ventricular izquierda (HVI) es frecuente y se asocia a un aumento de la mortalidad cardiovascular en hemodiálisis. Estudios preclínicos han asociado una menor activación de los RVD con HVI53-55.
Bodyak et al., en 2007, estudiaron la función cardíaca y la HVI en un modelo de ratas Dahl (sensibles a la sal) en tratamiento con una dieta rica en sodio y paricalcitol. Observaron que los ecocardiogramas de las ratas tratadas con paricalcitol se asemejaban a los de las ratas controles, ocurriendo lo mismo con la presión telediastólica del ventrículo izquierdo y la expresión de renina cardíaca56. Posteriormente estos mismos autores examinaron de forma retrospectiva los ecocardiogramas basales y a los 12 meses de tratamiento de pacientes en hemodiálisis tratados y no tratados con paricalcitol para corroborar los datos observados en las ratas Dahl. Los pacientes que habían recibido paricalcitol tenían una función diastólica mejorada (cociente E/A) y una disminución significativa del grosor de pared septal y posterior. En 2007 Becker et al. comunicaron en la American Society of Nephrology los resultados de un trabajo realizado en ratones ApoE -/- uninefrectomizados en tejido cardíaco. La activación del RVD por paricalcitol evitó el descenso de la densidad de longitud de los capilares miocárdicos que presentaban los ratones controles o no tratados y además paricalcitol evitó la expresión de colágeno en tejido cardíaco que sí se observó en los ratones controles y en los tratados con calcitriol57. Husain et al., en 2009, en un modelo experimental de ERC severa, mostraron que la combinación enalapril más paricalcitol redujo el estrés oxidativo frente a las ratas Nx control58. Yakupoglu et al. presentaron en el congreso de la European Renal Association/European Dialysis and Transplant Association de 2009 un trabajo prospectivo de 76 pacientes en hemodiálisis, de los cuales 36 se trataron con paricalcitol y 40 con calcitriol. Los pacientes tratados con paricalcitol mostraron un descenso estadísticamente significativo de la presión arterial media y de la HVI al final del estudio (12 meses)59. Un año más tarde Mizobuchi et al., en un modelo de ratas urémicas, demostraron que, tras un período de tratamiento de cuatro semanas, paricalcitol revertía la HVI y la fibrosis generada por la uremia, devolviendo además los niveles de RVD de los cardiomiocitos a los niveles de las ratas control (no nefrectomizadas)55. Ese mismo año, Kong et al. compararon losartán y ARVD (paricalcitol y doxercalciferol) en monoterapia y en combinación en un modelo de rata espontáneamente hipertensa. Tras dos meses de tratamiento, la combinación disminuyó el diámetro de los cardiomiocitos, así como la expresión del brain natriuretic peptide (BNP) y el atrial natriuretic peptide60. Un año más tarde, Bae et al., utilizando el mismo modelo experimental que Bodyak et al., realizaron un estudio comparativo entre enalapril y paricalcitol en monoterapia y en combinación, corroborando los resultados en cuanto a la reversión de la HVI, la mejoría de la función cardíaca (medida en este caso como variación de la fracción de acortamiento), la disminución de los niveles sanguíneos de BNP y la fibrosis cardíaca61. Recientemente Thadhani et al. han publicado en 2012 los resultados de un ensayo clínico controlado con placebo en el que 227 pacientes con ERC, HVI de leve a moderada y fracción de eyección del ventrículo izquierdo conservada y presión arterial conservada fueron aleatorizados a recibir paricalcitol en dosis de inicio de 2 µg/día o placebo durante 48 semanas. No se observaron diferencias estadísticamente significativas entre los grupos de tratamiento en lo que a disminución de la HVI se refería, establecido como parámetro principal de evaluación. Sin embargo, sí se observó una disminución estadísticamente significativa del índice del volumen auricular izquierdo mediante ecocardiografía, una atenuación de la elevación de los niveles de BNP y una disminución del número de hospitalizaciones frente a la rama placebo62.
Función endotelial
Karavalakis et al., en 2008, observaron en ratas Nx 5/6 y sometidas a una dieta especial que induce severa hiperfosfatemia una reducción de la vasoconstricción en los animales tratados con paricalcitol, aunque los cortes histológicos de aorta abdominal no mostraron resultados positivos a nivel de calcificación vascular63. Dos años más tarde, Wu-Wong et al. en un modelo de ERC severa mediante Nx de 5/6, demuestran tras 12 días de tratamiento con paricalcitol una mejoría de la relajación muscular mediada por acetil colina64.
Protección renal y reducción de proteinuria
La supresión farmacológica del sistema renina-angiotensina-aldosterona (SRAA) ha demostrado reducir la morbilidad y la mortalidad en pacientes con enfermedades cardiovasculares y nefropatías. Actualmente, el tratamiento más común para la proteinuria es la administración de fármacos que inhiben el SRAA (inhibidores de la enzima convertidora de la angiotensina y antagonistas de los receptores de angiotensina II). Sin embargo, recientemente se ha generado mucha expectación en torno a la disminución de la proteinuria en la ERC secundaria a la activación del RVD.
Agarwal et al., en 2005, basándose en los datos de tres estudios doble ciego, aleatorizados frente a placebo, encontraron en un análisis retrospectivo una reducción de la proteinuria (medida semicuantitativamente mediante tira reactiva) en el 51 % de los pacientes tratados con paricalcitol frente al 25 % de los pacientes tratados con placebo, independientemente de la coexistencia de un tratamiento concomitante con inhibidores del SRAA65. Tres años más tarde, Zhang et al. mostraron que el tratamiento con losartán y paricalcitol redujo la albuminuria, restauró la estructura de la barrera de filtración glomerular y disminuyó marcadamente la glomeruloesclerosis previniendo el daño renal en un modelo de nefropatía diabética en ratones66. En 2009, Fishbane et al., en un estudio doble ciego aleatorizado en 61 pacientes, demostraron que con una dosis de 1 μg/día había una reducción de excreción de proteínas de un 17,6 % frente a un aumento de un 2,9 % en el grupo control67. Un año más tarde, De Zeeuw et al., en un estudio doble ciego, aleatorizado y controlado con placebo, multicéntrico en 281 pacientes con diabetes tipo 2 y albuminuria, demostraron que con la dosificación de inicio de 2 μg/día de paricalcitol se producía una disminución temprana y sostenida de la albuminuria medida por el cociente albúmina/creatinina (reducción aproximada del 20 %). Este efecto se revertía tras la interrupción del tratamiento con paricalcitol68.
CALCIMIMÉTICOS
Los calcimiméticos son moduladores alostéricos positivos del receptor sensible al calcio. Estos fármacos aumentan la sensibilidad del RsCa al calcio extracelular, por lo que reducen las concentraciones de calcio que son necesarias para facilitar el proceso de señalización de este receptor que causa la supresión de la secreción de PTH.
Control del hiperparatiroidismo secundario y parámetros del metabolismo óseo mineral
Cinacalcet es un calcimimético de tipo II que fue el primer fármaco de esta clase terapéutica indicado para el tratamiento del HPTS en diálisis. Ensayos clínicos en fase III llevados a cabo en pacientes en hemodiálisis presentaron una disminución de los valores séricos de PTH, una disminución de las concentraciones séricas de calcio y fósforo, y un descenso del producto calcio x fósforo en los pacientes tratados con cinacalcet. Los niveles de calcio por debajo de 7,5 mg/dl en al menos dos medidas consecutivas fueron de un 5 % frente a placebo (p < 0,001). Estos episodios fueron transitorios y raramente asociados con síntomas y se controlaron modificando la dosis de quelantes cálcicos, análogos de la vitamina D o ambos9,69-71.
En 2008, Fishbane et al. publicaron los resultados del estudio ACHIEVE. Se trataba de un estudio prospectivo, aleatorizado y abierto, en el que 173 pacientes se asignaron aleatoriamente a un tratamiento con cinacalcet y dosis bajas de vitamina D o solo análogos de vitamina D (paricalcitol o doxercalciferol). El estudio tuvo un período de 6 semanas de cribaje, incluido el período de lavado, 16 semanas de titulación de dosis y un período de evaluación de 11 semanas. El porcentaje de pacientes que presentaron una reducción de la PTH > 30 % fue mayor en el grupo de pacientes que tomaron cinacalcet que en los asignados al grupo de dosis flexibles de análogos de vitamina D (68 % frente a 36 % p < 0,001). También fue superior el porcentaje de pacientes que presentó una PTH < 300 pg/ml al final del tratamiento en el grupo de cinacalcet que en el grupo de análogos de vitamina D (44 % frente a 26 % p = 0,006). El porcentaje de sujetos que consiguieron rangos de normalidad de PTH (150-300 pg/ml) y un producto calcio x fósforo inferior a 55 mg2/dl2 simultáneamente, fue del 21 % en el grupo de cinacalcet frente al 14 % en el grupo de análogos de vitamina D, no resultando esta diferencia estadísticamente significativa. Esto fue atribuido a que el 19 % de los pacientes del brazo de cinacalcet presentaban PTH por debajo del rango de normalidad de las guías KDOQI72.
En el año 2012 se han publicado los resultados del estudio IMPACT. Se trata de un estudio prospectivo, aleatorizado, abierto, con 272 pacientes sometidos a hemodiálisis, que compara la eficacia de paricalcitol en monoterapia (intravenoso u oral) frente a cinacalcet más dosis bajas de doxercalciferol/alfacalcidol (intravenoso/oral). Se trata del primer estudio que compara presentaciones de administración intravenosa y oral de ARVD. En el estrato intravenoso, el porcentaje de pacientes con niveles de PTH entre 150-300 pg/ml durante la semana 21-28 fue del 57,7 % en el grupo de paricalcitol frente al 32,7 % del grupo de cinacalcet (p = 0,016). En el estrato oral, la proporción fue del 54,4 % en el grupo de paricalcitol frente al 43,4 % del grupo de cinacalcet (diferencia no estadísticamente significativa). Cuatro pacientes del grupo de paricalcitol intravenoso (7,7 %) desarrollaron hipercalcemia y ninguno en el brazo oral (diferencias no significativas). El 46,9 % de los pacientes que recibieron cinacalcet intravenoso y el 54,7 % de los que recibieron este fármaco por vía oral desarrollaron hipocalcemia, siendo estadísticamente significativa la diferencia frente al grupo de pacientes que recibieron paricalcitol. Al mismo tiempo, se observó un descenso significativo de los valores de fosfatasa alcalina y de la fosfatasa alcalina específica de hueso en el grupo de paricalcitol y un aumento en el grupo de cinacalcet, siendo también esta diferencia estadísticamente significativa73.
Calcificación
En 2005, Henley et al. constataron que tanto cinacalcet como calcitriol fueron eficaces en la reducción de los niveles plasmáticos de PTH, pero, a diferencia de calcitriol, cinacalcet no produjo hipercalcemia, aumento del producto calcio x fósforo o calcificación vascular74. Posteriormente, López et al. observaron, en ratas urémicas, que cinacalcet disminuía los niveles elevados de PTH sin inducir calcificación vascular y previniendo la calcificación vascular inducida por calcitriol75. Ese mismo grupo, en 2009, en un ensayo experimental vio que las calcificaciones extraóseas se resolvieron parcialmente mediante una reducción de la ingesta de fósforo. El uso de un calcimimético podría acelerar este proceso a través de una estimulación directa en las células fagocíticas minerales, además de aumento de la excreción del calcio urinario76. Recientemente, se han publicado los resultados del estudio ADVANCE. En él, se comparó el efecto de la administración de cinacalcet más dosis bajas de ARVD (selectivos o no selectivos) frente a la administración de dosis flexibles de vitamina D sobre la calcificación vascular y de las válvulas cardíacas. No se alcanzaron diferencias estadísticamente significativas entre grupos en el objetivo primario (cambio porcentual en la puntuación en la escala Agatston de la calcificación de las arterias coronarias), pero sí se observaron diferencias estadísticamente significativas en los scores de volumen de la calcificación de las arterias coronarias y de la progresión de la calcificación de la válvula aórtica77.
Supervivencia
Block et al. publicaron en 2010 los resultados de un estudio observacional en el que las tasas de mortalidad cardiovascular o de cualquier causa en una cohorte de pacientes en hemodiálisis tratados con cinacalcet fueron menores que las observadas en una cohorte de pacientes que no recibían calcimiméticos78. Recientemente se han publicado los resultados del estudio EVOLVE, en el que 3883 pacientes con moderado severo HPTS en hemodiálisis recibieron cinacalcet o placebo, además de tratamiento convencional. Después de 64 meses en análisis por intención de tratar, no ajustado, no hubo diferencias en el objetivo primario de muerte o aparición de eventos cardiovasculares. Sin embargo, sí se observó una disminución de paratiroidectomías79. Desafortunadamente, el grupo de pacientes que se aleatorizó a cinacalcet fue de mayor edad (1 año mayor) que los que no recibían cinacalcet y una gran proporción de enfermos que no tenían que tomar cinacalcet acabó usándolo.
ASPECTOS FÁRMACO-ECONÓMICOS
Los estudios fármaco-económicos son contradictorios. En 2004, Dobrez et al. publicaron un estudio retrospectivo de 11 443 pacientes dializados que comparaba paricalcitol frente a calcitriol en términos indirectos de coste. Se investigó la influencia del tratamiento con ARVD (paricalcitol o calcitriol) sobre el número total de ingresos hospitalarios, días de hospitalización y tiempo transcurrido hasta la primera hospitalización. Los resultados demostraron un menor número de hospitalizaciones (-14 %, p < 0,0001), menos ingresos por año (-0,642; p < 0,001) y menos días de hospitalización (-6,84; p < 0,001) en el grupo tratado con paracalcitol. El análisis de coste-efectividad publicado por Rosery et al. en 2006 mostró que en el tratamiento con paricalcitol hubo un ahorro total de costes de 5394 euros/año, además de una ratio del 0,84 de supervivencia al año para los pacientes en tratamiento con paricalcitol y del 0,80 para los pacientes en tratamiento con calcitriol. En cuanto al análisis de coste-utilidad, se observó un incremento de los índices de calidad de vida para el tratamiento con paricalcitol. Los autores concluyen que paricalcitol era más eficiente que calcitriol y que alfacalcidol80.
En 2010, Shireman et al. realizaron un análisis de coste-efectividad con los datos del ensayo clínico ACHIEVE, anteriormente mencionado. Las dosis utilizadas en el brazo de cinacalcet más dosis bajas de AsRVD/ARVD fueron de 49,3 mg/día y 5,5 µg/semana, respectivamente, mientras que en el brazo de dosis flexibles de AsRVD/ARVD (paricalcitol/doxercalciferol) la dosis media fue de 10,5 µg/semana. El coste medio por paciente fue de 5852 y 4332 dólares, respectivamente. Tras los resultados de este análisis, los autores concluyeron que cinacalcet combinado con un ARVD no es más eficiente que los ARVD en monoterapia en alcanzar el objetivo primario del estudio (porcentaje de pacientes dentro de rango guías K/DOQI), resultando el brazo de cinacalcet más dosis bajas de un ARVD más costoso81.
En el año 2012 se ha publicado el análisis fármaco-económico del estudio FARO. Dichos autores concluyen que paricalcitol intravenoso y la combinación de paricalcitol más cinacalcet muestran similares efectos en la supresión de la PTH (no existiendo basalmente diferencias significativas en la gravedad de la enfermedad); los costes de tratamiento fueron menores en el grupo de paricalcitol intravenoso, incluidos los quelantes de fósforo. El grupo de calcitriol intravenoso no logró una mejora en la reducción de los niveles de PTH, mientras que calcitriol oral fue eficaz en pacientes con HPTS muy leve (PTH basal de 248,36 pg/ml). Además, solo en el grupo de paricalcitol intravenoso se observó una reducción de la dosificación a lo largo del seguimiento82.
En el análisis económico del estudio IMPACT, mencionado anteriormente, se constató que el gasto farmacéutico en el grupo de pacientes tratados con paricalcitol era un 41 % menor que en el grupo de pacientes tratados con cinacalcet, incluido el gasto de los quelantes de fósforo73.
Si bien en las comparaciones anteriores el tratamiento con cinacalcet no resultó más coste-efectivo que las pautas terapéuticas con las que se comparaba, existen algunos estudios en los que cinacalcet más el tratamiento estándar sí ha mostrado ser coste-eficaz en relación con el tratamiento estándar solo, si se excluían los costes de la diálisis.
La existencia de resultados contradictorios en los diferentes análisis fármaco-económicos realizados se podría explicar por la diferencia en la selección de los datos usados en los modelos y por las diferencias entre las regiones, en lo que a uso de recursos y costes de sus respectivos sistemas sanitarios se refiere83.
CONCLUSIONES
Para abordar un HPTS hemos de considerar lo que podríamos denominar como «fenotipo» del paciente. Existen dos tipos: fenotipo activación del RVD, con calcio y fósforo séricos normales o bajos que permiten un tratamiento con ARVD, y el fenotipo calcimimético, en el que los valores de calcio y fósforo son normales o elevados, el cual ha contribuido a un mejor control del HPTS en este fenotipo.
Existen circunstancias intermedias en las que la decisión puede inclinarse hacia uno u otro lado. Respecto a los compuestos de vitamina D, la utilización de AsRVD como paricalcitol parece implicar menor número de episodios de hipercalcemias, hiperfosforemia y elevaciones del producto calcio x fósforo frente a los activadores no selectivos de la vitamina D (calcitriol, alfacalcidol).
En el perfil de fenotipo activación del RVD, con un HPTS en el que los niveles de calcio y fósforo lo permiten, la utilización de paricalcitol en monoterapia supone una estrategia coste-eficiente frente a la combinación de este fármaco con cinacalcet, siendo este fármaco idóneo para los pacientes con el fenotipo calcimimético.
La activación del RVD podría tener efectos beneficiosos, no solo sobre las alteraciones del metabolismo mineral, sino también sobre la propia enfermedad renal, siendo diferencial el efecto entre los AsRVD y los ARVD. Estudios clínicos y preclínicos apuntan a que los AsRVD y paricalcitol en concreto ofrecen un beneficio más allá del control del HPTS, mostrando protección renal en el paciente con ERC y cardiovascular en hemodiálisis frente a vitamina D.
CONCEPTOS CLAVE
1. La activación tanto del RVD como del RsCa de la glándula paratiroidea produce la disminución de la secreción de PTH y una inhibición de la proliferación celular.
2. Varios estudios han confirmado que los ARVD selectivos reducen los niveles de PTH de forma más rápida y sostenida que los no selectivos.
3. Los ARVD selectivos respecto a los no selectivos tienen menores efectos sobre la absorción de calcio en el intestino y sobre la movilización del calcio y del fósforo en el hueso, provocando menos episodios de hipercalcemias e hiperfosfatemias.
4. Hay estudios que sugieren que los ARVD se asocian a una mayor supervivencia de los pacientes con ERC en hemodiálisis, siendo este beneficio más favorable con los ARVD selectivos que con los no selectivos.
5. Estudios experimentales han demostrado que los AsRVD producen una menor resorción ósea y que mejoran la formación ósea (síntesis de colágeno) respecto a los no selectivos.
6. El aumento de la calcificación vascular se ha asociado con una menor supervivencia en los pacientes en hemodiálisis crónica. Estudios experimentales han demostrado que paricalcitol produce menor calcificación vascular que calcitriol.
7. La disminución de la activación del RVD se relaciona con un incremento de marcadores plasmáticos de inflamación. Estudios experimentales y clínicos han demostrado que los AsRVD tienen capacidad potencial para modular el fenómeno inflamatorio.
8. Estudios preclínicos han asociado una menor activación de los RVD con HVI. Estudios experimentales en ratas urémicas han mostrado que los AsRVD reducen la HVI, mientras que los resultados a nivel clínico no son concluyentes.
9. Varios estudios han puesto de manifiesto que el tratamiento con paricalcitol se asocia a una reducción de la proteinuria.
Conflictos de interés
Los autores asistieron a una reunión promovida por Abbott, cuyo objetivo fue el debate científico, no la elaboración de ningún documento para publicación. Posteriormente los autores decidieron constituir un Grupo de Trabajo para la redacción de este artículo de revisión.
Tabla 1. Estudios comparativos de paricalcitol sobre el metabolismo óseo-mineral
Figura 1. Desarrollo del hiperparatiroidismo secundario en pacientes con enfermedad renal crónica (adaptada de Ronco et al. 43)
Figura 2. Efectos de la activación selectiva de los receptores de vitamina D en la enfermedad renal crónica (adaptada de Ronco et al. 43)