El presente estudio ha evaluado el criterio clínico que utilizan los nefrólogos españoles frente a la disfunción renal crónica (DRC) en receptores de trasplante renal (TR), y el grado de mantenimiento y control de la disfunción renal.
MétodosEstudio observacional, epidemiológico, multicéntrico, nacional y prospectivo, con un período de seguimiento de 6meses. Se incluyeron 368 pacientes adultos con disfunción renal de grado3 con un período mínimo de evolución posterior al trasplante de 24meses. La programación de las visitas incluyó una visita retrospectiva, una visita inicial, una visita intermedia opcional y una visita final al sexto mes.
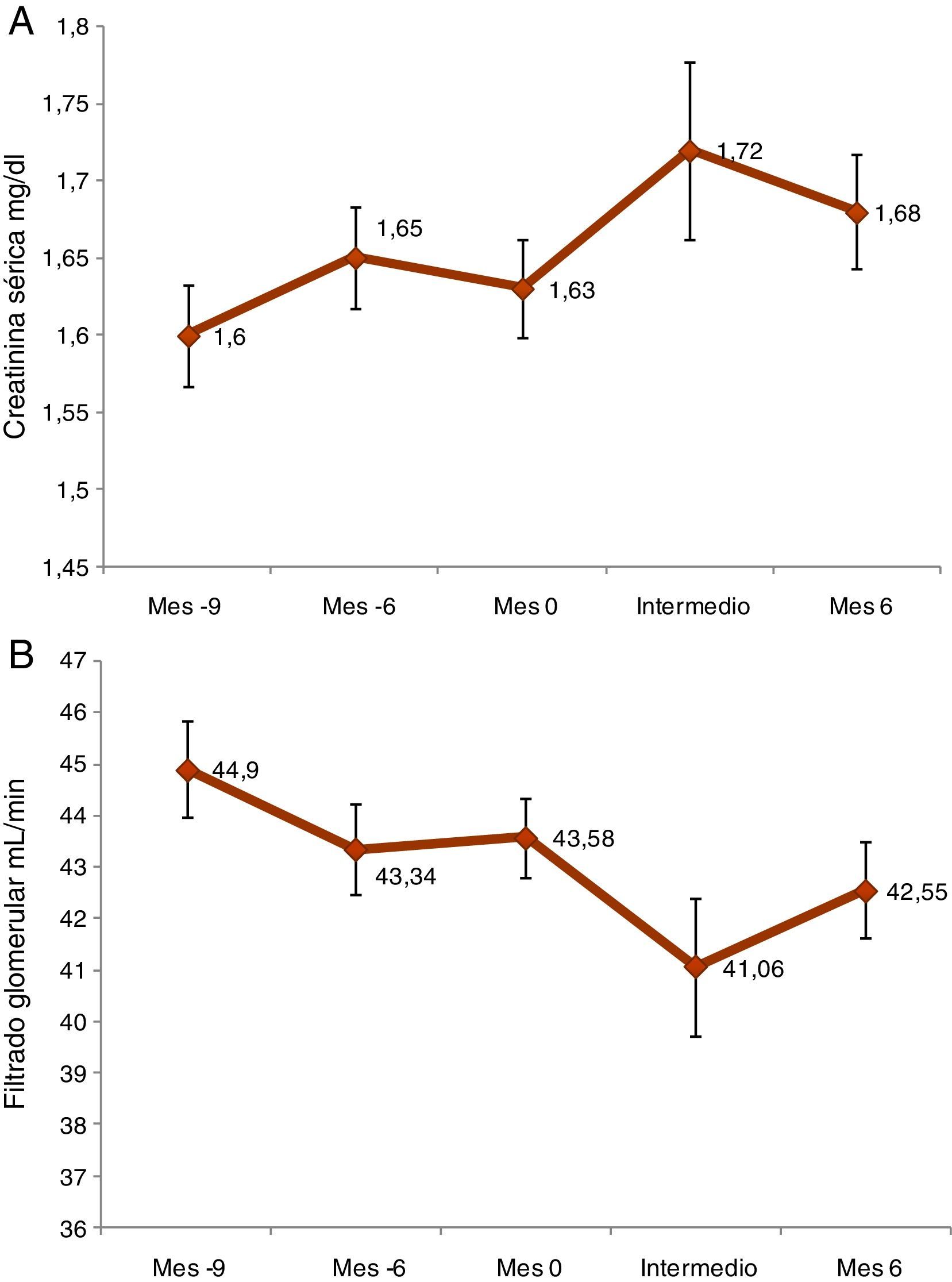
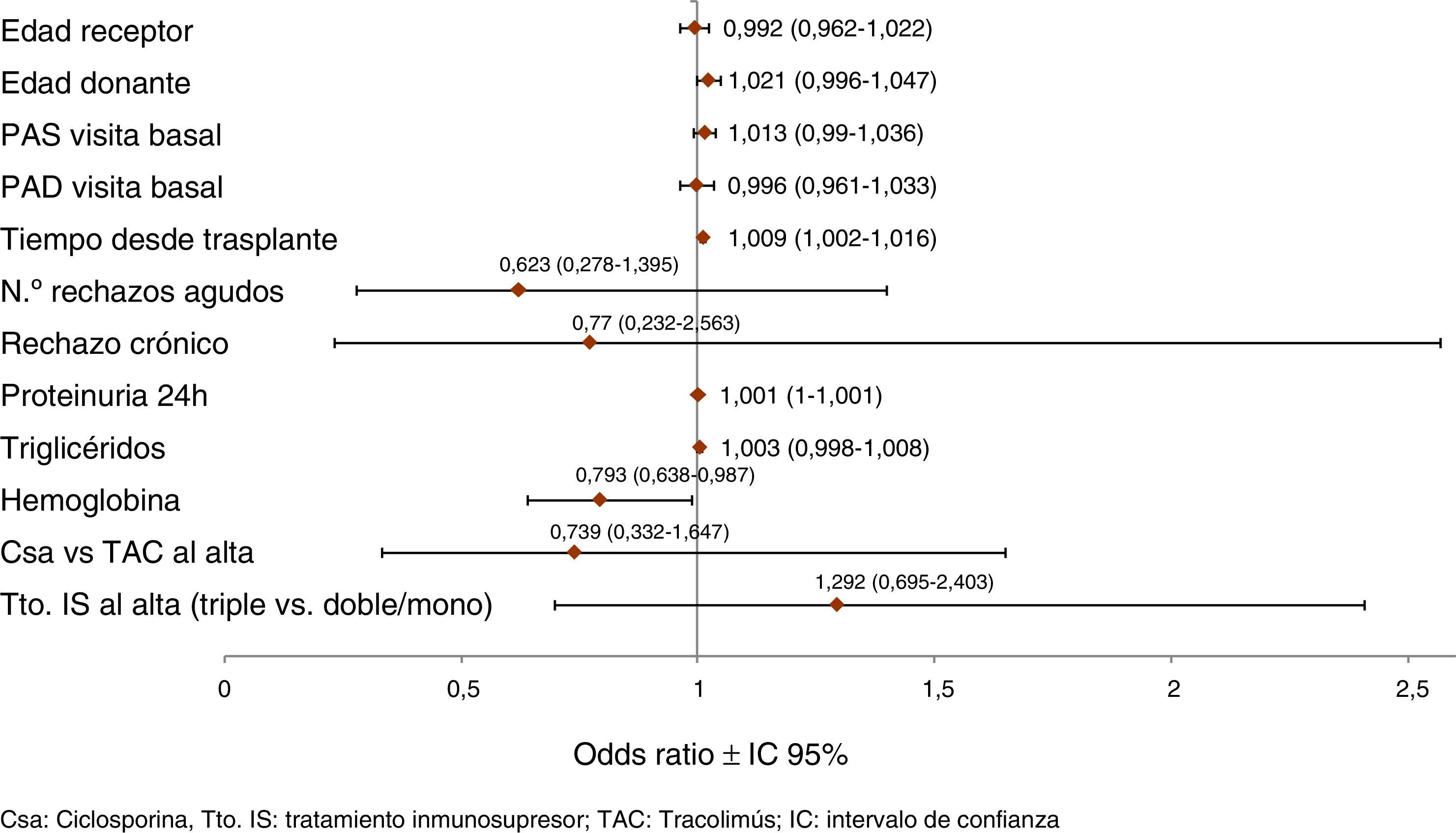
ResultadosEl tiempo medio desde el TR fue de 8,2±5,4años. La hipertensión (80,2%), seguida por la hipercolesterolemia (61,7%), fueron los factores de riesgo cardiovascular previos al trasplante más frecuentes. Las concentraciones de creatinina sérica entre la visita inicial y la visita de los 6meses mostraron una diferencia estadísticamente significativa de 0,06±0,22 (p<0,0001), y la diferencia del filtrado glomerular (FG) fue de −1,03±6,14 (p=0,0014). Los factores pronósticos independientes significativos del empeoramiento del FG fueron: proteinuria a 24h más alta (OR=1,001 por cada mg; p=0,020), más tiempo desde el trasplante (OR=1,009 por cada mes; p=0,017) y concentraciones bajas de hemoglobina (OR=1,261 por cada g/dl; p=0,038). También se observó cierta influencia negativa de la edad del donante (OR=1,021 por cada año; p=0,106). Solo se realizó biopsia en el 8% de los casos de receptores de TR con DRC de grado 3, suponiendo alguna intervención en el 25,4% de los casos.
ConclusionesCon frecuencia los marcadores secundarios y los factores de progresión de la DRC siguen sin estar controlados después del TR, principalmente la anemia. Solo aproximadamente el 2% de pacientes se benefician de una intervención terapéutica basada en una biopsia. Existe una disparidad entre la percepción clínica y los parámetros objetivos, que conduce a una clara inercia clínica del control de los factores de riesgo de estos pacientes.
In the present study, clinical criteria used by Spanish nephrologists when approaching chronic kidney disease (CKD) in kidney recipients, as well as their level of maintenance and control of renal function, were evaluated.
MethodsAn epidemiological, observational, multicenter, nation-wide, prospective study was carried out, with a 6-month follow-up period. Three hundred and sixty-eight adult patients with stage3 kidney disease after a 24-month or longer post-transplantation follow-up period were included. Visits schedule included a retrospective visit, a baseline visit, an optional mid-term visit, and a final visit at month6.
ResultsMean time since kidney transplantation was 8.2±5.4years. Most common pre-transplant cardiovascular risk factors were high blood pressure (80.2%), followed by high cholesterol levels (61.7%). Serum creatinine levels showed a statistically significant decrease from baseline visit to 6-month visit (0.06±0.22; P<.0001), and glomerular filtration rate (GFR) reduction was −1.03±6.14 (P=0.0014). Significant independent prognostic factors for GFR worsening were: higher 24-hour proteinuria (OR=1.001 per mg; P=.020), longer time since transplantation (OR=1.009 per month; P=.017), and lower hemoglobin levels (OR=1.261 per g/dl; P=.038). Donor age also had some negative influence (OR=1.021 per year; P=.106). Biopsies were obtained in only 8% of kidney transplant recipients with stage 3 CKD with an intervention being carried out in 25.4% of cases.
ConclusionsSecondary markers and factors resulting in CKD progression, particularly anemia, are still frequently uncontrolled after kidney transplantation. Only about 2% of patients benefit from a therapeutic intervention based on a biopsy. Clinical perception differs from objective measures, which results in an obvious clinical inertia regarding risk factor control in such patients.
A pesar de los avances recientes en los tratamientos inmunosupresores, la supervivencia a largo plazo de los pacientes de trasplante renal (TR) no ha aumentado de forma significativa durante los últimos 10años.
La disfunción renal crónica (DRC) en los pacientes de TR es una complicación frecuente cuyo tratamiento no acostumbra a ser simple, dado que depende, en gran parte, de los síntomas clínicos de cada paciente y de la gravedad de la disfunción. La DRC está relacionada con diversos factores, como son las características del trasplante (donante, conservación), las características personales del receptor, el tratamiento inmunosupresor utilizado y el desenlace clínico del trasplante1.
Las causas más frecuentes de pérdida o fracaso de un TR son la DRC y la muerte del paciente con trasplante funcional, con una tasa anual de aproximadamente el 3-5%2.
La DRC en el TR se caracteriza por un deterioro progresivo de la función renal, con fibrosis intersticial y atrofia tubular que provoca proteinuria, hipertensión arterial y un aumento progresivo de la creatinina sérica. La DRC leve (gradoi de Banff) se observa en casi todos los trasplantes al finalizar el primer año después del trasplante, y de gradoii y iii a los 10años después del trasplante en el 90% de los pacientes3.
Varios estudios con biopsias realizadas según protocolo han mostrado que algunos parámetros (p.ej., creatinina) de estimación de la función renal subestiman la gravedad de la DRC. Por lo tanto, las biopsias son una herramienta esencial para el diagnóstico acertado de la DRC3,4.
El deterioro progresivo de la función renal se acompaña a menudo de complicaciones relacionadas con la presencia de insuficiencia renal (proteinuria, hipertensión, diabetes, hiperlipidemia, anemia, acidosis metabólica, hiperfosfatemia, etc.)5-7. Tal y como se ha expuesto en numerosos estudios de cohortes de TR, muchos pacientes con DRC padecen un riesgo acelerado de deterioro de la función renal del trasplante como consecuencia de estas comorbilidades confirmadas8. El tratamiento adecuado de estas complicaciones y el hecho de evitar su inercia clínica requieren más atención por parte de los nefrólogos8. Concretamente, y a modo de ejemplo, en la DRC asociada a nefrotoxicidad debida a los inhibidores de calcineurina (ICN), debe considerarse la posibilidad de una exposición reducida mediante la disminución de dosis de ICN o la suspensión de la administración si fuera posible9.
El objetivo de este estudio fue evaluar la actitud clínica ante la disfunción renal por parte de los nefrólogos en pacientes de TR sometidos a tratamiento de mantenimiento, así como evaluar el grado de tratamiento y control de marcadores y factores de progresión de la disfunción renal, como son la hipertensión, la proteinuria y la anemia, y la presencia de factores de riesgo cardiovascular en estos pacientes.
Pacientes y métodosSe trata de un estudio no intervencionista, multicéntrico, nacional y prospectivo, con un período de seguimiento de 6meses. Inicialmente se incluyeron 446 receptores de TR adultos en tratamiento de mantenimiento, entre marzo de 2009 y marzo de 2010. De estos, 368 se incluyeron finalmente para la evaluación final de este estudio.
Los pacientes incluidos debían ser receptores de un TR simple, mayores de edad, presentar una DRC de grado3 según las nuevas guías Kidney/Disease Outcomes Quality Inititiative (K/DOQI) (filtrado glomerular [FG] de 30-59ml/min), haber pasado un período mínimo de evolución posterior al trasplante de 24meses y haber otorgado su consentimiento para participar en el estudio. Las guías K/DOQI recomiendan la estimación del FG con la fórmula MDRD10. Los criterios de exclusión fueron: presencia de receptores de TR dual o multiorgánico, y DRC de grado3 (escala de Banff) según biopsia de TR.
La programación de las visitas incluyó una visita retrospectiva (entre 6 y 9meses antes del inicio), una visita inicial (mes0), una visita intermedia opcional y una visita final (mes6). Todos los pacientes firmaron el consentimiento informado para participar en el estudio. Un Comité Ético de Investigación Clínica autorizó el estudio, que se realizó conforme a la Declaración de Helsinki.
La información del estudio se obtuvo mediante entrevista personal con el paciente y obtención de datos de la historia clínica, en 47 consultas externas de las unidades de TR de los hospitales españoles. La información de interés fue: datos demográficos de los pacientes y sus antecedentes médicos, etiología de la insuficiencia renal terminal, factores de riesgo cardiovascular previos al trasplante, evolución del trasplante, edad y sexo del donante, nivel de DRC con carácter retrospectivo, visitas inicial, intermedia (opcional) y final, presencia de marcadores secundarios de DRC (proteinuria, concentración de creatinina sérica, FG, presión arterial, concentración de hemoglobina), datos del análisis sanguíneo, tratamiento de inducción y tratamiento inmunosupresor en el momento del alta hospitalaria.
También se obtuvieron los antecedentes detallados posteriores al trasplante, que incluyeron información sobre historia clínica de interés posterior al trasplante (es decir, rechazo agudo, diabetes, hipertensión y neoplasia maligna), diagnóstico de DRC, biopsias renales realizadas, tratamiento inmunosupresor y farmacológico. Así mismo, se evaluó el tratamiento de la comorbilidad clínica. En la visita final se recogió información sobre la morbimortalidad del paciente durante el estudio.
Los criterios objetivos de control de las comorbilidades fueron evaluados según las guías de referencia correspondientes: diabetes (glucemia en ayunas <120mg/dl)11; hipertensión (presión arterial <130/85mmHg)12; metabolismo mineral (Ca: 8,4-9,5mg/dl, P: 2,7-4,6mg/dl, iPTH<6,5pg/ml)13; hipercolesterolemia (colesterol LDL <100mg/dl; colesterol HDL >40mg/dl en varones y >46mg/dl en mujeres); hipertrigliceridemia ≤200mg/dl)14. Finalmente, se entregó un cuestionario de opinión a los nefrólogos sobre los cambios que realizaban en el tratamiento inmunosupresor en sus pacientes trasplantados, para la posterior evaluación de la actitud clínica.
Análisis estadísticosSe realizó un análisis descriptivo de las variables iniciales demográficas y clínicas de todos los pacientes incluidos en el estudio. La prevalencia y el intervalo de confianza (IC) del 95% asociado de las variables cualitativas se calcularon en la visita retrospectiva, inicial, intermedia y final, para comparar las frecuencias y las medias entre las variables. Se utilizó el índice Kappa para evaluar la concordancia entre los criterios diagnósticos establecidos según criterio del clínico y según criterios objetivos funcionales para los marcadores de la DRC.
Se realizó la prueba de la t de Student, ANOVA para mediciones repetidas o test de Wilcoxon, según las características de cada variable. Para las variables cualitativas se realizó la prueba de McNemar.
Se realizó un análisis de regresión múltiple para determinar los factores pronósticos de empeoramiento del FG. Este análisis se basó en pacientes que mostraron un FG≥10% respecto a la visita inicial (n=67). En el análisis de regresión múltiple se incluyeron todas las variables demográficas y clínicas que resultaron cercanas a la significación estadística en las regresiones univariantes previas (p<0,1). Se utilizó un procedimiento logístico para la extracción de la variabilidad paso a paso, con evaluación de la bondad de ajuste mediante el test de Hosmer y Lemeshow.
Los datos se analizaron mediante la versión 9.1 o posterior del programa estadístico SAS.
ResultadosDe la muestra inicial de 446 pacientes identificados, un total de 368 pacientes con DRC de grado3 (82,51%) cumplieron con todos los criterios de inclusión y ninguno de exclusión, y fueron finalmente evaluables para los análisis detallados en este trabajo.
Datos demográficos y descriptivosLa media de edad de la muestra fue de 55,6±12,9años, y el 61,7% eran varones (tabla 1). El tiempo medio desde el TR fue de 8,2±5,4años. El caso más frecuente de insuficiencia renal terminal fue la glomerulonefritis crónica, que se observó en 114 casos (31,0%), mientras que solo se observó un paciente (0,3%) con toxicidad como causa. La hipertensión (80,2%), seguida por la anemia (34,5%), fueron los factores de riesgo cardiovascular previos al trasplante más frecuentes. Otros factores de riesgo fueron dislipidemia (22,8%) y enfermedad cerebrovascular previa (3,5%).
Características iniciales de la muestra
| Total | |
|---|---|
| Receptores del riñón | |
| Sexo, varón (%) | 227 (61,7) |
| Edad en años, media (DE) | 55,6 (12,9) |
| Donante | |
| Sexo, varón (%) | 211 (57,3) |
| Edad en años, media (DE) | 47,5 (16,4) |
| Tiempo desde el trasplante | |
| Media (±DE), años | 8,2±5,4 |
| Primer trasplante | 297 (80,7%) |
| Segundo trasplante | 50 (16,3%) |
| Tercer trasplante | 4 (1,1%) |
| PAR previa al trasplante | |
| 0% | 281 (76,4%) |
| Entre 0 y 10% | 20 (5,4%) |
| Entre 10 y 20% | 6 (1,6%) |
| 20% o más | 16 (4,4%) |
| N.° de incompatibilidades HLA | |
| 0 | 2 (0,5%) |
| 1 | 14 (3,8%) |
| 2 | 59 (16,0%) |
| 3 | 102 (27,7%) |
| 4 | 132 (35,9%) |
| 5 | 50 (13,6%) |
| 6 | 9 (2,5%) |
| Factores de riesgo cardiovascular (FRCV) | |
| Hipertensión | 295 (80,2%) |
| Hipercolesterolemia | 227 (61,7%) |
| Proteinuria | 161 (43,8%) |
| Anemia | 127 (34,5%) |
| Obesidad | 104 (28,3%) |
| Hipertrigliceridemia | 85 (23,1%) |
| Diabetes mellitus | 82 (22,3%) |
| Pacientes con ≥1FRCV previo al trasplante: | 331 (90,0%) |
DE: desviación estándar; HLA: antígenos leucocitarios humanos (Human Leukocyte Antigen); PAR: perfil de anticuerpos reactivos.
La concentración de creatinina sérica y el FG iniciales se evaluaron en 1,6±0,3mg/l y 43,6±7,6ml/min, respectivamente. En el momento de la inclusión, la proteinuria a 24h fue 425,7±639,9mg (25,5% de los pacientes >300mg), el 39,7% de los pacientes presentaban anemia, el 89,7%, hipertensión, y el 26,1%, diabetes.
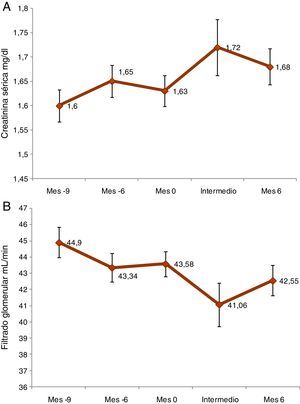
Se observó una diferencia estadísticamente significativa de 0,06±0,22 (p<0,0001) entre la concentración de creatinina sérica de la visita inicial y la de la visita de los 6meses. En el caso del FG, la diferencia fue de −1,03±6,14 (p=0,0014) (fig. 1). El 18,2% de los pacientes experimentaron un empeoramiento adicional del FG (disminución ≥10%) entre la visita inicial y la de los 6meses. La nefropatía por virus BK se investigó en el 32,6% de los pacientes.
El 9,8% (n=36) de los pacientes sufrieron neoplasia después del trasplante, y el tratamiento inmunosupresor se modificó en el 72,2% de los casos (n=26). El 14,7% de los pacientes (n=54) experimentaron complicaciones cardiovasculares: la angina de pecho fue la más frecuente (27,8%), seguida por la arteriopatía periférica (22,2%).
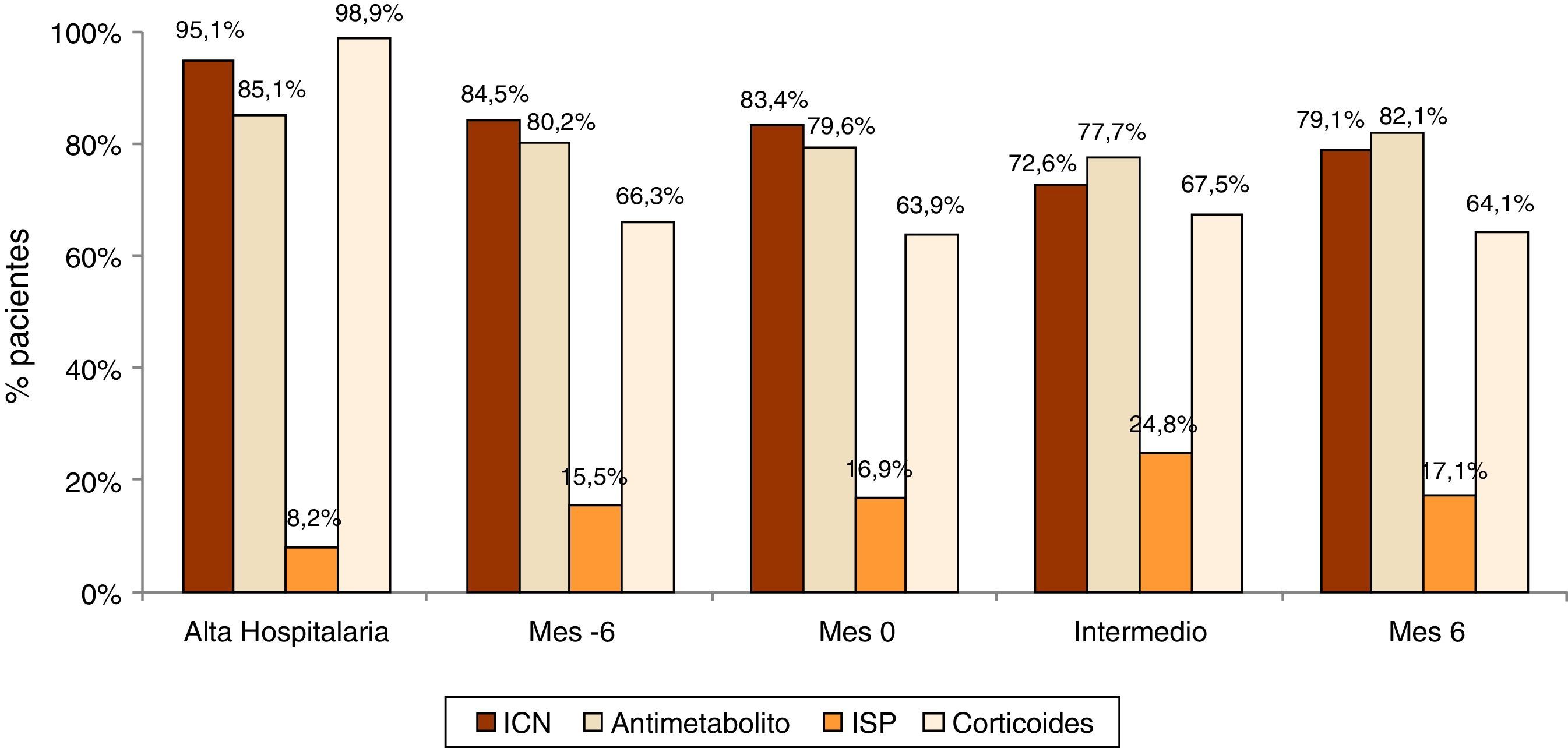
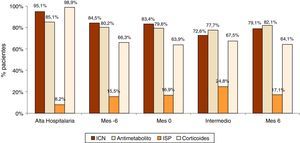
Tratamiento inmunosupresor y programación de las biopsiasA pesar de los tratamientos antiproteinúricos, antianémicos y antihipertensivos iniciales en el 34,2, el 34,0 y el 86,4% de los pacientes (y su intensificación en el 60-73% de los pacientes no controlados), el 26,1, el 7,3 y el 64,7% de los pacientes no lograron los objetivos de tratamiento a los 6meses, respectivamente. Durante el seguimiento no se observaron cambios significativos en el tratamiento inmunosupresor (fig. 2). El tratamiento inmunosupresor utilizado con más frecuencia fueron los ICN en combinación con antimetabolitos y corticoides.
La biopsia posterior al trasplante se realizó en 28 pacientes (7,6%) y el resultado más frecuente fue el rechazo crónico (n=8). La biopsia supuso alguna intervención en el 25,4% de los casos, y la modificación del tratamiento inmunosupresor fue la intervención más frecuente (50,0%). El 83,3% de los pacientes que sufrieron alguna intervención consiguieron estabilizar su función renal. La biopsia se indicó según criterios clínicos en todos los casos, siendo útil en el 88,9% de los casos según los criterios de los investigadores. Los investigadores también consideraron que las técnicas de inmunohistoquímica e inmunofluorescencia eran muy útiles para manejar e intentar estabilizar la función renal (88,9% de los casos).
Actitud clínica del médicoLos resultados obtenidos en el cuestionario de opinión a los nefrólogos muestran que el 88,1% de los médicos utilizaron el nivel de proteinuria como marcador de DRC, y más del 58% utilizaron la anemia y la hipertensión de la misma forma. De forma complementaria, el 80,6% de los médicos calcularon el cambio del FG durante el último año para evaluar la función renal. Los médicos han identificado la hipertensión, la dislipidemia y la hiperglucemia como factores igualmente y clínicamente adecuados para evaluar la progresión de la DRC (91,7, 91,7 y 88,9%, respectivamente). En el caso de la hipertensión, la modificación prioritaria del tratamiento inmunosupresor fue la reducción de la anticalcineurina con aumento del micofenolato (58,3%) y reducción o interrupción del tratamiento con corticoesteroides (ambas, 66,7%). En el caso de la hiperglucemia, la modificación prioritaria fue la reducción del tratamiento con corticoesteroides (88,3%) o su interrupción (80,6%). Finalmente, en los casos de dislipidemia, la elección fue la reducción del tratamiento con corticoesteroides (83,3%), y su interrupción en el 83,3% de los casos.
El 80,6% de los médicos consideraron que los receptores de TR con DRC necesitaban un control más intenso del riesgo cardiovascular, con análisis sanguíneos y ecocardiografías como técnicas más frecuentes para su atención.
Con respecto al control de los marcadores secundarios de la DRC, no se produjeron diferencias significativas en la hipertensión (p=0,513), ni en las tasas de proteinuria y de proteinuria a 24h (p=0,879) entre pacientes durante las visitas.
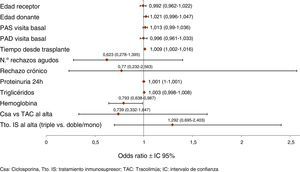
Factores pronósticos del empeoramiento del filtrado glomerularEl modelo de regresión logística multivariante (fig. 3) mostró que los factores pronósticos independientes significativos del empeoramiento del FG fueron: proteinuria a 24h más alta (OR=1,001 por cada mg; p=0,020), más tiempo desde el trasplante (OR=1,009 por cada mes; p=0,017) y concentraciones bajas de hemoglobina (OR=1,261 por cada g/dl; p=0,038). También se observó una influencia negativa de la edad del donante (OR=1,021 por cada año; p=0,106).
Manejo de la disfunción renal crónicaEn la visita inicial, aproximadamente un tercio de los pacientes presentó un buen manejo de la proteinuria, un 89,3% en el caso de la hipertensión y solo un 37,7% en el caso de la anemia. En el 31,3% de los casos que necesitaron intervención durante el tratamiento de la proteinuria no se produjo intensificación ni modificación. De igual forma ocurrió en un 18,6% de los casos de hipertensión y en un 16,7% de los casos de anemia.
En la visita inicial hubo un 27,3% de pacientes con buen control del metabolismo mineral, un 20,3% con buen control de la diabetes y un 72,9% con buen control de la hipercolesterolemia. En la visita final a los 6meses, solo 16 pacientes no estaban controlados respecto al metabolismo mineral, y se consiguió una intensificación del control en el 37,5% de los pacientes. En el caso de la diabetes y de la hipercolesterolemia, se produjo una intensificación del control en aproximadamente el 65% de los pacientes no controlados.
Los factores de riesgo cardiovascular como la glucosa, hemoglobina glucosilada, curva de glucemia, colesterol HDL, colesterol LDL, colesterol total y triglicéridos, se mantuvieron estables en los análisis sanguíneos a lo largo de todas las visitas.
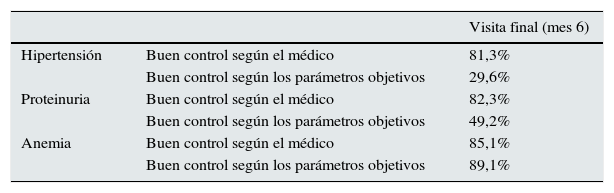
Existe una disparidad entre la percepción clínica y los parámetros objetivos, que conduce a una clara inercia clínica del control de los factores de riesgo asociados a la hipertensión y la proteinuria (tabla 2). En la hipertensión, la percepción de un buen control por parte del médico fue mayor que el estimado según parámetros objetivos recogidos en la hoja del paciente (81,3% frente a 29,7%). Por consiguiente, el índice Kappa de concordancia fue bastante bajo y no significativo, con valores entre 0,0762 en la visita inicial y 0,1438 en la visita final.
Grado de control de los factores de riesgo de la disfunción renal (hipertensión, proteinuria y anemia) en la visita final
| Visita final (mes 6) | ||
|---|---|---|
| Hipertensión | Buen control según el médico | 81,3% |
| Buen control según los parámetros objetivos | 29,6% | |
| Proteinuria | Buen control según el médico | 82,3% |
| Buen control según los parámetros objetivos | 49,2% | |
| Anemia | Buen control según el médico | 85,1% |
| Buen control según los parámetros objetivos | 89,1% |
Buen control según los parámetros objetivos o confirmados: PAS/PAD <130/80mmHg; proteinuria 24h ≤300mg/24h; hemoglobina >11g/dl.
Con respecto a la proteinuria, la percepción de un buen control por parte del médico fue mayor (82,3%) que según parámetros objetivos (49,2%). En este caso, el acuerdo entre la percepción clínica y los parámetros objetivos fue mayor que en la hipertensión, con un índice Kappa próximo a 0,5 (leve) durante todas las visitas.
Finalmente, la percepción clínica del buen control de la anemia se correspondió casi totalmente con los criterios objetivos (85,1% frente a 89,1%), lo que incrementa el acuerdo entre la visita retrospectiva y la visita final.
El 15-32% de los pacientes que necesitaron tratamiento inicial para comorbilidades como hipertensión, proteinuria y anemia no fueron controlados objetivamente.
Todos los pacientes se sometieron a modificaciones del tratamiento y a otra visita posterior al trasplante. La razón principal de la modificación del tratamiento fue la presencia de comorbilidades (12,5%). Tras el trasplante, se programaron consultas con otros especialistas en el 14,1% de los casos, con las unidades de endocrinología en la mayoría de los casos (42,3%). En el 25,8% de los pacientes se programó una nueva visita no prevista. En la visita final se realizó una ecografía Doppler del trasplante en 4 pacientes y se consiguió realizar 13 biopsias de trasplantes.
DiscusiónHemos realizado un estudio no intervencionista y prospectivo para evaluar la actitud clínica de los médicos en el tratamiento de los pacientes con DRC en mantenimiento y sometidos a un TR en España.
Nuestros resultados principales han mostrado que la hipertensión y la anemia son los factores de riesgo cardiovascular más frecuentes antes del trasplante. También han objetivado que los marcadores secundarios de la DRC que no pueden controlarse después del trasplante son frecuentes en los pacientes de TR, principalmente la anemia, que subsiste sin un tratamiento adecuado. En realidad, nuestros datos muestran que el 16,7% de los pacientes sin intensificación del tratamiento para la anemia en caso necesario representan una inercia clínica considerable con implicaciones importantes en la progresión de la DRC, debido a la baja tasa inicial de tratamiento adecuado de la anemia (37,7%). Esta situación es similar a la observada en estudios prospectivos recientes, que muestran como el control de los valores de la hemoglobina reduce la progresión de la DRC por alotrasplante en pacientes de TR15,16.
Se obtuvo una biopsia solo en algunos casos de receptores de TR con DRC de grado3, a pesar de tener en cuenta las pruebas expuestas en datos publicados recientemente que demuestran su gran necesidad3,4,17. El resultado de la biopsia conllevó una intervención terapéutica solo en el 25,4% de los pacientes en los que se realizó este procedimiento, un porcentaje que puede considerarse bajo según las recomendaciones recientes17.
Varios estudios de evaluación de biopsias renales han mostrado que el uso de la concentración de creatinina sérica para diagnosticar la nefropatía puede conllevar la subestimación de la gravedad de la DRC18. Según algunos autores, la biopsia es un procedimiento recomendado en pacientes con concentraciones de creatinina sérica ≥20% de la concentración mínima de creatinina durante los 3-6últimos meses, independientemente de la presencia de proteinuria19.
En nuestro estudio, la biopsia posterior al trasplante se realizó en el 7,6% de los pacientes entre la visita inicial y la final, y la causa más frecuente fue el rechazo crónico. Algunos estudios encontraron un rechazo agudo subclínico en las biopsias por protocolo de pacientes con DRC en estadios tempranos posteriores al trasplante. Esta asociación predice una menor supervivencia del trasplante en estos pacientes20. En un reciente estudio controlado y aleatorizado se demostró que el tratamiento precoz del rechazo mejoraba el desenlace clínico de estos pacientes21. Por consiguiente, es necesario un conocimiento más profundo de las causas de DRC para realizar el diagnóstico y el tratamiento precoces. Bajo este punto de vista, las biopsias deberían realizarse antes de que el paciente hubiera adquirido un grado avanzado de DRC.
Algunos resultados concluyen que una biopsia temprana del trasplante, la evaluación de la histología y los cambios en el tratamiento inmunosupresor pueden ser medidas disponibles especialmente útiles para proteger la función del trasplante21.
El reciente estudio transversal ICEBERG22 ha demostrado que la prevalencia de la DRC en los receptores de trasplante de riñón oscila entre el 35 y el 55% en función del método de diagnóstico (criterios clínicos o criterios objetivos como la creatinina sérica o el FG). Este estudio también ha mostrado que la DRC es una patología habitualmente infradiagnosticada en receptores de TR en mantenimiento. Los médicos solo la detectan en 4 de cada 10 pacientes diagnosticados objetivamente. Además, los resultados de OBSERVA confirman que, debido a este infradiagnóstico, la mayoría de pacientes trasplantados no reciben un tratamiento suficiente de sus comorbilidades. Por lo tanto, existen diferencias considerables entre las percepciones clínicas y los parámetros objetivos del tratamiento de los pacientes, lo que conduce a una inercia clínica importante. El hecho de evitar esta inercia clínica sería crucial para preservar la función del TR, permitiendo no solo la modificación de ICN en caso necesario, sino también la indicación de biopsia, la adaptación del tratamiento inmunosupresor a la DRC, el control de las comorbilidades y la introducción de recomendaciones para un estilo de vida saludable23.
Además, hemos observado que existe un gran porcentaje de pacientes con hipertensión no controlada que pueden contribuir al aumento de la morbimortalidad cardiovascular de los receptores de trasplante. Es necesario un tratamiento más intenso para mejorar la supervivencia del trasplante y de los pacientes. Según las recomendaciones vigentes en el momento del estudio, el control óptimo de la hipertensión sería una presión arterial <130/80mmHg o <125/75mmHg en pacientes con proteinuria24. Estos autores sugieren un control estricto de la hipertensión para evitar la inercia clínica en los centros de TR. Otros autores también sugieren que el FG reducido no representa el riesgo total de presentar DRC, lo que sugiere que hay otros factores, como la cardiopatía asintomática, que pueden estar implicados en el empeoramiento progresivo de la función renal y en el fallo del trasplante25. Igualmente, estudios recientes realizados en Estados Unidos han recalcado el hecho de que existe aún la oportunidad de mejorar el tratamiento y el control de los factores tradicionales de riesgo cardiovascular en los receptores de TR, como sugieren los altos índices de hipertensión no controlada en estos pacientes26,27.
Estudios recientes en receptores de TR han demostrado que existe un mal control de los factores de riesgo cardiovascular. En estos estudios se han observado grandes diferencias en el tratamiento de pacientes en el mismo estadio DRC, entre los pacientes sometidos a TR y los pacientes no trasplantados28,29. En los receptores de TR se ha observado un mal control de la presión arterial, de la concentración de lípidos y de hemoglobina, con respecto a los pacientes no trasplantados. Estos datos sugieren que el control adecuado de estos parámetros no se alcanza con un seguimiento ambulatorio.
Las guías KDIGO también proporcionan sugerencias sobre el control eficaz de la creatinina sérica y de la proteinuria30,31. El nivel de creatinina sérica a un año del trasplante es un factor de riesgo del desenlace clínico posterior y puede ayudar a determinar la frecuencia de las visitas en la atención a largo plazo. La proteinuria se ha asociado a complicaciones cardiovasculares y mortalidad en los pacientes con TR. Por tanto, se recomienda la medición de la proteinuria una vez al primer mes como valor inicial, después cada 3meses durante el primer año, y anualmente a partir de entonces32. También se recomienda el tratamiento de la proteinuria con inhibidores del sistema renina-angiotensina para reducir la DRC33.
Nuestro estudio tiene varios puntos fuertes, como el gran número de pacientes y de centros participantes, representativos de la población sujeta a TR en España, y puede reflejar el tratamiento de estos pacientes en la práctica clínica. Por otro lado, nuestro estudio tiene algunas limitaciones, como el corto período de seguimiento después del TR, de solo 6meses. Sin embargo, en pacientes con DRC de grado3, un seguimiento de 6meses tendría que ser suficiente para permitir la observación de las intervenciones médicas específicas para tratar el empeoramiento de la función renal. Además, entre las limitaciones, se debe mencionar que en las causas de progresión de la insuficiencia renal no se incluyó el daño inmunológico, aunque no es el objetivo de este estudio, que intenta evaluar la inercia clínica en patologías en las cuales aún se puede actuar siguiendo las guías disponibles.
En resumen, y aunque no debe descartarse un cierto efecto beneficioso del tratamiento de la proteinuria y en concreto del bloqueo renina-angiotensina, debería recomendarse un control más riguroso de los marcadores de DRC, con evaluación de las biopsias, seguimiento a largo plazo y estrategias específicas para el control de los factores de comorbilidad, para mejorar el desenlace clínico y la supervivencia de receptores de TR en mantenimiento34.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.