El cambio a ciclosporinaA podría revertir la diabetes inducida por tacrolimus. Sin embargo, los mecanismos de esta reversibilidad se desconocen.
MétodosUsamos como modelo de diabetes inducida por tacrolimus las ratas Zucker obesas. Un grupo de 44 ratas Zucker obesas fue tratado con tacrolimus durante 11días (0,3mg/kg/día) hasta que desarrollaron diabetes; posteriormente, a)22 fueron sacrificadas a día 12 como grupo referencia (tacrolimus-d12), y b)en otras 22 el tacrolimus fue reemplazado por ciclosporina (2,5mg/kg/día) durante 5días (tacrolimus-ciclosporina). Veintidós ratas Zucker obesas recibieron vehículo durante 17días (grupo control). A todos los animales se les realizó una sobrecarga intraperitoneal de glucosa al final del experimento.
ResultadosSe analizó la proliferación de la célulaβ, la apoptosis y la expresión del gen Ins2. En el grupo tacrolimus-ciclosporina, los niveles de glucemia mejoraron significativamente en cada punto del test intraperitoneal de glucosa comparados con el grupo tacrolimus-d12. La diabetes se redujo del 100% en los tacrolimus-d12 hasta el 50% en tacrolimus-ciclosporina. La proliferación de las células β en tacrolimus-ciclosporina se incrementó en comparación con tacrolimus-d12, pero fue menor que en los tratados con vehículo. La expresión génica de Ins2 en tacrolimus-ciclosporina fue comparable a los tratados con el vehículo.
ConclusiónEl cambio temprano de tacrolimus por ciclosporina en la diabetes inducida por tacrolimus incrementa la proliferación de la célulaβ y revierte la diabetes en un 50% de los casos.
Switching to cyclosporinA may result in a reversion of tacrolimus-induced diabetes mellitus. However, mechanisms underlying such a reversion are still unknown.
MethodsObese Zucker rats were used as a model for tacrolimus-induced diabetes mellitus. A cohort of 44 obese Zucker rats received tacrolimus for 11 days (0.3mg/kg/day) until diabetes development; then: (a)22 rats were euthanized at day 12 and were used as a reference group (tacrolimus-day 12), and (b)22 rats on tacrolimus were shifted to cyclosporin (2.5mg/kg/day) for 5 days (tacrolimus-cyclosporin). An additional cohort of 22 obese Zucker rats received the vehicle for 17 days and were used as a control group. All animals underwent an intraperitoneal glucose tolerance test at the end of the study.
Resultsβ-cell proliferation, apoptosis and Ins2 gene expression were evaluated. Compared to rats in tacrolimus-day 12 group, those in tacrolimus-cyclosporin group showed a significant improvement in blood glucose levels in all assessment points in intraperitoneal glucose tolerance test. Diabetes decreased from 100% in tacrolimus-day 12 group to 50% in tacrolimus-cyclosporin group. Compared to tacrolimus-day 12 group, rats in tacrolimus-cyclosporin group showed an increased β-cell proliferation, but such an increase was lower than in rats receiving the vehicle. Ins2 gene expressions in rats receiving tacrolimus-cyclosporin and rats receiving the vehicle were comparable.
ConclusionAn early switch from tacrolimus to cyclosporin in tacrolimus-induced diabetes mellitus resulted in an increased β-cell proliferation and reversion of diabetes in 50% of cases.
Los inhibidores de la calcineurina (ICN): ciclosporina-A (CsA) y tacrolimus (TAC), juegan un papel central en la inmunosupresión tras el trasplante renal, siendo TAC el más ampliamente usado1. TAC ofrece ventajas sobre CsA en términos de una mejor función del injerto y de menores tasas de rechazo agudo1,2, pero se asocia a una mayor incidencia de diabetes mellitus postrasplante (DMPT)3. La incidencia de DMPT oscila entre el 15 y el 25%4-6 y está asociada a mayores tasas de enfermedad cardiovascular y a un incremento en los costes sanitarios3,7,8. Con esto, el estudio de la DMPT inducida por TAC es relevante para establecer estrategias preventivas y terapéuticas tempranas que reduzcan sus consecuencias en esta población.
De acuerdo con las guías actuales3,9, la DMPT está considerada un fait accompli y su tratamiento sigue las pautas terapéuticas de la diabetes tipo 2: antidiabéticos orales y/o insulina9. Sin embargo, raramente se actúa sobre el compuesto que más frecuentemente produce DMPT: el TAC, a pesar de que la CsA tiene un menor efecto diabetógeno que este3,8,9. El cambio de TAC por CsA para la reversión de DMPT rara vez ha sido propuesto. En un estudio retrospectivo de 34 casos de DMPT, Ghisdal et al.10 demostraron unas tasas de remisión del 42% un año después del cambio de TAC a CsA, comparado con el 0% en el grupo control que se mantuvo con TAC. Sin embargo, hasta donde conocemos, no se ha realizado ningún estudio con modelos animales para establecer los mecanismos por los que el cambio de TAC a CsA pudiera ser una opción terapéutica en el tratamiento de la DMPT.
Nuestro grupo ha investigado previamente el efecto de los ICN en la homeostasis de la glucosa y en la célulaβ en animales tanto con resistencia a la insulina como sin ella11. En este modelo, los ICN solo inducían diabetes en animales insulinorresistentes, y TAC inducía más diabetes que CsA (100% vs. 40%). Además, los animales con CsA presentaban alteraciones menos severas en la homeostasis de la glucosa según los test de tolerancia intraperitoneal a la glucosa como en las glucemias en ayunas. Estos hechos se pueden explicar por una menor reducción de la proliferación de la célulaβ y de la expresión del gen de la insulina con CsA que con TAC11. Con estos datos, el objetivo de este estudio es investigar si el cambio de TAC a CsA en animales insulinorresistentes con diabetes inducida por TAC puede mejorar la homeostasis de la glucosa a través de la inducción de cambios en las tasas de proliferación y apoptosis de la célulaβ y la expresión del gen de la insulina.
Material y métodosAnimalesEn un estudio previo11 investigamos el efecto de los ICN sobre la homeostasis de la glucosa en animales tanto resistentes como sensibles a la insulina, a saber, ratas Zucker obesas (RZO) y delgadas (RZL). Las RZO tienen una mutación homocigótica en el receptor de la leptina (fa/fa)12,13 que como resultado produce hiperfagia, obesidad, hiperlipidemia y resistencia a la insulina severa14,15. Las RZO, en condiciones normales, son capaces de mantener la euglucemia gracias a una elevada proliferación de las célulasβ y a una hipersecreción de insulina16. Llama la atención el hecho de que los ICN solo inducen diabetes cuando son administrados a animales con resistencia a la insulina, o sea, a las RZO y no a las RZL11. Con estos datos, para el presente trabajo solo hemos realizado el estudio con las RZO.
Empleamos animales de entre 4 y 6semanas de edad, con un peso de 200±50g (Charles-River, Francia). Fueron estabulados en jaulas adecuadas, a 22°C, con un ciclo de luz-oscuridad de 12h y alimentadas con agua y comida en pellet ad libitum. El comité ético del Hospital Universitario de Canarias aprobó el experimento.
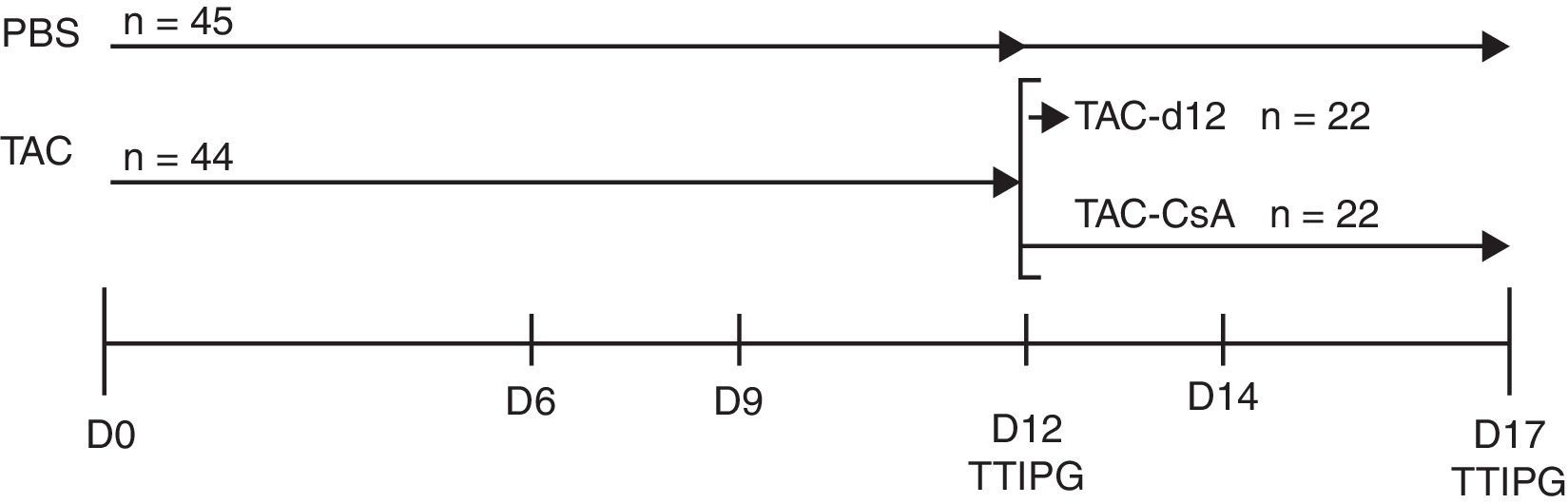
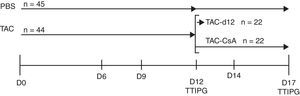
Diseño experimentalBasado en un estudio previo de nuestro grupo11, inducimos la diabetes por TAC en animales obesos y luego reemplazamos el TAC por CsA. Para ello tratamos un grupo de RZO (n=44) con TAC durante 11días para inducir la diabetes, y posteriormente, a día 12, los animales fueron divididos en 2 subgrupos: a)TAC-día12 (grupo de referencia), formado por 22 animales que fueron sometidos a un test de tolerancia intraperitoneal a la glucosa (TTIPG) y luego sacrificados, y b)TAC-CsA, formado por 22 animales a los que el día12 de tratamiento se les sustituyó el TAC por CsA durante 5días, en el día 17 los animales se sometieron a un TTIPG y luego fueron sacrificados. Como grupo control, 45 animales recibieron el vehículo (PBS) durante 12días; a 23 de ellos se les realizó el TTIPG y fueron sacrificados a día12, y a 22 se les realizó el TTIPG a día17 y luego fueron sacrificados (fig. 1).
Esquema temporal del experimento.
Los animales fueron tratados con tacrolimus (0,3mg/kg/dia) durante 11días y aleatoriamente asignados a uno de los siguientes grupos: a)TAC-d12 (n=22), sacrificados a día12, o b)TAC-CsA (n=22), tacrolimus fue reemplazado por CsA (2,5mg/kg/día) durante 5días. El control no tratado (PBS, n=23) recibió PBS por 11días y sacrificado en el día12, o recibieron PBS por 17días (PBS, n=22).
En nuestro estudio previo11 todos los animales mostraron diabetes con hiperglucemia severa tras 12días con TAC, lo que fue revertido con la retirada del fármaco. Además, algunos animales murieron durante el TTIPG a día1211 debido a una hiperglucemia severa. De este modo, para el presente estudio consideramos que los animales tratados con TAC durante 12días tenían ya una diabetes establecida, y por esto no prolongamos el tratamiento con TAC durante 17días. Para determinar la duración del tratamiento con CsA tras el cambio (TAC-CsA), realizamos análisis preliminares en un subgrupo de animales (n=5) en los cuales medimos diariamente los niveles de glucosa en ayunas tras el cambio a CsA. Todos los animales mostraron valores normales de glucosa (<126mg/dl) el quinto día tras el cambio a CsA; por tanto, decidimos realizar el estudio de la conversión del fármaco a los 5días de haberse realizado el cambio a CsA.
Los animales tratados con TAC recibieron una inyección intraperitoneal diaria de TAC (0,3mg/kg/día), y aquellos a los que se les realizó el cambio a CsA recibieron 2,5mg/kg/día. Las dosis de TAC (0,3mg/kg/día) y CsA (2,5mg/kg/día) empleadas fueron determinadas en experimentos previos11 para obtener los niveles plasmáticos similares a los empleados en la práctica clínica tanto para CsA (200-250ng/ml) como para TAC (8-10 ng/ml).
Los animales se pesaron diariamente y los niveles de glucosa en ayunas se midieron los días 12, 14 y 17. El día 12 del grupo TAC-d12 (n=20) y el día 17 del grupo TAC-CsA (n=15), los animales fueron sometidos a un TTIPG con glucosa (2g/kg) y los niveles de glucosa e insulina se midieron a 0, 30, 60 y 120min. Los animales con PBS también fueron sometidos al TTIPG los días 12 y 17. Todos los animales fueron sacrificados con una inyección intraperitoneal de pentobarbital sódico (50mg/kg).
El día 12 para los grupos PBS y TAC-d12, así como el día 17 para PBS y TAC-CsA, los páncreas de 10 animales por grupo fueron extraídos para los análisis inmunohistoquímicos y morfométricos. Los páncreas de otros 10 animales de cada grupo fueron extraídos para los análisis de expresión génica de la insulina.
Muestras de suero recogidas de la aorta abdominal fueron obtenidas para medir los niveles de insulina y los parámetros bioquímicos. Las determinaciones bioquímicas se llevaron a cabo en el laboratorio central del Hospital Universitario de Canarias.
DefinicionesDiabetes: glucemia en ayunas ≥126mg/dl o >200mg/dl a los 120min del TTIPG9. Prediabetes: glucemia anómala en ayunas: glucosa en ayunas ≥100 a 125mg/dl o intolerancia a la glucosa: ≥140 a 199mg/dl a 120min del TTIPG9.
Análisis morfométricos e inmunohistoquímicosEn 10 RZO por grupo de tratamiento a día17, los páncreas fueron extraídos y fijados durante 24h en paraformaldehído al 4% y posteriormente incluidos en parafina. Se realizaron secciones seriadas de 3μm de grosor y se montaron en portaobjetos. Para los análisis morfométricos, los páncreas fueron teñidos con suero antiinsulina de cerdo de guinea y revelado con métodos inmunológicos basados en la biotina-estreptavidina. Se determinó el número de islotes y el área relativa de los mismos en base al área total de páncreas.
La proliferación de la célulaβ se midió usando el método de incorporación de bromodeoxiuridina (BrdU) (Roche, Suiza). A los animales se les inyectó BrdU (100mg/kg) 8h antes del sacrificio. Los páncreas fueron extraídos y procesados como se describió previamente. Las secciones histológicas fueron teñidas con anticuerpos para BrdU e insulina. La proliferación se midió como una estimación del número de células positivas para BrdU en base al número de células positivas para la insulina. Los niveles de apoptosis se midieron con la técnica del TUNEL, llevada a cabo de acuerdo a las instrucciones del fabricante (Cell Death detection kit, POD) (Roche, Suiza). La estimación de células positivas en TUNEL se ajustó al área positiva para insulina. Todas las imágenes fueron tomadas con una cámara Olympus DP72 (Olympus, Tokyo, Japón) acoplada al microscopio Olympus DX41 (Olympus, Tokyo, Japón) y posteriormente analizadas usando el programa ImageJ (National Institute of Health).
Extracción del ácido ribonucleicoLos islotes de los animales restantes (n=10 por tratamiento) fueron aislados de los páncreas mediante digestión con colagenasa17. Los islotes usados para el aislamiento de ARN fueron rápidamente congelados en soluciónD con tiocianato de guanidio. El ARN total se obtuvo por el método de Chomczynski18. Determinamos la pureza y la concentración del ARN con Nano-drop 2000 (Thermo-Fisher, Boston, MA, EE.UU.).
Reacción en cadena de la polimerasa en tiempo realLa cuantificación de la abundancia relativa del ARNm de Ins2 se llevó a cabo mediante PCR cuantitativa (qPCR) usando SYBR green como método de detección. El ARN total de la muestra fue retrotranscrito usando un kit de síntesis de ADNc (Promega, Madison, WI, EE.UU.) y el ADNc de Ins2 fue amplificado usando cebadores específicos. La secuencia de los oligonucleótidos empleados fue: 5’-TCATCCTCTGGGAGCCCCGC-3’ (cebador con sentido) y 5’-GTTGCAGTAGTTCTCCAGTTGGT-3’ (cebador anti sentido). El incremento de la fluorescencia durante la reacción de PCR fue detectado con el sistema iQ5 (Bio-Rad, Hércules, CA, EE.UU.) y la expresión génica fue normalizada con los genes referencia beta-actina y SDHA. Los datos fueron analizados con el programa qBASE19.
Análisis estadísticosLas variables continuas son descritas como media y desviación estándar (DE) o mediana y rango intercuartílico cuando es apropiado, las variables dicotómicas se representan con la N y el %. Los grupos fueron comparados usando el test no paramétrico de Kruskall-Wallis y el test de Mann-Whitney según fue necesario. Para los datos de qPCR llevamos a cabo una transformación logarítmica de la expresión génica normalizada, lo que da más simetría a la distribución, atribuyendo igual peso a las condiciones mayor y menor expresión génica20.
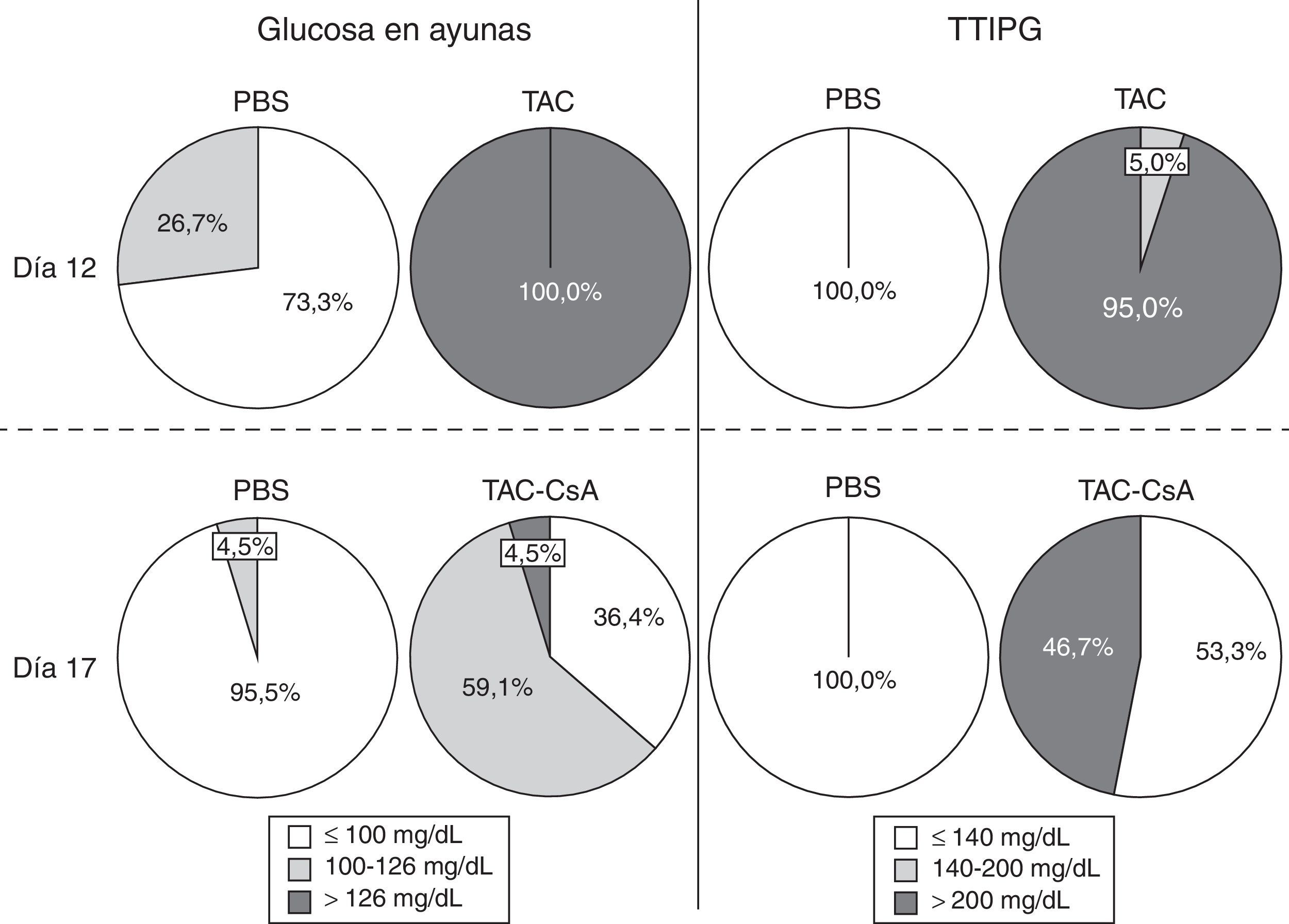
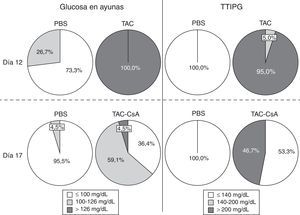
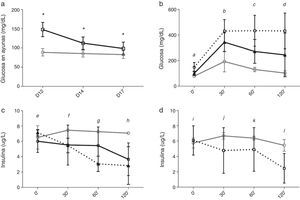
ResultadosHomeostasis de la glucosa tras 11días con tacrolimusDe acuerdo con la glucemia en ayunas, el TAC indujo diabetes en el 100% de los animales a día12 (fig. 2). Ningún animal con PBS desarrolló diabetes, y solo el 26,7% (12/45) tenían prediabetes (fig. 2). En el día12, el 95% de los animales con TAC que fueron sometidos al TTIPG (n=20) presentaron niveles de glucosa >200mg/dl a los 120min (fig. 2). Solo un animal tuvo glucemias entre 140 y 200mg/dl. Ningún animal con PBS presentó diabetes basado en el TTIPG a día12 (fig. 2).
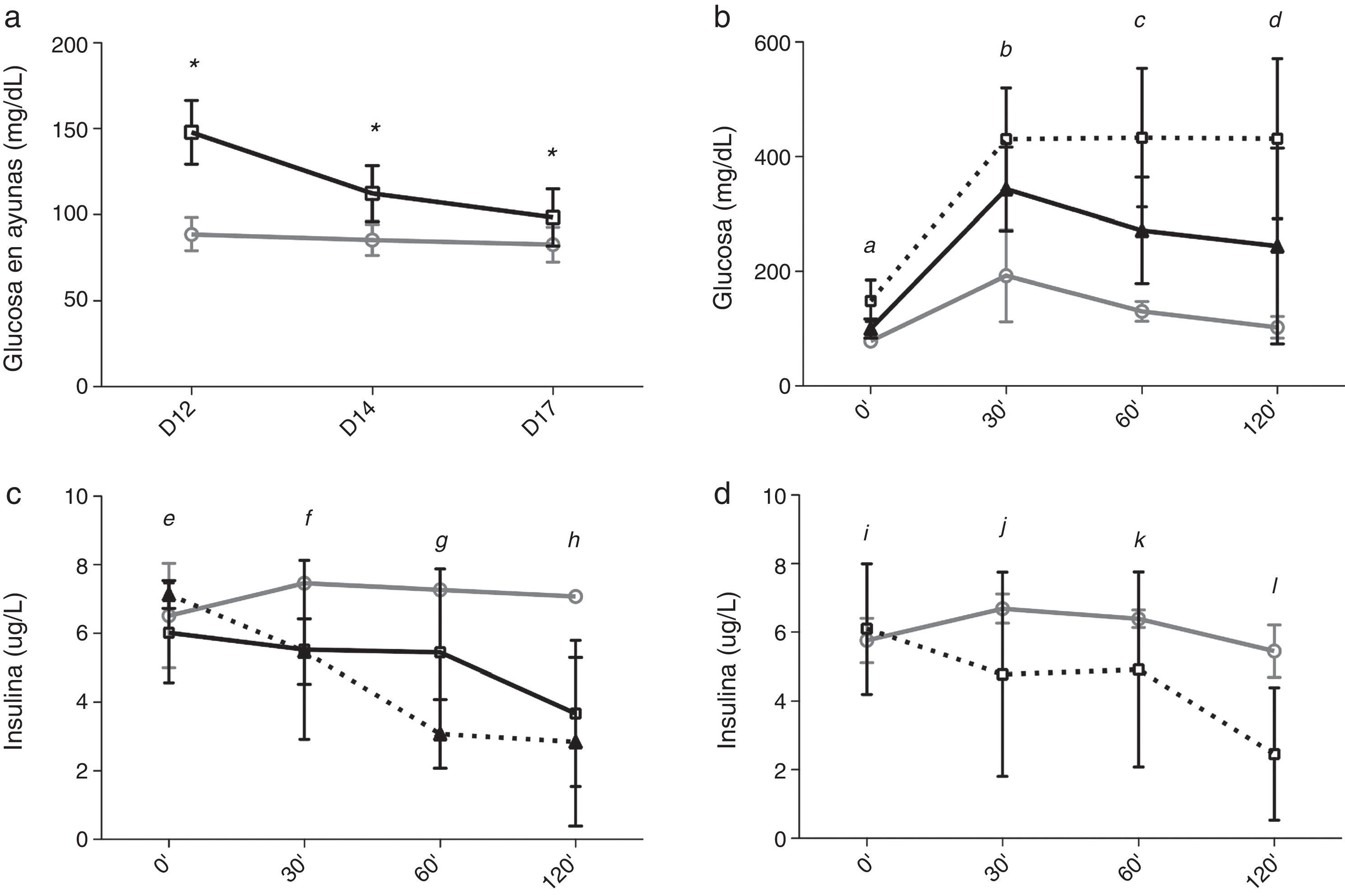
Homeostasis de la glucosa tras el cambio de tacrolimus a ciclosporinaEntre los días 12 y 17, tras el cambio de TAC a CsA los niveles de glucosa en ayunas disminuyeron en el grupo TAC-CsA (fig. 3a) y los niveles de glucosa a día17 fueron significativamente menores comparados con los del día12 (p<0.001) (fig. 3a). Basado en los niveles de glucosa en ayunas, en el grupo TAC-CsA solo uno de los 22 animales persistía con diabetes (4,5%), 13 de 22 (59,1%) tenían prediabetes, y 9 de 22 (36,4%) mostraron una glucemia en ayunas normal (fig. 2). Basado en TTIPG, 7 de 15 (46,7%) animales mantenían valores diabéticos (2-h glucosa >200mg/dl) en el grupo TAC-CsA, y 8 de 15 (53,3%) mostraron glucemias normales (<140ml/dl) a día17 (fig. 2). En cada punto del TTIPG, los animales del grupo TAC-CsA presentaron mayores niveles de glucosa que los de PBS (fig. 3b) pero menores niveles que aquellos en el grupo TAC-d12 (fig. 3b). Finalmente, los animales con PBS a día17 mostraron un TTIPG normal (fig. 3b).
Evolución de la glucemia y los niveles de insulina de la RZO.
a)Glucemia en ayunas para PBS (línea gris) y TAC (línea negra). b)Niveles de glucemia y c)niveles de insulina en el TTIPG a día17. La línea gris corresponde a PBS y la negra a TAC-CsA. Línea negra discontinua, TAC-d12. d)Niveles de inulina durante la TTIPG a día17 en los animales del grupo TAC-CsA con reversión de la diabetes (línea gris) o con diabetes persistente (línea discontinua).
* TAC-CsA vs PBS p≤0,0001.
a: todas las comparaciones p=0,0001.
b: TAC-CsA o TAC-d12 vs PBS p=0,0001; TAC-CsA vs TAC-d12 p=0,005.
c: TAC-CsA y TAC-d12 vs PBS p=0,0001; TAC-CsA vs TAC-d12 p=0,0001.
d: TAC-CsA vs PBS p=0,012; TAC-d12 vs PBS p=0,0001; TAC-d12 vs TAC-CsA p=0,002.
e: TAC-CsA o TAC-d12 vs PBS p>0,05; TAC-d12 vs TAC-CsA p=0,031.
f: TAC-CsA vs PBS y vs TAC-CsA p>0,05, TAC-d12 vs PBS p=0,033.
g: TAC-CsA vs PBS p=0,042; TAC-d12 vs PBS p=0,002; TAC-d12 vs TAC-CsA p=0,011.
h: TAC-CsA y TAC-d12 vs PBS p≤0,0001; TAC-d12 vs TAC-CsA p=0,002.
i-l: TAC-CsA-reversión de diabetes vs TAC-CsA-persistencia de diabetes i, j y k: p>0,05; l: p=0,005.
Durante el TTIPG del día 17, los animales a los que se les cambió el TAC por CsA no mostraron un incremento en la secreción temprana de insulina (0 a 30min), pero sí menores niveles de insulina que el grupo con PBS (fig. 3c), siendo comparables a los niveles determinados en el grupo TAC-d12 (fig. 3c). Sin embargo, en un análisis de sensibilidad, la secreción de insulina mejoró en el subgrupo de animales en los que la diabetes revirtió tras el cambio a CsA (n=8), como muestra una tendencia hacia mayores niveles de insulina a los 30 y los 60min y niveles significativamente superiores a los 120min, comparado con los animales en los que la diabetes persistió a pesar del cambio a CsA (n=7) (fig. 3d).
Finalmente, en el día 12 los niveles de TAC en el TAC-d12 fueron 8,37±3,94ng/ml, y a día17 los niveles de CsA en el grupo TAC-CsA fueron 508,18±67,85ng/ml, con unos niveles residuales de TAC de 2,46±0,90ng/ml.
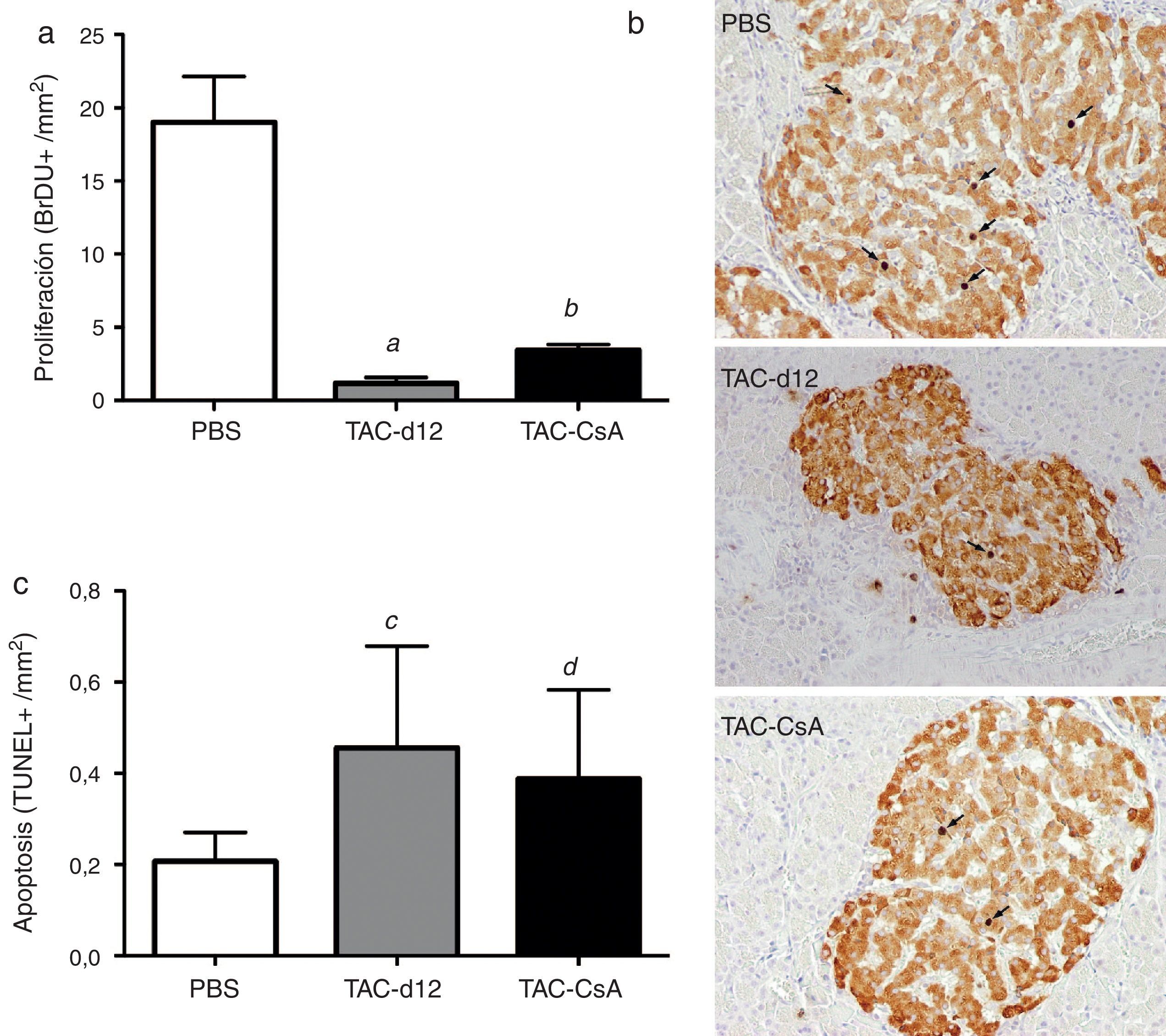
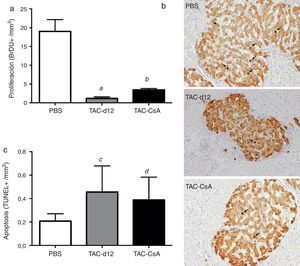
Proliferación de la célula beta pancreática, apoptosis y expresión génica de la insulina tras 11 días con tacrolimus y tras el cambio a ciclosporinaLa cuantificación con bromodeoxiuridina en las células positivas para insulina indicó una menor proliferación en el grupo TAC-d12 tras 11días de tratamiento que en el grupo con PBS (p=0,009) (fig. 4a). Al comparar el cambio de TAC a CsA (TAC-CsA) con el grupo TAC-d12, la tasa proliferativa de las célulasβ mejoró significativamente (p=0,003) (fig. 4a). No se apreciaron diferencias en la apoptosis entre ambos grupos (fig. 4c).
Proliferación (a) (b) y apoptosis (c) de las células β. Se representa la media ± DE. Las flechas (b) muestran los núcleos BrdU positivos para cada uno de los tratamientos.
a: TAC-d12 vs PBS p = 0,009.
b: TAC-CsA vs PBS p = 0,001 y vs TAC-d12 p = 0,003.
c: TAC-d12 vs PBS p = 0,172.
d: TAC-CsA vs PBS p = 0,311 y vs TAC-d12 p = 0,824.
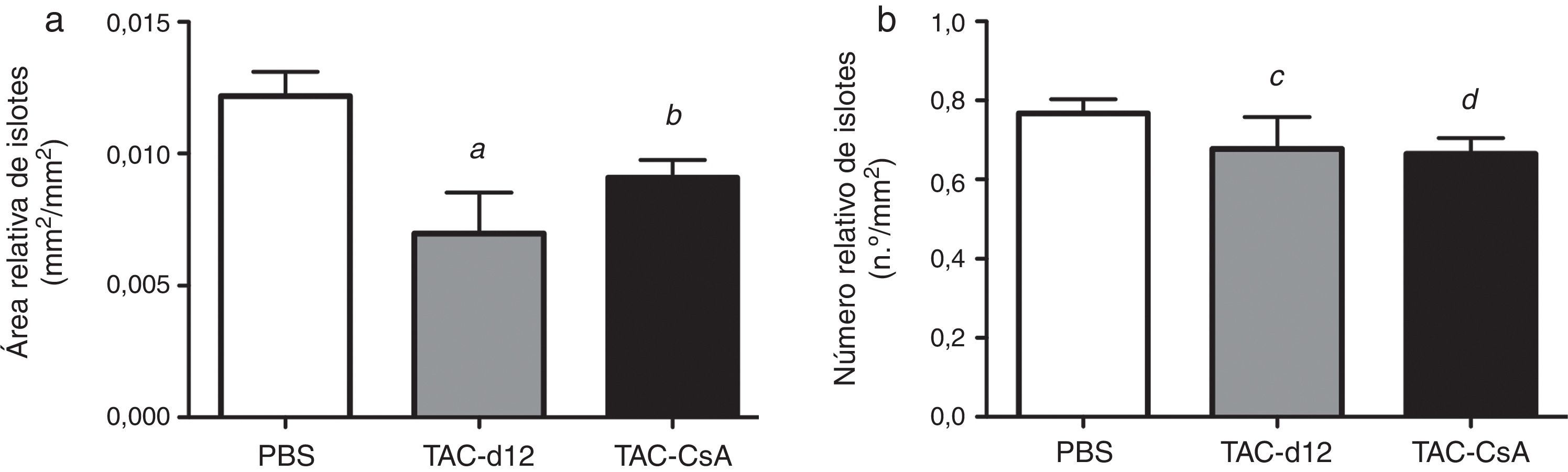
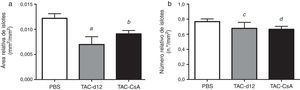
El área relativa de islote fue también menor en el grupo TAC-d12 al comprarlo con el de PBS (p=0,011) (fig. 5), pero no hubo diferencias con el TAC-CsA. No se apreciaron diferencias en el número relativo de islotes para ninguno de los grupos.
Morfometría de los islotes de RZO tratadas con PBS o TAC durante 11días (TAC-d12) o TAC durante 11días con cambio a CsA (TAC-CsA) durante 5días (n=10 por tratamiento). a)Área de islotes ajustada por el área total de páncreas. b)Número de islotes ajustado por milímetros cuadrados de páncreas. Se representa la media ± DE.
a: TAC-d12 vs PBS p=0,011.
b: TAC-CsA vs PBS p=0,016 y vs TAC-d12 p=0,197.
c: TAC-d12 vs PBS p=0,523.
d: TAC-CsA vs PBS p=0,078 y vs TAC-d12 p=0,892.
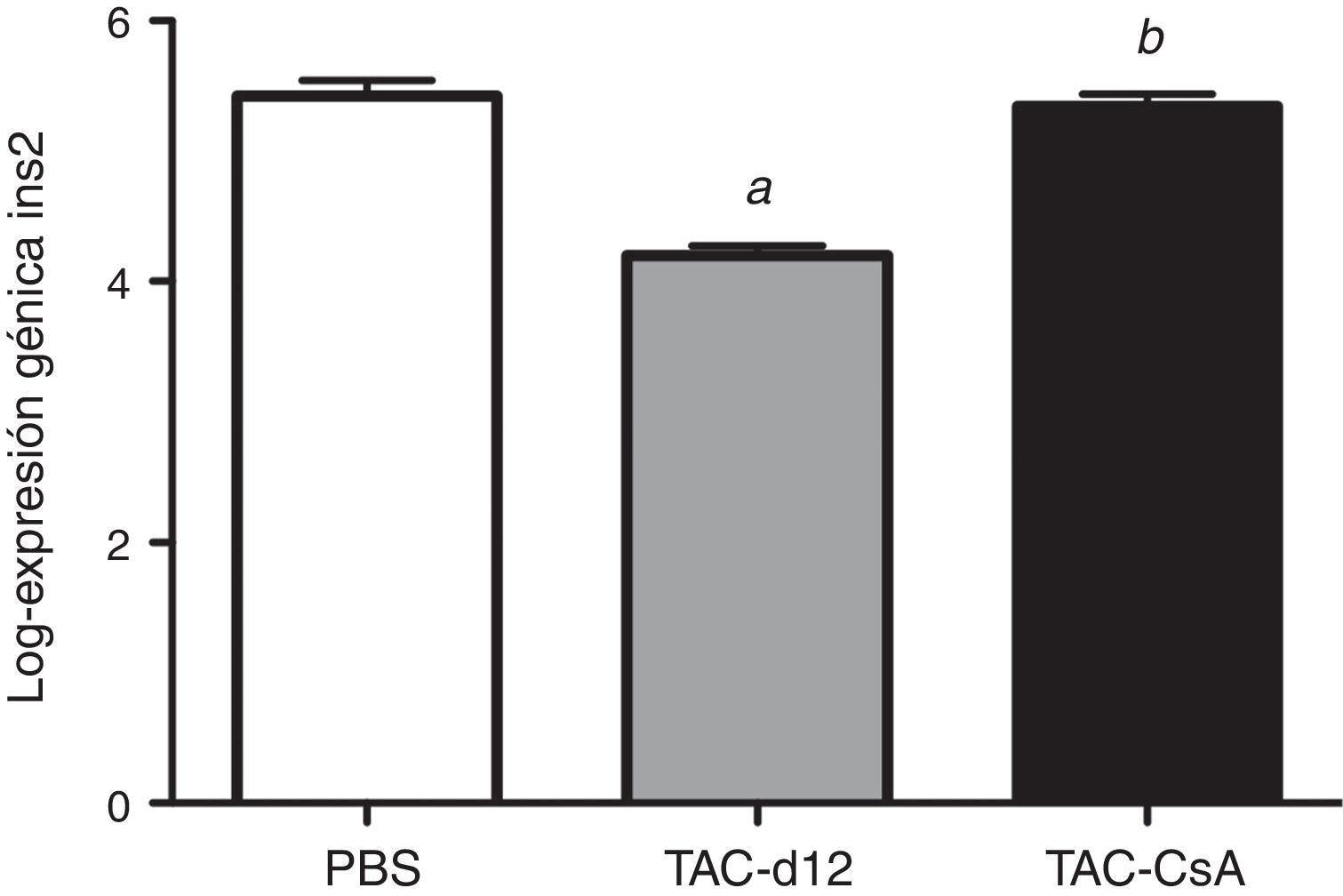
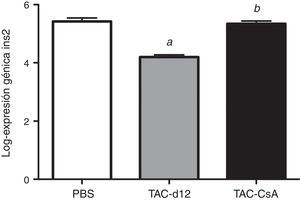
Once días con tacrolimus (TAC-d12) redujo la expresión del gen Ins2 significativamente con respecto al grupo con PBS (p≤0.0001) (fig. 6). Tras 5días del cambio a CsA (TAC-CsA), la expresión del gen Ins2 volvió a valores comparables a los de PBS (p=0,755) y se incrementó significativamente con respecto a TAC-d12 (p≤0,0001) (fig. 6).
DiscusiónEn este modelo de diabetes inducida por tacrolimus en animales con resistencia a la insulina hemos observado que el cambio a ciclosporina-A conduce a: 1)una mejora de los niveles de glucemia, tanto en ayunas como durante el TTIPG; 2)la reversión de la diabetes en el 53,3% de los animales; 3)un mejora en la proliferación de las células β, y finalmente 4)un aumento en la expresión génica de la insulina.
La rata Zucker obesa (RZO) es un modelo conocido de resistencia a la insulina. Hemos observado previamente que en las RZO, el mayor efecto diabetógeno de TAC comparado al de CsA es determinado por la resistencia a la insulina11. Para el presente estudio, cuyo objetivo fue comprender mejor los mecanismos de la reversión de la DMPT, usamos RZO en lugar de modelos animales insulina-sensibles como pueden ser Sprague Dawley, Wistar, o RZL. Hemos confirmado nuestro hallazgos previos, en los que la administración de TAC durante 11días inducía diabetes en el 100% de los animales insulinorresistentes diagnosticada bien por glucemia en ayunas o por TTIPG (figs. 2 y 3).
Nuestro principal hallazgo es que, en la diabetes inducida por TAC, el cambio a CsA conduce a una mejoría en el metabolismo de la glucosa y a la reversibilidad de la diabetes en el 50% de los animales (fig. 2). Esta reversibilidad se observó solo 5días después del cambio a CsA (fig. 3a,b). Sin embargo, no fue completa, ya que el 59,1% de los animales mostraron niveles de glucemia dentro del rango de la prediabetes (por glucemia basal en ayunas), y en el 46,7% la diabetes persistió según los resultados del TTIPG (glucemia a 120min >200mg/dl) (fig. 2). De este modo, los cambios en la homeostasis de la glucosa, aunque relevantes si se comparan con la diabetes establecida en el grupo de TAC, no representaron la reversibilidad total de la diabetes inducida por el fármaco.
Las causas de la mejoría en el metabolismo de la glucosa tras sustituir el TAC por CsA no están claras, pero podrían estar en parte relacionadas con un incremento en la proliferación de la célula β (fig. 4). Hemos observado previamente que el TAC es más potente inhibidor de la proliferación de la célulaβ que la CsA11. Con esto, es plausible que la sustitución de un potente inhibidor de la proliferación (TAC) por uno menos potente (CsA) ayude a la célulaβ a recuperar en cierta medida su capacidad proliferativa y, en consecuencia, a manejar mejor la hiperglucemia. Hoy en día, las célulasβ son consideradas más resistentes al daño de lo que antes se pensaba, con una alta capacidad de recuperación frente a un ambiente tóxico21. En nuestro trabajo resulta especialmente llamativa la reducción en el área media de islotes pancreáticos tras 11días de tratamiento con TAC, la cual no se corresponde con un aumento equivalente en la apoptosis de la célulaβ. En este aspecto, se han hecho numerosos esfuerzos para determinar los mecanismos que hacen que haya un descenso en la función y en el número de célulasβ en los enfermos con diabetes mellitus tipo2. Nuevas evidencias sugieren que estos cambios podrían deberse a procesos de desdiferenciación o transdiferenciación en estas células, y no a procesos de apoptosis, lo que sugiere un nuevo concepto en la patogénesis de la disfunción de la célulaβ22. Estas nuevas hipótesis estarían en consonancia con nuestro modelo, en el que se observa la pérdida de un marcador de identidad de la célulaβ como es la insulina, pero por el contrario no se aprecia un aumento en la apoptosis. Además, la pronta recuperación observada tras el cambio del fármaco, así como ya habíamos observado previamente con su retirada11, apoyan la idea de una pérdida de función e identidad de la célulaβ más que de un proceso de muerte celular. En cualquier caso, son necesarios futuros experimentos para confirmar estas hipótesis en este modelo de diabetes inducida por ICN.
También hemos observado en estudios previos que el TAC es un inhibidor más potente de la expresión del gen Ins2 que la CsA11. Según estos datos, la expresión del gen Ins2 (homólogo al gen de la proinsulina humana) tras 11días de exposición a TAC (TAC-d12) fue significativamente más baja que en los animales que recibieron solo el vehículo (PBS) durante 17días (fig. 6). El incremento en la expresión del gen Ins2 después del cambio a CsA fue significativamente superior cuando se comparó con el grupo al que solo se le administró TAC (p≤0,0001 vs. TAC-d12), lo cual sugiere que una mejoría en la expresión del gen Ins2 podría estar relacionada con el mejor manejo de la glucosa tras el cambio a CsA.
Los mecanismos moleculares involucrados en el incremento de la proliferación de la célulaβ asociados al cambio de TAC a CsA son, hasta donde llega nuestro conocimiento, desconocidos. El hecho de que el TAC sea un inhibidor más potente de la calcineurina que la CsA23 podría explicar el mayor impacto del primero en la disminución de factores de transcripción dependientes de la calcineurina, como pueden ser el factor nuclear de las célulasT (NFAT), el elemento de respuesta al cAMP (CREB) y el transductor de CREB (TORC2), los cuales resultan cruciales para la proliferación de la célulaβ24-26.
Nuestros resultados son consistentes con los pocos estudios retrospectivos realizados en humanos10. Ghisdal et al.10 observaron un 42% de reversibilidad de la DMPTcon el cambio de TAC a CsA en 34 pacientes y un 0% en 20 pacientes que continuaron con TAC. En este trabajo los autores también citaron otro estudio clínico con similares hallazgos. Sin embargo, estos trabajos presentan un diseño post hoc y un bajo poder estadístico para probar eficacia y seguridad. El presente trabajo en animales con resistencia a la insulina provee información sobre los mecanismos y la manera en que la mejoría del metabolismo de la glucosa se asocia a un temprano cambio a CsA, una vez que la diabetes inducida por TAC está establecida. Serán necesarios futuros ensayos clínicos para poder establecer el papel que esta estrategia puede tener a la hora de minimizar el daño producido a la célula β en el establecimiento de la DMPT.
Nuestro estudio tiene limitaciones. La primera de ellas es la aplicación de los datos obtenidos en un modelo animal a la investigación clínica. Sin embargo, las coincidencias entre este trabajo y los trabajos retrospectivos publicados en humanos10 podrían indicar la utilidad de este modelo animal para el estudio del impacto del cambio de TAC a CsA en el metabolismo de la glucosa y en la biología de la célulaβ. La segunda limitación hace referencia a la aplicación de criterios humanos como prediabetes y diabetes en un modelo animal. Sin embargo, esto es un estándar en investigación básica26-29, y hasta donde sabemos no hay un consenso claro para estas definiciones en roedores. Otra limitación está relacionada con el hecho de la duración del cambio; 5días de cambio a CsA podrían ser pocos, pero con ellos los niveles de glucosa en ayunas a día17 mostraron mejoras significativas. Además, nuestros resultados muestran que se trata de tiempo suficiente para diluir el efecto tóxico del TAC y, por tanto, descartar la posibilidad de un efecto acumulativo de ambos fármacos en la célulaβ. El efecto que pueda tener en la homeostasis de la glucosa una exposición más larga a CsA debe ser establecido en el futuro. En el presente estudio utilizamos niveles relativamente elevados de CsA, lo que pudo haber incrementado el riesgo de diabetes en animales que recibieron esta medicación. Sin embargo, el uso de niveles más bajos solo podría haber incrementado las diferencias con el grupo de TAC. Por último, en este modelo animal la diabetes ha sido establecida tras un corto periodo de exposición al fármaco y el experimento no fue diseñado para evaluar la reversibilidad de la diabetes tras un largo periodo, lo cual debe ser investigado.
En resumen, podemos concluir que en la diabetes inducida por TAC el cambio a ciclosporina mejora la homeostasis de la glucosa, lo cual está relacionado con un incremento en la proliferación de la célulaβ y posiblemente con un incremento en la expresión del gen de la insulina. La evaluación ad hoc de este efecto en pacientes con DMPT debe ser estudiada.
FinanciaciónLos autores quieren agradecer al proyecto IMBRAIN (FP7-RE6-POT-2012-CT2012-31637-IMBRAIN), fundado bajo el 7.° Frameworks Programme. Agradecen al Instituto de Salud CarlosIII (Fondo de Investigación Sanitaria: FIS) por las siguientes financiaciones: PI 07/0732, REDINREN RD/0021/0008 y PI10/02428. También agradecemos los fondos del IRSIN (Instituto Reina Sofía de Investigación) y Fondos FEDER.
Conflicto de interesesNinguno de los autores presenta conflicto de intereses en lo referente al presente trabajo.