En el síndrome nefrótico, la podocituria aumentada acompaña a la proteinuria patológica. El tratamiento con enalapril, losartán y amiloride podría reducir ambas variables.
ObjetivosEvaluamos el efecto antiproteinúrico de 2 esquemas terapéuticos no inmunológicos, la relación cuantitativa entre la podocituria y la proteinuria, y las variables de riesgo asociadas con la proteinuria.
Material y métodosIncluimos niños de 4 a 12 años de edad con síndrome nefrótico corticorresistente, utilizando 2 esquemas terapéuticos distintos: grupo A, enalapril+losartán, y grupo B, enalapril+losartán+amiloride.
ResultadosEn el grupo A finalizaron el estudio 17 pacientes, la proteinuria promedio inicial fue de 39mg/m2/h y la proteinuria media al finalizar fue de 24mg/m2/h, en tanto que en el grupo B tratamos a 14 pacientes, la proteinuria promedio inicial fue de 36mg/m2/h y la proteinuria promedio final de 13mg/m2/h, y si bien ningún paciente redujo su proteinuria a valores fisiológicos, tanto la prueba t apareada (11,5, p<0,001) como la prueba ordinal logarítmica (log-rank, χ2: 4, p<0,05) mostraron diferencias significativas en la disminución de la proteinuria, para los pacientes del grupo B frente a los pacientes del grupo A. En ninguno de los 2 grupos hubo una variación significativa de la podocituria durante el estudio, y los 2 factores asociados con el incremento de la proteinuria en el modelo de riesgos proporcionales fueron la podocituria y el tiempo transcurrido desde el diagnóstico de síndrome nefrótico corticorresistente primario hasta el inicio del tratamiento antiproteinúrico. En ningún paciente se observaron efectos adversos de los tratamientos empleados.
ConclusionesEl uso de amiloride disminuyó la proteinuria, sin modificar significativamente la podocituria; no observamos una relación positiva entre ambas variables.
In nephrotic syndrome, increased podocyturia accompanies pathologic proteinuria. The therapeutic regimen with enalapril, losartan and amiloride could reduce both variables.
ObjetivesEvaluate the anti-proteinuric effect of 2 non-immunological therapeutic regimens, the quantitative relationship between podocyturia and proteinuria.
Material and methodsWe included children aged 4 to 12 years with corticoresistant nephrotic syndrome, using 2 different schemes: group A, enalapril+losartan, and group B, enalapril+losartan+amiloride.
ResultsIn group A, 17 patients completed the study, the initial mean proteinuria was 39mg/m2/h and mean proteinuria at the end was 24mg/m2/h, while in group B 14 patients were treated and the initial average proteinuria was 36mg/m2/h and the end average proteinuria was 13mg/m2/h. The paired T test showed significant differences in the decrease in proteinuria, for patients in group B without variation in podocyturia. The 2 factors associated with an increase in proteinuria were podocyturia and the time elapsed from the diagnosis of cortico-resistant nephrotic syndrome to the start of treatment anti-proteinuric.
ConclusionsThe use of amiloride decreased proteinuria, without significantly modifying podocyturia; we did not observe a positive relationship between both variables.
La proteinuria persistente condiciona una progresiva declinación del filtrado glomerular (FG), constituyendo un marcador de daño renal progresivo y su descenso parece asociarse con la preservación de la función renal.
Clásicamente, si bien para lograr la reducción de la proteína urinaria se han implementado esquemas terapéuticos no inmunológicos con fármacos inhibidores de la enzima conversiva de la angiotensina y bloqueantes de la angiotensina ii, desde hace un tiempo se han documentado experiencias exitosas sobre la adición al esquema nefroprotector mencionado de un inhibidor sobre el receptor del activador del plasminógeno tipo uroquinasa, como el amiloride, el cual reduciría el daño podocitario y consecuentemente podría atenuar la proteinuria.
En el síndrome nefrótico, el desprendimiento podocitario causado a partir de la contracción patológica parece preceder a la aparición de la proteinuria, por lo cual el fundamento de este estudio consistió en examinar la acción del amiloride sobre la podocituria y la proteinuria en pacientes pediátricos con síndrome nefrótico corticorresistente (SNCR) primario.
Objetivos- 1.
Evaluar el efecto antiproteinúrico de 2 esquemas terapéuticos no inmunológicos.
- 2.
Evaluar la relación cuantitativa entre la podocituria y la proteinuria.
- 3.
Evaluar las variables de riesgo asociadas con la proteinuria.
Desde marzo de 2016 hasta marzo de 2020 se seleccionaron pacientes pediátricos con antecedentes de SNCR primario procedentes de la asistencia pública y privada, para la realización de un ensayo clínico, controlado, aleatorizado, apareado, no cegado entre niños de 4 a 12 años de edad, todos con biopsia renal realizada y sin estudio genético.
Se consideraron:
- a.
Criterios de inclusión: ingresamos pacientes con proteinuria>4mg/m2/h, registros de tensión arterial media en percentiles<95 para edad, sexo, peso y talla, sin tratamientos específicos inmunosupresores desde por lo menos 6 meses antes y FG mayor de 90ml/min/1,73m2. Con aceptación del consentimiento médico informado.
- b.
Criterios de exclusión: fueron excluidos los pacientes con intolerancia o reacciones alérgicas a los tratamientos indicados, monorrenos, con hipertensión vasculorrenal, disnatremias o enfermedad infecciosa y/u oncológica activa.
- c.
Criterios de suspensión: fueron retirados del estudio los pacientes que presentaron disminución persistente del FG mayor del 30% del valor inicial durante el seguimiento, en por lo menos 2 controles consecutivos, hiperkalemia (>5,5mEq/l) no corregible con el tratamiento habitual, hipotensión sintomática, reducción del ritmo diurético a menos de 1ml/kg/h, hiponatremia sintomática o aquellos que no concurrieron a, por lo menos, el 80% de las citas establecidas.
- d.
Tratamientos: la población se dividió aleatoriamente en 2 grupos: el grupo A recibió enalapril y losartán, en tanto que el grupo B fue tratado con enalapril, losartán y amiloride. En ambos grupos se mantuvo una dieta hiposódica.
- e.
Controles: desde el inicio del tratamiento y luego trimestralmente se realizaron controles clínicos y de laboratorio en el total de la población con SNCR, midiéndose en cada consulta el peso, la talla y la tensión arterial, considerándose normales los valores de acuerdo con los percentiles de peso y edad y estimando la tensión arterial media según la fórmula: 1/3 tensión arterial sistólica+2/3 tensión arterial diastólica1.
Los controles de laboratorio realizados fueron: proteinograma electroforético, proteinuria de 24h (expresada en mg/m2/h), creatininemia (calculando el aclaramiento de creatinina por el método de Schwartz, con constante de Barratt correspondiente a sexo y edad expresada en ml/min/1,73m2), hemograma, uremia, uricemia, ionograma sérico y lipidograma, y ionograma urinario (para estimar la ingesta de sodio en la dieta calculamos que cada gramo de sal corresponde a 17mEq/l del sodio urinario).
La podocituria fue medida en 2 momentos: antes del inicio del tratamiento y al finalizar el mismo. Para su cuantificación se utilizó la misma orina recogida para estudios de laboratorio (orina recogida en 24h); las muestras fueron procesadas dentro de la hora de la emisión, utilizando un volumen de 10ml al que se agregó 1ml de formol buffer al 10% en PB (pH 7,2-7,4). Se realizó una técnica de inmunofluorescencia indirecta en cámara húmeda y las muestras fueron observadas en un microscopio de epifluorescencia Nikon Eclipse E200. Se cuantificó el número de células positivas para sinaptopodina en 10 campos 200× para cada muestra a doble ciego. La podocituria se expresó en número de podocitos por 100mg de creatininuria2.
La duración del estudio fue de 24 meses.
- f.
Variables evaluadas: identificamos como variables dependientes los valores de la podocituria y de la proteinuria, y como variables independientes el tiempo transcurrido desde el diagnóstico del SNCR hasta la medición de la última podocituria y proteinuria, y las dosis de enalapril, losartán y amiloride administradas.
- g.
Metodología estadística: estimamos el cálculo del tamaño muestral en 30 pacientes y tolerando hasta una pérdida del 20% se buscó ingresar una población de 36 pacientes por grupo, sobre la cual implementamos una aleatorización simple 1:1.
Empleamos el riesgo relativo, la reducción absoluta del riesgo y el número necesario a tratar para evaluar las variaciones de la proteinuria en los pacientes de ambos grupos, y el test t de Student para determinar si existía una diferencia significativa con respecto al valor final de la proteinuria; para evaluar la reducción del número de pacientes con proteinuria masiva acumulada en diferentes tiempos del estudio, utilizamos la prueba ordinal logarítmica (log-rank).
La relación entre la proteinuria y la podocituria (variables cuantitativas) fue establecida con el coeficiente de Spearman y finalmente utilizamos el coeficiente de riesgos proporcionales de Cox para evaluar la asociación entre los factores de riesgo potenciales (edad, tiempo transcurrido desde el diagnóstico de SNCR hasta el inicio del tratamiento antiproteinúrico no inmunológico, podocituria y FG) y la magnitud de la proteinuria.
Los datos son presentados como medias con DE y una p<0,05 fue aceptada como significativa.
Definiciones:
Proteinuria fisiológica: valor en orina igual o menor de 4mg/m2/h3.
Proteinuria significativa: valores en orina superiores a 4mg/m2/h y hasta 40mg/m2/h3.
Proteinuria masiva: valor en orina mayor de 40mg/m2/h o una relación proteinuria/creatininuria en muestra única de orina mayor de 33.
Síndrome nefrótico primario: proteinuria masiva con hipoalbuminemia (definida como albúmina≤2,5g/dl), generalmente asociada a edema e hipercolesterolemia4.
SNCR: corresponde a la falta de remisión de la proteinuria luego de un tratamiento con: a) prednisona 2mg/kg/día o 60mg/m2/día (dosis máxima, 60mg) en días continuos durante 4-6 semanas en una dosis diaria por la mañana entre las 8 y las 10h, seguido de prednisona 1,5mg/kg o 40mg/m2 en días alternos durante 4-6 semanas; b) prednisona 60mg/m2/día o 2mg/kg/día durante 4-6 semanas en días continuos más 3 pulsos de metilprednisolona de 10mg/kg/dosis4.
El estudio, aprobado por el CEI hospitalario, se adhirió a la Declaración de Helsinki y a los principios descritos en las «Pautas para la buena práctica clínica» de la Conferencia Internacional sobre directrices tripartitas de armonización.
ResultadosIngresaron al protocolo 36 pacientes con SNCR, 9 niñas, con una edad media de 11 años (r=4,1-14,2). Finalizaron el estudio 31 pacientes asignados a 2 grupos (grupo A y grupo B) (tabla 1).
Descripción de los pacientes con síndrome nefrótico corticorresistente
| Pacientes grupo A | Género | Edad (años) | Tiempo transcurrido desde el inicio del tratamiento esteroideo hasta el inicio del tratamiento antiproteinúrico (meses) | Diagnóstico histológico | Fármacos inmunosupresores utilizados |
|---|---|---|---|---|---|
| 1 | Masc. | 7,5 | 28 | GEFS | MMF, CsA |
| 2 | Masc. | 6,2 | 26 | GEFS | CsA, MMF |
| 3 | Masc. | 7,5 | 28 | PM | CsA |
| 4 | Fem. | 8,5 | 24 | PM | CF, CsA |
| 5 | Masc. | 11,1 | 29 | GEFS | CF, CsA |
| 6 | Masc. | 11,9 | 33 | GEFS | CF, MMF, CsA |
| 7 | Masc. | 8,5 | 27 | ECM | CsA |
| 8 | Fem. | 5,7 | 26 | GEFS | CsA, MMF |
| 9 | Fem. | 9,9 | 22 | GEFS | CsA |
| 10 | Masc. | 5,4 | 29 | GEFS | CF, CsA |
| 11 | Masc. | 7,9 | 33 | PM | CF, CsA |
| 12 | Masc. | 8,5 | 28 | ECM | CF, CsA |
| 13 | Masc. | 5,8 | 22 | PM | CF, CsA |
| 14 | Masc. | 6,8 | 31 | GEFS | CF, MMF, CsA |
| 15 | Fem. | 5,3 | 27 | PM | CsA |
| 16 | Masc. | 5,1 | 29 | PM | MMF, CsA |
| 17 | Masc. | 10,5 | 26 | GEFS | CsA |
| Pacientes grupo B | Género | Edad (años) | Tiempo transcurrido desde el inicio del tratamiento esteroideo hasta el inicio del tratamiento antiproteinúrico (meses) | Diagnóstico histológico | Fármacos inmunosupresores utilizados |
|---|---|---|---|---|---|
| 1 | Masc. | 5,3 | 24 | PM | CF, CsA |
| 2 | Masc. | 7,2 | 28 | PM | MMF, CsA |
| 3 | Fem. | 10 | 22 | PM | CsA, MMF |
| 4 | Fem. | 10,4 | 26 | GEFS | CsA |
| 5 | Masc. | 6,6 | 33 | ECM | CF, CsA |
| 6 | Masc. | 8,6 | 26 | PM | CF, CsA |
| 7 | Masc. | 8,3 | 26 | GEFS | CF, MMF, CsA |
| 8 | Masc. | 5,7 | 29 | GEFS | CsA |
| 9 | Fem. | 4,9 | 25 | PM | CF, CsA |
| 10 | Masc. | 9,2 | 24 | ECM | MMF, CsA |
| 11 | Masc. | 11,3 | 26 | PM | MMF, CsA |
| 12 | Fem. | 7,9 | 26 | PM | MMF, CF |
| 13 | Fem. | 10,4 | 25 | GEFS | CF, CsA, MMF |
| 14 | Masc. | 9,3 | 22 | PM | CF, CsA |
CF: ciclofosfamida; CsA: ciclosporina; ECM: enfermedad por cambios mínimos; EN: enalapril; Fem.: femenino; GEFS: glomeruloesclerosis focal y segmentaria; LO: losartán; Masc.: masculino; MMF: mofetil micofenolato; PM: proliferación mesangial.
Grupo A: 17 pacientes (4 mujeres) con una media de edad de 7,7 años (r=5,1-11,9). El tiempo transcurrido desde el inicio del tratamiento esteroideo hasta el inicio del tratamiento antiproteinúrico fue de 27,5 meses (DE 3,1).
La dosis media final de enalapril fue de 0,4mg/kg/día (DE 0,2) y la de losartán fue de 1,2mg/kg/día (DE 0,4).
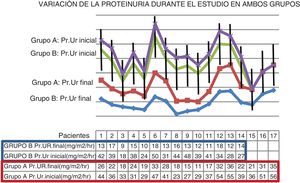
La proteinuria promedio inicial de los 17 pacientes fue de 39mg/m2/h y la proteinuria media al finalizar el estudio fue de 24mg/m2/h, p<0,01 (fig. 1). Cumplidos los 24 meses de tratamiento, ningún paciente redujo su proteinuria a valores fisiológicos (fig. 2).
Variación de la proteinuria (Pr.Ur) durante el estudio en ambos grupos. En cada grupo el descenso de la proteinuria fue significativo, grupo A: p<0,01, grupo B: p<0,001; sin embargo, al comparar la reducción de la proteinuria entre ambos grupos, el descenso de la proteinuria fue significativamente mayor en el grupo B (prueba t: 11,5, p<0,001).
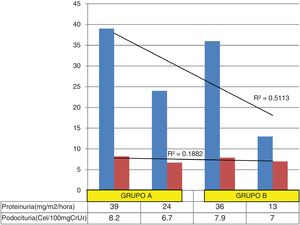
Variación de la proteinuria y la podocituria en ambos grupos. El coeficiente de determinación muestra que un mayor porcentaje de la varianza proteinuria (51%) desde el inicio hasta el final del estudio, no se relaciona proporcionalmente con la varianza podocituria (18,8%); esta disociación entre ambas varianzas se explica porque una mínima variación en los valores de podocituria (especialmente en el grupo B) condiciona una disminución significativa de la proteinuria.
La podocituria promedio de los 17 pacientes al inicio del tratamiento fue de 8,2cél/100mg de creatininuria y la podocituria media final fue de 6,7cél/100mg de creatininuria, p=0,07.
El coeficiente de correlación inversa entre la variación de la proteinuria y la podocituria fue al inicio del tratamiento de −0,40, y al finalizar el mismo fue de −0,51.
La creatinina sérica media fue de 0,62mg/dl (DE 0,2) y el FG fue de 102ml/min/1,73m2 (DE 9).
La proteína sérica media total fue de 4,1g/dl (DE 1,3) y la albuminemia media fue de 2,2g/dl (DE 0,5), en tanto el valor medio de la natremia fue de 143mEq/l (DE 8,3), el del potasio sérico de 4,4mEq/l (DE 0,7) y el de sodio urinario fue de 8mEq/l.
Finalmente, la tensión arterial media fue de 66mmHg (DE 5,5).
Grupo B: 14 pacientes (5 mujeres), con una media de edad de 8,2 años (r=5,3-11,3). El tiempo transcurrido desde el inicio del tratamiento esteroideo hasta el comienzo del tratamiento antiproteinúrico fue de 25,8 meses (DE 2,8).
La dosis media final de enalapril fue de 0,4mg/kg/día (DE 0,2), la de losartán fue de 1,2mg/kg/día (DE 0,4) y la de amiloride fue de 0,3mg/kg/día (DE 0,05).
El riesgo relativo fue de 0,33 (IC 95% 0,14-0,29), con una reducción absoluta del riesgo del 43% (IC 95% 0,22-0,83) y un número necesario a tratar de 2,5 pacientes.
La proteinuria promedio de los 14 pacientes antes de iniciar el tratamiento fue de 36mg/m2/h, y la proteinuria promedio al finalizar el estudio fue de 13mg/m2/h, p<0,001 (fig. 1). Cumplidos los 24 meses de tratamiento, ningún paciente redujo su proteinuria a valores fisiológicos.
La podocituria promedio de los 14 pacientes al iniciar el tratamiento fue de 7,9cél/100mg de creatininuria y la podocituria media final fue de 7,0cél/100mg de creatininuria, p=0,2.
El coeficiente de correlación inversa entre la variación de la proteinuria y la podocituria fue al inicio del tratamiento de −0,38, y al finalizar el mismo fue de −0,31.
La creatinina sérica media fue de 0,68mg/dl (DE 0,1) y el FG promedio fue de 96ml/min/1,73m2 (DE 7).
La proteína sérica media total fue de 3,9g/dl (DE 1,1) y la albuminemia media fue de 2,3g/dl (DE 0,8). El valor medio de la natremia fue de 136mEq/l (DE 2,3), el valor del potasio sérico de 4,0mEq/l (DE 0,3) y el valor medio de sodio urinario fue de 22mEq/l.
Finalmente, la tensión arterial media fue de 63mmHg (DE 2,5).
La prueba t apareada fue 11,5, p<0,001, y la prueba ordinal logarítmica (log-rank) fue χ2: 4 (p<0,05); ambas pruebas mostraron diferencias significativas en la disminución de la proteinuria, para los pacientes del grupo B frente a los pacientes del grupo A (tabla 2).
Variación de las proteinurias entre los pacientes del grupo A y del grupo B
| Meses de control de la proteinuria | Grupo ANúmero de pacientes en riesgo con proteinuria | Grupo BNúmero de pacientes en riesgo con proteinuria | Total | Grupo ANúmero de pacientes con proteinurias observadas | Grupo BNúmero de pacientes con proteinurias observadas | Total | Grupo ANúmero de pacientes con proteinurias esperadas | Grupo BNúmero de pacientes con proteinurias esperadas | Total |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 17 | 14 | 31 | 2 | 2 | 4 | 2,1 | 1,8 | 3,9 |
| 4 | 15 | 12 | 27 | 1 | 2 | 3 | 1,6 | 1,3 | 2,9 |
| 7 | 14 | 10 | 24 | 2 | 2 | 4 | 2,3 | 1,6 | 3,9 |
| 10 | 12 | 8 | 20 | 10 | 1 | 11 | 1,2 | 0,8 | 2 |
| 13 | 11 | 7 | 18 | 0 | 2 | 2 | 1,2 | 0,8 | 2 |
| 16 | 11 | 5 | 16 | 0 | 1 | 1 | 0,7 | 0,3 | 1 |
| 24 | 11 | 4 | 15 | 0 | 1 | 1 | 0,7 | 0,3 | 1 |
Estadística ordinal logarítmica (log-rank) para comparar distribuciones de supervivencia actuarial .La prueba ordinal logarítmica (χ2: 4, p<0,05) mostró diferencias significativas en las remisiones para los pacientes del grupo B frente a los pacientes del grupo A. La extensión de un decimal explica la mínima diferencia en los totales.
Los 2 factores asociados con el incremento de la proteinuria en el modelo de riesgos proporcionales de Cox fueron la podocituria (OR 14, IC 95% 1,1-20) y el tiempo transcurrido desde el diagnóstico de SNCR hasta el inicio del tratamiento antiproteinúrico (OR 18, IC 95% 1,1-39); no encontramos riesgo significativo asociado con la edad (OR 1,1, IC 95% 0,15-12) ni con el FG (OR 0,7, IC 95% 0,5-10).
DiscusiónNosotros implementamos 2 esquemas distintos de tratamiento no inmunológico para reducir la proteinuria en pacientes pediátricos con antecedentes de SNCR primario, y hallamos una disminución de la proteinuria en ambos grupos, aunque más significativa en el tratado con enalapril, losartán y amiloride, sin que la concentración de podocitos en orina mostrará una variación relacionada.
Aunque por motivos operativos no fue posible determinar el linaje genético de los síndromes nefróticos incluidos, no creemos que esta imposibilidad diagnóstica sea determinante para modificar la respuesta terapéutica implementada en este protocolo.
Para justificar el empleo de estos esquemas terapéuticos antiproteinúricos es necesario recorrer brevemente la fisiopatogenia del daño glomerular a partir del borramiento pedicelar, con desprendimiento podocitario, y del desarrollo de la albuminuria patológica5–7. La continuidad de estos eventos iniciales justifica la medición cuantitativa de la podocituria como un biomarcador adecuado para evaluar el compromiso glomerular, a partir de la aparición consecuente de la proteinuria en el mesangio y el desarrollo de la proliferación celular con migración y activación de diversos factores quimiotácticos; esta secuencia favorece la creciente expansión mesangial con compresión progresiva extrínseca del penacho glomerular8–10.
El fundamento del tratamiento combinado con enalapril y losartán se centra, entonces, en una acción básicamente hemodinámica: por un lado, el enalapril inhibe la síntesis de la angiotensina ii y aumenta la concentración de bradiquinina y prostaglandinas, ocasionando entonces un mayor flujo sanguíneo renal, con una disminución consecuente de la concentración proteínica en el capilar glomerular; por otra parte, el losartán bloquea la acción de la angiotensina ii sobre el receptor ATI11,12.
El descenso de la proteinuria en los pacientes del grupo B fue significativamente mayor que en el grupo A, sin que aumentara la podocituria. Posiblemente la adición del amiloride, un diurético bloqueador del canal de sodio, el cual actúa principalmente en los túbulos renales distales13, se justifique a partir de su capacidad para inhibir la activación de la ß3-integrina y la expresión del receptor de uroquinasa, con su forma soluble14. Esta interacción causarìa el borramiento (retracción) de los procesos pedicelares15,16 y el desprendimiento podocitario; ambos eventos representan lesiones tempranas en la progresión hacia la glomeruloesclerosis focal y segmentaria17–21. Apoyando esta hipótesis, Trimarchi et al. refieren que los pacientes con enfermedad de Fabry sin tratamiento presentan una alta podocituria con baja proteinuria22 y, coherentemente con este enunciado (aun tratándose de otra dolencia), nosotros vimos en los pacientes del grupo B, comparados con los del grupo A, una mayor reducción de la proteinuria con una menor concentración cuantitativa de podocitos en orina. Estas variaciones en los 2 grupos posiblemente ratifican la existencia de un patrón establecido entre el tiempo de evolución de la enfermedad y el riesgo progresivo de daño renal irreversible23, y a juzgar por los resultados en nuestra población, el uso del amiloride contribuiría a reducir la podocituria y la proteinuria consecuente.
El no cegamiento del estudio, la imposibilidad de medir algunos de los mediadores involucrados en la fisiopatogenia de la proteinuria, como la plasmina, el plasminógeno y el receptor de uroquinasa23,24, sumados a la imposibilidad operativa de realizar el estudio genético en este tipo de enfermedades, representan debilidades del trabajo, aunque, por otra parte, su originalidad reside en el uso de amiloride para el control de 2 variables tan significativas como la podocituria y la proteinuria en niños; existen pocos informes al respecto25 y creemos que este es el primer estudio en pacientes pediátricos con SNCR.
Conclusiones- 1.
El amiloride disminuyó la proteinuria, sin modificar significativamente la podocituria, y sin que observáramos efectos adversos asociados a su uso.
- 2.
Un mayor tiempo transcurrido desde el inicio de la enfermedad renal, acompañado de una reducción en los valores de podocituria, favorecieron el aumento de la proteinuria.
M. Liern participó en la idea original, la confección del protocolo, la redacción del artículo y las estadísticas. A. Collazo partició en la recogida de datos y la redacción del artículo. G. Vallejo participó en la redacción del artículo y la coordinación. E. Zotta participó en la recogida de datos y la redacción del artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.