En torno al 25% de los pacientes con nefropatía IgA (NIgA) progresa hacia el estadio 5 de la enfermedad renal crónica tras años de evolución. En los últimos años se han desarrollado diversas herramientas diseñadas para predecir qué pacientes evolucionan peor. El valor de IgA1 galactosil-deficiente (Gd-IgA1) circulante se ha relacionado con una peor evolución de la NIgA en algunos estudios. También hay varios trabajos que relacionan valores más elevados de APRIL con una peor evolución. Recientemente se ha desarrollado un método que permite medir el valor de Gd-IgA1 circulante de una manera más sencilla que los previamente disponibles. El objetivo de este estudio es analizar la influencia de la Gd-IgA1 circulante, medida por este método, en la progresión de la NIgA.
Materiales y métodosSe seleccionaron 49 pacientes con diagnóstico de NIgA demostrado mediante biopsia renal en nuestro centro, sin haber recibido tratamiento inmunosupresor previo, de los que se dispusiera de suero congelado. La mediana de seguimiento fue de cuatro años. Se midió Gd-IgA1 mediante ELISA independiente de lectina con el anticuerpo monoclonal KM55 (IgA1 kit Cat. No 30111694. IBL Int., Hamburgo, Alemania). Así mismo también se midieron los niveles de APRIL en estos pacientes.
Resultados19 (38,8%) pacientes alcanzaron ERC estadio 5. El cuarto cuartil de Gd-IgA1 circulante se relacionaba con un mayor riesgo acumulado de llegar a ERC estadio 5 en el análisis de Kaplan-Meier (riesgo al 5 año 39,4% vs. 24,3%; log rank p = 0,019). El valor de Gd-IgA1 se relacionaba con un mayor riesgo de ERC estadio 5 (HR 1,147; IC 95%: 1,035-1,270; p = 0,009), independientemente del filtrado glomerular, la proteinuria, el porcentaje de glomérulos esclerosados y el valor de esclerosis segmentaria. No encontramos diferencias significativas en los valores de APRIL.
ConclusionesEl valor de Gd-IgA1 circulante medido mediante el anticuerpo monoclonal KM55 se relaciona con una peor evolución de los pacientes con NIgA independientemente de otras variables, por lo que se podría incluir en el estudio de los pacientes para mejorar la predicción del riesgo de progresión de la enfermedad.
About 25% of patients with IgA nephropathy (IgAN) progress to stage 5 chronic kidney disease (CKD) after years of evolution. Various tools have been developed in recent years designed to predict which of the patients will had poorer outcomes. The value of circulating galactosyl-deficient IgA1 (Gd-IgA1) has been related to a worse evolution of IgAN in several studies. There are also some publications that relate higher APRIL values with a worse evolution. Recently, a new method has been developed that allows measuring the value of circulating Gd-IgA1 in a simpler way than those previously available. The objective of this study is to analyze the influence of circulating Gd-IgA1, measured by this method, on the progression of IgAN.
Materials and methodsForty-nine patients with a diagnosis of IgAN demonstrated by renal biopsy were selected in our center, without having received prior immunosuppressive treatment, for whom frozen serum was available. The median follow-up was 4 years. Gd-IgA1 was measured by lectin-independent ELISA with the monoclonal antibody KM55 (IgA1 kit Cat. No. 30111694. IBL Int., Hamburg, Germany). Likewise, APRIL levels were also measured in these patients.
Results19 (38.8%) patients reached stage 5 CKD. The fourth quartile of circulating Gd-IgA1 was related to a higher cumulative risk of reaching stage 5 CKD in the Kaplan–Meier analysis (risk at the 5th year 39.4% vs. 24.3%, log rank p=0.019). The Gd-IgA1 value was related to an increased risk of CKD stage 5 (HR 1.147, 95% CI 1.035–1.270, p=0.009), regardless of glomerular filtration rate, proteinuria, the percentage of sclerosed glomeruli and the value of segmental sclerosis. We did not find significant differences in the APRIL values.
ConclusionsThe value of circulating Gd-IgA1 measured by the monoclonal antibody KM55 is related to a worse evolution of patients with IgAN independently of other variables, so it could be included in the study of patients to improve the prediction of the risk of disease progression.
La nefropatía IgA (NIgA) es la glomerulonefritis primaria más común. Identificada inicialmente como una forma benigna, se sabe que hasta un 20-30% de los pacientes llegan al estadio final de la enfermedad renal crónica (ERC) al cabo de 20 años del diagnóstico1,2. En algunas series, con seguimiento a muy largo plazo, este pronóstico es todavía más oscuro, llegando incluso a enfermedad renal crónica terminal (ERCT) hasta el 50% de los pacientes diagnósticos3-6. En los últimos años se han ido desarrollando diversas herramientas diseñadas para predecir el curso de la NIgA y conocer qué pacientes tienen un mayor riesgo de sufrir una peor evolución. Algunas de estas herramientas utilizan datos clínico-analíticos o histológicos o una mezcla de ambos6-9. Aunque la eficacia de los tratamientos previamente ensayados para frenar la progresión de la NIgA es controvertida, se están desarrollando nuevas terapias que potencialmente podrían mejorar el pronóstico de la enfermedad10-12. En este sentido sería del máximo interés diferenciar a los pacientes con alto riesgo de progresión, que se podrían beneficiar de tratamientos más agresivos, de aquellos con una evolución más benigna13.
Desde 2001 se conoce que el defecto en la galactosilación de la región bisagra de la IgA es el factor principal patogénico que inicia la secuencia de eventos que conducen al desarrollo de NIgA14. Diversos estudios relacionan el tener un valor más elevado de IgA1 galactosil deficiente (Gd-IgA1) circulante con una peor evolución de la enfermedad15-19. Sin embargo, otros estudios no han confirmado esta relación20,21. Uno de los problemas detectados al realizar estos estudios ha sido la dificultad para medir de forma fiable y reproducible la Gd-IgA1 circulante. Los métodos empleados, como la espectrometría de masas y el uso de anticuerpos dependientes de lectina (aglutinina de Helix aspersa) para su reactividad, son difíciles de llevar a cabo y no están disponibles en muchos centros de investigación y asistenciales. En 2015, Yasutake et al. desarrollaron un anticuerpo monoclonal KM55 que no depende de lectina y que hace que la medida de Gd-IgA1, tanto circulante como sobre tejido, sea más fácil y reproducible22. Los estudios previos realizados con este anticuerpo en pacientes con NIgA han demostrado que la Gd-IgA1 circulante se relaciona con los hallazgos histológicos, con el depósito glomerular de Gd-IgA1 y con la función renal y la proteinuria en el momento de la biopsia, aunque no de forma consistente23-26. No se han realizado estudios que relacionen la medida de Gd-IgA1 por este método con la evolución de la función renal a largo plazo en población no asiática.
Por otro lado, se conoce que el ligando inductor de proliferación («A Proliferation Inducing Ligand», APRIL) participa en la patogénesis de NIgA incrementando la producción de Gd-IgA1 en las mucosas27,28. El objetivo de nuestro estudio fue analizar la relación entre Gd-IgA1 y APRIL circulantes en humanos en el momento de la biopsia diagnóstica de NIgA y su influencia en la progresión de la nefropatía a largo plazo.
Material y métodoSe seleccionaron de forma retrospectiva las biopsias renales realizadas entre 1990 y 2019 diagnosticadas de nefropatía IgA clasificadas con los criterios de Oxford, de las que se dispusiera de una muestra de suero extraído y congelado antes de la biopsia y antes de iniciar un tratamiento inmunosupresor y con seguimiento completo del paciente a lo largo de su evolución. Como grupo de comparación se seleccionaron las biopsias renales realizadas entre marzo/2015 y diciembre/2018 por sospecha de proceso glomerular (11 hialinosis focal y segmentaria, cinco nefritis intersticial, cuatro GN membranosa, cuatro GNRP, tres MAT, tres amiloidosis, dos membranoproliferativa, dos nefropatía diabética, dos nefroangioesclerosis y una GN postinfecciosa). Se excluyeron aquellas biopsias de las que no se disponía del suero antes de la biopsia, y también aquellas con diagnóstico de nefritis lúpica por ser un posible factor de confusión a la hora de analizar los valores de Gd-IgA y APRIL. Ningún paciente recibió tratamiento inmunosupresor antes de la biopsia. No se incluyeron pacientes sanos como un segundo grupo control. Se midió Gd-IgA1 mediante ELISA independiente de lectina con el anticuerpo monoclonal KM55 (IgA1 kit Cat. No 30111694. IBL Int., Hamburgo, Alemania). La determinación de APRIL se realizó mediante el kit de ELISA RYD-DY884B Human APRIL/TNFSF13 DuoSet (R&D Systems, Inc., Minneapolis, Minn., EE. UU.).
Se recogieron de la historia clínica los datos demográficos relevantes, así como los siguientes parámetros clínicos y bioquímicos en sangre y orina: edad, género, presión arterial sistólica (PAS) y diastólica, hemoglobinuria (resultado expresado de forma semicuantitativa, en cruces, mediante el estudio elemental o sistemático de la orina por tiras reactivas automatizadamente), creatinina, filtrado glomerular (FG) estimado por CKD-EPI, ácido úrico, albúmina, hemoglobina y proteinuria de 24 h en el momento de la biopsia. Se definió ERC estadio 5 cuando los pacientes alcanzaban un filtrado glomerular por debajo de 15 mL/min, iniciaban diálisis o se trasplantaban. También se recogió el momento en el que el filtrado glomerular bajaba de 30 mL/min. Respecto a los datos anatomopatológicos, se recogieron el número de glomérulos esclerosados y las variables de la clasificación MEST, incluido el porcentaje de semilunas.
Por otro lado, se calculó el riesgo de progresión a cinco años mediante dos diferentes herramientas online de libre acceso: la calculadora online IgA Nephropathy Progression Calculator (IgANPC) de acceso mediante la web http://www.columbiamedicine.org/divisions/gharavi/calc.progression.php y la International Risk-Prediction Tool in IgA Nephropathy (IRPT-IgAN) con acceso mediante la página web https://qxmd.com/calculate/calculator_499/international-igan-prediction-tool. En el caso de la IgANPC se utilizan cuatro parámetros determinados en el momento de la biopsia renal y obtenidos de la historia clínica y de los registros electrónicos del paciente: FG, hemoglobina sérica expresada en g/dL, albúmina sérica expresada en g/dL y PAS expresada en mmHg. Para el cálculo del riesgo a cinco años de alcanzar ERC estadio 5 mediante la otra calculadora pronóstica, la IRPT-IgAN, se recogieron cinco parámetros clínicos como tensión arterial (TA), edad, raza, uso de inhibidores de la enzima conversora de angiotensina (IECA) o antagonistas de los receptores de angiotensina II (ARAII), uso de inmunosupresión previa a la biopsia, analíticos como filtrado glomerular estimado (FGe) y proteinuria en el momento de la biopsia y también los datos histológicos obtenidos del MEST-C.
Análisis estadísticoLa diferencia entre los valores de IgA y APRIL entre los distintos grupos se comparó mediante el test U de Mann-Whitney para las variables dicotómicas y mediante el test de Kruskal-Wallis para las variables con más de dos categorias. Se calculó la capacidad discriminativa de Gd-IgA1 y de APRIL para diagnosticar NIgA mediante la curva ROC. Se analizó mediante correlación de Spearman la relación entre Gd-IgA1 y el resto de variables continuas. La relación entre las distintas variables y el riesgo de ERC estadio 5 se analizó mediante regresión de Cox univariante y multivariante.
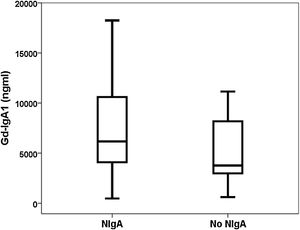
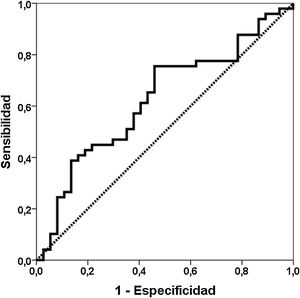
ResultadosCapacidad de discriminación de Gd-IgA1 y APRILCuarenta y nueve pacientes con diagnóstico de nefropatía IgA se compararon con 37 pacientes biopsiados con otros diagnósticos (tabla 1). El valor de Gd-IgA1 fue 6.170 (RIC 7.623) ng/mL en los pacientes con NIgA y 3.823 (RIC 5.353) ng/mL en los pacientes con otros diagnósticos (p = 0,047) (fig. 1). El valor de APRIL fue 1.149 (RIC 1.189) pg/mL en los pacientes con NIgA y 1.083 (RIC 916) pg/mL en los pacientes con otros diagnósticos (p = 0,239). El área bajo la curva ROC (AUC-ROC) de Gd-IgA1 para predecir NIgA fue 0,625 (IC 95%: 0,506-0,745; p = 0,047) (fig. 2). El punto de corte óptimo fue 3.900 ng/mL, con una sensibilidad de 75,5%, una especificidad de 54,1%, un valor predictivo positivo de 68,5% y un valor predictivo negativo de 62,5%. El AUC-ROC de APRIL para discriminar la presencia de NIgA en la biopsia renal fue 0,575 (IC 95%: 0,454-0,697; p = 0,239).
Características de los pacientes
| NIgA (n = 49) | No NIgA (n = 37) | p | |
|---|---|---|---|
| Edad (años) | 51,3 ± 15,9 | 59,5 ± 15,2 | 0,019 |
| Sexo masculino | 79,6% | 48,6% | 0,003 |
| Creatinina (mg/dl) | 2,1 ± 1,3 | 1,9 ± 1,2 | 0,496 |
| FG estimado (ml/min/1,73 m2) | 49 ± 31 | 46 ± 27 | 0,612 |
| Proteinuria (g/día) | 3,0 ± 2,8 | 3,6 ± 3,8 | 0,316 |
| Hemoglobinuria (+) | 3 ± 1 | 1 ± 1 | < 0,001 |
| Tensión arterial sistólica (mmHg) | 142 ± 21 | 131 ± 18 | 0,027 |
| Tensión arterial diastólica (mmHg) | 82 ± 13 | 76 ± 12 | 0,045 |
| Ácido úrico (mg/dl) | 7,2 ± 2,2 | 7,0 ± 2,5 | 0,655 |
| %Glomerulos esclerosados | 3,2 ± 5,1 | - | - |
| M (0/1) | 8/41 | - | - |
| E (0/1) | 24/25 | - | - |
| S (0/1) | 24/25 | - | - |
| T (0/1/2) | 23/20/6 | - | - |
| %Semilunas | 14,9 ± 23,6 | - | - |
| Riesgo Calculado a 5 años IgANPC | 35 ± 33 | - | - |
| Riesgo Calculado a 5 años IRPT-IgAN | 25 ± 20 | - | - |
| Bloqueo SRAA | 31 (63%) | ||
| Uso de Esteroides | 21 (43%) | ||
| Duración tratamiento Esteroides (meses) | 6,8 ± 11,5 | ||
| Cualquier inmunosupresor | 13 (27%) |
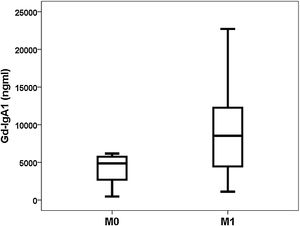
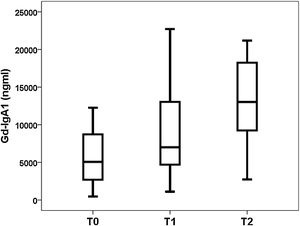
Gd-IgA1 se correlacionaba con M (rho = 0,308; p = 0,031) y T (rho = 0,377; p = 0,008), pero no se correlacionaba con el resto de parámetros histológicos (porcentaje de glomérulos esclerosado, porcentaje de semilunas, E y S). Respecto a las variables no histológicas, Gd-IgA1 se correlacionaba con la función renal en el momento de la biopsia (rho = -0,308; p = 0,034) y con el valor de ácido úrico (rho = 0,322; p = 0,029), pero no se correlacionaba con la edad del paciente (rho = 0,020; p = 0,890), con la tensión arterial (sistólica rho = -0,115; p = 0,432; diastólica rho = -0,225; p = 0,120), con la hemoglobinuria (rho = 0,062; p = 0,671), con la proteinuria (rho = 0,045; p = 0,761) ni con el riesgo estimado a cinco años (rho = 0,182; p = 0,210). Por el contrario, sí se correlacionaba con el riesgo a cinco años calculado mediante IRPT-IgAN (rho = 0,365; p = 0,010). Los valores de Gd-IgA1 no eran diferentes en función del sexo del paciente (mujer 5.493 y RIC 6.529 ng/mL vs. varón 6.643 y RIC 8.740 ng/mL; p = 0,650), pero sí eran mayores en los pacientes con más afectación histológica en M (M0 4.866 y RIC 3.176 ng/mL vs. M1 8.528 y RIC 8.277 ng/mL; p = 0,032) (fig. 3) y en T (T0 5.075 y RIC 6.266 ng/mL vs. T1 7013 y RIC 8.468 ng/mL vs. T2 13.025 y RIC 11.358 ng/mL; p = 0,032) (fig. 4). El valor de APRIL circulante no se correlacionaba con Gd-IgA1 circulante ni con ninguno de los parámetros clínicos, analíticos ni histológicos analizados.
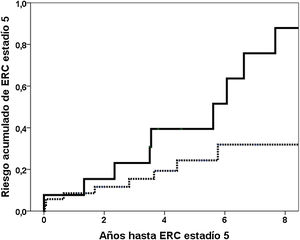
La mediana de seguimiento hasta alcanzar el estadio 5 o el último seguimiento fue de 4,0 años (percentil 25: 2,0; percentil 75: 5,9 años). 19 (38,8%) pacientes alcanzaron ERC estadio 5 y 22 (44,9%) llegaron al estadio 4. Las variables relacionadas con el riesgo de ERC estadio 5 están reflejadas en la tabla 2. En el modelo 1 incluyendo las variables significativas Gd-IgA1, APRIL, filtrado glomerular, proteinuria, %Glomérulos esclerosados y esclerosis glomerular segmentaria (S), el valor de GD-IgA1 se asociaba de forma independiente con un mayor riesgo de ERC estadio 5. El cuarto cuartil de Gd-IgA1 circulante se relacionaba con un mayor riesgo acumulado de llegar a ERC estadio 5 en el análisis de Kaplan-Meier (riesgo al 5° año 39,4% vs. 24,3%; log rank p = 0,019) (fig. 5). En el segundo modelo englobando los datos clínico-analíticos en la variable riesgo estimado a cinco años, el valor de Gd-IgA1 circulante se relacionaba de forma independiente con un mayor riesgo de ERC estadio 5. En los mismos modelos, sustituyendo la variable continua Gd-IgA1 por variables dicotómicas (cuarto cuartil, tercer tercil) perdía significación estadística.
Variables relacionadas con el riesgo de llegar a ERC estadío 5
| Univariante | Multivariante | |||||||
|---|---|---|---|---|---|---|---|---|
| HR (IC) | p | HR (IC) Modelo 1 | p | HR (IC) Modelo 2 | p | HR (IC) Modelo 3 | p | |
| Gd-IgA1 (μg/ml) | 1,092 (1,024-1,165) | 0,007 | 1,147 (1,035-1,270) | 0,009 | 1,141 (1,036-1,257) | 0,008 | 1,102 (1,000-1,214) | 0,049 |
| Cuarto Cuartil Gd-IgA1 | 2,930 (1,149-7,476) | 0,024 | - | - | ||||
| APRIL (ng/ml) | 2,086 (1,114-3,906) | 0,022 | 1,647 (0,632-4,297) | 0,307 | 2,113 (0,857-5,213) | 0,104 | 2,025 (0,824-4,979) | 0,124 |
| Filtrado glomerular estimado (ml/min/1,73 m2) | 0,956 (0,931-0,982) | 0,001 | 0,932 (0,894-0,971) | 0,001 | - | - | ||
| Hemoglobinuria | 0,988 (0,680-1,434) | 0,949 | - | - | - | - | ||
| Proteinuria 24 horas (gramos) | 1,317 (1,118-1,551) | 0,001 | 1,410 (1,077-1,845) | 0,012 | - | - | ||
| Edad | 1,026 (0,993-1,060) | 0,124 | - | - | - | - | ||
| Riesgo Calculado 5 años IgANPC | 1,024 (1,010-1,038) | 0,001 | - | - | 1,014 (0,994-1,034) | 0,180 | - | - |
| Riesgo Calculado 5 años IRPT-IgAN | 1,059 (1,032-1,086) | <0,001 | 1,041 (1,003-1,080) | 0,032 | ||||
| %Glomérulos esclerosados | 1,124 (1,046-1,209) | 0,002 | 0,978 (0,884-1,082) | 0,663 | 1,064 (0,967-1,172) | 0,204 | 1,007 (0,903-1,123) | 0,897 |
| M | 2,483 (0,325-18,993) | 0,381 | - | - | - | - | - | - |
| E | 1,684 (0,619-4,583) | 0,307 | - | - | - | - | - | - |
| S | 6,678 (1,811-24,622) | 0,004 | 6,678 (1,811-24,622) | 0,002 | 5,857 (1,180-29,075) | 0,031 | 6,015 (1,209-29,936) | 0,028 |
| T | 1,891 (0,989-3,616) | 0,054 | - | - | - | - | - | - |
| %Semilunas | 1,014 (0,996-1,031) | 0,127 | - | - | - | - | - | - |
| Bloqueo SRAA | 0,887 (0,336-2,342) | 0,809 | ||||||
| Uso de Esteroides (Si) | 1,419 (0,525-3,838) | 0,491 | ||||||
| Duración tratamiento Esteroides (meses) | 0,976 (0,930-1,024) | 0,323 | ||||||
| Cualquier inmunosupresor | 0,569 (0,162-2,005) | 0,569 | ||||||
En nuestro grupo de biopsias renales encontramos que la Gd-IgA1 circulante estaba significativamente más elevada en los pacientes con NIgA que en los pacientes con otros diagnósticos en la biopsia renal. Distintos estudios realizados tanto midiendo Gd-IgA1 con anticuerpos dependientes de lectina como no dependientes (KM55) han comunicado que los pacientes con NIgA tienen niveles más elevados de Gd-IgA1 comparados con un grupo de controles sanos y con otros pacientes con biopsia por patología renal11,23,25,26,29-35. Sin embargo, otros autores no han encontrado estas diferencias36. De forma similar, la capacidad de Gd-IgA1 para discriminar qué pacientes tienen NIgA demostrada en la biopsia renal ha oscilado entre 0,749 y 0,90226,29,35. Esta baja capacidad de discriminación, menor del 70%, entre pacientes con y sin NIgA observada en nuestro estudio, sugiere que la utilidad clínica del test es escasa y que no debería incorporarse a la rutina habitual como criterio diagnóstico. El punto óptimo tenía una sensibilidad de un 76%, pero la especificidad era tan solo del 54%. De forma ilustrativa, en la figura 1 se puede apreciar que los valores de Gd-IgA1 estaban elevados en muchos pacientes con NIgA, pero también que muchos pacientes NIgA tenían valores indistinguibles de Gd-IgA1 de aquellos sin NIgA. Este solapamiento en los valores de Gd-IgA1 circulante entre los pacientes con y sin NIgA ha sido también destacado por otros autores previamente26,35,37.
Relación entre Gd-IgA1 circulante y hallazgos histológicosDe forma interesante, encontramos que el valor de Gd-IgA1 se correlacionaba de forma significativa con dos de los parámetros histológicos incluidos en la clasificación de Oxford sobre los que se ha demostrado su relación con el pronóstico de la enfermedad7. En nuestro estudio, Gd-IgA1 era más elevado en los pacientes con más hipercelularidad mesangial y con más atrofia tubular. En el caso de la atrofia tubular, a mayor severidad de la lesión (T2 >T1 >T0), los niveles de Gd-IgA1 circulantes eran más elevados. Por una parte, se sabe que un mayor nivel de Gd-IgA1 circulante se correlaciona con un mayor depósito mesangial de Gd-IgA123-25. De hecho, la exposición de células mesangiales en cultivos a Gd-IgA1 se relaciona con un aumento en la secreción de un marcador de respuesta inflamatoria mesangial como es la proteína 1 quimiotáctica de los monocitos (MCP-1)38. Se podría especular que este aumento del depósito local incrementaría la lesión sobre el mesangio y el aumento de su celularidad, por lo cual el nivel de Gd-IgA1 circulante se debería correlacionar con una mayor hipercelularidad mesangial. Por otro lado, el daño crónico que refleja la afectación tubular e intersticial podría ser expresión del mayor daño renal mantenido producido por la Gd-IgA1 circulante y depositada. Sin embargo, otros autores han comunicado que la Gd-IgA1 circulante no se relaciona con las alteraciones histológicas23,26 o se relaciona con otros apartados de la clasificación de Oxford24,38. Por ejemplo, Nguyen et al. hallaron una correlación entre Gd-IgA1 y la glomerulosclerosis segmentaria «S» y la atrofia tubular «T» en un estudio en 33 pacientes con NIgA38. Hasta el momento las series analizadas han sido demasiado pequeñas como para poder extraer conclusiones definitivas sobre la relación entre Gd-IgA1 y MEST-C.
Relación entre Gd-IgA1 circulante y variables clínicas y analíticasEl Gd-IgA1 circulante no fue diferente según el sexo del paciente ni se relacionó con la edad, un dato ya observado por otros autores23. Sí se observó una relación entre niveles elevados de Gd-IgA1 y una peor función renal y niveles más elevados de ácido úrico. Esta relación ya había sido observada previamente23-25, aunque no en todos los estudios26,29,38, y podría explicarse por la correlación con la lesión histológica crónica a nivel tubular. La falta de relación con el grado de hemoglobinuria, ya demostrada por Zhang et al.23, y con el grado de proteinuria23,38 podría deberse a que éstos aparecen como consecuencia de toda la cascada de eventos posteriores al primer «hit» que representa la Gd-IgA1, como podrían ser la inflamación, la activación del complemento y el daño podocitario39.
Relación entre Gd-IgA1 circulante y progresión de la ERCEl hallazgo más relevante de nuestro estudio fue la influencia negativa que tienen los niveles circulantes elevados de Gd-IgA1 sobre la evolución renal. En el estudio univariante, los pacientes con NIgA en el cuartil superior de Gd-IgA1 tenían casi tres veces más riesgo de alcanzar el estadio 5 de ERC (fig. 5). Como variable continua, Gd-IgA1 se relacionaba también con una peor evolución, independientemente de otras variables clínicas e histológicas. A pesar de haber llevado a cabo un estudio con un número limitado de pacientes, utilizando tres métodos pronósticos validados como el histológico de Oxford MEST-C y las herramientas de predicción clínico-analítico IgAnephropathy progression calculator (IgANPC) y Risk-Prediction Tool inIgANephropathy (IRPT-IgAN), la Gd-IgA1 era capaz de aportar información sobre el pronóstico de la función renal independientemente de ellos. Además, la Gd-IgA se relaciona con la herramienta pronóstica IRPT-IgAN, lo que apoya que sí hay una relación con las características clínicas con valor pronóstico en la nefropatía IgA. Siendo importante también esta asociación entre la IRPT-IgAN y un marcador patogénico como es la Gd-IgA, no observada con la IgANPC.
Utilizando métodos de detección de Gd-IgA1 con lectina, técnicamente más complejos, otros autores habían descrito esta relación entre niveles elevados de Gd-IgA1 circulante y mayor progresión de la ERC15-19. Así, Maixnerova et al. reportaron en 91 pacientes de la República Checa una capacidad discriminatoria del 84% sobre qué pacientes iban a progresar el deterioro de la función renal utilizando el filtrado glomerular inicial, los datos del MEST y la Gd-IgA1 circulante40. En el estudio más amplio realizado, Chen et al. observaron en 1.210 pacientes con NIgA seguidos durante una mediana de 43 meses una relación no lineal entre los niveles circulantes de Gd-IgA1 y el riesgo de progresión, también independientemente del resto de variables19. Ya utilizando un método independiente de la lectina con KM55 para medir la Gd-IgA1, Bagchi et al. no encontraron una relación significativa entre niveles de Gd-IgA1 y progresión de la ERC en 136 pacientes indios con NIgA26. Nuestro estudio es el primero que utiliza esta metodología para analizar la relación entre Gd-IgA1 y progresión de la NIgA en población europea. Aunque la muestra de pacientes con NIgA es pequeña, los pacientes fueron seguidos de forma prolongada, con una mediana de 48 meses, lo que permite extraer conclusiones sobre el riesgo de progresión de la NIgA.
El tratamiento específico de la NIgA con esteroides y otros inmunosupresores, independiente del control tensional y de la proteinuria con IECA/ARA2, es parcialmente eficaz para limitar la progresión de la nefropatía y tiene efectos secundarios que limitan su aplicación10. Respecto a la relación entre el tratamiento inmunosupresor y los valores séricos de IgA1-Gd, en un trabajo publicado en los últimos años se ha observado que el tratamiento con esteroides reduce los niveles de IgA1Gd41, mientras que el uso de Rituximab no disminuye los niveles de IgA1-Gd ni los de IgG anti-Gd-IgA, lo que podría explicar su falta de eficacia para tratar esta nefropatía42. Para la utilización de los tratamientos estandarizados para esta enfermedad, así como para poder utilizar los nuevos tratamientos que se han ido desarrollando, es de máximo interés disponer de herramientas que permitan identificar a los pacientes con un mayor riesgo de progresión. Diversos grupos han desarrollado estas escalas de valoración pronóstica que incluían variables histológicas como la clasificación de Oxford o variables clínico-analíticas como la IgANPC6,7. Recientemente el grupo «International IgA Nephropathy Network» desarrolló una escala de valoración del riesgo incorporando tanto las variables histológicas de Oxford como variables clínico-analíticas con la que se alcanzaba una predicción por encima del 80% del riesgo de descenso de un 50% en el FG o de llegar a ERC estadio 59. En nuestro estudio, el valor de Gd-IgA1 circulante aportó información con utilidad pronóstica independiente de las variables histológicas y clínico-analíticas.
Dado que la nueva herramienta IRPT-IgAN parece más potente que el IgANPC, en nuestro estudio la IgAGd pierde valor estadístico y se queda en el borde de la significación, pero aun así se mantiene como variable relacionada con el riesgo de mala evolución de la nefropatía IgA, independientemente de un marcador tan robusto y tan demostrado en estudios multicentricos como la IRPT-IgAN.
Si se demuestra su utilidad en estudios con un mayor número de pacientes, añadir el valor de Gd-IgA1 circulante medido mediante una tecnología sencilla y reproducible, como es el anticuerpo KM55, a estas escalas de predicción del riesgo podría contribuir a incrementar su precisión pronóstica.
Papel de APRIL al diagnóstico de la NIgAPor otro lado, en nuestro estudio, APRIL no presentó ninguna utilidad para el diagnóstico de NIgA, ni se correlacionó con el valor de Gd-IgA1 circulante ni con otras variables clínicas o analíticas. Tan solo se observó un incremento del riesgo de alcanzar el estadio 5 en los pacientes con valores más altos de APRIL circulante en el análisis univariante.
Distintos tipos de estudios apoyan el papel de APRIL en la patogenia de la NIgA. Algunos polimorfismos de APRIL se han relacionado con un mayor riesgo de NIgA, con mayor proteinuria, peor función renal y un mayor riesgo de progresión al estadio 543-46. APRIL se produce fundamentalmente en las células epiteliales, dendríticas y mieloides de las mucosas y favorece la maduración y proliferación de las células B47,48. La exposición microbiana en las mucosas induce la producción de TLR9 que aumenta la síntesis y liberación de APRIL por las células dendríticas y el consiguiente aumento en la producción de IgA, mayoritariamente Gd-IgA1 que será el primer paso para la aparición de la NIgA27,28,47. Estudios en humanos han demostrado que los niveles circulantes de APRIL eran más elevados en los pacientes con NIgA y se asociaban a los niveles de Gd-IgA1, a una peor histología, peor función renal y proteinuria. La discordancia con nuestros hallazgos puede deberse al número elevado de pacientes con NIgA incluidos en estos estudios (637, 1.000, 99, 166, respectivamente)45,46,49,50. Por otra parte, nuestro grupo había observado que el riesgo de recurrencia de la NIgA tras el trasplante renal se relacionaba más con el mantenimiento de unos niveles elevados de APRIL a lo largo del tiempo postrasplante que a un valor puntual aislado, como se ha llevado a cabo en este estudio, por lo que los resultados parcialmente contradictorios no son extrapolables51.
Para concluir, el desarrollo del nuevo anticuerpo monoclonal KM55 ha permitido disponer de una metodología asequible y reproducible para medir Gd-igA1 circulante. Aunque su utilidad como marcador no invasivo de NIgA es escasa, la Gd-IgA1 circulante se relaciona, de forma independiente de otras variables, con el riesgo de progresión de la NIgA hacia el estadio final de la ERC. Si se confirmara esta relación en estudios más amplios se debería incorporar al resto de herramientas predictivas de que se dispone, ya que la tendencia actual para detectar aquellos pacientes con peor pronóstico en esta entidad es la de asociar diferentes marcadores clínicos, analíticos y anatomopatológicos en una única herramienta predictiva.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.