Los pacientes con trasplante renal deben recibir medicamentos inmunosupresores a largo plazo para evitar el rechazo del injerto; estos medicamentos los hacen susceptibles a infecciones y neoplasias que siguen siendo una causa importante de morbiletalidad en pacientes con trasplante de órganos sólidos1.
Recientemente el virus BK, perteneciente a la familia Polioma y con predilección especial por el tracto urinario se ha reconocido como un agente que puede ocasionar disfunción o pérdida del injerto renal2-4. Los virus polioma son de aproximadamente 40 nm icosahedros y tienen un DNA de alrededor 5.300 pares de bases.
Los virus BK (VBK) y JC (VJC) fueron nombrados con las iniciales de los pacientes en quienes fueron descritos por primera vez: el VBK se encontró en la orina de un paciente con trasplante renal que cursaba con estenosis ureteral5 y el VJC en el cerebro de un paciente con leucoencefalopatía multifocal progresiva6. VBK y VJC tienen 75% de homología en la secuencia de nucleótidos. El virus simiano 40 (SV40) también forma parte de los polioma virus y puede infectar humanos, tiene 70% de homología en la secuencia de nucleótidos con el VBK7, 8.
El genoma del VBK se divide funcionalmente en tres regiones: 1) región regulatoria no codificante; 2) región temprana que codifica para las proteínas t y T, las cuales se transcriben antes de la replicación viral, y 3) región tardía que codifica para la agnoproteína y las proteínas de la cápside VP1, VP2 y VP3 que se transcriben después de la replicación del virus9, 10.
MANIFESTACIONES CLÍNICAS
La infección primaria por VBK ocurre durante la infancia ya sea por vía gastrointestinal o respiratoria, generalmente es asintomática pero ocasionalmente puede dar síntomas respiratorios superiores o de infección de vías urinarias. Después de la infección primaria el virus permanece latente en el huésped en diferentes sitios principalmente del tracto urogenital (riñones, vejiga, próstata, cérvix, vulva, testículos) y en los tejidos hematolinfoides (amígdalas, células mononucleares de sangre periférica) y puede ser reactivado por eventos inmunosupresores. Ochenta a noventa por ciento de la población adulta es seropositiva para VBK11, 12, mientras que los niños alcanzan 80-90% de seropositividad a los 10 años13, 14.
En pacientes con trasplante de médula ósea el VBK se manifiesta con cistitis hemorrágica, mientras que en los pacientes con trasplante renal puede ocasionar hematuria, estenosis ureteral y/o nefritis tubulointersticial con riesgo de evolucionar a pérdida del injerto. Pacientes con trasplante de otros órganos sólidos y aquellos que por alguna circunstancia son inmunocomprometidos (síndrome de inmunodeficiencia adquirida, lupus eritematoso sistémico) también pueden presentar nefritis por polioma15-18.
La mayoría de las nefritis por polioma se presentan en el primer año post-trasplante, pero cerca de 25% de los casos se diagnostica posteriormente19. La pérdida del injerto va de 10 a 80% según la serie consultada y parece ser menor en centros que tienen programas de vigilancia activa. El VBK es el responsable de la mayoría de los casos de cistitis y nefritis, pero también se han reportado por VJC18 y ocasionalmente por SV4020.
En pacientes pediátricos con trasplante renal existe particular interés por el VBK ya que tienen mayor posibilidad de presentar infección primaria y el virus puede estar latente en el urotelio del injerto que reciben. Se ha confirmado viruria en 20-50% de los pacientes pediátricos y nefritis en 2-8%13, 21, 22. En un estudio multicéntrico, prospectivo realizado en nuestro país, se ha visto que los pacientes pediátricos tienen el doble de replicación de virus en orina que los adultos en los primeros seis meses post-trasplante renal23.
Factores de riesgo para la infección post-trasplante
Los factores de riesgo que han sido reportados incluyen aspectos inherentes al donante, al receptor, al injerto y al tipo de inmunosupresión24-26. Así, los factores referidos al donante abarcan: la presencia de infección activa por VBK, la infección por citomegalovirus, la seropositividad para el VBK ¿la cual ha sido implicada en el desarrollo de viruria, viremia o nefritis en población de trasplante pediátrica y adulta¿, la ausencia de HLA-C7, así como donante fallecido versus donante vivo25, 27. Por otro lado, los factores de riesgo relacionados al receptor incluyen: mayor edad, género masculino, infección por CMV, diabetes mellitus, seronegatividad del receptor para VBK, ausencia de HLA-C7 y raza caucásica. La contribución del injerto incluye como factores de riesgo asociados: el daño procedente de la obtención del órgano, el tiempo de isquemia fría y la función retardada del injerto. Uno de los aspectos frecuentemente citados como factor de riesgo señala a la inmunosupresión, especialmente a la terapia de mantenimiento con la combinación tacrolimus-mofetil micofenolato y al empleo de terapia antilinfocítica para tratamiento de rechazo agudo, como los más proclives para generar infección por VBK28, 29. El impacto real del tipo de inmunosupresor y de las combinaciones de éstos en particular, queda bastante bien resuelto en el estudio prospectivo de Brennan y cols., cuyos datos señalan que es la intensidad de la inmunosupresión más que el tipo de inmunosupresor lo que confiere el mayor riesgo para infección por VBK y en consecuencia para nefritis asociada a VBK (NVBK)26. Los análisis efectuados en dicho estudio indican que la elección del inhibidor de calcineurina o del inmunosupresor adyuvante, no afectaron de manera independiente, los niveles de viruria o viremia por VBK. Sin embargo, los rangos más elevados de viruria se detectaron con la combinación de tacrolimus-mofetil micofenolato y los más bajos con ciclosporina- mofetil micofenolato. Adicionalmente y de manera puntual el estudio demuestra cómo la monitorización y la eliminación anticipada del antimetabolito ante la detección de viremia estuvo asociada con resolución de la viremia y ausencia de NVBK sin que ocurrieran eventos de rechazo agudo o pérdidas de injerto. Sin duda, el tipo y el grado de inmunosupresión sobrepasan cualquier factor de riesgo ¿individual o en combinación¿ y son los factores, entre todos los señalados con mayores posibilidades de modificación. Es evidente que una estrategia de esta naturaleza merece seguimiento con marcadores virales.
DEFINICIONES Y DIAGNÓSTICO
Infección por virus polioma.¿ Evidencia de exposición al virus sin distinguir entre latencia y replicación activa24.
Replicación de virus polioma.¿ Evidencia de multiplicación viral (infección lítica o activa) detectada por cultivo viral, partículas de polioma por microscopia electrónica, proteínas estructurales de polioma por inmunohistoquímica, expresión de RNA mensajero de genes tardíos del virus (p. ej. VP1); ADN viral en sitios de no latencia (p. ej. plasma); evidencia citológica (células en señuelo) o histológica de replicación por polioma24, 30.
La infección puede ser primaria o secundaria dependiendo si la replicación se detecta en un individuo seronegativo o seropositivo, respectivamente.
La enfermedad por virus polioma se define como la evidencia histopatológica o ultraestructural del daño citopático y orgánico inducido por el virus.
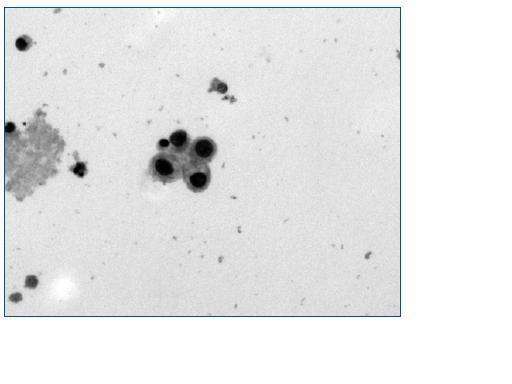
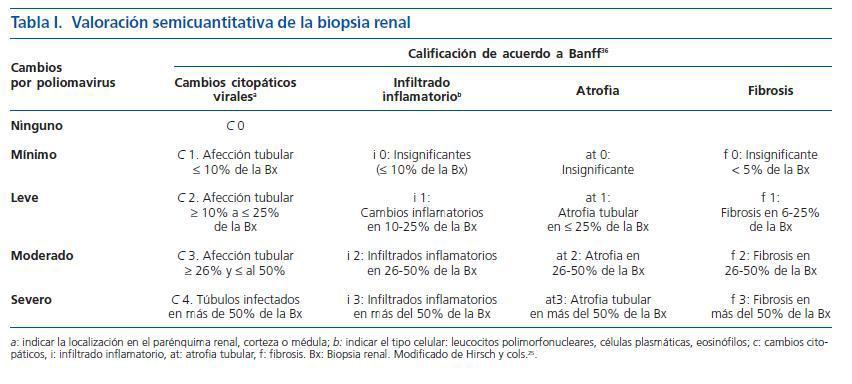
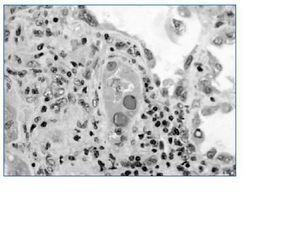
Las técnicas de visualización directa tienen la desventaja de que no son capaces de distinguir entre los tres tipos de polioma virus que infectan a los humanos (VJC, VBK y SV40) además de la posible confusión con otros virus tales como citomegalovirus y adenovirus31. La detección en la orina de las células señuelo (fig. 1) indica replicación activa del poliomavirus en el aparato genito urinario pero aunque es un método simple con sensibilidad de 100% su especificidad para el diagnóstico de NVBK es baja (71%); aún así se recomienda como un método de detección o tamiz32.
La mayor limitante de los métodos basados en la detección del ADN viral es que no son capaces de distinguir entre una infección latente y la reactivación. El uso de PCR en tiempo real estudiando la expresión de ARN mensajero en vez de ADN en células del sedimento urinario se ha descrito como un método certero y no invasivo para establecer el diagnóstico presuntivo de NVBK en pacientes adultos con trasplante renal. Utilizando un valor de corte de 6,5 x 105 copias de la región VP1 del virus BK por nanogramo de ARN total en orina se puede predecir la nefritis con una sensibilidad de 93,8% y especificidad de 93,9%33. Cabe mencionar que el uso de ARN de sedimento urinario se ha empleado con éxito para el diagnóstico de rechazo agudo del injerto renal34 y la técnica para la colección de orina se ha descrito en forma detallada35.
HISTOPATOLOGÍA
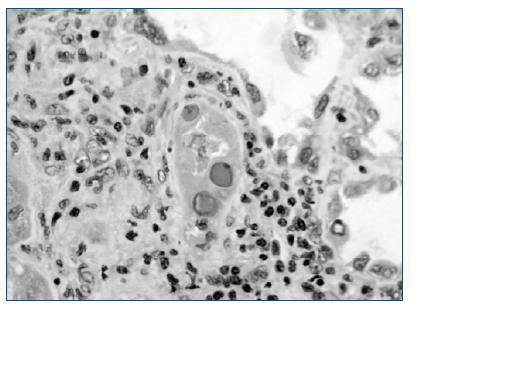
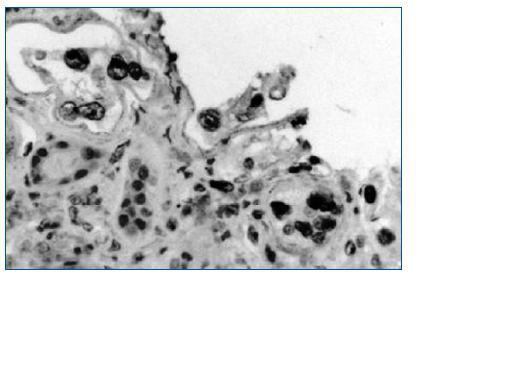
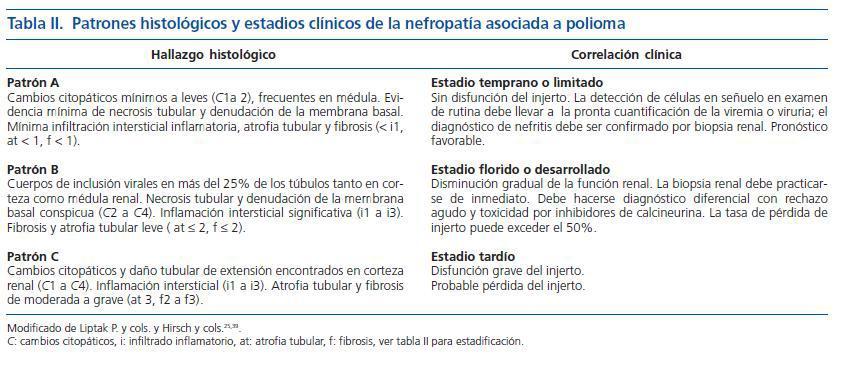
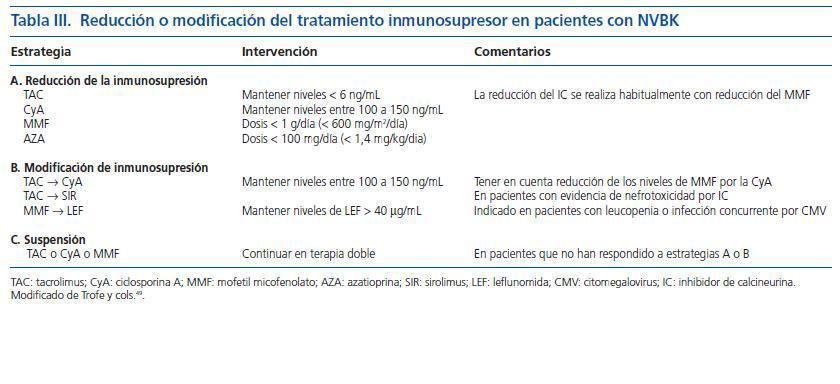
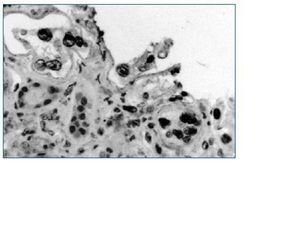
El estándar de oro para el diagnóstico de la nefritis viral sigue siendo la evaluación detallada de la biopsia renal. Siguiendo las recomendaciones de la clasificación de Banff36 se deben examinar dos cortes de tejido que deben contener parénquima medular para aumentar la sensibilidad. Los hallazgos histopatológicos incluyen cuerpos de inclusión intranucleares en las células epiteliales, cambios citopáticos tubulares e infiltrado intersticial (fig. 2)32. El infiltrado puede confundirse con rechazo del aloinjerto y con nefrotoxicidad inducida por medicamentos. La evaluación del tejido renal con microscopia electrónica37 o el uso de inmunohistoquímica establece firmemente el diagnóstico (figs. 3 y 4). Dado que la NVBK puede ser focal existe la posibilidad de errores de muestreo y una biopsia negativa no puede descartar completamente la posibilidad de nefritis por BK. En los casos con sospecha de VBK, con replicación viral por arriba de los valores de corte se recomienda realizar inmunohistoquímica y si resulta negativa considerar una nueva biopsia renal.
Se ha propuesto que el reporte de histopatología incluya dos componentes:
1) Valoración semicuantitativa de los cambios virales citopáticos y su localización, ya sea en corteza o médula y valoración de la fibrosis intersticial, atrofia tubular e inflamación de acuerdo a la clasificación de Banff (tabla I).
2) Clasificación de la valoración semicuantitativa en tipos de patrón de nefritis, A. Estadio temprano o limitado, B. Estadio florido o desarrollado y C. Estadio tardío (tabla II).
El diagnóstico diferencial debe hacerse con rechazo agudo del injerto y nefrotoxicidad por medicamentos, situaciones que pueden presentarse en forma simultánea. Puede ser muy difícil distinguir entre el infiltrado del rechazo tubulointersticial (Banff tipo I) y nefritis por BK38, 39. Si hay endarteritis, necrosis vascular fibrinoide y glomerulitis (Banff tipo II y III) así como depósito de C4d en los capilares peritubulares no queda duda de la coexistencia de rechazo agudo.
Una vez que se ha establecido la NVBK, ésta puede llevar a pérdida del injerto renal en 10 a 80% de los casos según la serie consultada4, 40. Por esto se ha insistido en la necesidad de nuevas estrategias diagnósticas que permitan identificar el problema en etapas tempranas.
Se ha visto que a mayor grado de inmunosupresión mayor frecuencia de viruria41, 42.
TRATAMIENTO
El tratamiento de la NVBK no es completamente satisfactorio, debido a dos aspectos: no se cuenta aún con un tratamiento antiviral uniformemente efectivo y no se han realizado estudios prospectivos controlados que demuestren concluyentemente la mejor estrategia de tratamiento40, 43.
En la mayor parte de los centros nefrológicos el primer abordaje es disminuir la inmunosupresión, también se ha sugerido descontinuar el tratamiento con tacrolimus e iniciar sirolimus44. Algunos grupos han utilizado cidofovir como terapia antiviral, con el inconveniente de ser un medicamento nefro y hepatotóxico45, 46.
El tratamiento de la NVBK tiene dos vertientes; por un lado, la reducción de la inmunosupresión con el fin de restaurar la inmunidad antiviral y por el otro el tratamiento antiviral específico47.
Modificación de la inmunosupresión
La modificación del tratamiento inmunosupresor ha sido la principal estrategia de tratamiento desde antes del desarrollo de la medicación antiviral24. Esta estrategia se ha dirigido por un lado a la reducción de la inmunosupresión al realizar el diagnóstico de NVBK, y por otro lado, en la vigilancia continua desde el momento del trasplante y modificación del tratamiento inmunosupresor desde la detección de replicación viral en plasma u orina.
Con respecto a la modificación de la inmunosupresión al realizar el diagnóstico de NVBK, es pertinente comentar el estudio realizado por Vasudev y cols48. Éste incluyó 41 pacientes adultos que recibieron un trasplante renal (36 casos) o combinado de riñón y páncreas (cinco casos), con el diagnóstico de NVBK confirmado por los hallazgos histológicos e inmunohistoquímicos (tinción de SV40 por el método de la peroxidasa) característicos en la biopsia renal. La mayoría de los pacientes se encontraba en tratamiento triple con prednisona, tacrolimus y mofetil micofenolato. El tiempo del momento del trasplante al diagnóstico de la NVBK que en promedio de 318 días (variación de 48 a 1.356 días). La reducción del tratamiento inmunosupresor (reducción de las dosis de los inmunosupresores o cambio de triple a doble terapia), permitió disminuir la tasa de pérdida de la función renal desde un valor de depuración de creatinina de 4,8 mL/min/1,73 m2 por mes antes del diagnóstico de la NVBK, a 0,7 mL/min/1,73 m2 durante el control subsecuente al diagnóstico. Sin embargo, se observó pérdida del injerto en 46% de los pacientes estudiados, lo cual muestra el impacto negativo de la infección por VBK en los pacientes con trasplante renal. Al reducir la inmunosupresión tres pacientes presentaron rechazo agudo, dos de los cuales perdieron la función del trasplante renal.
En el estudio comentado se observó mejor estabilización de la función renal con la reducción o suspensión del tratamiento con los inhibidores de calcineurina, en relación a la reducción global de la inmunosupresión. Los autores48 mencionan que aunque puede ser difícil discriminar entre el efecto inmunosupresor y el nefrotóxico de los inhibidores de calcineurina, en este estudio se observó que el efecto favorable de la suspensión o reducción de la dosis no se evidenció de forma inmediata, como hubiera ocurrido si sólo se hubiera suprimido su efecto vasoconstrictor arteriolar. A este respecto, se ha sugerido que los inhibidores de calcineurina pueden tener un efecto permisivo de la replicación viral, debido a su efecto tóxico sobre el epitelio renal43.
En un estudio realizado en niños, Hymes y cols.49, observaron que 20 (16%) de 122 pacientes que recibieron un trasplante renal, desarrollaron reacción positiva de la reacción en cadena de la polimerasa (PCR) para el ADN viral en suero en un promedio de 467 días (variación 23 a 1.410 días) postrasplante. Al comparar los esquemas de inmunosupresión (todos los niños recibieron tratamiento de inducción con basiliximab y de mantenimiento con tacrolimus, prednisona y mofetil micofenolato o azatioprina o sirolimus) que recibieron los pacientes que desarrollaron o no positividad al ADN viral, no se encontró diferencias entre éstos. En todos los casos se indicó reducción de la inmunosupresión y siete de ocho niños que presentaron NVBK en el estudio de biopsia renal, recibieron además tratamiento con cidofovir. Trece (65%) de los pacientes tratados permanecieron PCR positivos, la función renal se mantuvo estable en 16 (80%) de los niños a los 13 ± 6 meses después de iniciado el tratamiento; los otros cuatro pacientes (20%), todos con NVBK, presentaron deterioro progresivo de la función renal.
Recientemente, Trofe y cols.504 han presentado un resumen de las estrategias seguidas en diversos estudios dirigidas a reducir la inmunosupresión en los receptores de trasplante renal con el diagnóstico de NVBK (tabla III).
Si a consecuencia de la reducción del tratamiento inmunosupresor se presenta rechazo agudo del injerto se recomienda administrar metilprednisolona en dosis de 500 mg/día o 10 mg/kg/día, por vía intravenosa, por tres días, y posteriormente iniciar tratamiento de reducción de la dosis del corticosteroide por vía oral. En estos casos no se recomienda el tratamiento con preparaciones antilinfocitarias ya que éstas producen disfunción inmune más profunda lo que puede favorecer la reactivación del poliomavirus. Por otra parte, no se ha observado que el tratamiento del rechazo renal agudo con corticosteroides, favorezca la recurrencia de la NVBK26, 51.
La segunda estrategia en la reducción de la inmunosupresión fue descrita recientemente por Brennan y cols.26 en un estudio prospectivo llevado a cabo en 200 pacientes que recibieron un trasplante renal. Todos los pacientes recibieron tratamiento de inducción con globulina antitimocito de conejo y posteriormente tratamiento con tacrolimus o ciclosporina, prednisona y azatioprina o mofetil micofenolato. Los pacientes fueron evaluados prospectivamente para detectar replicación de VBK en plasma y orina por medio de la PCR. En los pacientes con viremia por VBK se suspendió el tratamiento con azatioprina o mofetil micofenolato; si esto fuera insuficiente para negativizar la viremia se indicaba la reducción de la dosis del inhibidor de calcineurina. Veintitrés (11,5%) pacientes desarrollaron viremia por VBK y 70 (35%) presentaron viruria. Veintidós de los 23 pacientes negativizaron la viremia con la reducción de la inmunosupresión: siete respondieron sólo a la suspensión de la azatioprina/mofetil micofenolato, dos con la suspensión sólo del inhibidor de calcineurina, siete con ambos procedimientos terapéuticos y los siete restantes con la reducción habitual de la inmunosupresión postrasplante. Sin embargo, sólo en cinco de los 23 pacientes se observó negativización de la viruria. La reducción de la inmunosupresión se acompañó sólo de un episodio de rechazo agudo.
En el estudio descrito26 no se observaron casos de NVBK demostrada por biopsia renal, aunque sólo se practicó biopsia renal en presencia de alteración funcional del injerto, por lo cual es posible que no se diagnosticaran los casos leves de replicación viral intrarrenal.
Una nueva estrategia descrita recientemente se basa en la manipulación ex vivo de las células T para incrementar la inmunidad específica contra el VBK52. Lo anterior haría posible proporcionar inmunidad específica contra el virus, evitando el riesgo de rechazo agudo asociado con la reducción de la inmunosupresión.
Tratamiento específico antiviral
Cidofovir
El cidofovir es un nucleótido análogo de la citosina inhibidor de la síntesis de DNA viral53, 54. Mucha de la experiencia clínica se ha obtenido en el manejo de la infección por citomegalovirus. El cidofovir se elimina principalmente por vía renal y su principal efecto adverso es la nefrotoxicidad, los pacientes con disfunción renal requieren menor dosis. Por esta razón, las dosis empleadas en el tratamiento de la NVBK son menores a las utilizadas en el tratamiento de la infección por CMV. A diferencia del tratamiento en los pacientes con retinitis por CMV, el cidofovir en los pacientes con NVBK no se ha asociado al empleo del probenecid. El probenecid inhibe la excreción tubular renal del cidofovir y permite obtener mejores niveles plasmáticos con menores dosis administradas. Sin embargo, en los pacientes con NVBK, la menor excreción intratubular del cidofovir podría potencialmente reducir la concentración del medicamento en el tejido que alberga la mayor concentración viral en esta enfermedad55. A este respecto se ha observado que debido a su nefrotoxicidad inherente, el cidofovir, en los pacientes con NVBK, se utiliza en dosis que representan 10 a 25% de la dosis efectiva para tratar la retinitis por CMV. Estudios in vitro han demostrado que a las dosis usadas en trasplante renal, la concentración pico en el suero alcanzada es aproximadamente una décima parte de la concentración efectiva in vitro y una vigésima parte de la concentración inhibitoria al 50%50.
Se han publicado informes del efecto favorable del tratamiento de nefritis por BK con cidofovir en dosis entre 0,25 a 1 mg/kg, por vía endovenosa, cada una a tres semanas, previa hidratación para reducir sus efectos nefrotóxicos43, 45, 56. En un estudio realizado en niños, Hymes y cols.49 indicaron el cidofovir en dosis de 0,3 mg/kg cada dos semanas por ocho semanas. En otro estudio, también en niños, Araya y cols.57 han utilizado dosis «intermedias » de 0,75 a 1,0 mg/kg/dosis, por cinco dosis administradas cada dos semanas, sin probenecid, sin evidencias de nefrotoxicidad. Kuypers y cols., utilizaron cidofovir 0,5 mg/kg semanal por 4 a 10 semanas en 8 pacientes adultos, después de un seguimiento promedio de 24 meses ningún paciente perdió el injerto por esta causa58.
En los pacientes tratados se ha indicado, asimismo, reducción en la dosis de inmunosupresores, por lo cual se ha comentado que es difícil distinguir el efecto antiviral del tratamiento con cidofovir del que se obtiene al mejorar la respuesta inmune del huésped43. Por otro lado, en algunos de los pacientes tratados con cidofovir se ha observado desarrollo de fibrosis intersticial renal y agravamiento de la disfunción renal43.
A pesar de lo anterior, actualmente se considera que el cidofovir es una alternativa terapéutica en los pacientes con NVBK que no han respondido a la reducción de la inmunosupresión y muestran evidencias de deterioro progresivo de la función renal24, 55.
Leflunomida
La leflunomida es metabolizada a su metabolito activo A77 1726 que inhibe la síntesis de pirimidina; asimismo, su efecto inhibidor de la fosforilación de proteínas puede ser responsable de su efecto antiviral59.
En un estudio reciente, Williams y cols.60 informaron de la evolución de 17 pacientes con NVBK tratados con leflunomida; en siete pacientes se observó negativización de la viremia y en otros ocho reducción de la carga viral; en los 15 pacientes se observó estabilización o mejoría de los niveles de creatinina en suero. Los principales efectos colaterales observados fueron leucopenia, erupción cutánea y pérdida del cabello.
En otro estudio realizado por Josephson y cols.61 se indicó tratamiento con leflunomida en 26 pacientes con NVBK, en siete de ellos asociado a cidofovir. Después de seis meses de tratamiento la carga viral por VBK en sangre y en orina fue significativamente menor que la basal en ambos grupos de pacientes; el virus fue indetectable en la sangre en 11 pacientes; en ocho de éstos también se negativizó la viruria. Después de seis a 40 meses de seguimiento se observó pérdida del injerto en cuatro pacientes, todos los cuales habían mostrado en la biopsia renal inicial grados avanzados de inflamación y daño renal. En este estudio no se observaron efectos colaterales serios del tratamiento61.
En adultos se ha utilizado la leflunomida en dosis de 100 mg/día por cinco días, reduciendo posteriormente la dosis a 20 a 60 mg/día, tratando de mantener niveles sanguíneos entre 50 a 100 μg/mL47. Se requiere el tratamiento prolongado (más de seis meses) y mantener un nivel mínimo de niveles sanguíneos (no menos de 40 μg/mL); por otro lado, la farmacocinética del medicamento puede variar ampliamente entre los pacientes46, 50, 55.
Recientemente se está investigando el inmunosupresor FK 778, un derivado de la leflunomida, que presenta actividad in vitro contra el VBK50.
Inmunoglobulina intravenosa
La inmunoglobulina intravenosa (IGIV) se emplea en el tratamiento de pacientes con inmunodeficiencias, así como en padecimientos autoinmunes e inflamatorios62, en pacientes con trasplante renal se ha utilizado en el tratamiento del rechazo resistente a esteroides, protocolos de desensibilización y como inmunosupresor de mantenimiento63-65. El mecanismo de acción es complejo y va más allá de la transferencia de anticuerpos, incluye la modulación y expresión de los receptores Fc, inhibición del daño mediado por complemento, interferencia en la red de citocinas inflamatorias, efectos en la activación, diferenciación y función efectora de células dendríticas, macrófagos, linfocitos T y B66, 67. Los efectos inmunomoduladores de la IVIG podrían evitar la presentación de rechazo al disminuir el tratamiento inmunosupresor. Los títulos de anticuerpos neutralizantes contra el virus BK en preparaciones de IGIV son en promedio de 2.048 (variación de 2.048 a 4.096) unidades de hemaglutinación, mucho menores que los niveles que presentan los pacientes con NVBK que tienen en promedio 8.192 (variación 2.048 a 65.536) de unidades de hemaglutinación68.
Existen varios reportes de pacientes con NVBK tratados con IVIG, ya sea como terapia única o bien asociada a antivirales.
Wadei y cols., reportan a 55 pacientes con NVBK, doce recibieron tratamiento con IVIG, dos dosis de 1,25 mg/kg administrada con 48 horas de diferencia, diez de ellos recibieron además cidofovir, no encontraron diferencia en el deterioro de la función renal a 30 meses en el grupo tratado con IVIG vs pacientes sin IVIG69.
Sener y cols., reportaron a ocho pacientes con NVBK que fueron tratados con IVIG 2 g/kg en dosis dividida en dos a cinco días y reducción de la inmunosupresión en 50%, después de un seguimiento promedio de 15 meses 88% tenían función renal estable70.
Quinolonas
Se ha demostrado que las quinolonas pueden inhibir la replicación del virus BK in vitro71. En un estudio piloto presentado por Josephson y cols.55, se indicó tratamiento con gatifloxacina (400 mg/día, vía oral) por 10 días, en 10 pacientes con trasplante renal que presentaron en dos ocasiones células «en señuelo» en la orina. No se modificó el esquema de inmunosupresión. Siete de los 10 pacientes tratados mostraron reducción mayor a 80% de la viremia y en todos se observó desaparición de las células en señuelo de la orina. Los autores mencionan que se decidió el uso de la gatifloxacina debido a su potencia in vitro contra el poliomavirus y también debido a que se concentra y excreta por el riñón; de esta manera, las células tubulares renales, donde ocurre la replicación viral, están expuestas a altas concentraciones de la quinolona.
De la misma manera, el empleo de otra fluoroquinolona, la ciprofloxacina, en pacientes con trasplante de células hematopoyéticas, se ha asociado a la reducción en la incidencia de viruria por el virus BK72.
Retrasplante
Se han descrito en la literatura 15 pacientes que recibieron un nuevo trasplante renal después de haber perdido el injerto por NVBK; se observó recurrencia de la infección en dos de los pacientes (13%). La mayoría de los pacientes (11, 73%) recibieron el mismo esquema inmunosupresor que el utilizado en el primer trasplante; se realizó nefrectomía del primer trasplante en 11 pacientes, aunque ésta no protegió contra el desarrollo posterior de la NVBK40. En estos casos se ha recomendado reducir la intensidad de la inmunosupresión y evitar el retrasplante en presencia de replicación del virus BK73.
Por otro lado, recientemente Womer y cols.74 han realizado retrasplante simultáneo con la nefrectomía del primer trasplante en dos pacientes, con adecuada función renal del retrasplante a un año de evolución. Sin embargo, se continúa sugiriendo que es más apropiado reducir la inmunosupresión (con el fin de propiciar el desarrollo de una respuesta inmune antiviral), antes de realizar un nuevo trasplante renal74.
ESCRUTINIO PARA DETECCIÓN OPORTUNA DE INFECCIÓN POR VIRUS BK EN PACIENTES CON TRASPLANTE RENAL
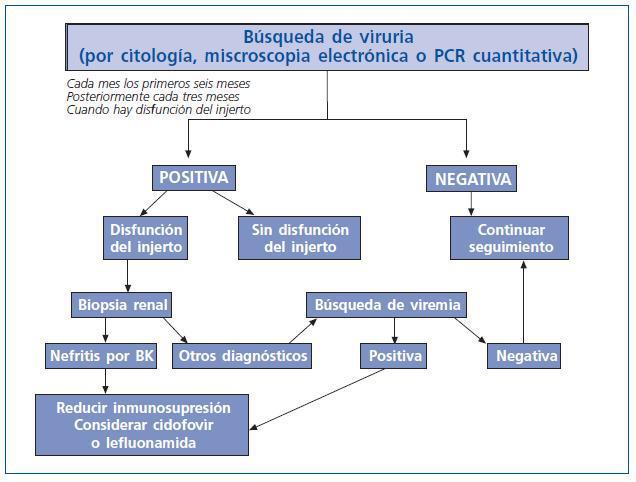
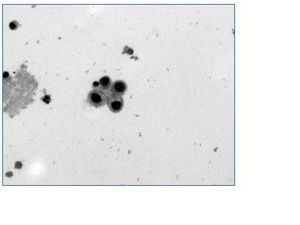
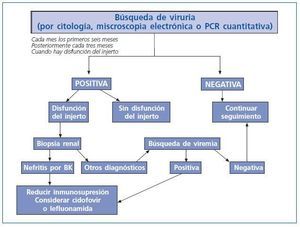
Es recomendable realizar un escrutinio periódico para búsqueda de replicación de virus BK en los pacientes con trasplante renal con determinación de viruria ya sea con células en señuelo por citología o por microscopia electrónica y preferentemente por PCR cuantitativa, o bien con viremia según la capacidad de cada centro de trasplantes, en forma mensual los primeros seis meses postrasplante renal y posteriormente en forma trimestral o cuando hay disfunción del injerto (fig. 4). En caso de que la viruria o viremia sea positiva debe considerarse la realización de biopsia renal, principalmente en los casos de disfunción del injerto. Si en la biopsia hay evidencia de nefritis por virus BK se debe disminuir la inmunosupresión y considerar tratamiento con Lefluonamida o Cidofovir.
Como quedó expuesto anteriormente, la ventaja que otorga el seguimiento mediante la determinación de viremia es que ofrece la oportunidad de evaluar el impacto que en la reducción de la carga viral produce la reducción de la inmunosupresión y el tratamiento antiviral administrado.
AGRADECIMIENTOS
Apoyo del Proyecto Sectorial de Investigación en Salud y Seguridad Social 2004-C01-193.
Figura 1.
Figura 2.
Figura 3.
Figura 4.
Tabla 1.
Tabla 2.
Tabla 3.