CASO CLÍNICO
Mujer de 64 años, con antecedentes de bocio multinodular, osteoporosis y ulcus duodenal, que consulta por clínica de varios meses de evolución de astenia y disnea de moderados esfuerzos. En el estudio inicial, se detecta Hb 9 g/dl. Posteriormente, en consulta de Hematología, se objetiva anemia normocítica hiporregenerativa, y en la bioquímica, destacan unos valores de proteínas totales de 8,2 g/dl y albúmina de 4,2 g/dl. La inmunofijación en suero detecta un pico IgG kappa y un aspirado de médula ósea muestra plasmocitosis difusa y un inmunofenotipo con componente mayoritario monoclonal, con datos aberrantes semejantes a células de mieloma. Según el porcentaje de plasmocitos, se clasifica como gammapatía monoclonal de significado incierto. En ese momento, tenía una creatinina de 1,6 mg/dl, con aclaramiento de 23 ml/min, por lo que se deriva a Nefrología. Las determinaciones de anticuerpos antinucleares, anti-mitocondriales y anti-citoplasmáticos fueron negativas. Se detecta proteinuria de 352 mg/24 h, que no da picos monoclonales en la inmunofijación en orina. Una ecografía renal muestra riñones de 9,5 y 10,5 cm, con área corticomedular respetada. Se inicia tratamiento con hierro oral y eritropoyetina.
En los meses siguientes, desarrolla hipertensión arterial. Se produce un deterioro progresivo de función renal, hasta llegar a creatinina de 4,7 mg/dl. Se realiza una biopsia de tejido celular subcutáneo, resultando negativa para la tinción Rojo Congo. Un ecocardiograma muestra disfunción diastólica, sin criterios de hipertrofia de ventrículo izquierdo. La proteinuria aumenta hasta 800 mg/24 h, y en la inmunofijación aparece IgG monoclonal tipo kappa e indicios de albúmina.
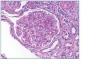
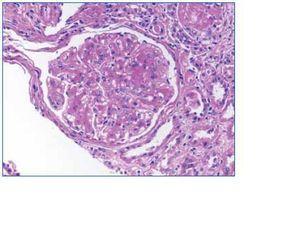
Se realiza biopsia renal percutánea, procediéndose al estudio por microscopia óptica convencional, inmunohistoquímica e inmunofluorescencia directa en cortes de 3 μm procedentes de microtomo criostático. La microscopia óptica muestra una arquitectura general distorsionada por importante afectación glomerular y nefropatía tubulointersticial crónica, infiltrado inflamatorio moderado de predominio linfoide, y grupos tubulares atróficos con glomérulos esclerosados. En total se observaron diez glomérulos de los cuales tres están esclerosados, los restantes muestran ovillos de aspecto lobular con marcado agrandamiento mesangial difuso, de tendencia nodular (figs. 1 y 2), con componente celular y con material PAS +, y aspecto reticulado. Se observa también material PAS + en la cápsula de Bowman, así como en la membrana basal tubular, en zona muy evidente, que con el tricrómico de Masson son fucsinófilos. No hay material tingible con la técnica de Rojo Congo. A nivel medular se aprecia abundante depósito intersticial de material PAS positivo.
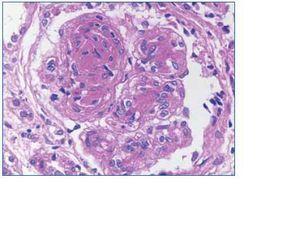
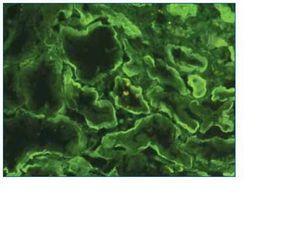
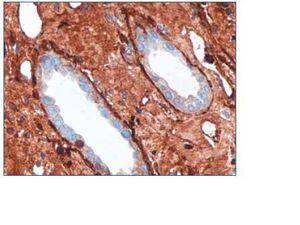
En el estudio por inmunofluorescencia directa, se aplicaron los siguientes antisueros (FITC): anti-IgG, anti-IgA, anti-IgM, anti-C3, anti-C1q, anti-cadenas kappa y anti-cadena lambda. Se observan 2 glomérulos por plano de corte. Destaca la fijación del suero anti-cadenas kappa a nivel de la membrana basal glomerular, tubular y cápsula de Bowman, incluso en el material intersticial descrito a nivel medular (fig. 3). Las técnicas de inmunohistoquímica para cadenas kappa y lambda muestran resultados similares a los aportados por la inmunofluorescencia (fig. 4).
Se informó con el diagnóstico anatomopatológico de nefropatía por depósito de cadenas kappa y nefropatía túbulo intersticial crónica.
EVOLUCIÓN POSTERIOR
Tras la realización de la biopsia, la función renal continuó deteriorándose hasta precisar tratamiento renal sustitutivo, estando la paciente incluida actualmente en programa de hemodiálisis crónica. Desde el punto de vista hematológico, se ha iniciado tratamiento con melfalán y prednisona, consiguiendo disminuir el pico de IgG monoclonal. En todo momento ha persistido con requerimientos transfusionales elevados.
DISCUSIÓN
Las disproteinemias, caracterizadas por las síntesis de inmunoglobulinas por clones de linfocitos B, se asocian con diferentes formas de afectación renal, entre ellas las causadas por el depósito o precipitación de Ig. En la enfermedad por depósito de cadenas ligeras, los fragmentos de Ig, típicamente tipo Kappa, se acumulan con una conformación desorganizada, granular, que no corresponde a la forma de depósito cristalino que se observa en el «riñón de mieloma», fibrilar en la amiloidosis y microtubular en la glomerulopatía inmunotactoide. Estas distintas características estructurales determinan diferencias clínicas, ya que por ejemplo el riñón de mieloma puede tener una evolución más acelerada a la insuficiencia renal, incluso con cuadros agudos, mientras que las enfermedades con depósitos predominantemente en el área mesangial dan lugar a manifestaciones como el síndrome nefrótico1.
Los factores que determinan el depósito granular o fibrilar de las cadenas ligeras en los tejidos no están claros. La observación de que la infusión de cadenas ligeras de individuos afectados produce en ratones una lesión renal similar a la de los pacientes, sugiere que las características bioquímicas de las proteínas son relevantes2. Asimismo, según algunos estudios in vitro, la composición de aminoácidos o la carga neta de la proteína podría ser un determinante de la formación adoptada para el depósito3. Por ejemplo, inicialmente, se observó que en la mayoría de los pacientes, las cadenas tenían una longitud mayor o menor de lo habitual, lo que se relacionaba con una mayor tendencia a precipitar. En estudios más recientes, la investigación de las cadenas inicialmente no detectadas, mostró que éstas eran N-glicosiladas, lo que aumentaba asimismo su capacidad de precipitación, siendo por lo tanto más difíciles de identificar en el suero4. Además, los estudios de secuenciación revelan que la mayoría de las anomalías se localizan en la zona de las moléculas implicadas en la unión con el antígeno, por lo que la conformación del depósito podría tener como primer paso la interacción con algún componente del entorno, que actuara como tal5. El caso que presentamos es un ejemplo particularmente claro de la importancia del tipo de proteína, ya que con un grado aparentemente menor de síntesis y eliminación de proteína anómala por orina, la patología renal es grave, acelerada y característica.
La afectación renal en la enfermedad por depósito de cadenas ligeras es constante, con insuficiencia renal y proteinuria en la mayoría de los casos6. En hasta un 55% aparece síndrome nefrótico, y en el porcentaje de pacientes con proteinuria menor de 1 g/día, la clínica predominante es un síndrome tubulointersticial7. Puede detectarse hematuria hasta en un 40%. La evolución hacia insuficiencia renal terminal suele ser rápida, y con frecuencia comparable entre pacientes con diferentes grados de proteinuria. La afectación de otros órganos es menos frecuente que en la amiloidosis, pudiendo aparecer hepatomegalia y disfunción hepática y más raramente cardiopatía. La enfermedad puede asociarse con otros procesos como linfomas, leucemias, macroglobulinemia de Waldenström o mieloma múltiple, que se diagnostica hasta en un 50% de los casos. En un 10-15%, no se detecta la presencia de una inmunoglobulina monoclonal en sangre u orina, lo que probablemente no se deba a la ausencia de secreción, sino a que se produzcan rápidamente postsíntesis el depósito tisular o la degradación de dichas proteínas.
En el estudio de biopsia renal mediante microscopio óptico, se observa de forma constante el depósito de material eosinófilo PAS positivo en la parte externa de la membrana basal. Las lesiones glomerulares son más heterogéneas, aunque lo más característico es la glomeruloesclerosis nodular. Los nódulos mesangiales están compuestos por material PAS positivo, Rojo Congo negativo, que en la mayoría de los casos se acompaña de hipercelularidad. En estadios iniciales o en enfermedad con escasa afectación, puede que lo único detectado sea un aumento de matriz mesangial y ligera hipercelularidad, con leve engrosamiento de las membranas basales. En estadios avanzados puede verse además una fibrosis intersticial marcada, incluyendo depósitos en dependientes de las lesiones tubulares8. Pueden observarse además depósitos en relación con las membranas basales en arterias, arteriolas y capilares peritubulares. El diagnóstico diferencial de las lesiones hay que hacerlo principalmente con la glomeruloesclerosis nodular diabética, en la que los nódulos de Kimmelstiel-Wilson se localizan más frecuentemente en la periferia del glomérulo y pueden observarse además lesiones exudativas y hialinosis de las arteriolas eferentes. La diferenciación con la nefropatía amiloidótica se realiza mediante la tinción Rojo Congo, que es negativa en los depósitos de cadenas ligeras.
El estudio con técnicas de inmunofluorescencia muestra fijación del suero anti-cadenas ligeras, especialmente de tipo kappa, a lo largo de las membranas basales tubulares. Los depósitos glomerulares se observan de forma más extensa en las membranas basales y menos en los nódulos propiamente dichos y la fijación es típicamente más débil que sobre los túbulos. En pacientes sin lesiones nodulares puede observarse afectación mesangial. Se observan además depósitos lineales de cadenas ligeras en la membrana basal de la cápsula de Bowman, y son constantes en las paredes vasculares. La inmunofluorescencia es fuertemente positiva, en relación con la observada en la amiloidosis, ya que la fracción depositada de la Ig es típicamente la región constante1.
Mediante microscopia electrónica, se observan depósitos granulares de material electrón-denso a lo largo de la parte externa de las membranas basales, que están preservadas, así como en los nódulos mesangiales.
La evolución de la enfermedad es variable, porque el depósito extrarrenal puede ser desde totalmente asintomático hasta causar disfunciones orgánicas graves. En las series publicadas, la supervivencia desde el diagnóstico puede variar desde 1 mes hasta 10 años, siendo peor el pronóstico en pacientes con asociación a mieloma y mayor afectación extrarrenal.
El tratamiento está enfocado a la disminución de la producción de inmunoglobulinas, mediante quimioterapia para eliminar el clon de células plasmáticas productor de la proteína monoclonal. En pacientes jóvenes, este tratamiento se hace conjuntamente con trasplante de médula. En algunos casos, además de la desaparición de la inmunoglobulina en sangre y orina, se ha observado la regresión de las lesiones nodulares mesangiales y de los depósitos de cadenas ligeras, lo que abogaría por un tratamiento intensivo en pacientes con importante afectación visceral9. Están descritos casos con mejoria importante de la función renal, incluso tras el inicio de terapia renal sustitutiva. La recidiva tras el trasplante es la norma, por lo que no debe indicarse sin haber conseguido remisión hematológica completa10.
PREGUNTAS
Dr. Rivera (Hospital General de Ciudad Real). Es muy frecuente ver pacientes diagnosticados de gammapatía monoclonal de significado incierto que presentan afectación renal con disminución de filtrado glomerular y proteinuria leve. La mayoría de estos pacientes son mayores y con otras enfermedades como diabetes mellitus tipo 2 o arteriosclerosis que justifican la afectación renal y se diagnostican con datos clínicos de nefroangiosclerosis o nefropatía diabética. En esta situación, ¿los resultados de la inmunofijación en sangre y orina orientan hacia la existencia de nefropatía de cadenas ligeras? ¿Qué tipo de inmunoglobulina o cadena ligera es más nefrotóxica?
R: La presencia de cadenas ligeras, principalmente kappa en la inmunofijación (teniendo en cuenta que hasta en un 10-15% no se detecta), puede orientar hacia esta nefropatía, especialmente en el seno de una NAE con una proteinuria no explicada o una progresión muy acelerada en una nefropatía diabética.
El isotipo kappa es el que se identifica con más frecuencia, aunque parece que la nefrotoxicidad viene determinada por la conformación con la que se deposita. Ahora bien, parece que diferentes mutaciones en las cadenas de Ig podrían estar involucradas en el tipo de depósito, y también se ha observado, en el caso concreto de la amiloidosis, que distintas regiones variables de la cadena lambda podrían determinar la afinidad por unos u otros tejidos11.
Dr. Poveda (Hospital de Bellvitge. Barcelona). Vuestro caso es muy demostrativo sobre el pronóstico desfavorable de la nefropatía de cadenas ligeras. Por otra parte algunos autores indican que el tratamiento quimioterápico puede tener resultados favorables si se aplica precozmente. Ello parece abogar por la conveniencia de un diagnóstico precoz. ¿Cuáles son en vuestra opinión las indicaciones de biopsia renal en pacientes con gammapatía monoclonal y afectación renal?
R: La prevalencia de gammapatía monoclonal de significado incierto en mayores de 70 años es del 3%, aumentando este porcentaje con la edad y siendo además muy frecuente, como hemos visto, la presencia de comorbilidad que justifique la afectación renal. Nos parece por lo tanto poco eficaz plantear la biopsia en todos los casos, limitando su indicación a procesos con ausencia de otras causas de insuficiencia renal o si existe un deterioro de función inexplicable. En este sentido, lo más interesante, de cara al futuro, sería poder detectar las características conformacionales de las proteínas responsables de la patogenicidad.
Dra. Julia Blanco (Hospital Clínico Universitario San Carlos. Madrid). Las imágenes de los glomérulos teñidas con Plata metenamina, muestran intensa positividad. ¿Has visto lo mismo en otros casos de enfermedad de cadenas ligeras? En los casos del Hospital Clínico de Madrid, siempre los nódulos mesangiales, así como las basales tubulares engrosadas, son intensamente argirófilos. Sin embargo, en algunos libros de Nefropatología, como Renal Pathology de Tisher-Krenner, establecen como dogma la negatividad de los depósitos glomerulares con la técnica de plata. ¿Qué piensas de ello?
R: Efectivamente también he visto positividad en otros casos similares. Pienso que las técnicas de plata son útiles, pero los resultados hay que interpretarlos con reserva, probablemente dependiente del grado evolutivo y de la diversidad de la composición de las cadenas con diferencias en la afinidad por las tinciones de plata.
Figura 1.
Figura 2.
Figura 3.
Figura 4.