El virus de la gripe o influenza (VI) es un virus ARN perteneciente a la familia Orthomyxoviridae. La vacuna contra dicho virus (VVI) está indicada en los grupos con mayor probabilidad de transmitir el VI, desarrollar complicaciones o morir a causa de la enfermedad como es el caso de los trasplantados renales1. A pesar de ser un procedimiento seguro, de forma excepcional se ha descrito la aparición de vasculitis tras la VVI2,3.
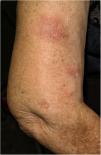
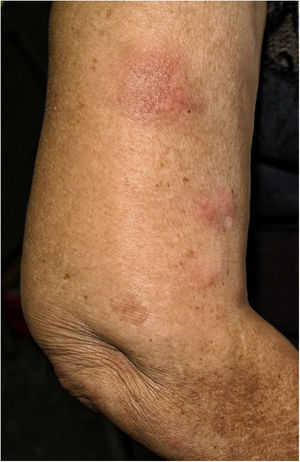
Describimos el caso de una mujer de 77 años de edad, trasplantada renal en 1999, por reflujo urinario bilateral con injerto funcionante. Entre sus antecedentes destacaba: positividad para anticuerpos Hb core total y anticuerpos Hbs y linfoma difuso de células grandes estadio II-B tratado con quimioterapia en 2006, logrando remisión completa hasta la actualidad. Su tratamiento inmunosupresor era rapamicina y micofenolato mofetilo desde hacía más de cinco años. Se le administró la VVI, virus fraccionado (trivalente: cepa similar a A/Michigan/45/2015 (H1N1)pdm09; cepa similar a A/Hong Kong/4801/2014 (H3N2); cepa similar a B/Brisbane/60/2008 (linaje Victoria)). A las 48 h de su administración comenzó a encontrarse mal, presentando dolores articulares, diarrea y febrícula de 37°C. Cuatro días después aparecieron nódulos eritematosos, de 1-2 cm de diámetro, mal delimitados, dolorosos a la presión, localizados en brazos y piernas (fig. 1).
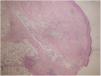
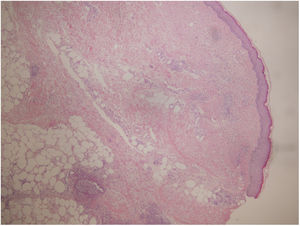
Se realizó biopsia donde se apreció un moderado infiltrado inflamatorio perivascular, con predominio de polimorfonucleares, daño del endotelio y presencia de polvo nuclear, localizado en dermis papilar y reticular con extensión a tejido celular subcutáneo con disposición lobulillar y septal (fig. 2). Se realizaron técnicas de PAS, Grocott y Giemsa, sin que se identificasen microorganismos.
La analítica con estudio de PCR, VSG, complemento, análisis de orina, estudio de inmunidad (ANCA, crioglobulinas, factor reumatoide, ANA) y estudio microbiológico (serología VHC) resultó normal y negativa.
Con estos datos se diagnostica de vasculitis leucocitoclástica (VL) como reacción post-VVI.
Fue tratada con prednisona 30 mg/24 h en pauta descendente durante 20 días con resolución completa del cuadro.
La mayoría de las vacunas que se emplean en los países europeos con programas específicos de vacunación, incluida España, son vacunas inactivadas: virus enteros, fraccionados o vacunas de subunidades. En torno al 1-10% de las personas que reciben la VVI registran algún tipo de efecto adverso, aunque en su mayoría son leves y autolimitados.
Se han descrito diferentes formas de vasculitis asociadas a vacunaciones (enfermedad de Kawasaki4, P-ANCA y C-ANCA positivas5), pero en el caso de la VVI, la vasculitis cutánea es la forma predominante3, apareciendo mayoritariamente en ancianos y mujeres, condiciones superponibles a la paciente descrita anteriormente. Sin embargo, en la mayoría de los casos descritos no se ha podido demostrar la relación causal entre la inmunización y la VL1,6.
A pesar de lo publicado, esta patología es una reacción adversa infrecuente y en especial en pacientes inmunodeprimidos1. Solo hemos encontrado un caso de un paciente trasplantado renal, por una nefropatía IgA, que desarrolló una vasculitis IgA tras la VVI7. Los autores plantean como hipótesis etiopatogénica, la presencia de autoinmunidad7. La paciente descrita en esta carta es una trasplantada renal por reflujo urinario que sufre una VL sin antecedentes de enfermedades autoinmunes.
Esto dota de mayor originalidad al caso ya que no existe ninguna descripción similar con anterioridad.
El mecanismo por el que se produce la vasculitis secundaria a la VVI permanece aún desconocido. La inmunosupresión de la paciente, rapamicina y micofenolato mofetilo, producen un efecto citostático sobre los linfocitos, aunque no de manera absoluta. Además, las vacunas de virus fraccionados o split (segunda generación), que contienen hemaglutinina, neuraminidasa y parte de la nucleoproteína y de la proteína M, inducen inmunidad humoral y son menos reactógenas que las de virus enteros. Y aunque el infiltrado inflamatorio es mayoritariamente neutroflílico, hay casos con predominio eosinofílico8 o de mastocitos9. Por tanto, y sin descartar otros mecanismos de producción, la VVI podría provocar la activación de células B/T autorreactivas, a pesar del tratamiento inmunosupresor, la formación de anticuerpos y el depósito de complejos inmunitarios dentro de los vasos pequeños, lo que llevaría a la activación del sistema del complemento y reclutamiento de leucocitos. Sin embargo, se podría plantear también la hipótesis de una respuesta inflamatoria a algún componente de la vacuna que se dirige al endotelio y provoca vasculitis de vasos pequeños, causando un daño citopático directo del virus a la célula endotelial. De hecho, se ha descrito un caso de VL tras VVI en la que se realizó una prueba intradérmica, observándose una erupción reticulada alrededor del sitio de inoculación probablemente causado por linfocinas citotóxicas6.
Por otra parte, existen algunos casos de VL en pacientes trasplantados de órgano sólido, donde se considera al sirolimus como agente causal. La relación se establece basándose en la temporalidad del cuadro con respecto a la introducción del fármaco10. Nuestra paciente llevaba más de cinco años con dicha medicación, lo que nos hace descartar al sirolimus como agente etiológico.
No hay estudios prospectivos sobre el progreso de la vasculitis tras VVI, a un cuadro sistémico con o sin afectación renal. Por esta razón, y teniendo en cuenta la excepcionalidad del caso, creemos dicha rutina no se debe restringir en general en pacientes trasplantados renales.
En conclusión, hasta donde sabemos presentamos el primer caso de VL tras VVI en un paciente trasplantado renal.