La infección por el virus de la varicela zóster (VVZ) puede manifestarse como dos cuadros principales: la primoinfección, conocida por varicela y consistente en lesiones vesiculares en diferente estadios distribuidas principalmente por tronco, cara y extremidades, y su posterior reactivación que da lugar al herpes zóster (HZ). Las complicaciones del HZ son más frecuentes en pacientes inmunodeprimidos con alta incidencia en trasplante de médula ósea. Puede coexistir una diseminación visceral de difícil diagnóstico si no se asocia con las habituales lesiones dérmicas y, por tanto, con tratamiento específico tardío, que conlleva una alta morbimortalidad, principalmente por síndrome de distrés respiratorio, hepatitis fulminante, pancreatitis o meningoencefalitis4,5.
Presentamos el caso de un paciente hombre de 79 años con antecedentes personales: vasculitis p-ANCA (anticuerpos anticitoplama de neutrófilos)diagnosticada en el año 2004 tras cuadro de hemorragia alveolar y síndrome nefrítico tratado con corticoides y ciclofosfamida, insuficiencia renal crónica (IRC) e inicio de hemodiálisis en año 2006, hemorragia pulmonar en diciembre del 2008 secundaria a reactivación en tratamiento con corticoides y ciclofosfamida y posterior mantenimiento con prednisona a dosis de 5 mg/día asociada a micofenolato (MMF) sódico a dosis de 180 mg/12 horas, que mantenía en la actualidad, resección transuretral (RTU) vesical en el año 2009 por neoformación vesical y fibrilación auricular. Como tratamiento habitual tomaba: ácido acetilsalicílico 100 mg, bisoprolol 2,5mg cada 24 horas, omeprazol 20 mg/24 horas, carbonato cálcico 2,5g/24 horas, dacortín 5 mg/24 horas y MMF 180 mg/24 horas. En hemodiálisis se le administraban Eprex 2000 y Venofer semanal.
Acude al servicio de urgencias por cuadro de disnea de varios días de evolución asociado con tos y escasa expectoración, acompañado de dolor abdominal de intensidad variable. Refiere sensación distérmica, sin otra sintomatología de interés, y es dado de alta. Acude de nuevo cuatro días después, por lo que es remitido a nuestro hospital; refiere la misma clínica y presenta en la exploración física lesiones vesiculares delimitadas al abdomen en dermatomas D9, D10 y D11, que aparecieron dos días antes. Destaca una presión arterial (PA) de 80/40 mmHg, saturación de oxígeno basal del 84%, taquipnea, dolor a la palpación profunda en el hipocondrio derecho y tiraje intercostal. En la auscultación destacan estertores bilaterales hasta campos medios. Los datos analíticos y radiológicos al ingreso son:
1. Hemoglobina (Hb) 11,7 g/dl, leucocitos 4.200 (N: 91,4%, L: 5,3%), plaquetas 77.000.
2. Aspartatoaminotransferasa (GOT) 6.926 U/l, alaninoaminotransferasa (GPT) 3.587 U/l, amilasa 100 U/l, lactato deshidrogenasa (LDH) 1.995 U/l, creatincinasa (CK) 152 U/l, mioglobina 708 U/l, creatinina (Crs) 6,3 mg/dl, urea 88 mg/dl, K 6 nmol/l, Na 144 mmol/l, bilirrubina total 2,17 mg/dl.
3. pH 7,21, CHO3 12 mEq/l, pCO2 32 mmHg, pO2 59 mmHg.
4. Índice normalizado internacional (INR) 1,7, actividad de protrombina del 37%, fibrinógeno 663mg.
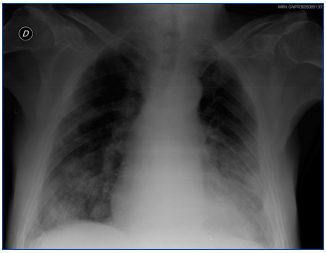
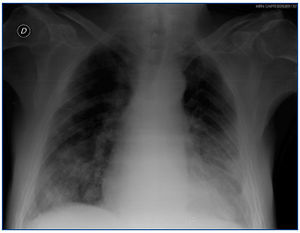
5. Radiografía de tórax: patrón alvéolo-intersticial bilateral con disposición periférica y de distribución algodonosa que no mejora tras ultrafiltración (figura 1).
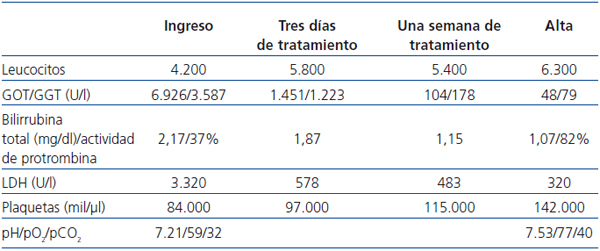
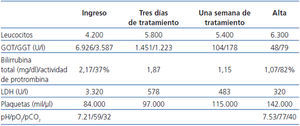
Ante un paciente inmunodeprimido con datos de fallo hepático más insuficiencia respiratoria aguda asociada con un cuadro dérmico, con alta sospecha de VVZ, se decide solicitar serología de atípicas, positiva para VVZ, e iniciar tratamiento empírico con aciclovir a dosis de 250 mg/12 horas asociado con tratamiento antibiótico (levofloxacino 250mg/48 h más cefotaxima 1 g/24 h). El diagnóstico de HZ complicado con diseminación visceral se confirma por reacción en cadena de la polimerasa (PCR) ADN viral asociado, con resto del estudio negativo. La evolución del cuadro es satisfactoria tras el inicio del tratamiento con aciclovir, tanto en el aspecto clínico, con recuperación de insuficiencia respiratoria y lesiones dérmicas, como radiológico, con desaparición del infiltrado alvéolo-intersticial y analítico, que se expone en la tabla 1.
Las complicaciones secundarias a reactivación del VVZ son frecuentes en pacientes inmunodeprimidos. Datos recogidos en trasplantes de medula ósea aportan una incidencia que varía, según diferentes series publicadas, entre el 17 y el 52%5,9. En trasplantes de órgano sólido cabe destacar un estudio retrospectivo con un total de 869 pacientes que refiere una incidencia del 8,6%. Cabe destacar una alta afectación en el trasplante pulmonar (15,1%) y en el trasplante renal3.
Las formas clínicas son variables: zóster local con o sin diseminación visceral, afectación visceral sin lesión dérmica o como zóster generalizado sin afectación visceral1,2. La reactivación tiene lugar desde los ganglios de la médula espinal; su mecanismo es aún poco conocido y se muestra como la causa principal del desarrollo de VHZ en todas sus formas. Sin embargo, en la literatura existen datos contradictorios sobre casos secundarios a reinfección1.
Como ocurre en nuestro caso, puede coexistir diseminación visceral. Oscila entre el 3 y el 15% de los HZ1,3. Presenta una alta mortalidad con series que muestran hasta un 55%3 secundaria a complicaciones como meningoencefalitis, pancreatitis o fallo hepático fulminante5. El órgano más afectado tras la piel es el pulmón, seguido por el hígado1,3. Su diagnóstico se ve dificultado si la afectación dérmica no precede a la diseminación visceral; como se ha demostrado en una serie de laparotomías blancas en pacientes con importante dolor abdominal, tres de los 123 casos presentaron cuadros por VHZ7. Se puede mostrar, por tanto, como un cuadro clínico variable con un síndrome constitucional asociado con síntomas propios de la afectación visceral, dolor abdominal por distensión de cápsula de Glisson o pancreatitis, insuficiencia respiratoria, etc., que posteriormente suele esclarecerse tras iniciarse la neuritis y el exantema vesicular habitual del cuadro por HZ.
Su diagnóstico requiere de una alta sospecha clínica en aquellos pacientes con historia previa de zóster no diseminado y con potente inmunosupresión. Entre los factores previos de la historia clínica que deben destacarse se encuentran la carga de inmunosupresión, el tratamiento con esteroides y/o MMF y la serología previa positiva3. En nuestro paciente desconocemos la serología previa, pero entre sus antecedentes destaca una importante inmunosupresión por su proceso de base, en la última etapa en tratamiento con MMF y corticoides, a lo que se suma la disfunción inmunitaria propia del estado urémico.
El diagnóstico en pacientes inmunodeprimidos o en cuadros atípicos puede confirmarse por diferentes técnicas de laboratorio, ya que una sospecha clínica asociada con serología positiva podría no ser suficiente para confirmarlo. La amplificación del ADN viral en sangre o líquido vesicular en casos de diseminación visceral es una prueba rápida con bajo riego de contaminación y mayor sensibilidad en comparación con técnica de cultivo convencional o inmunofluorescencia directa1,6.
En definitiva, es preciso que el tratamiento se adelante a las complicaciones. Ante una alta sospecha clínica puede ser recomendable iniciar tratamiento específico y temprano. El aciclovir a dosis plenas parece ser el agente más efectivo. Su duración aún no está definida en la literatura y es recomendable asociar antibioterapia de amplio espectro para evitar complicaciones por sobreinfecciones8.
A modo de conclusión podemos decir que la diseminación visceral del HZ es una complicación de frecuencia variable pero de elevada morbimortalidad, que requiere un manejo terapéutico rápido basado en una alta sospecha clínica.
Figura 1. Radiografía de tórax realizada al ingreso.
Tabla 1. Evolución analítica