La persistencia de la proteinuria nefrótica favorece la progresión hacia la insuficiencia renal. Hemos diseñado un protocolo terapéutico con sirolimus para ese grupo de pacientes implementando un estudio clínico prospectivo, intervencionista y no aleatorizado, sobre una cohorte de 13 pacientes con una edad media de 10 años; todos con síndrome nefrótico córtico-resistente primario y glomerulosclerosis focal y segmentaria; resistentes también a la ciclofosfamida, a los inhibidores de la calcineurina y al empleo de enalapril y losartán. La dosis media empleada de sirolimus fue de 3,6 mg/m2/día y el tratamiento duró 12 meses. Evaluamos la eficacia terapéutica acorde a la reducción de la proteinuria (respuesta total, parcial y ausente), y también fueron evaluadas la severidad del daño histológico pretratamiento y el tiempo previo transcurrido hasta recibir el sirolimus. Nueve de los trece pacientes tuvieron remisión parcial o total del síndrome nefrótico, y el tiempo medio previo transcurrido y la severidad del daño histológico influyeron en el tipo de respuesta. Consideramos que el sirolimus es una opción válida de tratamiento para los pacientes con síndrome nefrótico córtico-resistente, aunque probablemente sea necesario un inicio terapéutico más precoz.
Persistent nephrotic syndrome that does not respond to treatment may cause progression to kidney failure. We designed a therapeutic protocol with sirolimus for this group of patients. We conducted a prospective, interventional, time series, cohort study lasting 20 months. Thirteen patients were enrolled, with a mean age of 10 years (range: 8-18 years old) with steroid-resistant primary nephrotic syndrome and a histological diagnosis of focal and segmental glomerulosclerosis. We administered sirolimus 3.6mg/m2/day. The duration of this regimen was 12 months in responsive patients. The protocol’s efficacy was assessed according to reduction of proteinuria (3 response levels: total, partial, or no response). Severity of histological renal damage and mean time from clinical diagnosis to protocol initiation were also assessed. Nine of 13 patients responded to the treatment with sirolimus, and mean progression time and the severity of histological renal damage influenced response to therapy. We believe that sirolimus is a valid treatment option in patients with steroid-resistant nephrotic syndrome, even though this regimen probably requires an earlier treatment.
INTRODUCCIÓN
El síndrome nefrótico córtico-resistente (SNCR) puede conducir a la insuficiencia renal crónica1,2. La proteinuria en rango nefrótico es un marcador de lesión renal y su reducción está relacionada con el mantenimiento del filtrado glomerular3,4.
El masivo paso de proteínas hacia el mesangio condiciona la proliferación celular y la activación de factores quimiotácticos, con la consecuente progresión hacia la compresión extrínseca de los vasos glomerulares, causando finalmente una glomerulosclerosis global y difusa5,6. Para evitar esta progresión, se han utilizado varias opciones terapéuticas (ciclofosfamida [CFM], micofenolato sódico, ciclosporina [CsA], levamisol, tacrolimus, inhibidores de la enzima convertidora de la angiotensina [IECA], bloqueantes AT1 [BAT1], etc.), en algunos casos con respuesta poco satisfactoria y graves efectos tóxicos7-11.
Nosotros hemos diseñado un protocolo con sirolimus (droga inhibidora de la proteína mTOR, con efectos antiproliferativos) para pacientes nefróticos primarios con glomerulosclerosis focal y segmentaria (GEFS), resistentes a las terapias habituales.
OBJETIVOS
El objetivo primario es evaluar la reducción de la proteinuria en pacientes SNCR primario tratados con sirolimus.
Los objetivos secundarios son: 1) evaluar la respuesta terapéutica en relación con el tiempo transcurrido desde el diagnóstico clínico del síndrome nefrótico hasta iniciar el tratamiento con sirolimus; 2) evaluar la asociación entre el daño histológico al comenzar el tratamiento y el tipo de respuesta terapéutica ocurrida.
MATERIAL Y MÉTODOS
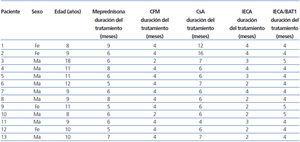
Se realizó un estudio clínico prospectivo, intervencionista y no aleatorizado, utilizando una serie de cohortes (intrasujeto) de 13 pacientes con una edad media de 10 años (rango: 8-18 años), todos con SNCR primario y resistentes a los inhibidores de la calcineurina (CsA, tacrolimus) y también a la ciclofosfamida. Tampoco obtuvieron la remisión con el empleo de enalapril (EN) y losartán (LO).
Definimos como síndrome nefrótico a la presencia de proteinuria superior a 40 mg/m2/hora con hipoalbuminemia menor a 2,5 g% y frecuentemente hipercolesterolemia mayor al percentil 95 para sexo y edad12; por otra parte definimos como SNCR a la persisten cia del síndrome nefrótico luego de haber completado 4 semanas de tratamiento con meprednisona a 48 mg/m2/día (dosis esteroide equivalente a 60 mg/m2/día de prednisona), seguidos por 3 pulsos consecutivos con 16-beta-metilprednisolona a 15 mg/kg/dosis1313,14.
Los pacientes fueron biopsiados antes del uso de la CsA, y el diagnóstico patológico de GEFS se definió por el hallazgo de al menos un glomérulo con una lesión segmentaria, considerando como lesión segmentaria a la existencia de por lo menos un lóbulo con cicatrices capilares presentes en el glomérulo implicado. El diagnóstico de la forma primaria se estableció ante la ausencia de pruebas inmunopatológicas o ultraestructurales de otra enfermedad glomerular coexistente o ante la ausencia de una enfermedad sistémica asociada con la GEFS. No fue posible realizar estudios genéticos en ninguno de los pacientes estudiados.
Los criterios de inclusión fueron los siguientes: síndrome nefrótico con GEFS primaria, prueba de embarazo negativa, consentimiento médico aprobado. Los criterios de exclusión fueron: aclaramiento de creatinina (CCr) < 60 ml/min/1,73 m2, úlceras gástricas o duodenales, tumores activos y/o infecciones con o sin tratamientos específicos, diabetes, obesidad mórbida, reflujo vesicoureteral, riñón único, abuso de drogas por vía intravenosa. Finalmente, establecimos como criterios de interrupción del tratamiento la reducción del CCr > 30% de los niveles iniciales por un período superior a 3 meses, la leucopenia (recuento de leucocitos < 3000/mm3), la anemia refractaria, la infección activa, la intolerancia gastrointestinal persistente y la falta de reducción de la proteinuria < 50% con respecto a la proteinuria inicial, después de 6 meses de iniciado el protocolo.
Las variables evaluadas fueron: proteinuria nefrótica, gravedad de la lesión histológica inicial, aparición de eventos adversos relacionados con el sirolimus y tiempo transcurrido desde el diagnóstico clínico hasta comenzar con el sirolimus.
Para evaluar la eficacia del tratamiento establecimos tres niveles de respuesta terapéutica: 1) respuesta total: reducción de los niveles de proteinuria < 4 mg/m2/hora; respuesta parcial: reducción de los niveles de proteinuria entre 4 y 40 mg/m2/hora; respuesta ausente: proteinuria nefrótica persistente > 40 mg/m2/hora.
La clasificación de la lesión histológica fue realizada por el mismo médico patólogo, quien estableció la severidad del daño renal histológico de acuerdo a los datos de la literatura15 y a la propia experiencia, estableciendo una escala de 0-3 (ausente, leve, moderada y severa) para la esclerosis glomerular, la fibrosis intersticial y la atrofia vascular, respectivamente. Por otra parte, en función del grado de sensibilidad y especificidad para cada variable histológica mencionada, se consideró de alto riesgo un puntaje > 6. También evaluamos el tiempo transcurrido desde el diagnóstico clínico del síndrome nefrótico hasta el comienzo del tratamiento con sirolimus.
Los 13 pacientes estaban recibiendo EN en el momento de ingresar al estudio, con un rango de dosis de 0,1 mg/ kg/día a 0,3 mg/kg/día, y LO con un rango de dosis de 0,8 mg/kg/día a 1,5 mg/kg/día. El rango de dosis establecido de sirolimus fue de 1 a 5 mg/m2/día (dosis máxima de 5 mg/día) una vez por día, manteniendo una concentración en sangre entera entre 7 a 10 ng/ml.
Los controles mensuales de laboratorio realizados fueron en sangre: creatinina (calculando el CCr por el método de Schwartz), uremia, hemograma completo, colesterolemia, trigliceridemia, colesterol LDL (asociado a lipoproteínas de baja densidad), colesterol HDL (asociado a lipoproteínas de alta densidad),, proteinograma electroforético, amilasa sérica, ácido úrico en sangre, lipasa sérica, hepatograma, electrolitos séricos, nivel de sirolimus en sangre entera. En la orina se midieron: electrolitos urinarios, proteinuria/día y urea urinaria.
Tras la presentación de eventos adversos relacionados con el tratamiento, se adoptaron las siguientes medidas:
-Reducción del 25% de la dosis inicial de sirolimus.
-Mantenimiento del tratamiento sintomático.
-Recuperación de la dosis inicial del fármaco una vez que los síntomas desaparecieron.
Los métodos estadísticos utilizados fueron:
-Prueba de Wilcoxon para evaluar la probabilidad de respuesta en función del tipo de terapia empleada y la variación de la proteinuria.
- Análisis de regresión múltiple para evaluar la asociación entre cada variable evaluada (atrofia tubular, fibrosis intersticial, esclerosis glomerular, tiempo transcurrido desde el diagnóstico clínico del síndrome nefrótico hasta la iniciación de la terapia y el rango de proteinuria previo al tratamiento) y la variación de la proteinuria durante el estudio.
La p < 0,05 se estableció como un valor significativamente estadístico. Los resultados se expresan como media ± SD. Utilizamos el programa estadístico SSPS 13.0.
La autorización médica se obtuvo de todos los pacientes previamente a ingresar en el estudio, y todos los pasos del protocolo fueron evaluados y aprobados por el Comité de ética e investigación de nuestro hospital. No hubo conflicto de intereses.
La duración total del tratamiento fue de 12 meses, y el último control realizado fue a los 26 meses de iniciado el tratamiento.
RESULTADOS
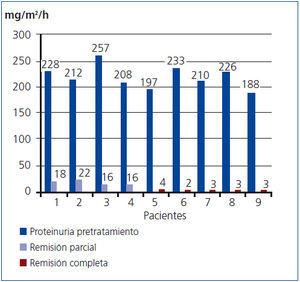
Al finalizar el estudio, 9/13 pacientes respondieron al tratamiento; de ellos, 5 presentaron remisión completa y 4 tuvieron una respuesta parcial. La prueba de Wilcoxon fue muy significativa (p = 0,0002). La media pretratamiento de los niveles de proteinuria de los 9 pacientes que respondieron fue de 212 mg/m2/hora (DE: 20), con un valor medio después del tratamiento en los 4 pacientes con respuesta parcial de 18 mg/m2/hora (DE: 3) y un porcentaje de reducción de la proteinuria del 92%. Mientras, el nivel medio postratamiento de la proteinuria en los 5 pacientes con respuesta completa fue de 3 mg/m2/hora (DE: 1); esta variación corresponde a un porcentaje de reducción de la proteinuria del 99% (figura 1).
El valor medio de la proteinuria pretratamiento en los 4 pacientes no respondedores fue de 226 mg/m2/hora (DE 22) y el postratamiento de 79 mg/m2/hora (DE 27). Se correspondía a un porcentaje de reducción de 65%.
Durante los 12 meses de tratamiento, 2 de los pacientes con respuestas parciales tuvieron recaídas; ambos alcanzaron nuevamente una respuesta parcial con el tratamiento esteroide clásico y se mantuvieron sin variantes hasta pasado el año del protocolo.
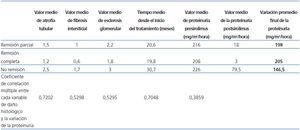
De todas las variables evaluadas, el tiempo de inicio de tratamiento con sirolimus (21,2 meses para la respuesta total, 25 meses para la respuesta parcial y 31,5 meses para la respuesta ausente; R2: 0,70) y la atrofia tubular (R2: 0,72) mostraron una fuerte correlación con la variación de la proteinuria para los 3 tipos de respuesta establecidos (tabla 1).
Por otra parte, la tasa de correlación fue moderada para la fibrosis intersticial (R2: 0,52) y para la esclerosis glomerular (R2: 0,52), y baja para los niveles de proteinuria pretratamiento (R2: 0,38) (P: 0,01) (tabla 2).
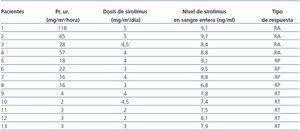
La dosis media de sirolimus fue de 3,6 mg/m2/día (3,1 mg/m2/día para la respuesta total; 3,5 mg/m2/día para la respuesta parcial y 5,8 mg/m2/día para la respuesta ausente).
La dosis media utilizada de EN fue: 0,18 mg/kg/día (0,18 mg/kg/día para la respuesta total, 0,16 mg/kg/día para la respuesta parcial y 0,20 mg/kg/día para respuesta ausente). Y la de LO fue: 1,1 mg/kg/día (1,1 mg/kg/día para la respuesta total, 1,2 mg/kg/día para la respuesta parcial y 1,2 mg/kg/día para la respuesta ausente).
El nivel medio en sangre entera de sirolimus fue: 8,4 ng/ml (7,7 ng/ml para la respuesta total, 8,5 ng/ml para la respuesta parcial y 9 ng/ml para la respuesta ausente) (tabla 3).
Los eventos adversos informados fueron los siguientes:
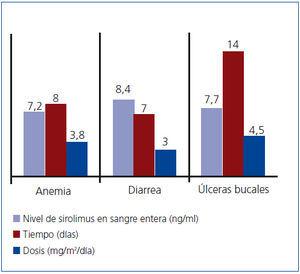
- Anemia: se presentó en 3 pacientes. Dos tenían niveles bajos de ferritina y respondieron bien al tratamiento con sulfato ferroso, y el restante tuvo niveles normales de ferritina pero niveles inadecuados de saturación de transferrina. Esta paciente mejoró tras recibir dosis de sulfato ferroso de 7 mg/kg/día y 5 mg/día de ácido fólico.
- Diarrea aguda: se presentó en 2 pacientes, que respondieron adecuadamente a una reducción temporal de la dosis de sirolimus y a una dieta hipofermentativa.
- Úlceras bucales: se presentaron en 3 pacientes, con remisión tras enjuagues bucales con sucralfato, por lo que la reducción de la dosis de sirolimus no fue necesaria (figura 2).
No hubo diferencias significativas en las dosis o los niveles de sirolimus en sangre total entre los pacientes con y sin efectos adversos. No se informó de ningún otro efecto adverso presumiblemente relacionado con el tratamiento.
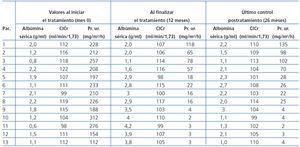
A lo largo del protocolo, 13 pacientes tuvieron los siguientes registros medios de presión arterial: 77 mmHg (+/- 5) para la respuesta total; 74 mmHg (+/- 5) para la respuesta parcial, y 77 mmHg (+/- 5) para la respuesta ausente. Los valores de creatinina sérica fueron: 0,8 mg/dl (+/- 0,1) para la respuesta total; 0,9 mg/dl (+/- 0,2) para la remisión parcial, y 0,8 mg/dl (+/- 0,1) para la respuesta ausente.
Los 13 pacientes completaron los 12 meses de tratamiento, incluidos los 4 que permanecieron nefróticos, ya que tuvieron una reducción de la proteinuria > 50% con respecto a la proteinuria inicial. De los 9 pacientes respondedores, 8 presentaron variación en la proteinuria pero no tuvieron recaídas hasta el último control clínico, realizado a los 26 meses. Por otra parte, los 4 pacientes no respondedores permanecen con el síndrome nefrótico y su filtrado glomerular es normal (tabla 4).
Hasta el último control realizado, ninguno de los 13 pacientes fue nuevamente biopsiado.
DISCUSIÓN
En nuestra experiencia, 9 de los 13 pacientes tratados tuvieron un descenso de los niveles de proteinuria superior al 90%. Con esta importante reducción, 5 de estos pacientes remitieron su síndrome nefrótico y los otros cuatro mantuvieron una proteinuria significativa; incluso los 4 niños restantes aún con la proteinuria masiva obtuvieron una disminución superior al 50% del valor inicial. Similares resultados fueron referidos en una población adulta por Tumlin tras 6 meses de tratamiento con sirolimus16.
El manejo del SNCR constituye un desafío médico. Aproximadamente el 80% de los pacientes con síndrome nefrótico primario responden al tratamiento con esteroides, y el uso de drogas citotóxicas asociadas en general mejora el ritmo de remisión1,3; sin embargo, el 20% restante puede requerir otros regímenes terapéuticos. Esta situación puede generar una significativa proporción de efectos adversos4,5, lo que justifica la búsqueda de otras variantes de tratamiento que apunten básicamente al descenso de la proteinuria, aunque no siempre a la recuperación completa del daño renal. Se han implementado varias alternativas (esteroides, CFM, CsA, tacrolimus, IECA, BAT1, etc.) como monoterapia o terapia combinada, pero en muchos casos con una respuesta poco satisfactoria16, 17.
Con el empleo principalmente de CsA y tacrolimus14,18,19, se obtuvieron tasas de remisión superiores al 70%, aunque muchos de estos pacientes presentaron recaídas por lo general dentro de los 6 meses de completado el tratamiento. Para evitar este importante número de recurrencias, han sido implementados prolongados períodos terapéuticos, con el riesgo nefrotóxico resultante18.
Sirolimus es un nuevo agente inmunosupresor que bloquea la proliferación de células T y que tiene una estructura similar al tacrolimus, uniéndose a los mismos inmunomoduladores sin afectar la actividad de la calcineurina. A dosis terapéuticas, sirolimus bloquea la proliferación de células T en la fase G1-S. Este mecanismo probablemente reduzca la alteración estructural de los podocitos en la GEFS19,20.
Existen pocas publicaciones sobre el mecanismo de acción de la rapamicina en este tipo de glomerulopatías, y las objeciones principales se relacionan con sus potenciales efectos tóxicos a largo plazo21,22. Entre los más mencionados se encuentra la anemia, con una reducción del hematocrito en el 50% de la población tratada. Este tipo de anemia puede ser causada por varios mecanismos, incluyendo la interferencia con la proliferación de las células eritroides primitivas23,24. Tres de nuestros pacientes desarrollaron anemia ferropénica, que se corrigió con el empleo de sulfato ferroso y ácido fólico; la eritropoyetina no fue necesaria en ningún caso.
En cuanto a los lípidos, se ha informado una relación causal del sirolimus con la hiperlipidemia, caracterizada por aumentos del colesterol total, el colesterol LDL, la apo-B100, la apoC-III, los ácidos grasos libres y los triglicéridos25,26. En nuestra población, la hiperlipidemia estuvo presente previa al ingreso al protocolo de estudio, situación esperable frecuentemente en el síndrome nefrótico. Sin embargo, considerando la reducción de los niveles elevados de lípidos en el grupo que logró la remisión, no apreciamos una asociación causal entre el uso de sirolimus y la hiperlipidemia.
Con respecto al eventual desarrollo de proteinuria patológica y de insuficiencia renal como consecuencia de un mecanismo de hiperfiltración relacionado con el empleo de sirolimus, a partir de cambios hemodinámicos (aumento del flujo sanguíneo renal y de la presión intraglomerular)27 o por un mecanismo de nefrotoxicidad aún no determinado, Fervenza21 informa del empeoramiento de la falla renal preexistente en 6 de 11 pacientes con diagnósticos de GEFS, nefropatía por IgA y glomerulonefritis membranosa primaria; todos tratados con sirolimus. Letavernier describe pacientes adultos trasplantados que desarrollaron GEFS con síndrome nefrótico consecuente tras recibir sirolimus a dosis elevadas28. Por su parte, Cho refiere que en ninguno de los 5 pacientes adultos con GEFS tratados con sirolimus obtuvo una remisión total ni parcial del síndrome nefrótico, debiendo por otra parte suspender el tratamiento ante la aparición de efectos adversos (descenso del filtrado glomerular e hiperlipidemias)29. En contraposición a estos informes, el total de nuestros pacientes no tuvieron deterioro de la función renal (probablemente la circunstancia que los mismos iniciaran el protocolo con filtrado glomerular normal podría considerarse como una variable evolutiva determinante) y, por otra parte, aunque con diferente magnitud, siempre se registró un descenso de la proteinuria.
La diarrea es otro de los potenciales eventos adversos descritos30. En nuestro grupo, tres niños presentaron diarrea aguda, dolor abdominal, náuseas y vómitos durante el tratamiento, respondiendo rápidamente a una reducción temporal en la dosis de sirolimus y a una dieta acorde. La eventual aparición de lesiones bucales (úlceras, glositis, gingivitis, etc.) puede ocurrir en los pacientes que reciben sirolimus (al parecer, dependiente de la dosis). La mayoría de estos diagnósticos se realizaron de acuerdo a criterios clínicos (no microbiológicos), y se ha comprobado que la reducción de la dosis o la suspensión temporal del medicamento podrían ser utilizadas para minimizar estos efectos. Además, el tratamiento sintomático parece mejorar los síntomas31. Tres de nuestros pacientes presentaron úlceras en la boca, que desaparecieron después de realizar enjuagues bucales con sucralfato, sin requerir una reducción de las dosis de sirolimus.
Antecedentes bibliográficos justifican la razón del fracaso terapéutico en el SNCR fundamentalmente en el momento diagnóstico y el inicio precoz del tratamiento32-34. Probablemente en consonancia con los resultados obtenidos y a partir de nuestra experiencia en este estudio, observamos que el tiempo transcurrido hasta administrar el sirolimus y la gravedad de las lesiones histológicas previas fueron dos de las variables que afectaron a la respuesta terapéutica (aunque debemos admitir que la imposibilidad de realizar pruebas genéticas para el síndrome nefrótico impidió analizar esta importante variable). Por lo tanto, suponemos que ambos factores están relacionados entre sí, pudiendo promover el desarrollo progresivo de proteinuria no-inmunológica, presente en el proceso de hiperfiltración al que están expuestas las unidades nefronales remanentes. Por este motivo, mantuvimos la asociación de EN y LO a lo largo de todo el protocolo, y creemos que la adición de este régimen combinado al sirolimus se justifica por los mecanismos hemodinámicos y moleculares del IECA con el BAT1, con la consiguiente reducción del gradiente de difusión y, finalmente, de la proteinuria35,36.
CONCLUSIÓN
Consideramos que el sirolimus es una opción válida de tratamiento para los pacientes con SNCR, aunque probablemente sea necesario un inicio terapéutico más precoz. Futuros estudios podrían contribuir a aclarar esta cuestión.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Tabla 1. Terapéutica y tiempo transcurrido previo hasta comenzar el tratamiento con sirolimus
Tabla 2. Relación entre el daño histológico y el tiempo previo al uso del sirolimus con la variación de la proteinuria
Tabla 3. Valores finales de proteinuria, dosis y niveles de sirolimus en sangre entera
Tabla 4. Variación de los valores de laboratorio diagnósticos de síndrome nefrótico y del aclaramiento de creatinina desde el inicio del protocolo hasta el último control postratamiento
Figura 1. Variación de la proteinuria en los pacientes respondedores
Figura 2. Eventos adversos: tiempo de aparición, dosis y niveles de sirolimus en sangre entera