Objetivos: Determinar la prevalencia de insuficiencia renal en población mayor de 49 años de edad con enfermedad arterial periférica y analizar su relación con factores de riesgo y enfermedad cardiovascular. Material y métodos: Estudio epidemiológico prospectivo de 3 años de duración con selección por muestreo aleatorio simple en población general de edad superior a 49 años. Se recogieron datos demográficos, clínicos, prevalencia de factores de riesgo y enfermedad cardiovascular. Se definió enfermedad arterial periférica (EAP) por índice tobillo-brazo ≤ 0,9 e insuficiencia renal crónica (IRC) según valores de filtrado glomerular estimado por la fórmula MDRD < 60 ml/min/1,73 m2. Se presentan datos basales. Resultados: Se incluyeron 511 personas de 66,6 (9,7) años de edad media (desviación estándar), 37% varones. La prevalencia de EAP fue del 12,4% (n = 63) de la muestra, de 72,6 años de edad media, 46% varones. La presencia de enfermedad renal crónica en estadios 3-5 fue del 39,7%. Los pacientes con EAP e IRC, en comparación con los que tenían función renal normal, eran de mayor edad (75,6 vs. 70,6, p = 0,08), predominantemente mujeres (64 vs. 47,4%, p = no significativa [ns]), presentaban cifras más elevadas de presión arterial sistólica y diastólica (159,2 vs. 146,1, p = ns y 85,7 vs. 80,3 mmHg, p = 0,09), proteína C reactiva (1,23 vs. 0,38 mg/dl, p = 0,05) y cociente albúmina-creatinina (90,2 vs. 26,4 mg/g, p = ns). En este grupo, la prevalencia de factores de riesgo cardiovascular y enfermedad cardiovascular asociada fueron notablemente superiores, sin alcanzar significación estadística. Conclusiones: La insuficiencia renal está presente en el 39,7% de los pacientes con EAP y delimita un subgrupo de pacientes con elevado riesgo cardiovascular.
Objectives: To determine the prevalence of kidney failure in people older than 49 years old with peripheral arterial disease and to analyse its relationship with risk factors and cardiovascular disease. Material and method: Prospective epidemiological study 3 years in duration with selection by simple random sampling in the general population aged over 49 years. Data on demographic, clinical, prevalence of risk factors and cardiovascular disease were registered. We defined peripheral arterial disease (PAD) by ankle-brachial index (ABI) <_0.9 and chronic kidney disease (CKD) according to estimated glomerular filtration rates by the MDRD <60 ml/min/1.73m2. Baseline data are presented. Results: 511 people were included. The mean age was 66.6 (9.7) years (SD), 37% were men. The prevalence of PAD was 12.4% (N=63) of the sample, average age 72.6 years, 46% men. The presence of CKD stages 3-5 was 39.7%. Patients with PAD and CKD compared with those with normal renal function were older (75.6 vs. 70.6, p=0.08), predominantly women (64% vs 47.4%, p=ns), and showed higher values for systolic and diastolic blood pressure (159.2 vs 146.1, p=ns and 85.7 vs 80.3 mmHg, p=0.09), CRP (1.23 vs 0.38 mg/dl, p=0.05) and albumin creatinine ratio (90.2 vs 26.4 mg/g, p=ns). In this group, the prevalence of cardiovascular risk factors and associated cardiovascular disease, were significantly higher without reaching statistical significance. Conclusions: Kidney failure is present in 39.7% of patients with PAD and it defines a subgroup of patients with high cardiovascular risk.
INTRODUCCIÓN
En la práctica clínica se suele asimilar el término de enfermedad arterial periférica (EAP) a patología vascular en las extremidades inferiores, definida como la causada por la estenosis o trombosis de las arterias de las extremidades, siendo una manifestación más de la aterosclerosis sistémica1.
Aunque tradicionalmente la presencia de claudicación intermitente ha sido usada como marcador de EAP para aproximarse al cálculo de su prevalencia en la población general, hoy se considera que la determinación del índice tobillo-brazo (ITB) tiene mayor precisión diagnóstica, por lo que se recomienda tanto para el diagnóstico individual como para estudios epidemiológicos1,2. Un ITB inferior a 0,9 permite detectar con una sensibilidad del 95% y una especificidad del 100% la presencia de una estenosis en el territorio vascular de extremidades inferiores, lo que traduce la presencia de arteriosclerosis en dicha zona3,4. El ITB se reconoce además como marcador de riesgo cardiovascular y guarda una excelente relación con el desarrollo de complicaciones coronarias, con la incidencia de ictus y con la mortalidad cardiovascular o por cualquier causa en la población general y especialmente en la población anciana5,6.
Es bien conocido que la presencia de la insuficiencia renal terminal en tratamiento sustitutivo en pacientes con EAP incrementa las amputaciones de miembros inferiores, la hospitalización y la mortalidad total y cardiovascular7-9. Y cada vez es mayor el interés por examinar la relación entre función renal y EAP no ya sólo en la fase de insuficiencia renal terminal, sino a lo largo de todos los estadios de enfermedad renal. En el estudio epidemiológico NHANES 1999-2000, se analizó la prevalencia de EAP en pacientes con enfermedad renal definida por un filtrado glomerular estimado (FGe) por fórmula de Cockroft-Gault inferior a 60 ml/min/1,73 m2, que fue del 24%, en comparación con la población cuyo FGe era superior a 60 ml/min/1,73 m2, que fue del 3,7% (odds ratio [OR]: 9,7, 95% intervalo de confianza [IC]: 5,6-16,7), p < 0,001). Esta relación fue independiente de otras variables como edad, diabetes, hipertensión, hipercolesterolemia, enfermedad coronaria o ictus (OR: 2,5, 95% IC: 1,2-5,1), p < 0,011)10. Resultados muy similares se obtuvieron en el NHANES 1999-200411. También en estudios longitudinales de seguimiento se ha demostrado un incremento de riesgo para desarrollar EAP en los pacientes con FGe inferior a 60 ml/min en comparación con los que tenían un filtrado glomerular (FG) más elevado12,13.
La insuficiencia renal crónica (IRC) y la EAP no sólo tienen en común la aterosclerosis como sustrato anatomopatológico, sino que también comparten factores de riesgo como la diabetes, la hipertensión arterial (HTA) y el tabaquismo, y es probable que el control de esos factores de riesgo reduzca o enlentezca la progresión de ambas enfermedades. Esto explicaría una relación recíproca entre ambas entidades; es decir, los pacientes con función renal disminuida presentarán mayor incidencia y prevalencia de enfermedad arterial y al contrario, los enfermos con isquemia crónica de miembros inferiores deberían presentar más insuficiencia renal. Sin embargo, este último extremo ha sido poco analizado.
OBJETIVOS
Objetivo principal
Conocer la prevalencia de enfermedad renal crónica (ERC) definida por FGe < 60 ml/min/1,73 m2 en población mayor de 49 años con EAP.
Objetivo secundario
Analizar la relación de los pacientes con EAP e insuficiencia renal con los factores de riesgo cardiovascular clásicos y con la patología vascular a otros niveles.
MATERIAL Y MÉTODOS
Población y muestra
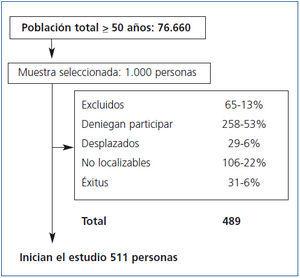
La población de estudio es la totalidad de los individuos con edad superior a 49 años (n = 76.660) residentes en la ciudad de Oviedo (Asturias), obtenidos a partir de la base de datos de tarjeta sanitaria individual. Con el fin de calcular la prevalencia de la EAP, se seleccionaron sobre la población inicial 1000 individuos por muestreo aleatorio simple. Esta cifra se prefijó con base a los siguientes supuestos: prevalencia estimada de 0,10 basada en otros estudios, con un error alfa de 0,05 y precisión deseada 0,03, lo que resultó en un tamaño muestral (453) que se incrementó en función de una previsión de pérdidas y no respuestas del 60%, de modo que se obtuvo un tamaño final de 996 individuos. Se excluyeron los enfermos terminales e inmovilizados. Se consideraron como pérdidas, y no fueron sustituidos, los fallecidos, los desplazados a otras localidades y los que expresaron su deseo de no participar en el estudio. El estudio fue aprobado por el Comité Ético de Investigación Clínica de Asturias.
El objetivo principal del estudio es verificar la relación de la EAP con la patología cardiovascular en población mayor de 49 años con un seguimiento a lo largo de 3 años. El presente trabajo es un subestudio para analizar si los pacientes con EAP que además tenían enfermedad renal crónica (ERC) mostraban un perfil de riesgo más desfavorable, tanto basalmente como durante el período evolutivo. Aquí se muestran los datos iniciales.
Registro de datos
Se elaboró un protocolo de recogida de datos demográficos (edad y sexo), clínicos (peso, talla, índice de masa corporal), presión arterial sistólica (PAS), diastólica (PAD), existencia de factores de riesgo cardiovascular (tabaco, dislipemia, HTA, diabetes, obesidad), patología cardiovascular (cardiopatía isquémica, insuficiencia cardíaca, accidente cerebrovascular, arteriopatía periférica), al igual que datos correspondientes al tratamiento de la hipertensión, dislipemia, diabetes y antiagregantes. A todos los sujetos se les realizó un electrocardiograma y una bioquímica general que incluyó las concentraciones séricas de glucosa, ácido úrico, creatinina, colesterol total, colesterol HDL, triglicéridos, fibrinógeno, proteína C reactiva y lipoproteína (a).
Para el diagnóstico de HTA se consideró la existencia de cifras de PAS > 140 mmHg y/o PAD > 90 mmHg, en tres visitas separadas, o bien en individuos que ya estaban recibiendo tratamiento dietético o farmacológico antihipertensivo. Las cifras de presión arterial corresponderán a las cifras promedio de tres medidas separadas entre sí por 2 minutos.
Se consideró fumadora a toda persona que hubiera consumido tabaco durante el último mes y exfumadora a aquella que, habiendo sido fumadora, no había fumado en el último año.
Aquellos sujetos con cifras de glucemia basal > 126 mg/dl en dos ocasiones, o bien con el test de tolerancia oral a la glucosa superior a 200 mg/dl a las dos horas, fueron considerados diabéticos, al igual que aquellos que ya recibían tratamiento antidiabético bien con insulina, bien con antidiabéticos orales.
Se consideró hipercolesterolemia si presentaban cifras de colesterol total superiores a 240 mg/dl en dos ocasiones separadas por un intervalo superior a 3 semanas, e hipertrigliceridemia si mostraban cifras de triglicéridos superiores a 200 mg/dl en dos ocasiones o si ya recibían tratamiento hipolipemiante.
Se consideró obesidad si el índice de masa corporal (peso en kilogramos dividido por la altura en metros al cuadrado) era igual o superior a 30 kg/m2.
En cuanto a la existencia de enfermedad cardiovascular, se incluyeron la cardiopatía isquémica, la insuficiencia cardíaca, el accidente cerebrovascular y el aneurisma de aorta abdominal si estaban documentados por ingreso hospitalario o por estudio especializado. No se realizó búsqueda activa de enfermedad cardiovascular subclínica (infarto lacunar, cardiopatía isquémica silente, etc.).
Para la determinación del ITB, cada sujeto permaneció en posición de decúbito supino durante 5 minutos y se obtuvo del cociente de la presión sistólica en tobillo (arteria tibial posterior) y en el brazo dominante (arteria humeral) y se calculó de forma separada para cada extremidad. Se utilizó un doppler de modelo unidireccional portátil Mini/Audio/Aqua/Dopplex® con transductor VP8 a 8 MHz. Se consideró que existía EAP si el índice era igual o inferior a 0,90.
Se utilizó la fórmula Modification of Diet in Renal Disease (MDRD) abreviada o modificada para estimar el FG y se aplicó el término de insuficiencia renal cuando éste era menor de 60 ml/min/1,73 m2,14,15. Los estadios de la ERC fueron los expuestos por las guías K/DOQI y se incluyeron las modificaciones sugeridas recientemente por Levey et al. y Tonelli et al.16,17.
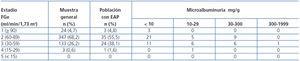
La albuminuria se determinó como cociente albúmina-creatinina (mg/g) en una muestra recogida por la mañana. Se clasificó como óptima para valores < 10 mg/g; normal-alta, 10-299 mg/g; alta, 30-299 mg/g; muy alta, 300-1999 mg/g, y nefrótica para cifras > 2000 mg/g.
Fórmula MDRD abreviada o modificada:
FG (ml/min/1,73 m2) = 186 x [creatinina plasmática (mg/dl)] – 1154 x (edad) – 0,203 x (0,742 si mujer) x (1,212 si raza negra).
Las variables cuantitativas se resumen en su media e IC del 95%. Las variables cualitativas se presentan con su distribución de frecuencias. Se evaluó la asociación de variables empleando el método de χ2 o prueba exacta de Fisher para el estudio de variables cualitativas y el test de la t de Student para las cuantitativas. En todos los casos los valores de la p < 0,05 se consideraron estadísticamente significativos. Para el análisis estadístico se utilizó el paquete informático SPSS 15.0.
RESULTADOS
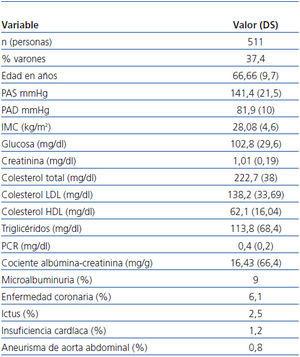
Iniciaron el estudio 511 personas (los motivos de exclusión se recogen en la figura 1) siendo el 37,4% varones, de 66,6 años de edad media. De la anamnesis inicial se concluyó que la prevalencia de HTA era del 31,2%, el 16,6% eran fumadores, el 7,8% presentaba diabetes y el 26,7% alteración del metabolismo lipídico. Los datos generales se describen en la tabla 1.
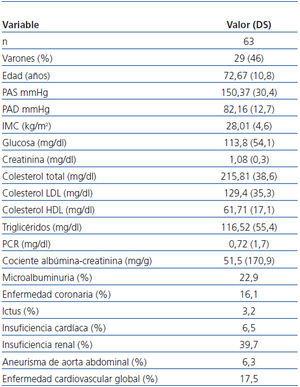
En total, 63 casos (12,4%) de la muestra mostraban EAP definida por ITB < 0,9. El 46% de los pacientes con EAP eran varones y de 72,6 años de edad media. Presentaban cifras medias ligeramente elevadas de PAS (150,3 mmHg), glucemia basal (113,8 mg/dl) y microalbuminuria (51,46 mg/g) Entre los factores de riesgo cardiovascular destacaban HTA (40,3%), dislipemia (24,2%), microalbuminuria (22,9%), hábito tabáquico (19,4%) y diabetes mellitus (12,9%). Incluimos en el apartado de microalbuminuria también a un paciente que presentaba cifras de excreción urinaria de albúmina superiores a 300 mg/g (tabla 2).
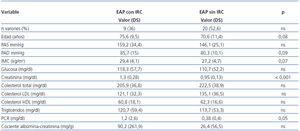
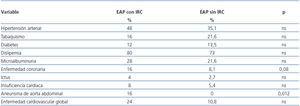
Un total de 25 (39,7%) pacientes con EAP mostraron un FGe < 60 ml/min/1,73 m2. La tabla 3 recoge la distribución por estadios según FGe y la excreción urinaria de albúmina tanto en la muestra general como en los pacientes con EAP. Los pacientes con EAP e insuficiencia renal eran de mayor edad, presentaban cifras más elevadas de PAS y PAD, glucemia basal, así como proteína C reactiva y excreción urinaria de albúmina, aunque ninguno de ellos mostraba diferencias significativas (tabla 4). En el grupo con IRC había una mayor prevalencia de aneurismas de aorta abdominal y tendencia a una mayor presencia de enfermedad coronaria, insuficiencia cardíaca y enfermedad cardiovascular global sin alcanzar significación estadística (tabla 5).
DISCUSIÓN
Se trata del primer estudio en nuestro país que analiza la prevalencia de IRC en población con EAP. En pacientes con EAP de edad ≥ 50 años la prevalencia de IRC definida por FGe por fórmula MDRD < 60 ml/min/1,73 m2 fue de 39,7%.
La prevalencia de EAP en nuestra población (12,4%) se corresponde con la de otros estudios poblacionales que utilizaron el criterio de ITB < 0,9. En el estudio de la National Health and Nutrition Examination Survey (NHANES 1999-2004) en población mayor de 60 años, la prevalencia fue del 12,2%, mientras que llegaba al 19,1% en un trabajo epidemiológico realizado en Holanda, pero en población general mayor de 55 años18,19. Sin embargo, en un reciente trabajo realizado en nuestro país en población también de edad mayor a 49 años asignada a 28 centros de salud, se describe una prevalencia de EAP del 7,6%, que se justifica por entender que España es un país con bajo riesgo cardiovascular según la tablas de riesgo internacionales20. Es difícil explicar esta diferencia de prevalencia, porque cuando comparamos ambas poblaciones observamos que en nuestro caso la edad (72,67 vs. 70,7 años), la prevalencia de HTA (40,3 vs. 11,9%), el tabaquismo (19,4 vs. 11,9%) y la hipercolesterolemia (24,2 vs. 10,2%) son muy superiores, pero ocurre lo contrario con la diabetes (12,9 vs. 17%), la obesidad (1,6 vs. 8,2%) y la enfermedad cardiovascular, especialmente el infarto de miocardio (6,1 vs. 29%) y el ictus (3,2 vs. 24%) que predominan en su muestra.
Casi el 40% de los pacientes con EAP padecen IRC, cifra superior al 29,7% del estudio EROCAP y al 35% del estudio de YP Liew, realizado en más de 1.000 pacientes21,22. La asociación de ambas enfermedades es muy frecuente. O’Hare analiza la prevalencia de EAP en 2229 personas mayores de 40 años estableciendo dos grupos según el FGe (mayor y menor de 60 ml/min/1,73 m2). La prevalencia de EAP en el grupo con función renal normal fue del 3,7% y alcanzó el 24% en aquellos cuyo FGe estaba disminuido, siendo la OR de 3,0 (IC 95% [1,7-5,3], p < 0,001), y de 2,5 (IC 95% [1,2-5,1], p = 0,011), tras ajustar factores de riesgo como colesterol, edad, HTA y enfermedad coronaria10. La misma tendencia se observa en un subanálisis del estudio ARIC, donde el riesgo relativo de desarrollar EAP comparando los pacientes con FGe > 90 ml/min/1,73 m2 y FGe ≤ 60ml/min/1,73 m2 fue del 1,04 (IC 95%, 0,91-1,18) y de 1,82 (IC 95%, 1,13-2,14) respectivamente12.
Analizando factores de riesgo conocidos y compartidos por estas dos entidades, se observó que el grupo de EAP con IRC estaba compuesto por gente de mayor edad, predominantemente mujeres (64%) y con todas las variables, a excepción del perfil lipídico, superiores a las de los pacientes con función renal normal. Los únicos parámetros que alcanzaron diferencias estadísticamente significativas fueron la creatinina plasmática y la proteína C reactiva. Varios trabajos realizados en pacientes con insuficiencia renal en estadios III, IV o V presentan resultados similares, en cuanto a prevalencia de factores de riesgo cardiovascular, a los obtenidos en nuestro trabajo23,24.
Las diferencias en la creatinina plasmática son lógicas por la relación de la creatinina con la función renal y es consistente con otros estudios, donde elevaciones de la creatinina plasmática se acompañan de incrementos en la incidencia de EAP21,25.
Las diferencias en el perfil lipídico pueden justificarse por la posibilidad de coexistencia de tratamiento farmacológico, dada la mayor prevalencia de dislipemia en pacientes con afectación renal.
La excreción urinaria de albúmina es superior en el grupo de pacientes con enfermedad renal [90,16 (261,9) vs. 26,36 (56,53)], aunque sin alcanzar significación estadística. La ERC se define no sólo por la reducción del FG, sino también por la presencia de daño renal persistente durante al menos 3 meses, determinado por métodos directos (biopsia renal) o de forma indirecta por la presencia de albuminuria o proteinuria, alteraciones en pruebas de imagen o en el sedimento urinario14. Baber describe que la asociación de la reducción del FG y de la microalbuminuria se relaciona con una elevada prevalencia de EAP y puede ser útil para identificar a un subgrupo con enfermedad vascular, aunque en nuestro caso no ha podido verificarse11.
En el presente estudio, se ha contabilizado por separado la prevalencia de cardiopatía isquémica, ictus e insuficiencia cardíaca, siendo todas ellas mucho más prevalentes en los afectos renales y vasculares concomitantemente, aunque muy inferiores a las cifras publicadas en otros estudios26,27.
No hemos encontrado referencias que analicen la asociación de aneurismas de aorta abdominal (AAA) en población con EAP e insuficiencia renal. Nuestros resultados pueden ser consistentes con los hallazgos de Nakamura et al. en un pequeño trabajo donde objetiva peor función renal en pacientes con AAA en comparación con población hipertensa, y de Barba et al., que documentan una prevalencia de AAA en población con EAP muy superior a la de la población general. Chue formula una hipótesis sugerente en la que considera que la ERC, además de estar relacionada con la enfermedad ateromatosa, incrementa la rigidez arterial por una serie de complejos procesos relacionados con la uremia, lo que unido a otros factores de riesgo, especialmente la HTA, podría asociarse con un riesgo incrementado de aneurismas. Sin embargo, la incidencia y la prevalencia de AAA en población con ERC es desconocida28-31.
La presencia de EAP es un signo de aterosclerosis generalizada y está asociada a una mayor morbimortalidad cardiovascular. Y también en este sentido, varios estudios poblacionales, algunos con seguimientos prolongados y correctamente diseñados, muestran la estrecha vinculación existente entre la función renal disminuida, evaluada por cifras de creatinina sérica o por FGe, y la morbimortalidad cardiovascular y total26,27. Cabe pensar, por tanto, que este grupo es una población diana a tratar para prevenir eventos cardiovasculares y para ello debe establecerse una estrategia de detección con objeto de encontrar a esta población en riesgo.
Desafortunadamente, los mecanismos exactos que contribuyen a la elevada prevalencia de IRC en pacientes con arteriopatía periférica son todavía desconocidos. Los factores de riesgo cardiovascular clásicos, muy prevalentes en pacientes con IRC, podrían contribuir etiológicamente al desarrollo de EAP, pero sólo explican una pequeña parte de esta asociación32. La lesión ateromatosa no se circunscribe a un solo territorio, sino que progresa tanto en extensión como en intensidad y así los pacientes con EAP tienen asociada con alguna frecuencia estenosis de la arteria renal como se describe en el trabajo prospectivo de Marin et al., de seguimiento de 418 pacientes que ingresaron en el hospital con EAP grave. Se objetivó estenosis no sospechada de la arteria renal en el 27% de los casos, con peor función renal y mayor prevalencia de cardiopatía isquémica. Es probable que, dado que comparten etiopatogenia, puedan coexistir diversos grados de nefropatía isquémica y nefroangioesclerosis que permitan explicar el descenso del FG33. No hemos investigado, porque excedía los objetivos del presente estudio, el papel que podrían jugar las alteraciones del metabolismo calcio-fósforo, especialmente en el subgrupo de pacientes con ERC y EAP, como causantes de mayor presencia de calcificación vascular y por ende de EAP y/o renal.
Distintos autores incorporan otros factores de riesgo menos tradicionales, y menos estudiados, como marcadores inflamatorios, incremento de lipoproteína (a), estrés oxidativo, disfunción endotelial e hiperhomocistinemia que podrían contribuir al desarrollo de ateroesclerosis en este tipo de pacientes32. A favor de esta teoría, en el presente estudio se encontraron cifras superiores de lipoproteína (a) y de proteína C reactiva en el primer grupo.
Este estudio presenta algunas limitaciones. En primer lugar, el tamaño muestral fue hasta cierto punto pequeño, adecuado para estimar la prevalencia de EAP pero probablemente insuficiente para encontrar diferencias estadísticamente significativas entre ambos grupos en lo que respecta a la distribución de factores de riesgo o enfermedad cardiovascular. En segundo lugar, el objetivo era medir la prevalencia de IRC en pacientes con EAP, y no lo contrario (prevalencia de EAP en pacientes con IRC), lo que dificultó la comparación con importantes estudios cuyo diseño no era coincidente. Por último, el carácter transversal del estudio, ya que las asociaciones no son prospectivas; impide establecer correctamente la relación causa-efecto entre EAP e insuficiencia renal o viceversa. Todas estas limitaciones, muy especialmente el tamaño muestral, sólo nos permiten aventurar la hipótesis de que la ERC en la población con enfermedad arterial supone un mayor riesgo cardiovascular que quizá podamos confirmar con los datos evolutivos del estudio.
La IRC está presente en casi el 40% de los pacientes con EAP. La presencia de una función renal disminuida no sólo obliga a tenerlo presente para ajustar y emplear adecuadamente numerosos fármacos, sino que la coexistencia de ambas enfermedades probablemente delimita un subgrupo de pacientes con elevado riesgo cardiovascular que podrían beneficiarse de un diagnóstico y tratamiento tempranos, por lo que son necesarios estudios que analicen en profundidad la relación entre ambas entidades.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Figura 1. Flujo de personas del estudio
Tabla 1. Datos generales de la muestra
Tabla 2. Características de los pacientes con enfermedad arterial periférica
Tabla 3. Distribución según estadios de enfermedad renal crónica por filtrado glomerular estimado y excreción urinaria de albúmina
Tabla 4. Comparación de las variables clínicas entre los pacientes con enfermedad arterial periférica con y sin insuficiencia renal asociada
Tabla 5. Prevalencia de factores de riesgo cardiovascular en pacientes con enfermedad arterial periférica con y sin insuficiencia renal asociada