INTRODUCCIÓN
El control de fósforo sigue siendo uno de los grandes retos con los que se enfrentan los nefrólogos1. Actualmente existe una amplia oferta de compuestos que disminuyen los niveles de fósforo en sangre, sin embargo, la búsqueda de mejores captores aún permanece abierta2, 3. Aunque el hidróxido de aluminio haya sido desaconsejado, su utilización permanece vigente en la práctica clínica habitual, e incluso las guías de práctica clínica para el metabolismo óseo y mineral aceptan la posibilidad de su uso con ciertas restricciones4.
La toxicidad por aluminio fue un problema grave de las unidades de hemodiálisis5. La primera vez que se relacionó el aluminio con toxicidad en pacientes en hemodiálisis fue en 19766, y este metal ha sido implicado en la demencia o encefalopatía de diálisis7, en la anemia microcítica sin déficit de hierro8, 9, en la osteomalacia10 y se ha considerado responsable de numerosas fracturas en diálisis11.
Casi todas las referencias bibliográficas sobre este tema se sitúan en las décadas de los 70 y 80, época en la que sólo existían los captores que contenían aluminio, y las exigencias en la calidad del agua tratada eran muy inferiores a las que existen actualmente12-15. Posteriormente, y de forma ocasional, se han comunicado intoxicaciones masivas que han cursado con la variante fulminante de encefalopatía por aluminio, secundarias a accidentes relacionados con el agua de hemodiálisis16.
El objetivo de este estudio es analizar la repercusión que ha tenido el tratamiento prolongado con bajas dosis de captores alumínicos en una población de pacientes que se dializan en una unidad con doble sistema de ósmosis inversa y niveles de aluminio en el líquido de diálisis inferiores a 2 microgramos/litro.
MATERIAL Y MÉTODOS
Se han estudiado 295 pacientes en hemodiálisis que se dializaron en nuestra unidad desde enero de 2005 hasta noviembre de 2007. Cuarenta y un pacientes recibieron captores alumínicos en este periodo. Los criterios para utilizar captores alumínicos fueron: mal control del fósforo y/o intolerancia o efectos secundarios con otros captores como sevelamer o captores cálcicos. El objetivo fue mantener unos niveles de fósforo sérico inferiores a 5 mg/dl.
Los niveles de fósforo, calcio, hemoglobina y volumen corpuscular medio (VCM) y dosis de estimulantes eritropoyéticos se midieron mensualmente. Los de PTH y ferritina cada 2 meses y los niveles séricos de aluminio cada 3 meses.
Antes de febrero de 2001 la planta de tratamiento de aguas constaba de una única etapa de ósmosis inversa. A partir de dicha fecha se instaló un doble sistema de ósmosis inversa en serie. La determinación de los niveles de aluminio en el líquido de hemodiálisis se realizó mensualmente antes y de después de la incorporación de dicho sistema.
Variables estudiadas
En los pacientes que fueron tratados con captores alumínicos se compararon las siguientes variables, antes de iniciado el tratamiento, a los 3 y a los 6 meses:
1. Dosis de otros captores: sevelamer, captores cálcicos.
2. Coste de cada tratamiento.
3. Parámetros de osteodistrofia: fósforo, calcio, PTH.
4. Parámetros de anemia: Hemoglobina, dosis de estimulantes eritopoyéticos, VCM e índice de resistencia a la eritropoyetina (IRE).
5. Los niveles séricos de aluminio.
Se comparó el nivel de aluminio sérico entre el grupo de pacientes que no recibió hidróxido de aluminio en el periodo estudiado con el que si lo recibió.
Se comparó la conductividad y el aluminio en el líquido de diálisis y el nivel sérico de aluminio en los pacientes que iniciaron hemodiálisis antes y después de la incorporación del doble sistema de ósmosis inversa en la unidad.
Análisis estadístico
El análisis estadístico de los datos se realizó mediante estadística básica descriptiva. Los resultados se expresan como media ± desviación típica. El ajuste de las variables a una distribución normal se realizó mediante el test de Kolmogorov-Smirnov. Las diferencias entre grupos se analizaron mediante la t-Student.
La asociación entre variables numéricas se estableció mediante análisis de correlación de Pearson. Se consideró estadísticamente significativa una p < 0,05.
RESULTADOS
Desde enero de 2005 hasta noviembre de 2007, doscientos noventa y cinco pacientes se dializaron en la unidad. La edad media era 65,7 ± 15,1 años y el tiempo medio en hemodiálisis fue 66,6 ± 85,7 meses. 62% eran varones. Cuarenta y un pacientes fueron tratados con captores alumínicos para el control del fósforo (13,8% de la población estudiada). El tiempo medio de tratamiento fue 17,8 ± 14,6 meses. La dosis media de hidróxido alumínico utilizado (pepsamar® 233 mg) fue 3,9 ± 2,29 comprimidos al día, o que supone un total de 463 g de aluminio recibido como media en el periodo estudiado.
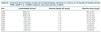
En la tabla I se muestran los resultados obtenidos antes, a lo 3 y los 6 meses de la introducción del hidróxido de aluminio, respecto al control del fósforo y el uso de otros captores.
El tratamiento con hidróxilo de aluminio supuso un coste medio de 2,34 euros/paciente/mes (pepsamar 233 mg®: 0,02 euros por comprimido) frente a los 220,8 euros/paciente/mes del sevelamer (Renagel 800 mg®: 0,92 euros por comprimido) o los 6,57 euros/paciente/mes de los captores cálcicos (Royen® 500 mg: 0,07 euros por comprimido). El coste global por quelantes descendió en 69,8 euros/mensuales tras añadir pepsamar®, con un mejor control del fósforo. Tras el tratamiento con hidróxido de aluminio el porcentaje de pacientes con fósforo < 5 mg/dl pasó de 4,9% a 73,2% del grupo tratado.
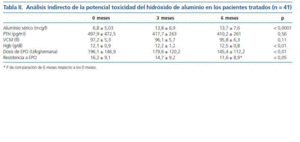
La tabla II muestra el análisis indirecto de la potencial toxicidad del hidróxido de aluminio. 5 pacientes (12,1%) alcanzaron unos niveles de aluminio superiores a 20 microgramos/l, y en ningún caso este valor alcanzó los 40 microgramos/l.
La media de los niveles de aluminio sérico durante el periodo de estudio fue significativamente más alta en los pacientes que recibieron tratamiento con captores alumínicos (11,6 ± 6 mcg/l) que el grupo no tratado (8,7 ± 4,8 mcg/l) (p < 0,01).
Desde febrero de 2001 se instaló un doble sistema de ósmosis inversa en serie en la unidad. La conductividad en el agua tratada, el aluminio en el líquido de diálisis y el aluminio sérico medio de la unidad descienden de forma llamativa a partir de esa fecha (tabla III).
Los niveles de aluminio sérico fueron significativamente superiores en el grupo de pacientes que inició hemodiálisis antes de la introducción del doble sistema de ósmosis inversa en el tratamiento del agua en 2001 (N = 77) (13,06 ± 7,13) frente a los que se incorporaron a la unidad en fechas posteriores (N = 189) (8,54 ± 6,07) (p < 0,0001).
Los niveles séricos de aluminio al final del estudio en los pacientes tratados se correlacionó significativamente con el tiempo de tratamiento con hidróxido de aluminio (r: 0,41; p < 0,01) y con los valores de aluminio sérico antes de recibir tratamiento (r: 0,58; p < 0,0001).
DISCUSIÓN
Los principales hallazgos de este estudio son:
1. La asociación de captores del fósforo alumínicos a dosis bajas permitió un mejor control del fósforo, con una reducción en las dosis de otros fármacos.
2. El tratamiento de la hiperfosforemia con hidróxido de aluminio es un tratamiento más coste-efectivo que otros captores: se consigue un mejor resultado a un menor coste.
3. Los niveles de aluminio sérico aumentaron tras el tratamiento con hidróxido de aluminio, y se mantuvieron estables en un nivel medio de alrededor de 13 microgramos/l a lo largo de todo el periodo de estudio. No se observaron signos indirectos de toxicidad sobre el VCM, la hemoglobina ni la PTH, y se observó un descenso en el IRE.
4. La media de los niveles de aluminio en sangre descendió tras la instalación de un doble sistema de ósmosis inversa, junto al descenso en la conductividad del agua de hemodiálisis y en los niveles de aluminio en el líquido de diálisis a < 0,002 microgramos/l. Asimismo, el nivel de aluminio sérico de los pacientes que se incorporaron a la unidad a partir del cambio en la planta de tratamiento de agua, fue significativamente inferior a los que se habían dializado en la unidad antes de dicha fecha.
Las sales alumínicas fueron el primer quelante del fósforo que apareció, hace ya más de 30 años. Sin embargo, a pesar de su alto poder de unión al fósforo, han sido denostados al condicionar numerosas complicaciones derivadas del acúmulo de aluminio en diferentes tejidos2-7. Las guías que recomiendan un uso restrictivo de los captores alumínicos se han basado en las experiencias de toxicidad obtenidas con este compuesto16. Estas experiencias datan de la etapa en la que el hidróxido de aluminio era el único captor del fósforo comercializado, lo que obligaba a dar elevadas dosis de este compuesto, y en la que la comunidad nefrológica no era tan consciente de la necesidad de disponer de adecuados sistemas de tratamiento de agua. Por tanto la vía de aporte de aluminio era doble: enteral y parenteral.
En nuestro estudio observamos que los niveles séricos de aluminio aumentaron tras la introducción del hidróxido de aluminio, y que los niveles de aluminio sérico del grupo tratado eran significativamente superiores a los del grupo que no recibió aluminio. Sin embargo, solo 5 pacientes (12,1%) alcanzaron un nivel sérico de aluminio superior a 20 microgramos/l, valor considerado por las guías KDOQI como el nivel máximo permitido16. El tiempo medio de tratamiento fue 17 meses, superior al recomendado por las KDOQI (3 meses)16, sin observar un aumento significativo de aluminio sérico a lo largo del tiempo; y sin observar signos indirectos de toxicidad sobre hueso o anemia, ante los niveles de hemoglobina, volumen corpuscular medio ni PTH en nuestros pacientes.
Una limitación de este estudio es que la sobrecarga de aluminio se ha medido indirectamente a través de la determinación periódica de aluminio sérico, y no se han utilizado biopsias óseas o encefalogramas. Durante años se han desarrollado estrategias de validación que, si bien no dan una seguridad del 100%, permiten inferir el riesgo de toxicidad por aluminio a distintos niveles. De hecho, se ha descrito que un aluminio sérico de 60 microgramos/l tiene un valor predictivo de 73% en el diagnóstico de enfermedad ósea relacionada con el aluminio17. Es llamativo como el nivel sérico de aluminio en los pacientes tratados con captores alumínicos es muy inferior a esta cifra, por lo que cabría esperar que la toxicidad a nivel de tejidos sea mínima o prácticamente inexistente. No obstante, sería interesante realizar un estudio con biopsias óseas en estos pacientes, para determinar la repercusión exacta a nivel óseo que tiene este tratamiento en estas circunstancias. En un trabajo publicado por Smith y cols.18, el 50% de una muestra de 97 pacientes en tratamiento renal sustitutivo mostraban depósitos de aluminio en la biopsia ósea, sin embargo eran pacientes que habían estado expuestos a dosis muy superiores de aluminio tanto en agua de hemodiálisis (media de 2,35 microgramos/l tras la ósmosis inversa, y previamente 342 microgramos/l frente a < 0,002 microgramos/l en nuestro estudio), como oral en forma hidróxido de aluminio (media de 5,93 g diarios frente a los 0,98 g diarios en nuestros pacientes). La dosis de aluminio acumulativa de aluminio oral también fue muy superior en el grupo de Smith, incluso en los pacientes sin toxicidad alumínica (2,59 kg) frente a nuestro grupo (0,463 kg). Estas cifras son similares a las descritas en otros trabajos que también muestran aluminio en la biopsia ósea, y en todos ellos las cifras de aluminio sérico están considerablemente más elevadas que en nuestro estudio, siendo en todos ellos superiores a 60 microgramos/l19, 20.
Una consideración importante a tener en cuenta es evitar el hidróxido de aluminio en los grupos de pacientes con mayor riesgo de sobrecarga, como los niños, diabéticos, paratiroidectomizados, trasplantados que regresan a diálisis, sujetos con déficit de hierro, especialmente aquellos en tratamiento con eritropoyetina21 y los que reciben tratamiento con citrato22, ya que aumenta la absorción del aluminio. Se han descrito mayores niveles séricos de aluminio en pacientes con bajos niveles de ferritina sérica y/o saturación de la transferrina, probablemente como consecuencia de un incremento en la absorción de aluminio a nivel intestinal y/o a un mayor número de receptores disponibles para el aluminio sobre la transferrina 11, en nuestro estudio todos los pacientes tratados tenían niveles de ferritina e índice de saturación de la transferrina superiores a 150 mg/dl y 20%, respectivamente.
Por otra parte, una cuestión fundamental para tratar con captores alumínicos en hemodiálisis es asegurar una calidad de agua adecuada10. Concentraciones de aluminio tan bajas como 5 microgramos/l pueden provocar una acumulación lenta de este elemento ya que esta concentración sería suficiente para crear un balance positivo de aluminio23. Es por esto que se recomienda que la concentración de aluminio en el líquido de diálisis sea inferior a 1 microgramo/l10, 16. En nuestra unidad la concentración de aluminio en el líquido de diálisis ha sido siempre inferior a 2 microgramos/l, nivel mínimo de detección en nuestro laboratorio, y en una determinación realizada de forma aleatoria en el líquido de diálisis en un laboratorio con un nivel de detección mayor fue < a 1 microgramos/l.
Resulta interesante la evolución paralela que han seguido los niveles de aluminio en el líquido de diálisis, la conductividad del agua y los niveles séricos de aluminio tras la instalación del doble sistema de ósmosis inversa, similar a la encontrada por otros grupos24. De hecho, los niveles de aluminio fueron significativamente superiores en aquellos pacientes que se dializaban en la unidad antes de su instalación frente a los que se incorporaron a la unidad en fechas posteriores (< 0,0001). Un grupo italiano comunicó un descenso significativo en las cantidades de aluminio óseo, a pesar de mantener cantidades similares de aporte oral de aluminio en forma de captores, atribuyendo este hecho a la disminución en la cantidad de aluminio contenido en el líquido de diálisis, lo que confirmaría el papel fundamental que juega el aporte parenteral en el acúmulo de aluminio en pacientes en hemodiálisis25.
En España, el porcentaje de centros con una concentración de aluminio en el líquido de diálisis inferior a 2 microgramos/l se incrementó desde 1990 a 1999; y casi un 70% tenían niveles indetectables de aluminio (< 1 microgramo/L)26. El doble sistema de ósmosis inversa permite obtener esas cifras y, de alguna manera, supone un mecanismo más de seguridad de cara a prevenir posibles accidentes por aporte inadecuado de aluminio en el agua de red. El agua se puede contaminar con aluminio cuando se utiliza sulfato de aluminio como agente de sedimentación en el tratamiento de las aguas municipales, práctica habitual en muchos lugares. La cantidad de sulfato de aluminio añadida al agua aumenta en las épocas en las que hay mayor concentración de partículas suspendidas en el agua, bien en épocas de sequía o lluvias torrenciales, situación que habitualmente no es comunicada a los centros de diálisis.
Se ha demostrado que la hiperfosfatemia es un importante factor de riesgo de mortalidad en los pacientes en hemodiálisis27. Uno de los principales obstáculos para su exitoso manejo en la enfermedad renal crónica radica en la no adherencia al tratamiento con captores del fósforo. Aunque desde la década de los 90 disponemos de nuevos captores, la realidad es que todavía no ha surgido ese tratamiento ideal: potente, económico y bien tolerado, y nos vemos obligados, en algunos casos, a utilizar captores que contienen aluminio. Las sales de calcio en forma de carbonato y acetato son efectivas, pero las evidencias actuales sugieren que altas dosis pueden aumentar la carga corporal total de calcio, con el consiguiente riesgo de calcificación cardiovascular y de tejidos blandos28. Es por esto que las guías KDOQI limitan la cantidad de calcio suministrada en forma de captores a menos de 1.500 mg/día16, lo que contribuye también a asociar captores de otro tipo para lograr conseguir el objetivo. Sevelamer CLH no tiene absorción sistémica y no aporta calcio ni metales; pero su poder de unión al fósforo es menor, requiere un número de comprimidos considerable y el coste de tratamiento es muy elevado29; además puede producir acidosis metabólica14. Resulta interesante el efecto colateral observado sobre el IRE, que desciende tras el tratamiento con hidróxido de aluminio. Este efecto es posible que esté relacionado con un descenso de la PTH, como consecuencia de un mejor control sobre el fósforo, cuestión que ya ha sido descrito en otras publicaciones30. Sin embargo en nuestro estudio no pudimos encontrar relación entre ambas variables (datos no mostrados), quizá por el escaso número muestral o por un corto periodo de seguimiento.
Así, por el momento, la asociación de varios captores es una de las opciones terapéuticas más utilizadas31 con el fin de minimizar en lo posible los efectos secundarios de cada uno de ellos y, en ese escenario, los ligantes del fósforo alumínicos se ha mostrado efectivos, económicos y, actualmente, con un aparente mejor perfil de seguridad que en épocas previas. En nuestra experiencia, al poner en la balanza el riesgo de una hiperfosfatemia mantenida ante una hipotética afectación ósea por aluminio, sólo utilizamos este tipo de captores del fósforo en aquellos casos en los que no se consigue un adecuado control del fósforo con los otros ligantes, bien por intolerancia o por no adherencia al precisar altas dosis de los otros fármacos, siempre en asociación con otros fármacos, y nunca a dosis superiores a la descrita en este estudio. Aún así hay que ser prudentes en su uso evitando las poblaciones de riesgo anteriormente descritas, y seguir una estricta vigilancia del aluminio sérico de los pacientes y del líquido de diálisis.
Es posible que el futuro esté en el carbonato de lantano, un potente y selectivo captor del fósforo, que próximamente se comercializará en España, que quizá consiga aumentar la adherencia al tratamiento al requerir un menor número de comprimidos para obtener el mismo efecto, y en el que se tienen depositadas muchas esperanzas32.
Tabla 1.
Tabla 2.
Tabla 3.