INTRODUCCIÓN
El trasplante renal de donante vivo ofrece mejores resultados que el trasplante renal de donante cadáver. Esta afirmación ha sido recogida ampliamente por la literatura médica, especialmente por la que se basa en los grandes registros de pacientes. En el estudio europeo, Opelz y cols.1 (Collaborative Trasplant Study) llegan a la conclusión de que la mayor supervivencia de los injertos renales se consigue con los gemelos univitelinos, seguido del donante vivo haploidéntico y finalmente la peor supervivencia se consigue con el trasplante renal de donante cadáver.
El Registro de la UNOS también muestra resultados parecidos, la supervivencia de paciente e injerto a 5 años es 80,7% y 65,7% para el trasplante renal de donante cadáver, siendo de 90,1% y 78,6% para el trasplante renal de donante vivo2. Estudios previos3 realizados con datos del RMRC con la misma metodología univariada, obtuvieron resultados similares.
A pesar de que los citados estudios se basan en grandes series, no queda claro que las diferencias encontradas puedan ser atribuidas en exclusiva a la mejor calidad del injerto de donante vivo. De hecho, en un estudio previo4, realizado con otra metodología, encontramos que al ajustar por determinados factores se igualaban las supervivencias del paciente y del injerto.
El objetivo de nuestro trabajo es estudiar cuáles son los factores que determinan los mejores resultados obtenidos en el trasplante de donante vivo respecto del de donante cadáver en los estudios univariados.
PACIENTES Y MÉTODOS
Se analizan todos los primeros trasplantes renales realizados en Cataluña en el período 1990-2004 en pacientes mayores de 17 años, 135 pacientes recibieron un trasplante de donante vivo y 3.831 de donante cadáver. Por falta de información en alguna de las variables se han excluido 171 casos (4,3% del total). Los datos proceden del Registre de malalts renals de Cataluña (RMRC), que es un registro de base poblacional y de cumplimentación obligatoria, que recoge información de todos los pacientes con insuficiencia renal terminal (IRT), tratados en diálisis o con un trasplante renal, en centros públicos o privados de Cataluña.
Las variables analizadas fueron la edad y el sexo del receptor y del donante, la enfermedad renal primaria, los antecedentes en cuanto a comorbilidad (diabetes, enfermedad isquémica del corazón, cardiomiopatía, arritmia, enfermedad cerebro-vascular, enfermedad vascular periférica, EPOC, tumores malignos, artropatía, enfermedad crónica del hígado, enfermedades del esófago, estómago y duodeno y enfermedades intestinales), el tiempo previo de diálisis, el año del trasplante, el porcentaje máximo y el último de anticuerpos (PRA máximo y último), las identidades HLAA, B y DR, las horas de isquemia fría y la necrosis tubular aguda.
La enfermedad renal primaria (ERP) se agrupó en tres categorías utilizando la codificación del Registro de la European Renal Association- European Diálisis and Transplant Association (ERA-EDTA)5 (Apéndice 1).
El RMRC recoge la información de comorbilidad de todos los pacientes mediante los cuestionarios habituales de notificación y de seguimiento anual en los que figuran, entre otras, preguntas específicas relativas a 13 patologías agrupadas según los códigos de la Clasificación Internacional de Enfermedades (CIE-9) (Apéndice 2).
Para el análisis descriptivo se presentan los datos de las variables cuantitativas con la media y la desviación estándar (M ± DS) y con porcentajes para las categóricas. En la comparación de medias se ha utilizado el test de la t-Student y en la de proporciones el test de la x2. Para el análisis de la supervivencia se ha utilizado el método actuarial. Se ha evaluado el nivel de significación estadística entre las diferentes curvas con la prueba de Gehan test. En el análisis multivariado, se aplicó la regresión de Cox. La significación estadística de los riesgos relativos estimados se ha determinado con el método de la máxima verosimilitud y la prueba de x2. En la construcción del modelo multivariado, se excluyeron, una a una, todas las variables que no mostraban significación estadística excepto cuando la variable en cuestión había mostrado diferencias en su distribución entre los pacientes con TRV y TRC.
Otro indicador estudiado para valorar el funcionamiento del injerto fue la depuración estimada de la creatinina. El problema para analizar este indicador radica en que cambia a lo largo del tiempo y que, en caso de pérdida del injerto y dejar de tener determinaciones, se produce un sesgo de selección. Así pues, cualquier análisis longitudinal con este indicador debe tener en cuenta, por un lado su evolución en el tiempo, y por otro el efecto que sobre el mismo tienen los casos con pérdida del injerto o defunción.
Anualmente, el RMRC recoge información de la creatinina y el peso de todos los enfermos con un trasplante funcionante. Con estos datos se ha aplicado la fórmula de Cockroft-Gault6 que permite obtener la depuración estimada de creatinina anual para cada paciente. Se ha utilizado el Selwood Análisis modificado7, donde el tiempo cero corresponde al momento del trasplante y se muestra para cada intervalo de tiempo, la distribución porcentual de las diferentes agrupaciones de filtrado glomerular estimado de los pacientes con un trasplante funcionante junto al porcentaje de pacientes con fracaso del injerto y el porcentaje de pacientes fallecidos. Debido a las características de este tipo de metodología y al bajo número de casos de TRV, los análisis sólo pueden ser bivariados.
En los análisis se ha utilizado el paquete estadístico SPSS, 12.01.
RESULTADOS
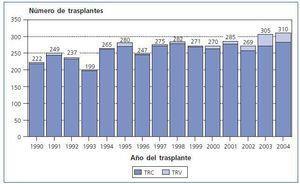
En la figura 1 se puede observar la evolución en el número de trasplantes renales realizados según el tipo de donante a lo largo del periodo estudiado.
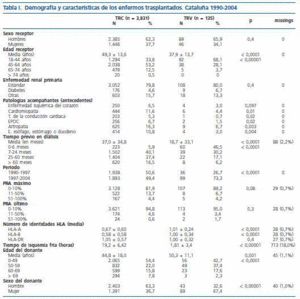
La tabla I muestra las diferencias encontradas entre los TRC y los TRV. Los sujetos que reciben un TRV son más jóvenes (11 años de media), padecen menos cardiomiopatía, trastornos de la conducción cardíaca, EPOC, artropatía y enfermedades digestivas que los que reciben un TRC. No se observan diferencias en cuanto al sexo, a la ERP ni a los siguientes antecedentes patológicos: AVC, enfermedad vascular periférica, tumores malignos, diabetes (no ERP), enfermedad crónica del hígado y enfermedades del intestino. Los pacientes que reciben un TRV, han estado menos tiempo en TSR (la mitad en promedio). Los TRV poseen más identidades HLA entre donante y receptor que los TRC, aunque éstas se limitan a las identidades HLA-A y HLA-B, ya que no se encuentran diferencias en el número de identidades HLA-DR. Tampoco existen diferencias significativas en la proporción de enfermos hipersensibilizados, independientemente que observemos el PRAmáximo o el último. Existe una mayor proporción de mujeres entre los donantes vivos, así como una mayor proporción de donantes de entre 50 y 59 años. El tiempo de isquemia fría es sustancialmente diferente en ambos tipos de trasplante, situándose la media alrededor de las 20 horas para los TRC y en menos de 2 horas para los TRV. Para los TRC, la mitad de los donantes murieron de AVC.
Se han estudiado dos indicadores de resultado: la supervivencia del injerto y la estimación del filtrado glomerular. Se ha realizado un análisis univariado y multivariado para el análisis de la supervivencia del injerto.
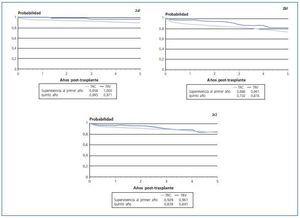
Se ha realizado un primer análisis univariado de supervivencia del paciente, del injerto y del injerto censurando los pacientes que murieron. Los resultados se muestran en la figura 2. Estos datos muestran que, teniendo en cuenta únicamente el tipo de trasplante recibido, los pacientes que reciben un trasplante de donante vivo tienen una mejor supervivencia y su injerto tiene mejores resultados que los que lo reciben de un donante cadáver (p = 0,016 y p = 0,047, respectivamente). Analizando la supervivencia del injerto censurando los pacientes que murieron, las diferencias dejan de ser significativas (p = 0,67).
En la tabla II se pueden observar los resultados obtenidos en el análisis de la regresión de Cox, en el que se compara la supervivencia del injerto según el tipo de donante, TRV o TRC, y ajustando por las variables que pueden influir en la misma. Al ajustar por todos estos factores las diferencias observadas en el análisis anterior desaparecen. La regresión de Cox muestra, como factores que incrementan el riesgo de pérdida del injerto, el incremento de la edad del receptor y del donante, la diabetes como enfermedad renal primaria, determinada comorbilidad (trastornos de la conducción cardíaca, EPOC, diabetes y enfermedad crónica del hígado), el incremento en el tiempo de diálisis y los pacientes hipersensibilizados (porcentaje de anticuerpos máximo > 50%). Disminuye el riesgo el mayor número de identidades HLADR y el hecho de haber recibido el trasplante en el período más reciente. En el modelo se han incluido otras variables de ajuste (sexo del donante, número de identidades HLA-A, HLA-B, y determinada comorbilidad) que a pesar de no ser estadísticamente significativas, se han mantenido porque tal como se observa en la tabla I, mostraban diferencias en las poblaciones que recibieron los diferentes tipos de trasplante.
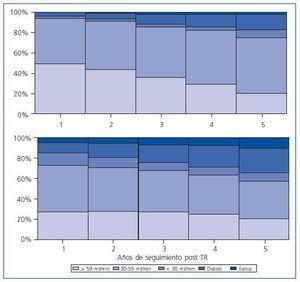
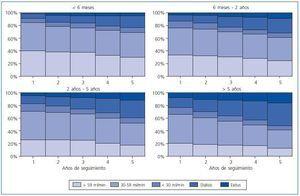
Los datos de estimación del filtrado glomerular según el Selwood análisis modificado5 se presentan en formato de gráfico (figs. 3 y 4). En la figura 3 se muestra la evolución en el tiempo de los distintos niveles del filtrado glomerular y la proporción de pacientes que han fallecido o han vuelto a diálisis, para los pacientes que han recibido un trasplante procedente de donante cadáver y para los que lo han recibido de un donante vivo. Los pacientes que han recibido un trasplante de donante vivo tienen mejor supervivencia del paciente y del injerto, la mortalidad del paciente es prácticamente nula. Los filtrados glomerulares, en general también son mejores. También se presentan los datos del filtrado glomerular en función del tiempo previo en TSR en la figura 4. Conforme aumenta el tiempo previo en TSR empeoran los filtrados glomerulares y la supervivencia de los pacientes como también aumenta el porcentaje de pacientes que vuelven a diálisis. La mortalidad a los 5 años para los pacientes con menos de 6 meses de diálisis previa es un tercio de la de los pacientes con tratamientos superiores a 5 años, mientras que los pacientes con un buen filtrado glomerular (> 59 ml/min) es casi tres veces mayor (29% vs 12,5%), las diferencias no son tan importantes en otras categorías: para un filtrado entre 30 y 59 ml/min es de 40% vs 28% y el porcentaje de pacientes de nuevo en diálisis 18% vs un 35%; el porcentaje más estable a los 5 años en todos los grupos de estudio es el de los que tienen un mal filtrado glomerular, que se sitúa alrededor del 7%.
DISCUSIÓN
Los datos presentados proceden del RMRC que es un registro poblacional y obligatorio que recoge información de todos los pacientes que reciben TSR en Cataluña. En 1988 se realizó una validación externa que mostró una notificación exhaustiva de las variables relevantes, así como una excelente concordancia. Estos resultados verificaron la validez de los datos para su uso en estudios clínicos y epidemiológicos. En 1990 el RMRC se convirtió en registro local de la EDTA y a partir de 1998 colaborador del Colaborative Transplant Study (CTS).
No hemos observado diferencias en los resultados obtenidos por el TRC y el TRV al ajustar por todos los factores que afectan a la supervivencia del injerto, a pesar de que en los análisis univariados se observan unos mejores resultados de los TRV.
Según distintos estudios8,9, existen diversos factores que podrían contribuir a explicar la mejor supervivencia y filtrado glomerular de los TRV. Alguno de estos factores se ha mostrado relevante también en nuestro análisis, como es el caso de la mejor compatibilidad HLA, la menor edad del receptor y el menor tiempo en diálisis de los TRV.
Por lo que respecta a la compatibilidad HLA, en el TRV, debido a que la mayoría de donantes se seleccionan dentro del ámbito familiar, podemos obtener un mayor número de identidades HLA, y en algunas ocasiones, incluso podemos obtener trasplantes entre hermanos idénticos, los cuales van a ser los de mejor pronóstico2,10. Sin embargo esta tendencia puede cambiar ya que cada vez es más habitual el trasplante entre parejas.
Sin duda, la edad del receptor es un factor de gran importancia en los resultados del trasplante2. Apesar de haber seleccionado únicamente pacientes adultos (> 17 años), en el TRV la diferencia de edad entre el donante y el receptor es muy importante, debido a que habitualmente los donantes son los padres del receptor. En nuestro estudio, la media de edad de los receptores de TRV es 11 años menor que la de los TRC, y los donantes de TRV son 5 años mayores que los de TRC. Cuando el receptor llegaba a determinadas edades, encontrar un donante vivo adecuado entre su familia biológica era más difícil. De nuevo, esto puede cambiar con la donación entre parejas. Hay que tener en cuenta, además, que el aumento de la edad, en donante y receptor, está asociado al aumento de la patología asociada, que también es un factor de riesgo para la supervivencia del trasplante.
El trasplante previo a la diálisis proporciona mejores resultados tal y como ha demostrado Meier-Kriesche en numerosas publicaciones11-14. El aumento de la supervivencia de injerto y de paciente se ha constatado tanto en receptores de donante vivo como de donante cadáver. A consecuencia del bajo número de casos, en nuestro estudio no hemos podido establecer un grupo de análisis de pacientes con un trasplante previo a la diálisis, aún así nuestros resultados también confirman que conforme aumenta el tiempo de diálisis previo al trasplante empeoran los resultados obtenidos, tanto de supervivencia del injerto (ajustando por todos los factores relevantes), como la estimación del filtrado glomerular. La gran ventaja del trasplante de donante vivo es que permite rebajar e incluso eliminar el tiempo previo en diálisis de los pacientes con IRT susceptibles de ser trasplantados. En nuestro estudio, los TRC han pasado, de media, 37 meses en diálisis antes de acceder al trasplante, aunque, gracias a las elevadas tasas de donación de nuestra comunidad15 en estos 15 años que abarca el estudio se ha conseguido reducir en casi un año y medio (de 50 meses a 33) el tiempo medio en diálisis de los pacientes que han recibido un primer trasplante. El acceso de determinados enfermos a un TRV no sólo mejora sus propios resultados, sino que contribuye a disminuir el número de enfermos en lista de espera16 y por tanto el tiempo que estos pasan en diálisis, mejorando de forma global los resultados de todos los trasplantes realizados.
En la literatura se mencionan otros factores relacionados con los mejores resultados de los TRV, tales como el estudio más extenso del donante vivo, la inmunosupresión anticipada del TRV, la ausencia de fenómenos asociados a la muerte cerebral del donante cadáver (lesiones de isquemia reperfusión) o que el tiempo de isquemia fría es menor. Por diferentes motivos, no hemos podido validar dichos factores.
El trasplante renal de donante vivo permite la colocación del implante con un tiempo de isquemia fría mucho más corto que el de donante cadáver. En nuestra serie, no hemos podido introducir esta variable en el modelo debido al gran número de casos no informados (18% de los trasplantes), aún así, con los casos informados, los tiempos medios de isquemia fría fueron de 1,5 horas para el donante vivo y 18 horas para el donante cadáver. La isquemia fría ha sido también relacionada en numerosas publicaciones con los resultados del trasplante renal17. Otra de las ventajas de la donación de vivo, al poder planificar el trasplante, es el hecho de poder tener inmunosuprimido al receptor desde unos días antes del trasplante. Ello contribuiría a disminuir las posibilidades de rechazo agudo del injerto18,19.
Los injertos procedentes de donante vivo no sufren la muerte cerebral y los fenómenos intrínsecos a la misma20. Numerosos estudios21,22 demuestran que la muerte cerebral es un factor de riesgo independiente de mala evolución del injerto. La muerte cerebral libera citoquinas que ejercen efectos en la adhesión y migración leucocitaria. Ello predispone a las lesiones de isquemia reperfusión y facilita el rechazo agudo. Por otro lado, el edema cerebral ocasiona compresión venosa y ésta, liberación de catecolaminas que causan vasoconstricción y lesión endotelial. La lesión endotelial aumenta la expresión de antígenos de clase II y liberación de citoquinas que aceleran los procesos de rechazo del injerto. Paralelamente, la muerte cerebral ocasiona necrosis hipofisaria y diabetes insípida (75%), puede causar hipovolemia y lesiones secundarias a la propia muerte cerebral. La lesión hipotalámica causa disfunción térmica (coagulopatía, hipoxia, disfunción hepática y cardíaca).
El donante vivo, a diferencia del donante cadáver, puede ser estudiado extensamente a lo largo de meses para determinar detalladamente su idoneidad o no. Al mismo tiempo, al donante vivo se le escoge, en numerosas ocasiones, entre varios miembros de una misma familia (el mejor donante posible de entre los disponibles) con lo cual el proceso de selección es distinto al del donante cadáver (es apto o no). En este caso, una vez finalizado el riguroso proceso que determina que el riñón es apto para el trasplante, se busca al mejor receptor posible de entre los pacientes en lista de espera. Cuando se acepta un donante cadáver con patología asociada (hipertensión arterial, diabetes...) se valora que la posible afectación del injerto renal sea mínima o inexistente al objeto de no transmitir lesiones importantes al receptor que condicionen la supervivencia del injerto; mientras que en el caso del donante vivo, ante lesiones menores en el injerto, se impide la donación para evitar que la patología de base del donante pueda ocasionarle lesiones irreversibles en el riñón residual que puedan llevarle en el futuro a la necesidad de diálisis y/o trasplante renal23.
Estos últimos factores, intrínsecos a la donación de vivo, y que no hemos podido introducir como variables dentro del modelo, deberían haber quedado reflejados en el análisis multivariante, mostrando un mejor resultado de los TRV respecto del TRC, sin embargo no hemos observado diferencias significativas entre ambos tipos de tratamiento.
Las limitaciones de este trabajo son las propias de los estudios realizados con datos procedentes de un registro poblacional, en el que las variables utilizadas son pocas y de baja especificidad clínica, aunque de gran solidez.
Otra limitación relacionada con la fuente de los datos, es la ausencia de determinadas variables que podrían ser relevantes como factores pronósticos de la supervivencia del injerto, como el tiempo de isquemia fría o la NTA, que a causa del elevado número de casos no informados no se han podido analizar.
El bajo número de TRV realizados así como su distribución en el tiempo (sólo un 26% de los TRV se efectuaron en el periodo 1990-97), provoca diferentes tiempos de seguimiento y pautas inmunosupresoras. Para solventar este problema se introduce la variable «Periodo» en el análisis multivariado. De la misma manera que se intenta solucionar el problema de la distinta distribución etaria entre los receptores de TRC y TRV.
CONCLUSIONES
Al igual que ocurre con las grandes series de trasplantados renales, el RMRC objetiva que, globalmente y sin ningún tipo de ajuste, el trasplante renal de donante vivo presenta mejores resultados de supervivencia de paciente e injerto que el trasplante renal de donante cadáver. Cuando estudiamos los factores más relevantes para explicar los mejores resultados del TRV obtenemos que los más determinantes son la menor edad del receptor y el inferior tiempo en diálisis. Tanto uno como otro factor han demostrado en numerosas publicaciones que tienen una gran influencia sobre la supervivencia del paciente trasplantado renal, condicionando la diferencia en las supervivencias obtenidas. Concluimos que, una vez ajustado el análisis por los diferentes factores que intervienen en la supervivencia del paciente y del injerto, no existen diferencias en los resultados obtenidos por los dos tratamientos, ya que los mejores resultados del TRV son debidos a factores como la menor edad del receptor y el TR anticipado que, permiten mejorar las expectativas de supervivencia y funcionamiento del TR. Además la realización de TRV, permite reducir las listas de espera globales de TR con la consecuente mejora de resultados globales.
APÉNDICE 1. AGRUPACIÓN DE LOS CÓDIGOS DE ERP
ERP estándar: códigos 00-66.
Nefropatía diabética: códigos 80-81.
Otras ERP: códigos 70-79 y 82-99.
APÉNDICE 2. MORBILIDAD AGRUPADA SEGÚN CÓDIGOS DE LA CIE-9
Enfermedad del corazón: códigos 410-414.
Cardiomiopatía o insuficiencia cardíaca: códigos 425 y 428.
Trastornos de la conducción cardíaca: códigos 426-427.
Enfermedad cerebrovascular: códigos 430-438 y 342.
Enfermedad vascular: códigos 440, 441 y 443.
Enfermedad pulmonar obstructiva crónica (EPOC): códigos 491-496.
Tuberculosis: códigos 10-18.
Neoplasias malignas: códigos 140-208.
Cirrosis y otras enfermedades crónicas del hígado: código 571.
Artropatía: códigos 712, 714 y 715.
Enfermedades del esófago, estómago y duodeno: códigos 530-537.
Enfermedades intestinales: códigos 562-569.
Figura 1.
Figura 2.
Figura 3.
Figura 4.
Tabla 1.
Tabla 2.