INTRODUCCIÓN
Al inicio del trasplante renal se contraindicaba el embarazo, pero ya hace 48 años1 que nació el primer niño hijo de una trasplantada renal y desde entonces los conceptos han ido cambiando progresivamente, de tal manera que hoy en día se considera que el embarazo es una parte más de los beneficios que aporta el trasplante renal, aunque existen todavía algunas dudas sobre los efectos del mismo en la madre y en el feto2. Las pacientes con enfermedad renal crónica avanzada presentan una disfunción hipotálamo-gonadal que confiere infertilidad en prácticamente todos los casos, pero 6 meses después del trasplante esta disfunción gonadal desaparece y se inician las posibilidades de concepción.
Los datos más fiables se han obtenido a partir de tres registros específicos sobre embarazo y trasplante (europeo, americano e inglés)3-5, que informan de las peculiaridades que presenta el embarazo en la paciente trasplantada renal. Como datos más relevantes destaca que el 24-34% presenta un aborto terapéutico o espontáneo, la prevalencia de HTA es alta y hay un aumento de pre-eclampsia, y en más del 50% de los casos habrá prematuridad y bajo peso en el recién nacido.
MATERIAL Y MÉTODOS
Se realizó un estudio observacional prospectivo analizando 10 pacientes trasplantadas renales embarazadas cuya edad media era de 28,9 años (18-36). El tiempo medio post-trasplante fue de 44 meses (12-113). El filtrado glomerular estimado medio por MDRD fue de 64 ml/min (49-82), y el tratamiento inmunosupresor que seguían todas las pacientes fue prednisona 5 mg/ día y tacrolimus (dosis variables para conseguir niveles plasmáticos de 6-8 ng/ml).
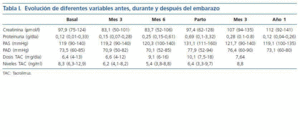
Se evaluaron diferentes variables relacionadas con el injerto renal tanto durante los meses de gestación como después del parto (función renal, proteinuria, presión arterial, dosis y niveles de tacrolimus), así como otras relacionadas con el parto y el neonato.
Los resultados se expresan en medias y entre paréntesis queda reflejados los valores mínimo y máximo.
RESULTADOS
Tras revisar el curso de la gestación y los meses posteriores, se objetivó que el embarazo llegó a término en nueve pacientes y hubo un aborto espontáneo en el primer trimestre. El parto fue por vía vaginal en 6 casos y fue preciso practicar una cesárea en 3 de las pacientes.
El análisis de la presión arterial reveló un aumento al final del embarazo tanto de presión arterial sistólica como diastólica (tabla I). Únicamente una paciente tomaba tratamiento hipotensor antes del embarazo (amlodipino) que se mantuvo durante el mismo, siendo necesario añadir alfa-metildopa durante el tercer trimestre. El resto de las pacientes no tomaban tratamiento hipotensor pre-embarazo y fue necesario instaurar alfa-metildopa a una paciente en el tercer trimestre, requiriendo practicar cesárea urgente por pre-eclampsia.
En la tabla I, podemos observar también el seguimiento de la función renal, que se mantuvo estable durante el embarazo, y de la proteinuria que aumentó ligeramente en el tercer trimestre. También en la misma tabla podemos observar que fue necesario aumentar las dosis de tacrolimus para conseguir los niveles plasmáticos deseados. No se detectó ningún rechazo agudo y solamente hubo una pre-eclampsia resuelta con cesárea.
El parto tuvo lugar a las 37,2 (34-40) semanas, y los recién nacidos presentaron un peso de 2.809 g (2.040-3.760), destacando dos recién nacidos afectos de prematuridad-bajo peso al nacer. No obstante ninguno de los neonatos presentó complicaciones de interés.
DISCUSIÓN
Nuestra experiencia del seguimiento del embarazo post-trasplante con la utilización de prednisona y tacrolimus es satisfactoria dado que prácticamente no ha habido complicaciones maternas ni fetales. Probablemente ello se debe a que las pacientes se adecuaban a las recomendaciones que tanto el «Report on the AST Consensus Conference on Reproductive Issues and Transplantation»6 como las Guías Europeas7 preconizan para plantearse un embarazo después del trasplante renal (tabla II).
Al analizar las diferentes revisiones publicadas en pacientes trasplantadas renales, se objetiva que la hipertensión arterial es prevalente en las pacientes que toman anticalcineurínicos, oscilando según los registros entre un 47-73%8-11. Nuestro estudio objetiva un aumento de presión arterial, tanto sistólica como diastólica. La pre-eclampsia se da en un 30% de las pacientes trasplantadas que están embarazadas11, 12, siendo un diagnóstico complicado, ya que la presión arterial suele aumentar después de la semana veinte y muchas veces la paciente ya tiene una proteinuria ligera antes del embarazo, además de unos niveles de ácido úrico elevados. La hipertensión arterial puede explicar, al menos en parte, el hecho de que más de la mitad de los embarazos acabe antes de la fecha prevista. El tratamiento de la HTA debe ser agresivo13 y tanto la metildopa como el labetalol y los calciantagonistas pueden utilizarse con seguridad14. Los inhibidores del sistema reninaangiotensina están contraindicados formalmente después del primer trimestre del embarazo y a ser posible deben suspenderse antes de la concepción. Dado que el volumen plasmático efectivo está disminuido durante el embarazo tampoco se aconseja utilizar diuréticos, a no ser que la paciente ya estuviera tomando tiacidas previamente al embarazo.
Al analizar la función renal cabe destacar que en aquellas pacientes con disfunción renal pre-existente (creatinina > 1,5 mg%-> 133 μmol/l), el riesgo de pérdida del injerto está aumentado, tanto durante como después del embarazo, por lo que no se recomienda el embarazo por encima de esas cifras. Aunque un estudio15 publicado en 1993 observó que la supervivencia del injerto a los 10 años de trasplante renal era menor en las mujeres que habían quedado embarazadas respecto a las que no, publicaciones recientes16, 17 demuestran que la supervivencia de injerto y de paciente a los 15 años de seguimiento es igual en las pacientes trasplantadas que estuvieron embarazadas post-trasplante que en las que no. La disfunción del injerto puede ser difícil de detectar durante el embarazo, ya que habitualmente los niveles de creatinina disminuyen durante la gestación, sobre todo durante el primer y segundo trimestre tal y como se observa en nuestra muestra, y a veces el rechazo solamente se pone de manifiesto con leves aumentos de creatinina plasmática. En el caso de que se presente el rechazo, habitualmente responde a metilprednisolona. La seguridad de las globulinas antilinfocitarias y rituximab son desconocidas.
Es preciso mantener unos niveles adecuados de inmunosupresión durante el embarazo. Tal y como se observa en nuestro análisis, los niveles plasmáticos de anticalcineurínicos pueden oscilar ya que hay cambios de volumen de distribución y alteraciones del volumen extracelular que acompañan a la gestación7, 18, no obstante en la mayoría de los estudios publicados no se han monitorizado los niveles. En nuestro estudio, tras analizar los niveles de tacrolimus, se objetivó que se deben aumentar las dosis para mantener el rango requerido, hecho que coincide con uno de los escasos estudios donde sí se monitorizó el tratamiento19. Por otro lado, un estudio practicado en 21 pacientes sin modificación de dosis de tacrolimus no observó ningún episodio de rechazo agudo20.
Según las guías publicadas, aunque un embarazo en una paciente trasplantada renal sea de alto riesgo, la cesárea solamente estaría indicada por razones obstétricas. No obstante cabe destacar que, aunque en nuestra muestra se de en el 33% de las pacientes, en las diferentes series ocurre en alrededor del 50% de los partos.
El resultado final de obtener tan solo un 10% de abortos en nuestra serie difiere de los obtenidos al revisar los registros europeo, americano e inglés3-5 en los cuales el aborto terapéutico o espontáneo aparece en un 24-34% de las embarazadas.
En nuestra experiencia solamente 2 pacientes tuvieron una infección urinaria no complicada. El embarazo en la paciente trasplantada renal aumenta el riesgo de infección, especialmente la de origen bacteriano. Alrededor del 40% de las embarazadas tienen infección de orina, sobre todo en pacientes con pielonefritis crónica o reflujo vesico-ureteral como causa de enfermedad renal primaria (criterio que cumplían nuestras dos pacientes). Por ello se recomienda practicar sedimento y urocultivo mensualmente y en caso de que aparezca bacteriuria asintomática tratar con antibiótico durante dos semanas y dejarlo profiláctico hasta el parto7.
A la hora de analizar las complicaciones fetales, destaca que riesgo de prematuridad y de bajo peso al nacer es mayor del 50% y el de retraso del crecimiento intrauterino mayor del 20% según las diferentes series4, 21, siendo el porcentaje en nuestra modesta representación, de un 22%.
Todos los inmunosupresores atraviesan la barrera placentaria, por lo que el feto está expuesto a la toxicidad de los diferentes fármacos. En el caso de la prednisona, el 90% de la dosis es metabolizada en la placenta antes de llegar al feto, no obstante se han reportado casos de supresión adrenal en el feto. En el caso de los anticalcineurínicos se han detectado niveles plasmáticos en el feto, aunque en una concentración inferior a la de la madre22. Los efectos adversos potenciales pueden ir desde malformaciones mayores hasta defectos neurocognitivos que pueden descubrirse años después del nacimiento. Según las Guías Europeas, si la terapia inmunosupresora está basada en un anticalcineurínico, con o sin esteroides o azatioprina puede continuarse con el mismo tratamiento durante el embarazo. Otras drogas como micofenolato mofetil o inhibidores de mTOR no se recomiendan7.
En los recién nacidos no objetivamos ninguna malformación. La prevalencia de malformaciones estructurales según el Registro Americano es de 4-5%, muy parecido al 3% de las series de embarazo en población general4, 23, y aunque no se ha podido demostrar un patrón de malformación asociado a prednisona, azatioprina o anticalcineurínicos, sí se han descrito algunas malformaciones relacionadas con la toma de micofenolato mofetil por lo que se aconseja su suspensión antes de la concepción24. Las consecuencias a largo plazo de la exposición a los inmunosupresores durante el embarazo son desconocidas. En un estudio25 practicado en 48 niños seguidos durante una media de 5.2 años no se observó ninguna anomalía estructural ni del desarrollo, si bien en esta serie la prematuridad fue del 56%. En el Registro Americano4 el 4% de los recién nacidos de una cohorte de 164 pacientes trasplantadas de diferentes órganos sólidos tenía alguna anomalía estructural, pero no se dispone de seguimiento a largo plazo de estos niños. En otro estudio26 realizado en 175 niños que durante el embarazo estuvieron expuestos a ciclosporina, 71 fueron escolarizados en Primaria (5-12 años) y de ellos el 24% tenían un retraso en el desarrollo intelectual. Al pesar de que los datos no son concluyentes, sí parece necesario que estos niños deben tener un seguimiento neurocognitivo a largo plazo. Los datos de los registros, probablemente infraestimen las complicaciones como los retrasos de crecimiento fetal, la preeclampsia y los nacimientos prematuros, todos ellos, factores de riesgo para el deterioro neurocognitivo.
Aunque nuestra experiencia con solamente diez pacientes ha sido satisfactoria, cabe comentar dos aspectos finales. En primer lugar, muchas pacientes trasplantadas renales no llevan la misma pauta inmunosupresora que nuestras pacientes, bien por retirada precoz de esteroides, bien por asociación de micofenolato o bien por conversión de anticalcineurínico a inhibidor de mTOR. Dado que no existe seguridad con estas pautas, deberían modificarlas antes del embarazo con los riesgos sobreañadidos que esto supondría. Por otro lado, la información deber ser rigurosa e individualizada para cada paciente, explicando con detalle los posibles riesgos, pero preservando el derecho a elegir de la madre.
Aunque no hay datos definitivos en la literatura, dado que los inmunosupresores han aparecido en la leche materna a concentraciones variables, parece que lo más prudente es desaconsejar la lactancia, cosa que hicimos con nuestras pacientes.
En conclusión, el embarazo post-trasplante renal es bastante seguro con una pauta inmunosupresora basada en esteroides y tacrolimus, con buenos resultados cuando en el pre- embarazo la función renal es correcta, no hay proteinuria y la presión arterial está controlada. No obstante, el embarazo post-trasplante renal debe seguir considerándose de alto riesgo debido a las complicaciones que pueden aparecer tanto en la madre (infección, proteinuria, anemia, HTA y rechazo agudo) como en el feto (prematuridad y bajo peso al nacer)7, por lo que el abordaje ha de ser multidisciplinario, y tanto las visitas como la monitorización de inmunosupresores deben realizarse con mayor frecuencia.
Tabla 1.
Tabla 2.