INTRODUCCIÓN
El mundo enfrenta una verdadera epidemia de hepatitis C, lo que significa un enorme reto para la salud pública en el actual milenio. Hasta 1998 se registraron 170 millones de personas que eran portadoras del HCV en todo el mundo1, 2 y, en los últimos años, 200 millones o un 3% de la población mundial está infectada por este virus3, 4. Una estimación del impacto económico de la hepatitis C crónica revela una pérdida del orden de los 600 millones de dólares. Se calcula que entre 2010 y 2019 esa enfermedad podrá causar la pérdida de cerca de 1,83 millones de años de vida útil, previéndose una pérdida aproximada de 54,2 mil millones de dólares5.
La infección por HCV es la principal causa de enfermedad hepática crónica en pacientes en HD. Los pacientes con ERC estadio V en HD representan un grupo de riesgo propenso a adquirir esta infección. Los estudios epidemiológicos han constatado que la incidencia y seroprevalencia de infección por HCV en pacientes en HD está declinando en los últimos años6-8. No obstante, y a pesar de las políticas de salud públicas adoptadas en países desarrollados y en desarrollo, la frecuencia de seroprevalencia de HCV en pacientes con ERC estadio V en HD todavía permanece más elevada que en la población general7, 9-12. Para esos pacientes, los principales factores de riesgo para adquirir ese virus son la frecuente exposición a hemoderivados13, los equipos médicos contaminados, el tiempo en años de tratamiento dialítico13, 14 y el incumplimiento de las medidas universales de prevención y control de infecciones10, 15.
La seroprevalencia de HCV en trabajadores de la salud es tres veces superior a la de los trabajadores de otros sectores. De esa manera, los PS de los CH son un grupo especial de riesgo para adquirir ese virus16, 17.
Los estudios de seroprevalencia de HCV de base poblacional en el Brasil son aún muy escasos. Quedó demostrada la seroprevalencia de HCV del 1,42% en 1.059 individuos sanos18 y del 1,7% en 119 individuos sanos de una población indígena19. En MG, hasta el momento, no existen datos consistentes de seroprevalencia de HCV de base poblacional.
Los objetivos de este estudio fueron: evaluar la frecuencia de seroprevalencia del HCV en pacientes con ERC estadio V en programa de HD en los CH del Estado de MG en el sudeste de Brasil, correlacionar esta seroprevalencia con el tiempo de tratamiento en HD, investigar la seroprevalencia del HCV en PS de estos CH y verificar si hay una correlación entre la media de seroprevalencia del HCV en los CH y el IDH de las diferentes regiones del Estado de MG.
PARTICIPANTES Y MÉTODOS
Diseño del estudio: Estudio epidemiológico transversal y multicéntrico realizado en el período de enero a diciembre de 2003 en los CH del Estado de MG en la región sudeste do Brasil, donde se investigó la situación de salud en relación con la infección por HCV en individuos con ERC estadio V en programa de HD y en PS.
Sujetos. Criterios de inclusión: CH que dieron su consentimiento para participar en el estudio de seroprevalencia de HCV y con control serológico por intermedio del ensayo anti-HCV ELISA III de los pacientes en HD y de los PS, rellenando un cuestionario validado. Se incluyeron en el estudio, tras previo consentimiento, 66 (92%) CH sobre un total de 72. De los seis CH excluidos, uno no respondió el cuestionario y cinco no contenían en su totalidad los datos mensuales de serología anti-HCV de los pacientes en HD. Fueron incluidos los CH que iniciaron sus servicios en el año 2003, siempre y cuando contaran con datos sólidos correspondientes a los meses subsiguientes, durante el período de estudio. En esos casos, se tuvieron en cuenta las informaciones a partir del mes de inicio del funcionamiento.
Métodos: Se aplicó un cuestionario previamente elaborado, testado y validado, exclusivamente para este estudio. La Secretaría de Salud del Estado de MG (SESMG) puso a disposición su banco de datos para una eventual consulta. Los valores del IDH se obtuvieron gracias al Atlas de Desarrollo Humano20. La seroprevalencia mensual de HVC de los municipios y regiones geográficas del Estado de MG fue calculada dividiéndose el número de pacientes con serología anti-HCV positivos por el número total de pacientes sometidos a la HD cada mes en los CH. Para calcular la frecuencia de seroprevalencia de HCV en los PS se utilizó la misma metodología.
Medidas: La variable de interés principal fue la serología de anticuerpos anti-HCV ELISA III realizada mensualmente en los pacientes con ERC en HD en los CH incluidos. Las variables secundarias fueron los datos demográficos de los pacientes: edad, sexo, etiología de la enfermedad renal, tiempo de HD, serología de anticuerpos anti-HCV ELISA III en los PS, frecuencia de seroprevalencia de HCV en los CH de los municipios de una región y el IDH medio regional.
Análisis estadístico: Las informaciones recolectadas en los cuestionarios fueron digitalizadas en un banco de datos desarrollado en el programa Microsoft Access versión 2000. Se estableció la seroprevalencia anual media de HCV como variable respuesta. Los resultados descriptivos se obtuvieron a través de la frecuencia de las características de las diferentes variables. Para comparar el IDH medio de la región y el medio mensual de la frecuencia de seroprevalencia HCV regional, y variables continuas, se utilizó el coeficiente de correlación de Pearson (r). Este coeficiente suministra la medida de la fuerza de relación lineal entre dos variables continuas y varía entre -1 y +1 pasando por cero. El valor de r2 es la proporción de la variación em y explicada por x (o viceversa). El nivel de significancia estadística se estableció como 0,05 y el poder estadístico de 80%21.
Aspectos éticos: El proyecto de investigación fue aprobado por el Comité de Ética e Investigación de la Universidad Federal de Minas Gerais (UFMG) y obedece a la Resolución 196/96 del Consejo Nacional de Salud, el que establece las normas para las investigaciones en donde se incluyen seres humanos22. Asimismo, se enviaron cartas aclaratorias sobre el proyecto de investigación a la Secretaría del Estado de la Salud de Minas Gerais (SESMG), a la Sociedad Brasileña de Nefrología (SBN), a la Asociación Nacional de los Donadores y Trasplantados Renales (DORETRANS) y a los CH del Estado de MG.
RESULTADOS
Estudio descriptivo: En diciembre de 2003 eran 7.636 los pacientes con ERC estadio V que estaban en el programa de HD en 66 CH del Estado de MG en el sudeste de Brasil. De dicha cantidad, 4.290 (56,2%) eran masculinos y 3.346 (43,8%) femeninos. Con respecto a la edad, 265 (3,5%) pacientes tenían de 0 a 20 años, 647 (8,5%) de 21 a 30 años, 1.154 (15,0%) de 31 a 40 años, 1.819 (23,8%) de 41 a 50 años, 1.654 (21,7%) de 51 a 60 años, 1.259 (16,5%) de 61 a 70 años y 838 (11,0%) más de 70 años. Hubo un predominio del sexo masculino en todas las edades (tabla I).
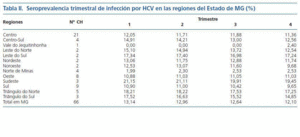
Las etiologías más frecuentes de ERC fueron la hipertensión arterial (30%), la glomerulonefritis crónica (24%) y la nefropatía diabética (20%). La pérdida muestral fue de un 10%. El número medio de pacientes de los seis CH excluidos (83 ± 29) fue semejante al número medio de pacientes de los 66 CH incluidos (101 ± 59). No hubo diferencia (p = 0,46) con significancia estadística. El número de CH por región del Estado de MG y los resultados de la seroprevalencia trimestral de infección por HCV se halla en la tabla II.
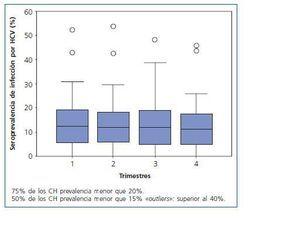
La seroprevalencia media trimestral de infección por HCV en el Estado de MG fue 13 ± 9%. La menor seroprevalencia de HCV se encontró en la región del Vale do Jequitinhonha y la mayor en la región sudeste del Estado. La seroprevalencia trimestral de infección por HCV en los 66 CH de MG fue inferior a 20%, 15% y 10% en 75%, 50% y 40% de los CH, respectivamente, como está demostrado en la figura 1.
Se agruparon los 66 CH en cinco intervalos de la frecuencia de seroprevalencia de infección por HCV, considerándose la media de seroprevalencia de infección por el virus (≤ 10%, 11% a 20%, 21% a 30%, 31% a 40% y 41% a 50%). Solamente dos CH fueron incluidos en el intervalo entre 41 y 50%, siendo uno de la región Sudeste y otro de la región Triângulo do Norte. Ningún CH fue incluido en el intervalo entre 31 y 40%, y 80% de los CH fueron incluidos en el intervalo ≤ 20%. Se agruparon también los 66 CH según la frecuencia de seroprevalencia de infección por HCV en tres categorías: baja seroprevalencia de HCV (< 5%), mediana seroprevalencia de HCV (5 a 15%), y alta seroprevalencia de HCV (> 15%). Se constató que el 20% de ellas tiene baja, el 42% mediana y el 37,5% alta seroprevalencia de HCV, tal como lo propuesto por Lombardi y cols., en 199923.
El tiempo en años de tratamiento dialítico se correlacionó significativamente con la seroprevalencia de infección por HCV (p < 0,001), como quedó demostrado en la evaluación de una población de 884 pacientes en cuatro CH (tabla III).
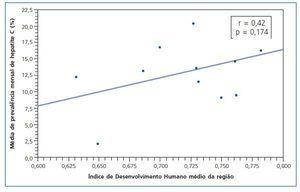
No se encontró correlación con significancia estadística (r = 0,42; p = 0,174) entre el IDH medio regional y la media de seroprevalencia mensual de infección por HCV en los municipios de la misma región geográfica. Sin embargo, en las regiones donde el IDH es más pronunciado, se observó una tendencia de seroprevalencia de infección por HCV mayor (fig. 2).
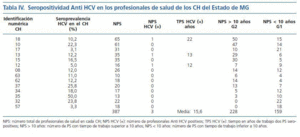
La seroprevalencia de infección por HCV fue investigada en 387 (29%) profesionales del sector salud que trabajaban en 14 CH (19%) del Estado de MG. El número medio de PS fue de 27 (7%) en cada CH. Los PS se distribuyeron de acuerdo con el tiempo de trabajo en HD: mayor o menor que diez años en los grupos G1 y G2, respectivamente. El G1 totalizó 159 PS (41%) y el G2 totalizó 228 PS (59%). En el G1 la seropositividad anti-HCV fue negativa y en el G2 tres PS tenían seropositividad anti-HCV. El tiempo medio de trabajo en los CH de los PS seropositivos fue de 15,6 años. De los PS seropositivos, uno de ellos tuvo un accidente con material contaminado. La seroprevalencia de HCV en todos los PS fue del 0,8%, siendo que llegó al 1,3% cuando se computaron solamente los PS del G2. No hubo diferencia con significancia estadística al analizarse la seroprevalencia de infección por HCV entre G1 y G2, teniéndose en cuenta el tiempo de exposición ocupacional (p = 0,27). En los PS de G2 la seropositividad anti-HCV no se correlacionó con transfusión de hemoderivados, tatuajes, uso de droga inyectable (UDI) o uso de piercing (tabla IV).
DISCUSIÓN
La hepatitis C crónica provoca un gran impacto en la morbilidad y mortalidad de pacientes portadores de ERC en HD24, 25. Los pacientes en HD son especialmente susceptibles a la infección por HCV, lo que puede ser atribuido a la transmisión nosocomial y a las alteraciones inmunes características de ese grupo específico26, 27. Los estudios de prevalencia son especialmente útiles para orientar la toma de decisiones sobre el rastreo diagnóstico y para auxiliar durante el planeamiento estratégico de acciones preventivas y terapéuticas. Por esos motivos, el conocimiento de la realidad sobre la seroprevalencia de infección por HCV en los CH en el Estado de MG fue el principal objetivo de este estudio y, seguramente, contribuirá para que se adopten rigurosamente las medidas de prevención y de control de infección, bien como la reducción de la elevada seroprevalencia de esta enfermedad.
Para estudios de la naturaleza epidemiológica es necesario que la muestra sea bien representativa. En el Estado de MG existen 72 CH en sus 13 regiones geográficas y todos ellos fueron convocados. Sin embargo, la muestra poblacional estudiada estuvo constituida por los pacientes en tratamiento de hemodiálisis en 66 CH. La exclusión de seis CH no comprometió los resultados, considerando que la mayoría de ellos fue incluida en la investigación y posibilitó una muestra representativa de la población de pacientes renales crónicos en HD en el Estado de MG. Los datos sobre seroprevalencia de hepatitis C fueron obtenidos de 7.636 pacientes. El número elevado de pacientes, aunado al hecho de que se hayan incluido en el estudio CH de todo el Estado, demuestran que los resultados encontrados son representativos de la seroprevalencia de infección por HCV en los CH en MG y reflejan, desde el punto de vista epidemiológico, la situación actual de la seroprevalencia de hepatitis C en pacientes en HD en el Estado de MG, región sudeste de Brasil.
La seroprevalencia media de hepatitis C hallada fue del 13%. La evaluación mensual y trimestral de la serología anti-HCV en los CH en MG en el año 2003 mostró que no hubo un aumento de la frecuencia de seroprevalencia de HCV. Esos datos corroboran la literatura científica nacional, como por ejemplo lo descrito por Romão Junior y cols., en 2004 en todo Brasil28. Del mismo modo, esos datos son semejantes a los descritos en otros países, como por ejemplo, por Geerlings y cols.29 y Jadoul y cols8. Según esos autores, la adopción de los ensayos serológicos en los casos de hepatitis C en los hemocentros y en los CH, juntamente con las medidas de prevención y control de infecciones en esos centros, dieron como resultado una merma en la seroprevalencia de infección por HCV en pacientes en HD8, 29.
Se observó un predominio del sexo masculino en todas las edades, la mayoría entre 40 y 60 años, siendo dichos resultados semejantes a descripciones previas28, 30-32. Se sabe que la edad y el sexo no se correlacionan con mayor riesgo de transmisión del HCV10, 11, 25, 33, sin embargo, en pacientes en HD esto puede ser diferente, considerando que hay predominio del sexo masculino en pacientes con ERC terminal28, 30-32.
Las principales etiologías de la ERC encontradas fueron la hipertensión arterial (30%), seguida por la glomerulonefritis crónica (24%) y por la nefropatía asociada a la diabetes mellitus (20%). Estos datos se asemejan a las descripciones previas en MG30, 34, en Brasil28, 32, en los Estados Unidos31 y en otras naciones35. No obstante, ese dato debe ser analizado con cautela, considerándose que la etiología de la enfermedad renal terminal es desconocida en una parte expresiva de la población de portadores de ERC, tal como lo observado en el 10% de la población que inició HD en MG, en 199530.
Estudios regionales en Brasil32 y en otros países latinoamericanos36 han situado y destacado a la glomerulonefritis crónica como una de las principales etiologías de la ERC. Entre las glomerulopatías, se sabe que la glomeruloesclerosis segmentaria y focal (GESF) y la glomerulonefritis membrano-proliferativa (GNMP) son las que más a menudo se transforman en ERC32. La GNMP tiene la peculiaridad de asociarse a la esquistosomosis mansoni, infecciones por el estreptococo y el virus de las hepatitis B y C15, 32. Esas características contribuyen para que la GNMP sea un tipo histológico común en nuestro medio, diferente a lo observado en otros países32. A pesar de que la hipertensión arterial y la diabetes mellitus constituyan las principales causas de la ERC terminal31, 35, se debe tener en cuenta que, en Brasil, los brotes de enfermedades infectocontagiosas, aún prevalecientes, son los responsables por una gran parte de los casos que culminan como ERC terminal37, 38. De todas maneras, y en los últimos años, el perfil etiológico de la ERC se ha modificado tanto en Brasil como en otros países de América Latina36, 38. La ausencia de comprobación histopatológica, la característica silenciosa de la progresión de la lesión glomerular tras el insulto inicial y la falta de un planeamiento adecuado de seguimiento para los pacientes en el período predialítico, son los obstáculos habidos que impiden el conocimiento de la verdadera etiología de la enfermedad renal crónica avanzada en todo el mundo38.
El número de pacientes mantenidos en HD en Brasil constituye la cuarta casuística mundial, superada únicamente por los Estados Unidos, Japón y Alemania28. La mayor parte de esa población en Brasil se concentra en la región Sudeste, donde se sitúa el Estado de MG. La seroprevalencia media de infección por HCV de los 66 CH estudiados fue del 13 ± 9,5% con una variación de 0 a 50%. En sólo un CH la seroprevalencia de HCV fue cero. Este acontecimiento aislado y atípico se atribuyó al hecho de que se trata de un centro nuevo, en el que no se contempló el ingreso de pacientes anti-HCV positivos («casos viejos»), pacientes en tránsito seropositivos, pacientes en la «ventana inmunológica» debido al ensayo serológico anti-HCV, o, también, por la no detección de pacientes contaminados durante el estudio. Seroprevalencia de HCV mayor también ocurrió en solamente un CH y, según informes, varios pacientes admitidos para tratamiento venían de otros CH del Estado de MG y de otros estados, en razón de la indisponibilidad de techo presupuestario del Sistema Único de Salud (SUS).
Otro CH inició sus actividades en febrero de 2003. Por lo tanto, se consideró para el objeto de este estudio la seroprevalencia mensual del HCV de febrero a diciembre de 2003. Es interesante observar que se trata de un CH recién inaugurado con seroprevalencia inicial de 2,2%, y una media anual del 2,6%. Este hecho puede atribuirse al ingreso de pacientes seropositivos provenientes de otro CH de la misma región con seroprevalencia media del 18,5%.
Agrupando los 66 CH en cinco intervalos de frecuencia de seroprevalencia de HCV se observó que el 80% de los CH estaban incluidos en el intervalo de frecuencia de seroprevalencia ≤ 20% y solamente dos estaban entre el 41 y el 50%. Similar forma de agrupar utilizaron Lombardi y cols., en 1999, en Italia, y los autores encontraron tasas con variaciones cercanas a las halladas en el estudio23.
El tiempo de tratamiento en HD es un importante factor de riesgo individual e independiente para adquirir la infección por HCV, siendo estimado en un 10% al año10, 39. Las múltiples oportunidades de contaminación a que la población de urémicos en HD está expuesta son las principales razones para explicar ese índice de seroconversión. Lo que se ha observado es un significativo cambio en los factores de riesgo que provocan la adquisición del HCV en la actualidad. Hasta mediados de 1992, el mayor riesgo de contraer la infección viral en los CH era las hemotransfusiones sumadas a la indisponibilidad comercial de la eritropoyetina para llevar a cabo el tratamiento de la anemia secundaria a ERC. Recientemente, ese cuadro empezó a modificarse y la transmisión nosocomial es el principal mecanismo de contaminación por HCV en los CH10. Con respecto a la transmisión del HCV por tiempo de exposición a la HD, se pudo inferir una mayor seroprevalencia de HCV en aquellos CH más antiguos, en razón del mayor riesgo de contaminación. De hecho, el estudio identificó un número de pacientes HCV seropositivos en HD que se encuentran hace más de una década en CH que funcionan hace más de 20 años. Es posible que tales pacientes hayan sido infectados como consecuencia de las hemotransfusiones, realizadas frecuentemente en aquella ocasión. Bajo el punto de vista epidemiológico, esos pacientes son los llamados «casos viejos», que pueden llegar a interferir a la hora de realizarse los cálculos de las tasas de seroprevalencia en estudios de esa índole. Por otro lado, se espera una menor seroprevalencia de infección por HCV en los CH que ya llevan funcionando entre cinco y diez años. No obstante, el ingreso de pacientes antiguos seropositivos transferidos de otros CH, o pacientes en tránsito en esos centros, que se suman a los casos incidentes en tránsito o transferidos de otros CH hacia los centros más nuevos, pueden haber contribuido, en parte, para alterar la tasa de seroprevalencia de HCV en estos CH. Es importante resaltar que la investigación de la incidencia de la infección por HCV en los CH no formaba parte de los objetivos de este estudio.
La mayoría de los CH tenía una seroprevalencia de HCV < 20% y cuando fueron evaluados en los grupos de baja, mediana y alta seroprevalencia hubo un predominio de la franja de mediana seroprevalencia (5-15%).
Se observó también una estabilidad en las tasas de seroprevalencia de HCV en el período del estudio y no hubo ningún registro de nuevos casos de hepatitis C. Resultados semejantes fueron relatados en Brasil28, 40 y en otros países7, 16, 41-43.
En Italia se relató una correlación positiva entre mayor seroprevalencia y mayor incidencia de HCV23. Los autores encontraron una tasa de incidencia de HCV de 0,40% en los CH que tenían seroprevalencia hasta 20% e incidencia de 0,94% a 1,77% en aquellos CH con seroprevalencia entre 40 y 50%. Las razones para los mayores índices de seroconversión fueron las hemotransfusiones (13,6%), la violación a las normas universales (17%) y las intervenciones quirúrgicas (8,5%). En un 54,2% de los casos, las causas no fueron determinadas. Es importante resaltar que la transmisión del HCV en los centros de HD puede ocurrir inclusive con la ausencia de factores de riesgo conocidos. Otro estudio relató que hay entre un 10% y un 50% de pacientes seropositivos en los que no se identifican los factores de riesgo10. Este acontecimiento es uno de los principales argumentos a favor de la transmisión nosocomial del HCV, asociada a procedimientos como las punciones venosas frecuentes y el uso de equipos comunes en los CH. Además, la posibilidad de que los pacientes en HD adquieran la infección por HCV en la propia comunidad, o por otros factores de riesgo (uso de drogas inyectables), no debe ser subestimada10. Algunos autores sugieren que la homogeneidad de los genotipos de pacientes HCV positivos en una misma sala de HD refuerza la hipótesis de la transmisión nosocomial10, 15, 44, 45. Sin embargo, esta hipótesis requiere una cautelosa evaluación considerándose la mayor distribución mundial del genotipo 1 y, por ende, mayores chances de infección por el genotipo prevaleciente en la región. En Brasil, el genotipo más frecuente es el 1, seguido del 346, 47. Entre otros factores potenciales de transmisión nosocomial del HCV son citados la reutilización de capilares, la contaminación de la superficie de las máquinas de HD y de otros equipos, bien como de los ítems compartidos entre los pacientes durante los procedimientos de HD10, 48, 49.
Aun cuando las tasas de seroprevalencia de HCV en los pacientes en HD continúan mayores que en la población general50, los estudios muestran una tendencia hacia la disminución de tales tasas y de la incidencia de hepatitis C en los CH, en los últimos años28, 41, 43, 51. Esos hechos fueron atribuidos a la adopción de medidas efectivas de prevención y control de la transmisión nosocomial, a la disminución del número de transfusiones y a la puesta en práctica de los ensayos de rastreo serológico en los hemocentros y en los CH. Los ensayos de rastreo serológico anti-HCV en los hemocentros, de carácter obligatorio en Brasil a partir de 1993, constituyen la principal razón para explicar la merma expresiva de la transmisión horizontal del virus C. En los CH esa obligatoriedad entró en vigor a partir de 199651, 52.
El IDH es una medida general del desarrollo humano y no abarca todos los aspectos de desarrollo20, de todas maneras, se trata de un índice más completo y realista cuando se lo compara con el PIB per cápita que considera tan sólo la dimensión económica del desarrollo. Según la clasificación del Programa de las Naciones Unidas para el Desarrollo (PNUD)53, el Estado de MG está entre las regiones de mediano desarrollo humano (IDH entre 0,5 y 0,8). En el Estado de MG los CH están situados en municipios estratégicos y estructurados con condiciones de obtener los recursos necesarios para la implementación de los servicios de salud de alta complejidad. El IDH de esos municipios está alrededor de 0,7 y se encontraron seroprevalencias para el HCV variables. En otro sentido, no hubo asociación entre el IDH y la seroprevalencia media de HCV en esos municipios (r = 0,42; p = 0,174), aunque haya habido una tendencia de correlación. Una observación interesante es el haberse encontrado un expresivo número de seroprevalencias de HCV en regiones con un alto índice de IDH. La posible explicación para eso sería la concentración de la mayoría de los CH antiguos en las regiones en donde el IDH es más elevado y con una mayor cantidad de seropositivos atribuidos a los «casos viejos».
El riesgo de que haya contaminación por accidente con agujas entre los PS se estima entre un 0 y un 3%, alcanzando un máximo del 10%, en el caso de que el contaminante tenga una viremia positiva detectada por ensayos de biología molecular54-56. Otro estudio estima en un 0,7% el riesgo en PS no expuestos57 y de hasta un 2% en PS expuestos55. La seroprevalencia anti-HCV fue investigada en 387 (29%) PS que trabajan en 14 CH (19%) del Estado de MG. Los PS fueron divididos en dos grupos ¿G1 y G2¿ basados en el tiempo de actividad profesional en HD menor o mayor que 10 años, respectivamente. Los resultados demuestran que, en media, cada CH tiene 27 PS. En el G1 fueron incluidos 159 PS (41%) y ninguno fue seropositivo. El G2 estuvo constituido por 228 PS (59%) siendo tres seropositivos. El tiempo medio de actividad profesional de esos PS seropositivos fue de 15,6 años. El factor de riesgo en un caso fue accidente con material contaminado. En otros dos casos no se identificó el factor de riesgo. La seroprevalencia de HCV, considerando todos los PS de los G1 y G2, fue del 0,8% y de 1,3% para los PS del grupo G2. La seroprevalencia de HCV en profesionales de salud encontrada en el estudio, a pesar de no ser una medida de riesgo, se asemeja a la descrita en otras investigaciones. En 1995, la seroprevalencia de HCV observada en PS del 16% de los CH en los Estados Unidos fue del 2%, con variaciones entre 0 y 10%41. En 2000, Fabrizi y colaboradores investigaron la seroprevalencia de HCV en 20.091 PS en los Estados Unidos. Trescientos cuarenta y nueve PS (1,7%) fueron positivos17.
No se observó una diferencia significativa en la seroprevalencia de HCV con relación al tiempo de exposición ocupacional entre PS de los grupos G1 y G2 (p = 0,27). Así, el tiempo de ocupación de los PS en los CH no se asoció al aumento de la seroprevalencia de HCV en estos PS. No fue un objetivo del estudio el evaluar el riesgo de transmisión de HCV de pacientes a los PS durante sus actividades en los CH.
En conclusión, este estudio demuestra que la seroprevalencia de HCV en los pacientes en HD en MG es más elevada que en la población general, pero inferior a los años anteriores al estudio y semejante a las tasas descritas en países europeos y en los Estados Unidos de América; la seroprevalencia de HCV varía entre los CH de un mismo municipio y entre los CH de diferentes regiones del Estado de MG; el tiempo en HD estuvo asociado a la mayor seroprevalencia de HCV; no se observó un aumento trimestral de la seroprevalencia de HCV en los CH en el período del estudio; no hubo una correlación entre el IDH regional y la seroprevalencia de HCV; la tendencia de seroprevalencia de HCV más acentuada en sitios de mayor IDH puede explicarse por la existencia de CH más antiguos en estas regiones; la seroprevalencia de anti-HCV en los PS es semejante a la descrita en otros estudios.
Tabla 1.
Tabla 2.
Tabla 3.
Tabla 4.
Figura 1.
Figura 2.