Los bifosfonatos son compuestos sintéticos análogos de los pirofosfatos. Mientras que la biodisponibilidad de una dosis endovenosa es del 100%, la biodisponibilidad oral es del 1 al 5%. Aproximadamente el 50-80% del bifosfonato disponible es captado por el hueso.
En pacientes con deterioro de función renal debemos ser cautelosos fundamentalmente porque se eliminan a nivel renal (se filtran por el glomérulo y secretan en el túbulo). Su diferente toxicidad renal puede deberse a factores como: diferente capacidad de unión a proteínas, distinta vida media en tejido renal, y diferente toxicidad renal acumulada. No obstante, la toxicidad se debe a la administración rápida y a dosis excesivas. En pacientes con filtrado glomerular inferior a 30 ml/min es aconsejable reducir la dosis a la mitad. Con la administración endovenosa es importante mantener el tiempo de infusión y en hemodiálisis administrar durante la sesion. Con el ibandronato, hasta el momento actual, no se ha descrito patología renal y con las formas orales de cualquiera de ellos tampoco.
Los bifosfonatos se han demostrado eficaces en la prevención de la pérdida ósea postrasplante, en tratamiento de calcifilaxis y prevención de las calcificaciones vasculares. En los pacientes con ERC avanzada ó en diálisis, los bifosfonatos estarían indicados, sobre todo, ante la presencia de franca disminución de la masa ósea y la existencia de factores de riesgo de osteoporosis junto a alto remodelado óseo. Se debe sopesar con cuidado su indicación en pacientes con sospecha de enfermedad ósea adinámica, siendo en este caso mandatoria la biopsia ósea.
Bisphosphonates are synthetic compounds similar to organic pyrophosphates. The bioavailability of intravenous preparations is 100%, whereas the availability of oral therapy ranges from 1 to 5%. About 50% to 80% of free bisphosphonates are incorporated into the bone. Because of their urinary elimination, bisphosphonates must be carefully administered in chronic kidney disease (CKD) patients. In spite of this, bisphosphonates can safely be used at all CKD stages, including dialysis and kidney transplant. Renal toxicity seems different among these compounds, and it is basically due to their protein binding and the average lifespan of renal tissues. In practice, renal toxicity has been associated with infusion speed and excessive dosage. In patients with CKD, it is very relevant to maintain infusion time and in haemodialysis patients we recommend administration during the haemodialysis session. When bisphosphonates are given to 4-5 CKD patients it seems reasonable to reduce the dose to 50%. No renal pathology has been associated to oral administration. The indications of bisphosphonates in CKD include: hypercalcaemia episodes, preventing bone loss after renal transplantation, treating low bone mineral density in all CKD stages including transplantation. They are also a promising therapy for calciphylaxis and to prevent vascular calcifications. When suppressed bone turnover is suspected, bone biopsy is mandatory before bisphosphonates therapy.
Introducción
Los bifosfonatos son compuestos sintéticos análogos de los pirofosfatos con efectos físico-químicos similares. Se desarrollaron a mediados del siglo pasado como inhibidores del crecimiento, constatándose posteriormente que también disminuían la resorción ósea.
Los pirofosfatos, a su vez, son compuestos orgánicos formados por dos ácidos fosfóricos unidos por esterificación a una molécula de oxígeno (estructura P-O-P); se detectan en sangre y orina por ser productos de liberación de diversas reacciones fisiológicas.
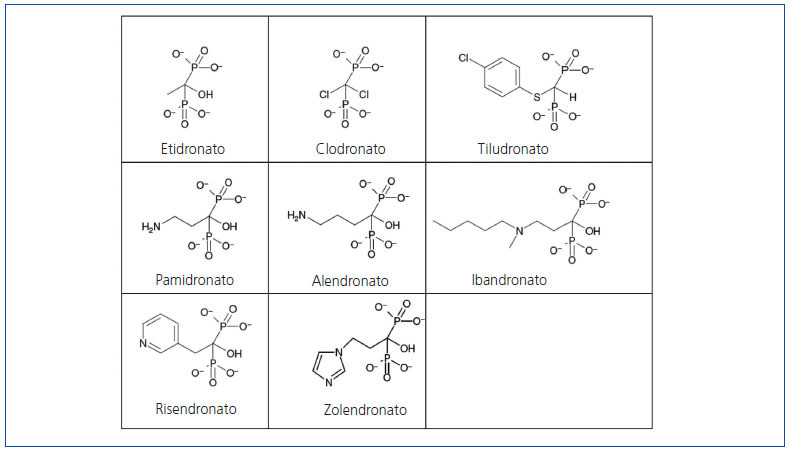
Los bifosfonatos se diferencian de los pirofosfatos en que la molécula de oxígeno se ha sustituido por una de carbono (estructura P-C-P) (figura 1), lo que les hace difícilmente degradables y, por otro lado, les confiere una alta afinidad por los cristales de hidroxiapatita. Al carbono central también se le unen dos cadenas laterales que son diferentes para cada tipo de bifosfonato y que determinan su potencia, duración de acción, efectos secundarios y otros parámetros clínicos u óseos (figura 1). Los bifosfonatos más potentes poseen un grupo hidroxilo en una de sus cadenas laterales que aumenta su capacidad para unirse al calcio.
Distribución.
Los bifosfonatos, al no ser biodegradables, son absorbidos, almacenados y excretados por el organismo sin metabolizarse. Mientras que la biodisponibilidad de una dosis endovenosa es del 100%, la biodisponibilidad de una dosis oral es sólo del 1 al 5%.
La absorción se realiza por difusión pasiva en estómago e intestino y disminuye cuando la droga es administrada con las comidas, especialmente con la presencia de calcio, por lo que se recomienda que la administración del producto sea al menos 30 minutos antes del desayuno (aunque también se pueden administrar 2-3 horas después de la comida), y sólo con agua.
Aproximadamente el 50-80% del bifosfonato disponible es captado por el hueso. El 30-50% restante se excreta en orina sin ser metabolizado. La captación del bifosfonato por el hueso se incrementa en condiciones de alto remodelado óseo o de menor excreción renal. La vida media en el plasma es de aproximadamente 1-2 horas, mientras que el bifosfonato suele persistir en el hueso por muchos años (1). En el hueso, los bifosfonatos se encuentran unidos con alta afinidad a los cristales de hidroxiapatita de la superficie ósea, inhibiendo su ruptura. Desde aquí se absorben rápidamente y se dirigen principalmente hacia áreas de remodelación activa, actuando como potentes inhibidores de la resorción ósea. Los bifosfonatos también impiden la formación de cristales de fosfato de calcio e inhiben la apoptosis de osteocitos y osteoblastos.
En modelos experimentales, se ha demostrado que inhiben la calcificación de los tejidos blandos, evitan la calcificación inducida por la vitamina D en la aorta y las arterias renales y también otras formas de calcificación ectópica1,2.
Mecanismo de acción.
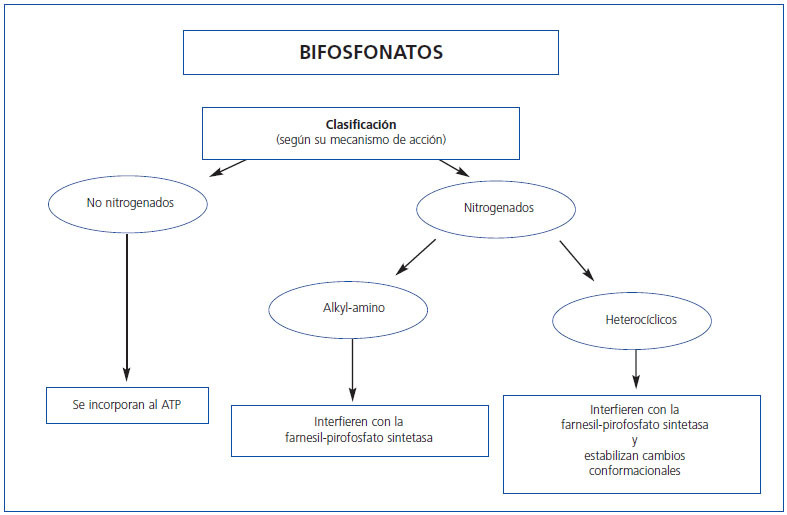
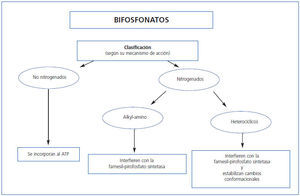
Se han propuesto dos mecanismos moleculares básicos responsables de los efectos de estos fármacos sobre la función osteoclástica (tabla 1, figura 2) que permiten su clasificación:
a) Los bifosfonatos que no contienen nitrógeno (etidronato, clodronato y tiludronato), considerados de primera generación, se unen a moléculas de ATP que, incorporadas en osteoclastos, llegan a ser citotóxicas para estas células, alterando su función celular y produciendo su apoptosis.
b) Los bifosfonatos nitrogenados, llamados de segunda y tercera generación (pamidronato, alendronato, ibandronato, risedronato y zolendronato) son más potentes que los anteriores. Inhiben a la farnesil pirofosfatasa sintasa y otros pasos finales de la vía intracelular del mevalonato, cuyo producto final es el colesterol.
En función de los diferentes radicales, los bifosfonatos varían en su afinidad mineral, poder de inhibición de la farnesil-pirofosfato sintetasa y capacidad de unión a la hidroxiapatita, lo que condicionará su potencia y sus efectos.
Si consideramos al etidronato como de potencia 1, el pamidronato tiene una potencia de 100, el alendronato de 1000, el risedronato de 5000, el ibandronato de 10000 y el zolendronato de 20000.
Teóricamente, a mayor potencia del fármaco, las dosis y frecuencia de administración deben ser menores, aunque se incrementa el riesgo de acúmulo y la probable toxicidad y efectos secundarios.
BIFOSFONATOS EN LA ERC.
En pacientes con deterioro de la función renal debemos ser cautelosos con la administración de estos fármacos, fundamentalmente porque los bisfosfonatos, en su eliminación renal, se filtran libremente por el glomérulo y se secretan de forma activa en el túbulo. Esto no significa que no puedan estar indicados en estos pacientes3.
Estudios experimentales en animales han mostrado que altas dosis de bifosfonatos pueden producir disminución del filtrado glomerular y alteraciones en la histología renal4.
No obstante, no todos los bifosfonatos se comportan igual. En animales de experimentación la administración de altas dosis de ibandronato (1 mg/Kg) no producen deterioro de la función renal, mientras que sí se ha visto leve deterioro con ácido zolendrónico (1 mg/Kg)5.
En estos mismos estudios, la administración de altas y repetidas dosis de ácido zolendrónico produjeron alteraciones en la histología renal con presencia de degeneración y atrofia tubular, hallazgos que apenas se evidenciaron con repetidas dosis de ibandronato5.
a) Experiencia clínica.
Si se revisan los estudios publicados hasta la fecha con bifosfonatos administrados por vía endovenosa, se observa un leve deterioro de la función renal en un 6-10% de todos los pacientes incluidos, excepto en el caso del ibandronato en que el porcentaje es solo del 2-3%6,7,8,9,10. Con las formas orales no se han reportado casos de deterioro de la función renal.
En pacientes oncológicos, la administración endovenosa de altas dosis de bifosfonatos se ha asociado a cierto grado de toxicidad renal. El pamidronato administrado en dosis muy superiores a las recomendadas, ha provocado en algunos casos proteinuria en rango nefrótico y glomerulonefritis colapsante11-14. También se han publicado cuadros de necrosis tubular aguda con altas dosis de ácido zolendrónico endovenoso15. Con el ibandronato endovenoso no se han recogido efectos secundarios16.
Con la administración de bifosfonatos orales, si bien se ha comunicado algún caso de afectación renal, siempre se trataba de pacientes con síndrome nefrótico previo y patología renal confirmada en los que la asociación del deterioro de función renal con el bifosfonato no queda del todo bien establecida17.
Fisiopatológicamente, la diferente toxicidad renal de estos fármacos puede deberse a diferentes factores como:
- su diferente capacidad de unión a proteínas, siendo el ibandronato el que posee el mayor porcentaje (87%),
- su distinta vida media en el tejido renal, que es baja con el ibandronato (24 días) si lo comparamos con el ácido zolendrónico, 150-200 días, y
- la diferente toxicidad renal acumulada, que también es menor en el caso del ibandronato9.
Con todo ello y en general, hay que remarcar que la toxicidad suele ser secundaria a la administración rápida y a dosis excesivas del fármaco.
b) Dosificación.
No se han realizado ensayos prospectivos en pacientes con deterioro de la función renal, aunque se ha podido observar que, en general, a las dosis recomendadas, estos fármacos no producen alteración de la función renal. No es necesario ajustar la dosis en los pacientes con insuficiencia renal leve o moderada (Clcr > 30 ml/min), aunque puede verse aumentado el riesgo de toxicidad renal en pacientes de edad avanzada, o que simultáneamente reciben otras drogas nefrotóxicas18-20.
En pacientes con aclaramientos inferiores a 30 ml/min hay una menor eliminación, siendo la concentración aproximadamente 2 veces mayor que en pacientes con función renal normal; por ello, es aconsejable la reducción de la dosis a la mitad15-21.
Curiosamente, en algunos pacientes con mieloma múltiple, se ha observado una mejoría no solo de la calcemia sino también de la función renal con la administración de ibandronato22.
c) Tiempo de infusión.
Aunque un trabajo reciente con ibandronato no objetivó diferencias al comparar un período de infusión de 60 min vs un período de 15 min23, en general, la velocidad de infusión puede también condicionar la toxicidad renal, observándose menor toxicidad cuando la infusión se realiza más lentamente24,25.
d) Eliminación en la ERC.
La eliminación renal de los bifosfonatos guarda una relación lineal con el aclaramiento de creatinina.
En pacientes con función renal normal, los bifosfonatos se eliminan rápidamente del plasma antes de las 2 primeras horas post administración, siendo la excreción renal la principal ruta de eliminación y el hueso el tejido que lo retiene. La captación por el esqueleto es del 47-82% y depende del remodelado óseo. Así, a mayor remodelado, mayor captación.
En pacientes en hemodiálisis la eliminación de los distintos tipos de bifosfonatos es similar. No se han encontrado diferencias entre el aclaramiento de estas sustancias en hemodiálisis respecto a la población con función renal normal26-30. Si a esto unimos que la duración de las sesiones es equivalente al período de eliminación del bifosfonato en pacientes con función renal normal, creemos conveniente administrar estos fármacos durante las primeras horas de diálisis.
En relación a la diálisis peritoneal, no existe apenas información, salvo un trabajo con clodronato, en el que no se encontraban diferencias en la actuación del fármaco respecto a los pacientes en hemodiálisis31.
INDICACIONES EN PACIENTES CON ERC.
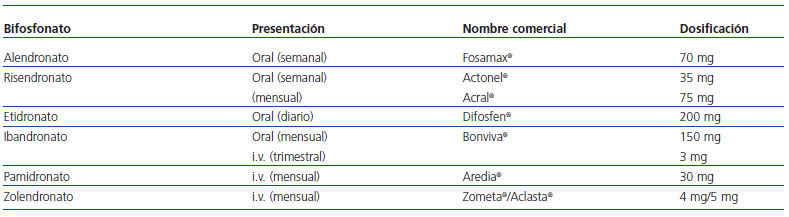
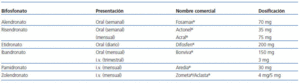
La forma de administración y dosificación varía entre los distintos tipos de bifosfonatos (tabla 2).
Las posibles indicaciones de los bifosfonatos, tanto en administración oral como endovenosa en pacientes con ERC son (tabla 3):
1) Prevención y tratamiento de la pérdida de masa ósea post trasplante renal.
Los bifosfonatos se han demostrado eficaces en la prevención de la pérdida ósea postrasplante. El pamidronato i.v. (60 mg el día 0, y 30 mg/mes desde el mes uno al sexto), el ibandronato i.v. (1 mg el día 0 y 2 mg los meses 3, 6 y 9), o el risedronato oral (35 mg/semana) previene la pérdida de densidad mineral ósea (DMO) en las diferentes regiones esqueléticas en los primeros dos años postrasplante32,33. No obstante, no está justificado el uso indiscriminado de bifosfonatos en el postrasplante. Parece recomendado su uso en pacientes con osteoporosis y/ó factores de riesgo de padecerla, como son: diabéticos tipo I, varones por encima de 65 y mujeres por encima de 45 años, fracturas óseas de estrés preexistentes e inmunosupresión con esteroides a altas dosis.
2) Tratamiento de la disminución de masa ósea en ERC estadios 3-5 y diálisis.
Existen pocos datos en este tipo de pacientes, lo cual es paradójico, si consideramos que los pacientes con ERC presentan un mayor riesgo de fracturas que la población general.
Estudios realizados en población general con pacientes que presentan deterioro de la función renal, han mostrado una mejoría de la DMO y una disminución del riesgo de fracturas, independientemente de la función renal34. Así mismo, en los pocos estudios publicados de pacientes en diálisis también se ha observado mejoría de la DMO, sobre todo cuando los pacientes presentaban unos valores de hormona paratiroidea (PTH) elevados35-38.
Se desconoce si la acumulación en el hueso se incrementa con el deterioro de la función renal. Habría que considerar que, en estos pacientes, el acúmulo podría provocar una disminución del remodelado óseo con dificultad en la reparación de microfracturas y deterioro de la calidad ósea. Por otro lado, también es cierto que en situaciones de bajo remodelado el acúmulo de bifosfonatos es menor.
Resumiendo, en los pacientes con ERC avanzada ó en diálisis, los bifosfonatos estarían indicados, sobre todo, ante la presencia de franca disminución de la masa ósea (z-score < 2,5) y la la existencia de factores de riesgo de osteoporosis (fracturas óseas previas, diabétes tipo I, varones de más de 65 y mujeres de más de 45 años), junto a alto remodelado óseo (PTH > 450 pg/ml). En situaciones con PTH < 100, indicativas de probable bajo remodelado, y aunque hasta la fecha se ha desaconsejado de forma taxativa el uso de bifosfonatos, parecería adecuado individualizar la situación. Se debe considerar y, en este caso, valorar la posibilidad de realización de biopsia ósea y tratamiento con hormona paratiroidea. En las situaciones con PTH entre 100-450 se debe también considerar cada caso de forma particular, aunque se puede ser más laxo.
3) Tratamiento de la Calcifilaxis.
Algunos estudios han mostrado que los bifosfonatos podrían tener un efecto beneficioso en el tratamiento de la calcifilaxis.
La inhibición de la resorción ósea que provocan los bifosfonatos podría disminuir la concentración de calcio en sangre, así como reducir la tendencia de los núcleos minerales para formarse y crecer en las paredes arteriales. Por otro lado, los bifosfonatos podrían inhibir la secreción de citoquinas pro-inflamatorias a nivel de la pared vascular y con ello mejorar el cuadro39.
Se han empleado tanto bifosfonatos de administración endovenosa (pamidronato) como de administración oral (alendronato o risedronato) con resultados similares40-42.
En nuestra experiencia, se ha conseguido la resolución de siete casos de calcifilaxis, cinco de ellos en pacientes en diálisis y dos con trasplante renal funcionante, con la administración durante 6 meses de alendronato en un caso, risedronato en otros tres e ibandronato en los últimos dos casos.
4) Tratamiento de la Hipercalcemia.
En los pacientes con ERC, podemos encontrar situaciones de hipercalcemia cuando se utilizan altas dosis de sales de calcio como captores del fósforo, con altas dosis de vitamina D, hipercalcemia maligna, mieloma múltiple y algún caso de hiperparatiroidismo primario. La administración de bifosfonatos endovenosos pueden ser útiles como complemento a las otras estrategias.
El pamidronato es el bifosfonato de experiencia más acumulada en el tratamiento de la hipercalcemia, aunque también existen experiencias con zolendronato e ibandronato43.
Se deben administrar por periodos muy breves para evitar la hipocalcemia a medio plazo. En nuestra experiencia y por su margen de seguridad recomendamos ibandronato 6 mg/ev como primera opción.
5) Prevención y tratamiento de la calcificación vascular.
El mecanismo por el cual los bifosfonatos inhiben la calcificación vascular no está dilucidado. Los diferentes mecanismos propuestos son: a) inhibición de la resorción ósea que conlleva una disminución de salida de calcio y fósforo desde el hueso limitando su disponibilidad para depositarse en el árbol vascular, b) modulación de la actividad del cotransportador NaP de las células musculares lisas, c) efecto directo sobre la pared vascular previniendo la formación de cristales de hidroxiapatita y d) efecto positivo sobre el eje osteoprotegerina/RANK-L44.
Los pacientes en diálisis presentan valores séricos bajos de pirofosfato, siendo uno de los posibles mecanismos que contribuyen al mayor índice de calcificaciones vasculares. La administración de bifosfonatos podria restablecer los niveles de pirofosfato45.
Existen muy pocos estudios en pacientes en diálisis y todos con un número reducido de pacientes. En la mayoría, los bifosfonatos a dosis bajas parecen tener efectos beneficiosos sobre las calcificaciones vasculares, habiendo mostrado una mejoría en las calcificaciones coronarias ó aórticas46-50.
No deja de ser una alternativa muy prometedora que necesita de estudios prospectivos más amplios para su validación.
OSTEONECROSIS DE MANDIBULA.
Merece una mención especial, si bien su incidencia es muy baja. Es excepcional que se presente con los bifosfonatos orales. Los factores de riesgo favorecedores incluyen la administración de bifosfonatos endovenosos durante largos períodos de tiempo, altas dosis de esteroides, abuso de alcohol y/ó tabaco y sobre todo factores locales como: patología periodontal, extracción dental y cirugía máxilo-facial51-53.
Es importante la prevención en pacientes con ERC, aunque hasta la fecha no se ha reportado ningún caso.
Se han desarrollado unas directrices básicas para el manejo de esta complicación en pacientes en tratamiento con bifosfonatos54:
- Antes de iniciar tratamiento con bifosfonatos, se deben extraer las piezas dentales con mal pronóstico y realizar todos los procedimientos dentales quirúrgicos.
- Como medida preventiva, durante el tratamiento con bifosfonatos y en el caso de cirugía dental, administrar antibiótico pre y postcirugía durante 10 días.
- Es fundamental, en todos los casos, mantener una buena higiene bucal.
PUNTOS CLAVE.
Los bifosfonatos pueden emplearse en diferentes estadios de enfermedad renal crónica incluyendo diálisis y trasplante renal.
En pacientes con filtrado glomerular inferior a 30 ml/min es aconsejable reducir la dosis a la mitad de la recomendada para pacientes con función renal normal.
Si bien se han descrito muy pocos efectos negativos sobre el riñón, con la administración endovenosa es importante mantener e incluso alargar el tiempo de infusión para evitar efectos secundarios. Con el ibandronato, hasta el momento actual, no se ha descrito patología renal.
La administración oral no parece alterar la función renal.
En los pacientes en hemodiálisis se debe administrar durante la sesión.
Hay que sopesar con cuidado la indicación de bifosfonatos en pacientes con sospecha de enfermedad ósea adinámica, siendo en este caso mandatoria la biopsia ósea.
Figura 1. Estructura molecular de los bifosfonatos.
Tabla 1. Clasificación de los bifosfonatos según su mecanismo de acción
Figura 2. Clasificación de los bifosfonatos según su mecanismo de acción.
Tabla 2. Bifosfonatos comercializados en nuestro país, tipo de presentación y nombre comercial
Tabla 3. Posibles indicaciones de los bifosfonatos en nefrología