Los fenómenos tromboembólicos son una complicación grave del síndrome nefrótico (SN) con una incidencia general de un 20%1. Sin embargo, las trombosis arteriales (TA) son raras en el adulto1,2. En este documento, describimos múltiples TA en un adulto con SN. El estudio genético evidenció una mutación de la antitrombina tipo Cambridge II (ACII). Hasta donde conocemos, este es el primer caso de SN con TA asociada con esta trombofilia genética.
Se trata de un varón de 73 años que consultó por edemas, de dos a tres semanas de evolución y disnea reagudizada en las últimas horas. Cuatro semanas antes había sufrido un ictus isquémico parietal derecho (albuminemia 2,7 mg/dL). Como antecedentes personales, era fumador de 50 años/paquete y tenía dislipemia e hipertensión arterial de unos meses de evolución. Su tratamiento diario consistía en enalapril 20 mg, atorvastatina 80 mg, ácido acetil salicílico 100 mg y furosemida 60 mg. Durante la exploración física se observaron los siguientes resultados: tensión arterial 120/73 mmHg, saturación de oxígeno 97%, edemas con fóvea hasta rodilla.
Los resultados de la analítica fueron hemograma normal, fibrinógeno 706 mg/dL, dímero D 1.7 microg/mL (vn [valor normal]: 0,3 a 0,5), resto de coagulación normal; creatinina 1,1 mg/dL, urea 39 mg/dL, albúmina 2 g/dL, colesterol 191 mg/dL, triglicéridos 80 mg/dL, iones normales. IgG 389 mg/dL, el resto de las inmunoglobulinas fueron normales sin componente monoclonal; complementos, autoinmunidad incluyendo anti-PLA2R, hormonas tiroideas, antígeno prostático específico (PSA), marcadores de hepatitis, virus de la inmunodeficiencia humana (VIH) y serología de lúes normales o negativos. Proteinuria 6,59 g/24 h sin componente monoclonal; sedimento con uno a tres hematíes por campo. El electrocardiograma (ECG) y el ecocardiograma resultaron normales. En la angiotomografía computarizada (Angio-TAC) de arterias pulmonares/tomografía computarizada (TAC) torácica se observó un defecto en la arteria segmentaria lateral de la pirámide basal derecha compatible con tromboembolismo pulmonar, por lo que se inició la anticoagulación (que se suspendió transitoriamente cuando fue necesario); en el lóbulo superior izquierdo se objetivó también una opacidad nodular de 10 mm. En el ecodoppler de extremidades inferiores (EEII), se encontró un aneurisma de arterias femoral/poplítea izquierdas, de 2 cm de diámetro, parcialmente trombosado, sin signos de trombosis venosa profunda. En la ecografía abdominal/eco doppler de vasos renales no hubo hallazgos patológicos en la ecoestructura renal, ni trombosis de venas renales. El TAC abdomino-pélvico evidenció un trombo mural de 6 mm de espesor en la aorta infrarrenal (fig. 1). Por biopsia renal, se obtuvieron 10 glomérulos con lesiones, por microscopía óptica e inmunofluorescencia, de glomerulonefritis membranosa. La gastroscopia fue normal; en la colonoscopia se evidenciaron adenomas de bajo grado displásico que se resecaron. Se realizó polipectomía de varios adenomas de bajo grado displásico. En cuanto al estudio de trombofilia, los resultados de anticuerpos (Ac) anticardiolipinas, anticoagulante lúpico, factor V Leiden, proteína C y S y gen de la protrombina fueron negativos o normales, mientras que la antitrombina fue de 66% (VN 80 a 100%), mediante el ensayo de reacción en cadena de polimerasa alelo-específica seguido de análisis de restricción, se identifica la mutación heterocigota (A384S) de la ACII.
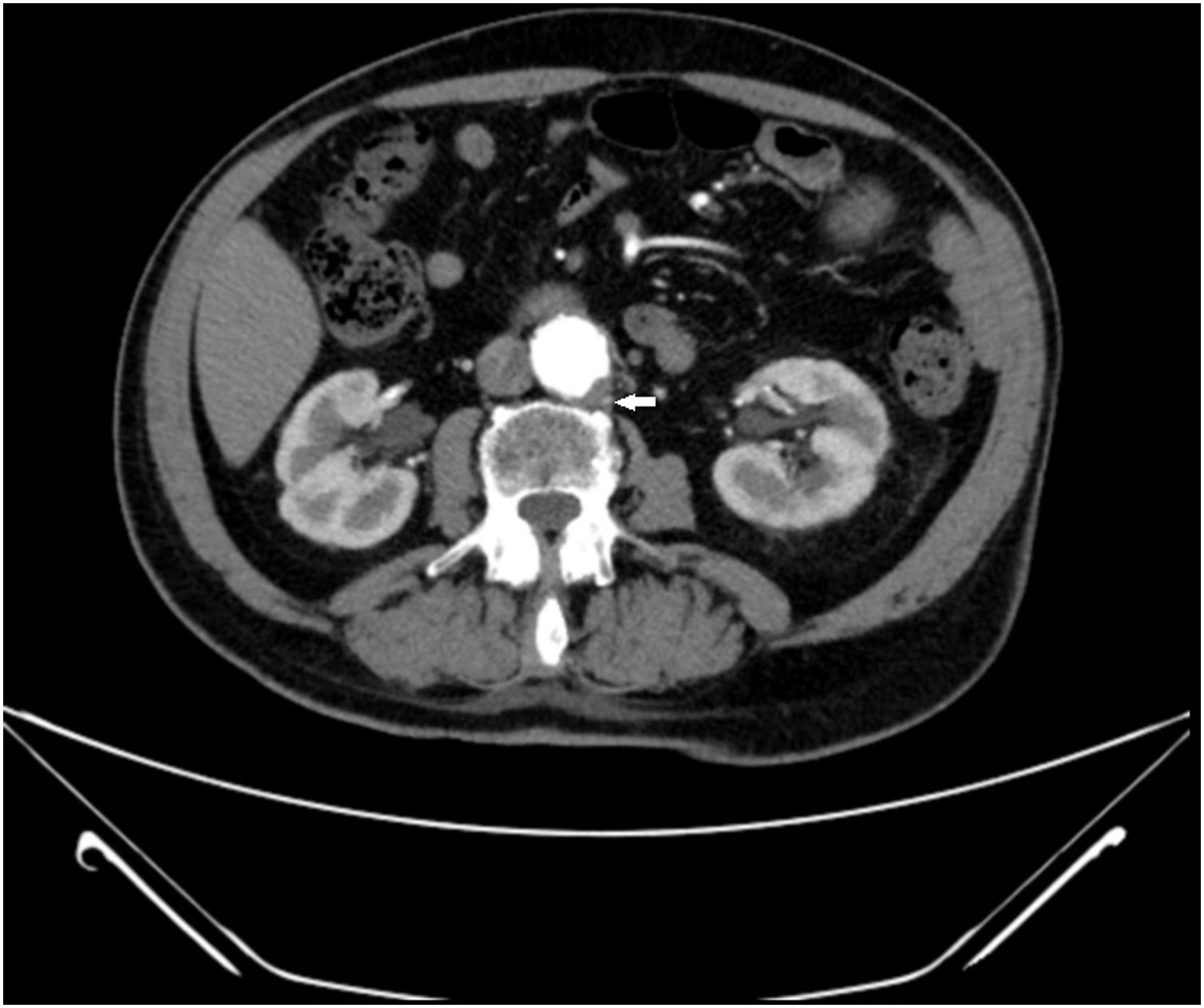
Trombosis aórtica
Tomografía axial computarizada de abdomen tras la administración de contraste intravenoso en fase arterial, en la que se observa la dilatación de la aorta infrarrenal de 32 x 27 mm, con pequeño trombo intramural en su vertiente posteroizquierda de 6 mm de espesor (flecha).
Se extirpó el nódulo pulmonar cuyo estudio histológico demostró un carcinoma broncogénico in situ. Al alta, se mantuvo la anticoagulación con heparina de bajo peso molecular; los niveles del factor Xa mostraban una anticoagulación adecuada. Al año de seguimiento, persiste una proteinuria 6,5 g en 24 h con hipoalbuminemia y la función renal conservada, anti-PLA2R negativos, sin datos de recidiva tumoral, posteriormente, se administra rituximab 1 g X 2.
La antitrombina es el factor anticoagulante fisiológico más importante del organismo, de peso molecular similar a la albúmina, ambos niveles se correlacionan en el SN3–5. El déficit de antitrombina está presente en el 70% de los SN6 y favorece el estado de hipercoagulabilidad multifactorial de este síndrome (tabla 1) que, habitualmente, induce trombosis venosa1,7. En cambio, en el SN la TA se describe en niños y suele localizarse en extremidades inferiores y coronarias; la afectación aórtica es muy rara y potencialmente catastrófica8,9. Algunos autores apuntan a la hipoalbuminemia severa (1,6 mg/dL) y al empleo de diuréticos y corticoides como factores de riesgo2,5. La nefropatía membranosa no es necesariamente la causa más frecuente de SN asociado con TA2,4. En nuestro paciente con trombosis en poplítea, arteria femoral, aorta y un ictus isquémico, existían factores de riesgo de TA como la dislipemia, la hipertensión arterial y el tabaquismo, y se descartaron otras diátesis trombogénicas implicadas en la TA como son los déficits de proteínas C y S o el síndrome antifosfolípido8.
Hipercoagulabilidad del SN
| Mecanismos: aumento de factores: V, VII, von Willebrand, inhibidor de la plasmina alfa2, inhibidor del activador del plasminógeno, fibrinógeno |
| Pérdidas urinarias: antitrombina, posiblemente proteína C y S |
| Aumento de la agregación plaquetaria |
| Disminución del plasminógeno |
| Nefropatías implicadas: membranosa, membranoproliferativa, cambios mínimos, esclerosante y focal |
| Factores de riesgo: membranosa*, diuréticos, esteroides, venopunción repetida, neoplasias* |
| Localización venosa: vena renal (35%), tromboembolismo pulmonar (8%), TVP EEII (10%) |
| Localización arterial: renal, aórtica, femoral, cerebral, mesentérica, coronaria |
| Anticoagulación profiláctica: en caso de albuminemia < 2 g/dL |
Por otra parte, la ACII se debe a una mutación en el gen de la antitrombina, de herencia autosómica dominante y penetrancia variable. Esta mutación provoca un déficit funcional local y no circulante de antitrombina, y su prevalencia está probablemente infraestimada con los métodos diagnósticos rutinarios al no afectar a la actividad ni a los niveles de los parámetros de la coagulación9. La ACII es un factor de riesgo moderado trombótico venoso y arterial9,10; en este último territorio, parece alterar la capacidad de regulación de la trombina a nivel endotelial. Esta disfunción se encontraría potenciada en situaciones de hipercoagulabilidad9, como pudiera ser el SN y es factible que haya desempeñado algún papel en las trombosis de este paciente. Desde el punto de vista terapéutico, en presencia de la ACII parece que la heparina no fraccionada muestra una menor eficacia anticoagulante que la heparina de bajo peso molecular.
La patogenia de la enfermedad arterial implica múltiples fenómenos genéticos y ambientales, por ello, ante la presencia de TA en el SN se debe excluir, dentro de las posibilidades diagnósticas, la presencia de factores genéticos protrombóticos por su potencial relevancia pronóstica y terapéutica.
FinanciaciónLos autores declaran que no han recibido financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecimientos al Dr. Jaime Corral que realizó el estudio genético de la antitrombina y al Dr. Ricardo Enríquez por su colaboración.