El mieloma múltiple (MM) es una tumoración hematológica que se caracteriza por la proliferación incontrolada de células plasmáticas y la existencia de una importante cantidad de cadenas libres en sangre (CLLs) que puede ocasionar un fallo renal agudo por la precipitación intratubular de ellas, causando nefropatía por cilindros.
La insuficiencia renal aguda es una complicación que puede presentarse en más de un 20% de los pacientes con MM, y la mitad de estos precisarán diálisis.
MétodosPresentamos nuestra experiencia de 13 pacientes tratados con diálisis mediante filtros de high cut off (HCO), durante el período comprendido entre julio de 2011 y febrero de 2015.
Se realizan 6 sesiones consecutivas de 6 h de duración, utilizando un filtro de HCO (Theralite® de Gambro®) de 2,1 m2 de superficie. Posteriormente se continúa con sesiones a días alternos de igual duración.
ResultadosSe realizaron un total de 151 sesiones; una media de 11,6 sesiones/paciente (rango 6-27).
El tratamiento se mostró efectivo para eliminar tanto CLLs kappa como lambda. El porcentaje de disminución de CLLs desde el inicio hasta el final del tratamiento fue del 93,7%. La reducción media por sesión de diálisis fue del 57,7%. En 10 de los 13 casos se recuperó la función renal y los pacientes pudieron permanecer sin diálisis.
No hubo grandes cambios en los niveles de albúmina utilizando un protocolo de infusión de 2 viales de 50mL de albúmina al 20% al final de la sesión de diálisis.
ConclusionesEl tratamiento combinado con quimioterapia más diálisis largas con filtros de HCO resultó eficaz para reducir el nivel de CLLs y recuperar un nivel de función renal suficiente en el 77% de los casos. Con filtros de HCO se consigue un ahorro significativo, en contraposición a lo descrito previamente en la literatura.
Multiple myeloma (MM) is a haematological tumour that is characterised by uncontrolled proliferation of plasma cells and a significant volume of serum free light chains (sFLCs), which can cause acute renal failure due to intratubular precipitation, resulting in cast nephropathy.
Acute renal failure is a complication that can arise in more than 20% of patients with multiple myeloma, half of which will require dialysis.
MethodsWe report our experience with 13 patients who were treated with dialysis using high cut off filters (HCO) between July 2011 and February 2015.
A total of 6 consecutive 6-hour sessions were performed using a 2.1 m2 HCO filter (Theralite® by Gambro®). Afterwards, further 6-hour sessions were continued on alternate days.
ResultsA total of 151 sessions were conducted, with an average of 11.6 sessions per patient (range 6-27).
The treatment proved to be effective in removing both kappa and lambda sFLCs, resulting in a 93.7% fall in sFLCs by the end of treatment. The average reduction was 57.7% per dialysis session. 10 out of the 13 cases recovered sufficient renal function to become independent of dialysis.
There were no major changes in albumin levels using an infusion protocol of 2 50-mL vials of 20% albumin at the end of the dialysis session.
ConclusionsCombination treatment with chemotherapy and long dialysis with HCO filters was effective in reducing the sFLC levels and recovering sufficient renal function in 77% of cases. With HCO filters, significant cost savings are achieved, contrary to what was previously believed.
El mieloma múltiple (MM) es una enfermedad neoplásica caracterizada por una proliferación incontrolada de células plasmáticas en la médula ósea1, que produce una liberación excesiva de inmunoglobulinas y sus cadenas, que quedan circulantes en sangre. La formación de cilindros en los túbulos distales ocasionados por el depósito de cadenas ligeras junto a la proteína de Tamm-Horsfall es la causante de la mayor parte de los fracasos renales en estos pacientes2,3.
Existen 2 tipos de cadenas ligeras: cadenas kappa, que son formas monoméricas de 22,5 KDa de peso molecular, y lambda, que son dímeros de 45 KDa de peso molecular.
El MM representa el 0,1% de las neoplasias. En España son diagnosticados más de 2.000 nuevos casos cada año, con una incidencia de 5-6 casos/100.000 habitantes, lo que representa el 13% de los cánceres hematológicos4. Se trata de una enfermedad más frecuente en adultos, solo el 15% tiene menos de 50 años, y la incidencia máxima se encuentra entre los 60 y 70 años; afecta más a hombres que a mujeres y más a negros que a blancos5.
La esperanza de vida es inferior a un año, si existe insuficiencia renal, aunque con tratamiento se puede alargar hasta 5-7 años5,6.
El 20% de los pacientes con MM puede presentar una insuficiencia renal aguda y la mitad de ellos puede precisar diálisis. La insuficiencia renal aguda puede agravarse por diversas circunstancias, como la deshidratación, la hipercalcemia, la hiperuricemia, la hiperviscosidad7, el empleo de fármacos nefrotóxicos, etc.
Las manifestaciones clínicas al principio son muy inespecíficas, lo que puede retrasar el diagnóstico; posteriormente aparecen los primeros síntomas, como dolor óseo, fracturas patológicas, anemia, fatiga, hipercalcemia, infecciones, insuficiencia renal aguda, y otras.
La afectación renal aguda o crónica suele ser la segunda causa de muerte y su presencia ensombrece el pronóstico.
Las causas de disfunción renal en pacientes con mieloma incluyen una alteración tubular proximal y distal por daño celular por las cadenas ligeras filtradas, nefropatía por cilindros, amiloidosis, enfermedad por depósito de cadenas ligeras o pesadas8, crioglobulinemia, infiltración intersticial por células plasmáticas y, en raras ocasiones, una glomerulonefritis proliferativa o una nefritis intersticial9.
El tratamiento de la insuficiencia renal aguda se asienta sobre 3 pilares:
- 1.
Eliminar factores que agravan la nefrotoxicidad y la formación de cilindros: hidratación adecuada (2-3 L de líquidos al día). La deshidratación ralentiza el flujo tubular y aumenta la concentración de cadenas ligeras libres (CLLs), incrementando la formación de agregados. Evitar la furosemida (solo con euvolemia). Evitar nefrotóxicos, sobre todo antiinflamatorios no esteroideos, inhibidores de la enzima de conversión, antagonistas del receptor de la angiotensina II y la exposición a contrastes. Tratar la hiperuricemia. Tratar la hipercalcemia: (si calcio<14mg/dL, administrar líquidos y si persiste la hipercalcemia, añadir bifosfonatos; si calcio >14mg/dL, administrar bifosfonatos de entrada).
- 2.
Eliminar o reducir la producción de CLL por las células neoplásicas. El régimen usual de quimioterapia empleado en el MM mejora la insuficiencia renal en aproximadamente el 50% de los casos. Las lesiones tubulares responden mejor que las glomerulopatías10.
Sobre el tratamiento quimioterápico, cabe señalar que en los últimos años hemos asistido a una revolución en el tratamiento del MM. Durante años el tratamiento habitual de estos pacientes era la dexametasona más melfalán (agente alquilante). En los últimos años han aparecido nuevos fármacos que han proporcionado un aumento de la supervivencia de estos pacientes, los principales son:
El bortezomib, que ha constituido uno de los principales avances en el tratamiento del MM.
La talidomida y la lenalidomida para el tratamiento de pacientes en recaída se están utilizando ya desde hace unos años, y últimamente ha aparecido la pomalidomida11.
La bendamustina (alquilante) y el melfluten, que buscan un efecto menos tóxico y más específico que el resto de alquilantes12.
Por último, los anticuerpos monoclonales, que van dirigidos específicamente contra las dianas de la célula tumoral. Entre estas nuevas moléculas tenemos: elotuzumab, el CD38 y el SLAM-F7; además, hay otros en estudio13,14.
Todas estas nuevas alternativas permiten ser optimistas sobre el futuro y pensar que, si no conseguimos la curación, al menos seremos capaces de convertir el MM en una enfermedad crónica.
- 3.
Eliminar o reducir las CLL circulantes. La recuperación renal está asociada a una reducción temprana de CLL en suero. Hutchison, utilizando filtros de high cut-off (HCO) y hemodiálisis largas de 6h, consigue reducciones de CLLs superiores al 85% y hasta un 60% de los pacientes recuperan una función renal suficiente para permanecer sin necesidad de diálisis15.
Los métodos clásicos de depuración extracorpórea, como la hemodiálisis o la plasmaféresis, no permiten un aclaramiento eficaz de las CLLs. En la diálisis convencional la membrana del dializador no tiene el tamaño de poro adecuado para eliminarlas y hay un aclaramiento mínimo. En la plasmaféresis solo se elimina un 10-20% de las CLL que están en el espacio intravascular, mientras que el resto está en el espacio extravascular, lo que dificulta su eliminación con los recambios de volumen plasmático, además de originar una pérdida importante de proteínas esenciales16,17.
Otro tipo de técnica es la hemodiafiltración con regeneración del ultrafiltrado mediante adsorción de resina (HFR supra) que utiliza convección, adsorción y difusión con un dializador de doble cámara18,19. Aunque es algo más económico, son pocos los estudios realizados, estos se han hecho en muy pocos pacientes y parece útil solo en el tipo de cadenas kappa, no en las lambda.
Recientemente se han desarrollado otro tipo de membranas llamadas de alta permeabilidad, alto poro o HCO, que sí son eficaces para reducir las cadenas ligeras en sangre (hasta el 90%) durante sesiones prolongadas de 6-8 h15. Está demostrado que un diagnóstico y tratamiento precoz en la disminución de las CLLs en las 3 primeras semanas se asocia con un aumento significativo de la supervivencia20. El tamaño del poro es efectivo para las CLLs, pero conlleva la pérdida de proteínas a través del dializador, lo que requiere administrar albúmina al final de cada sesión. Otros suplementos suelen ser necesarios durante las sesiones de hemodiálisis, los más frecuentes: calcio, fósforo, magnesio y potasio.
ObjetivoEl objetivo del artículo es presentar nuestra experiencia de 13 casos de tratamiento de la insuficiencia renal aguda secundaria a MM con filtros de HCO.
MétodosSe utilizó un monitor Integra Hospal®, equipado con ultrafiltros de 1,4 m2, agua ultrapura, cartucho de bicarbonato (Bicart® de Hospal®) y ácido centralizado en circuito cerrado.
El cebado del circuito se realizaba con Prontoprime® 2.000mL a una velocidad de 100mL/min y con una ultrafiltración de 2kg/h; es importante el cuidadoso cebado del circuito sanguíneo para evitar en lo posible la presencia de burbujas de aire que pudiera favorecer la coagulación y disminuir la eficacia de la diálisis.
El dializador empleado en todos los casos es un filtro de HCO de 2,1 m2 de superficie Theralite® de Gambro®.
Se realizaron diálisis diarias durante 6 sesiones, para pasar posteriormente a diálisis a días alternos hasta alcanzar niveles de CLLs inferiores a 500mg/L o recuperación de la función renal que permitiera prescindir de la diálisis.
La duración de las diálisis fue de 6 h con flujos de sangre bajos de 250 a 300mL/min y flujo de baño de 500mL/min. Disponemos en nuestra unidad de 3 baños diferentes de diálisis, habitualmente fue empleado un baño con potasio 3 mEq/L para evitar la hipopotasemia, sobre todo, en el período en que la diálisis era diaria. Otros componentes eran: calcio 3,5 mEq/L, magnesio 0,9 mEq/L, sodio .139 mEq/L y glucosa 1,5g/L.
La pauta habitual de heparina fue: 2.500 UI de heparina sódica de inicio en bolo y bomba de infusión continua a 1.500 UI por hora, con parada de bomba 30 min antes de terminar la sesión de diálisis.
Se administraron suplementos durante las sesiones de diálisis: el tamaño del poro conlleva la pérdida de proteínas a través del dializador, por lo que se requiere administrar albúmina hacia el final de la sesión. Nosotros protocolizamos la infusión durante la última hora de la diálisis de 2 viales de 50mL de albúmina humana al 20% (20g). Otros suplementos fueron necesarios en ocasiones, como gluconato cálcico, sulfato de magnesio o Epoetin beta.
El acceso vascular habitual era un catéter temporal (Shalldon), colocado en la yugular derecha; los catéteres se sellaban con heparina sódica al 1%. En una ocasión fue necesaria la colocación de catéter permanente tunelizado de tipo Tesio®. Ambas técnicas eran realizadas por los nefrólogos del propio Servicio de Nefrología.
Se realizó monitorización de: función renal, cadenas ligeras libres en sangre (CLLs) con el sistema Frelite the Bindin Site® pre- y posdiálisis, urea, creatinina, cloro, sodio, así como potasio pre- y posdiálisis. Además, se medía prediálisis: calcio total, calcio iónico, magnesio y hemograma, albúmina a mitad de sesión y nuevamente urea, creatinina e iones posdiálisis. También tenemos protocolizada la determinación de serologías VHB, VHC y VIH al inicio de diálisis.
En la gráfica de enfermería se anotaban los flujos de sangre horarios, las presiones venosas, la ultrafiltración horaria y total, la tensión arterial y la frecuencia cardiaca, la temperatura, la administración de medicación, así como todas las incidencias que se registraban durante las diálisis21.
Todos los pacientes firmaron un consentimiento informado para la colocación del acceso vascular y otro para la realización de la hemodiálisis.
ResultadosDurante un período de 43 meses, desde julio de 2011 hasta febrero de 2015, hemos realizado un total de 13 tratamientos mediante hemodiálisis con filtro de HCO, en pacientes con insuficiencia renal aguda secundaria a MM. No obstante, han sido 12 pacientes, pues uno de ellos tuvo una recaída y fue nuevamente tratado.
Fueron 9 varones y 3 mujeres, con una edad media de 60,8 años y edades comprendidas entre los 43 y los 71 años.
Existía igual número de pacientes con cadenas kappa y lambda, 6 en cada caso.
En cuanto al infiltrado de médula ósea, podemos decir que conocemos el resultado en 10 pacientes y todos ellos presentaban niveles elevados de células plasmáticas (y en un caso, evidencia de plasmocitoma) con rangos entre 13 y 93%.
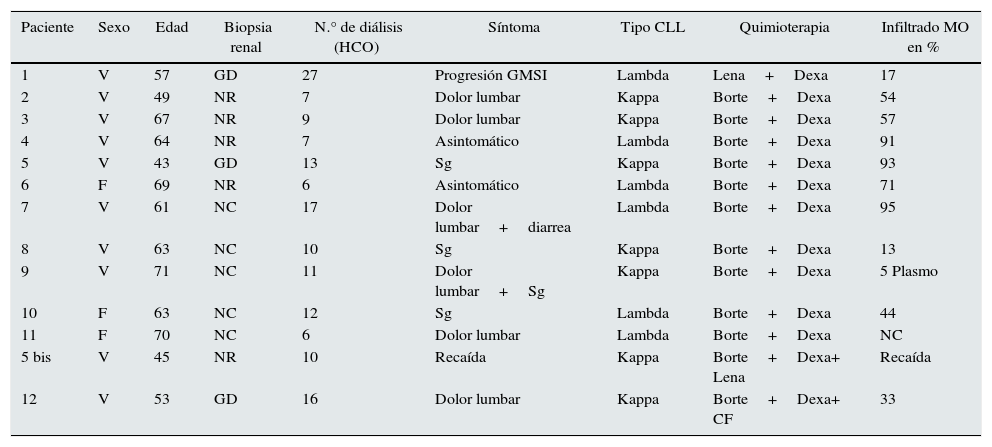
Se realizaron 8 biopsias renales, 4 pacientes no fueron biopsiados; los resultados fueron: 5 nefropatías por cilindros, 2 afectaciones glomerulares por depósitos más nefropatías por cilindros y un caso de solo afectación glomerular, pero con cifras muy elevadas de CLLs (69.000mg/L), por lo que pensamos que en caso de no ser tratado terminaría produciéndose una nefropatía por cilindros (tabla 1).
Datos de filiación, biopsia renal, número diálisis realizadas, síntomas, tipo de cadena, tratamiento, infiltrado de médula ósea
| Paciente | Sexo | Edad | Biopsia renal | N.° de diálisis (HCO) | Síntoma | Tipo CLL | Quimioterapia | Infiltrado MO en % |
|---|---|---|---|---|---|---|---|---|
| 1 | V | 57 | GD | 27 | Progresión GMSI | Lambda | Lena+Dexa | 17 |
| 2 | V | 49 | NR | 7 | Dolor lumbar | Kappa | Borte+Dexa | 54 |
| 3 | V | 67 | NR | 9 | Dolor lumbar | Kappa | Borte+Dexa | 57 |
| 4 | V | 64 | NR | 7 | Asintomático | Lambda | Borte+Dexa | 91 |
| 5 | V | 43 | GD | 13 | Sg | Kappa | Borte+Dexa | 93 |
| 6 | F | 69 | NR | 6 | Asintomático | Lambda | Borte+Dexa | 71 |
| 7 | V | 61 | NC | 17 | Dolor lumbar+diarrea | Lambda | Borte+Dexa | 95 |
| 8 | V | 63 | NC | 10 | Sg | Kappa | Borte+Dexa | 13 |
| 9 | V | 71 | NC | 11 | Dolor lumbar+Sg | Kappa | Borte+Dexa | 5 Plasmo |
| 10 | F | 63 | NC | 12 | Sg | Lambda | Borte+Dexa | 44 |
| 11 | F | 70 | NC | 6 | Dolor lumbar | Lambda | Borte+Dexa | NC |
| 5 bis | V | 45 | NR | 10 | Recaída | Kappa | Borte+Dexa+ Lena | Recaída |
| 12 | V | 53 | GD | 16 | Dolor lumbar | Kappa | Borte+Dexa+ CF | 33 |
Borte: bortezomid; CF: ciclofosfamida; CLL: cadenas ligeras libres; Dexa: dexametasona; GD: depósitos glomerulares; HCO: número de diálisis con filtro de high cut off; Lena: lenaledomida; MO: médula ósea; NC: nefropatía por cilindros; NR: no realizada; Plasmo: plasmocitoma; Sg: síndrome general.
El tratamiento con quimioterapia fue bortezomib más dexametasona en 10 ocasiones (1.ª línea). Al paciente número 1 se le trató con lenaledomida más dexametasona (2.ª línea). El paciente número 5 bis (recaída) fue tratado con bortezomib más dexametasona más lenalidomida, y al paciente número 12 se le trató con beortezomib, dexametasona y ciclosporina.
La media de los días trascurridos desde que se inició el fracaso renal agudo hasta que fue tratado con hemodiálisis mediante filtro de HCO fue de 27,3 días, con un rango entre 0 y 90. El paciente de 0 días fue la recaída, debido a la estrecha vigilancia a la que era sometido. En los que recuperaron la función renal trascurrieron 24,5 días, y 34 en los que no la recuperaron.
Se realizaron en total 151 sesiones de diálisis; la media de días que permanecieron en tratamiento dialítico con el filtro de HCO fue de 11,6, con un rango entre 6 y 27 sesiones. Un total de 7 pacientes precisaron menos de 10 sesiones; 5 entre 11 y 17 sesiones; uno de ellos precisó 27 sesiones, pero se logró la recuperación de la función renal y un nivel de CLLs inferior a 500mg/L (tabla 1).
Actualmente 6 pacientes tienen una buena evolución y permanecen sin necesidad de diálisis, 3 pacientes están en hemodiálisis convencional y 3 pacientes han fallecido.
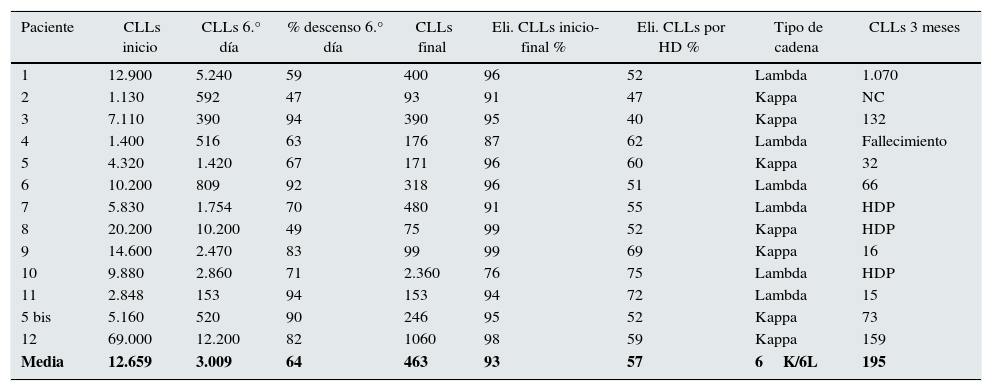
La media de CLLs al inicio del tratamiento fue de 11.036mg/L, con un rango muy amplio, entre 69.000 y 1.130mg/L. El porcentaje de disminución de CLLs desde el inicio hasta el final del tratamiento fue 93,7%. La reducción media por sesión de diálisis fue del 57,7%, con rango comprendido entre el 40,2 y el 75,4%. Los 6 casos con cadenas lambda tuvieron una eliminación media del 61,3% y los 7 casos de cadenas kappa, de un 54,6%. Después de las 6 primeras sesiones de tratamiento, el descenso medio de CLLs fue del 64,2% (tabla 2).
Evolución de CLL inicio, 6.° día, y final, % eliminación, tipo de cadena ligera
| Paciente | CLLs inicio | CLLs 6.° día | % descenso 6.° día | CLLs final | Eli. CLLs inicio-final % | Eli. CLLs por HD % | Tipo de cadena | CLLs 3 meses |
|---|---|---|---|---|---|---|---|---|
| 1 | 12.900 | 5.240 | 59 | 400 | 96 | 52 | Lambda | 1.070 |
| 2 | 1.130 | 592 | 47 | 93 | 91 | 47 | Kappa | NC |
| 3 | 7.110 | 390 | 94 | 390 | 95 | 40 | Kappa | 132 |
| 4 | 1.400 | 516 | 63 | 176 | 87 | 62 | Lambda | Fallecimiento |
| 5 | 4.320 | 1.420 | 67 | 171 | 96 | 60 | Kappa | 32 |
| 6 | 10.200 | 809 | 92 | 318 | 96 | 51 | Lambda | 66 |
| 7 | 5.830 | 1.754 | 70 | 480 | 91 | 55 | Lambda | HDP |
| 8 | 20.200 | 10.200 | 49 | 75 | 99 | 52 | Kappa | HDP |
| 9 | 14.600 | 2.470 | 83 | 99 | 99 | 69 | Kappa | 16 |
| 10 | 9.880 | 2.860 | 71 | 2.360 | 76 | 75 | Lambda | HDP |
| 11 | 2.848 | 153 | 94 | 153 | 94 | 72 | Lambda | 15 |
| 5 bis | 5.160 | 520 | 90 | 246 | 95 | 52 | Kappa | 73 |
| 12 | 69.000 | 12.200 | 82 | 1060 | 98 | 59 | Kappa | 159 |
| Media | 12.659 | 3.009 | 64 | 463 | 93 | 57 | 6K/6L | 195 |
CLLs: evolución de cadenas ligeras libres en sangre.
Unidades: mg/L.
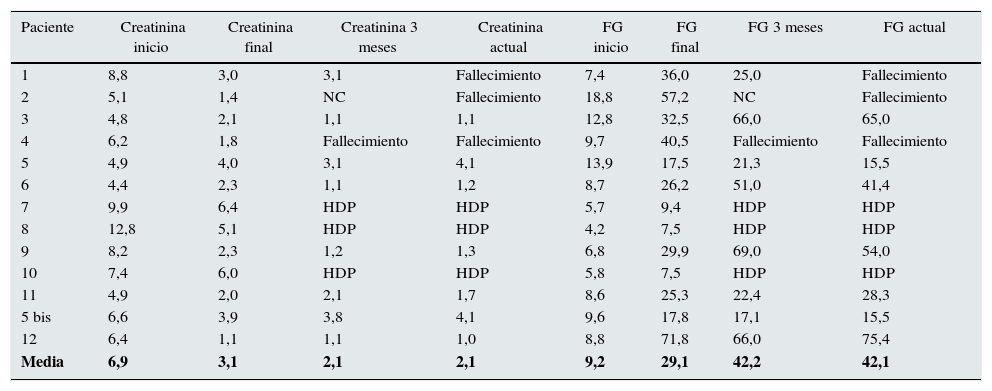
De los 13 pacientes, 10 consiguieron una recuperación parcial de función renal, suficiente como para no precisar sesiones de diálisis. La media de creatinina sérica con que se inició la hemodiálisis fue de 6,95mg/dL (12,8-4,4); y la final, de 3,18mg/dL (6,0-1,1). A los 3 meses, la creatinina de los 8 pacientes que permanecían sin diálisis era de 2,2mg/dL (3,8-1,1) y la creatinina actual (última analítica realizada) de los 7 pacientes que continúan sin diálisis es de 2,1mg/dL (4,1-1,0). Es nuestra intención continuar el seguimiento de estos pacientes de forma indefinida para poder establecer la supervivencia alcanzada (tabla 3).
Evolución de creatinina y FG en pacientes con FRA secundario a MM, tratados con filtros de HCO
| Paciente | Creatinina inicio | Creatinina final | Creatinina 3 meses | Creatinina actual | FG inicio | FG final | FG 3 meses | FG actual |
|---|---|---|---|---|---|---|---|---|
| 1 | 8,8 | 3,0 | 3,1 | Fallecimiento | 7,4 | 36,0 | 25,0 | Fallecimiento |
| 2 | 5,1 | 1,4 | NC | Fallecimiento | 18,8 | 57,2 | NC | Fallecimiento |
| 3 | 4,8 | 2,1 | 1,1 | 1,1 | 12,8 | 32,5 | 66,0 | 65,0 |
| 4 | 6,2 | 1,8 | Fallecimiento | Fallecimiento | 9,7 | 40,5 | Fallecimiento | Fallecimiento |
| 5 | 4,9 | 4,0 | 3,1 | 4,1 | 13,9 | 17,5 | 21,3 | 15,5 |
| 6 | 4,4 | 2,3 | 1,1 | 1,2 | 8,7 | 26,2 | 51,0 | 41,4 |
| 7 | 9,9 | 6,4 | HDP | HDP | 5,7 | 9,4 | HDP | HDP |
| 8 | 12,8 | 5,1 | HDP | HDP | 4,2 | 7,5 | HDP | HDP |
| 9 | 8,2 | 2,3 | 1,2 | 1,3 | 6,8 | 29,9 | 69,0 | 54,0 |
| 10 | 7,4 | 6,0 | HDP | HDP | 5,8 | 7,5 | HDP | HDP |
| 11 | 4,9 | 2,0 | 2,1 | 1,7 | 8,6 | 25,3 | 22,4 | 28,3 |
| 5 bis | 6,6 | 3,9 | 3,8 | 4,1 | 9,6 | 17,8 | 17,1 | 15,5 |
| 12 | 6,4 | 1,1 | 1,1 | 1,0 | 8,8 | 71,8 | 66,0 | 75,4 |
| Media | 6,9 | 3,1 | 2,1 | 2,1 | 9,2 | 29,1 | 42,2 | 42,1 |
Hemodiálisis periódica y filtrado glomerular en mL/min; creatinina en mg/dL.
FG: filtrado glomerular; HCO: filtros de high cut off; HDP: hemodiálisis periódica; MM: mieloma múltiple.
También monitorizamos la función renal mediante la fórmula del MDRD-4, aun no siendo el método adecuado en pacientes con insuficiencia renal aguda, pues no disponíamos de otro. Además, este es el método que se emplea en el estudio multicéntrico liderado por Hutchison y aún no publicado EuLITE.
Al inicio del tratamiento con hemodiálisis con HCO el filtrado glomerular (FG) estimado tenía como media 9,29mL/min (18,8-4,2). Al finalizar el tratamiento, la media del FG era de 29,16mL/min (71,8-7,5). Si consideramos la media del FG de los 10 pacientes que respondieron al tratamiento combinado con quimioterapia más diálisis con filtro de HCO, esta se eleva hasta 35,4mL/min. Por su parte, la media de los 3 pacientes que no respondieron al tratamiento quedó en 8,12mL/min.
El filtrado glomerular estimado (FGe) de los 8 pacientes que permanecían sin tratamiento a los 3 meses era de 39,8mL/min (69-17,1) y actualmente los 7 pacientes que han tenido una buena evolución y continúan sin precisar diálisis tienen una media de FG de 41,44mL/min. (75,4-15,5) (tabla 3).
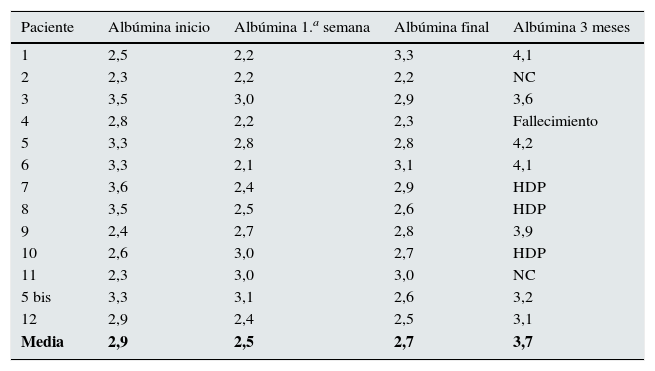
Uno de los parámetros que más preocupa es la pérdida de proteínas. Determinamos la albúmina antes de iniciar el tratamiento y obtuvimos una media de 2,95g/dL, (3,6-2,3) a la primera semana de tratamiento la albúmina había descendido hasta los 2,58g/dL (3,2-2,1), a pesar de la infusión de 2 viales de 50mL de albúmina humana al 20% (20g). Sin embargo, al finalizar el tratamiento dialítico, la albúmina había aumentado hasta los 2,75g/dL (3,3-2,2) y a los 3 meses la albúmina determinada en los pacientes que habían tenido una buena evolución y permanecían sin diálisis estaba dentro de los límites de la normalidad 3,85g/dL (4,2-3,2), muy superior a la del inicio del tratamiento dialítico (tabla 4).
Evolución de la albúmina en pacientes con FRA secundario a MM, tratados con filtros HCO
| Paciente | Albúmina inicio | Albúmina 1.a semana | Albúmina final | Albúmina 3 meses |
|---|---|---|---|---|
| 1 | 2,5 | 2,2 | 3,3 | 4,1 |
| 2 | 2,3 | 2,2 | 2,2 | NC |
| 3 | 3,5 | 3,0 | 2,9 | 3,6 |
| 4 | 2,8 | 2,2 | 2,3 | Fallecimiento |
| 5 | 3,3 | 2,8 | 2,8 | 4,2 |
| 6 | 3,3 | 2,1 | 3,1 | 4,1 |
| 7 | 3,6 | 2,4 | 2,9 | HDP |
| 8 | 3,5 | 2,5 | 2,6 | HDP |
| 9 | 2,4 | 2,7 | 2,8 | 3,9 |
| 10 | 2,6 | 3,0 | 2,7 | HDP |
| 11 | 2,3 | 3,0 | 3,0 | NC |
| 5 bis | 3,3 | 3,1 | 2,6 | 3,2 |
| 12 | 2,9 | 2,4 | 2,5 | 3,1 |
| Media | 2,9 | 2,5 | 2,7 | 3,7 |
Albúmina en g/dL.
FRA: fracaso renal agudo; HCO: filtros high cut off; HDP: hemodiálisis periódica; MM: mieloma múltiple.
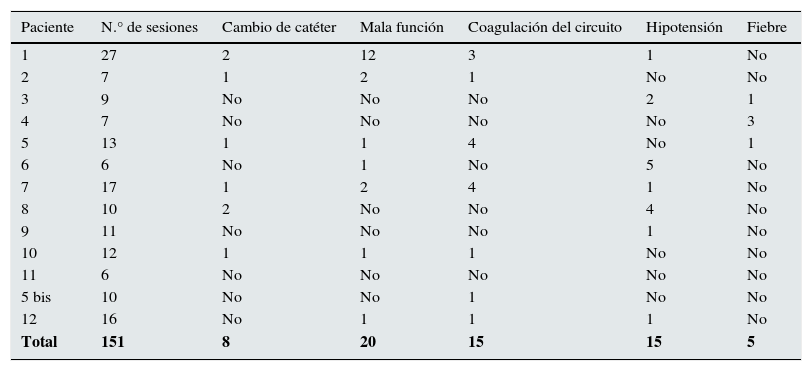
Todos los pacientes eran portadores de catéter temporal yugular. Se realizaron un total de 8 recambios de catéter en 6 pacientes, incluso en el paciente 1 se colocó un catéter permanente de tipo Tesio® debido al largo período de tratamiento (27 sesiones).
Los flujos medios fueron de 250-300mL/min, como estaban pautados, pero en 7 pacientes y durante 20 sesiones se registraron problemas de flujo o de obstrucción con cifras menores de 200mL/min.
La coagulación del circuito, de las cámaras o del dializador, y su cambio por otros nuevos, se produjo en 7 pacientes durante 15 sesiones.
Los episodios de hipotensión con cifras de tensión arterial menores de 100mm/Hg de sistólica o sensación manifiesta de bajada de tensión con sudoración, náuseas o malestar se presentaron en 7 pacientes durante 15 sesiones, que se resolvieron mediante la infusión de cantidades variables de suero fisiológico.
Se objetivaron 13 episodios febriles en 6 pacientes con cifras superiores a 37,5°C. Se realizaron hemocultivos que resultaron siempre negativos excepto en 4 pacientes. Los gérmenes encontrados fueron: Escherichia coli (tratado con amoxicilina+clavulánico), Staphylococcus aureus (tratado con daptomicina), Staphylococcus epidermidis (tratado con meropenem) y Klebsiella pneumoniae (tratado con meropenem); coincide que estos 4 pacientes son los mismos a los que hubo que cambiar el catéter (tabla 5).
Complicaciones durante el tratamiento dialítico con HCO
| Paciente | N.° de sesiones | Cambio de catéter | Mala función | Coagulación del circuito | Hipotensión | Fiebre |
|---|---|---|---|---|---|---|
| 1 | 27 | 2 | 12 | 3 | 1 | No |
| 2 | 7 | 1 | 2 | 1 | No | No |
| 3 | 9 | No | No | No | 2 | 1 |
| 4 | 7 | No | No | No | No | 3 |
| 5 | 13 | 1 | 1 | 4 | No | 1 |
| 6 | 6 | No | 1 | No | 5 | No |
| 7 | 17 | 1 | 2 | 4 | 1 | No |
| 8 | 10 | 2 | No | No | 4 | No |
| 9 | 11 | No | No | No | 1 | No |
| 10 | 12 | 1 | 1 | 1 | No | No |
| 11 | 6 | No | No | No | No | No |
| 5 bis | 10 | No | No | 1 | No | No |
| 12 | 16 | No | 1 | 1 | 1 | No |
| Total | 151 | 8 | 20 | 15 | 15 | 5 |
Complicaciones: número de diálisis, cambios de catéter, mala función, coagulaciones del circuito, hipotensión y fiebre.
Presentamos nuestra experiencia de 13 tratamientos a 12 pacientes que presentaron insuficiencia renal aguda secundaria a MM, algunos con diagnóstico anatomopatológico de nefropatía por cilindros y otros con glomerulopatía por depósitos.
El tratamiento combinado de quimioterapia, habitualmente bortezomib más dexametasona, y hemodiálisis de larga duración con filtro de HCO resultó eficaz y se obtuvo una recuperación del 77%, que permitió a los pacientes vivir sin necesidad de hemodiálisis. Estos resultados son superiores a los obtenidos en otras series; así, Hutchison habla de un 60%15, mientras que Martín Reyes establece un 50%22.
No podemos saber todavía la supervivencia que alcanzarán nuestros pacientes; alguno de ellos ya supera los 3 años. Diversos autores hablan de un aumento de supervivencia muy significativo, de 8 a 42 meses.
Algunos autores sostienen que los mielomas productores de cadenas kappa responden mejor al tener un menor peso molecular y, por ello, una más fácil eliminación a través del filtro de HCO12, mientras que otros encuentran una eficacia similar23.
De nuestros pacientes, por un lado, 6 eran productores de cadenas kappa y recuperaron la función renal 5; por otro lado, 6 eran productores de cadenas lambda y mejoraron 4 (recordamos que un paciente fue tratado 2 veces por recaída), por ello podemos sacar como conclusión que el tratamiento es efectivo tanto para mielomas productores de cadenas kappa como lambda
En cuanto a la realización de biopsia renal, al comienzo del tratamiento con filtros HCO, los distintos autores eran más selectivos en su indicación y precisaban la demostración de nefropatía por cilindros mediante biopsia renal para el inicio de la técnica15. Con el paso del tiempo se está siendo más permisivo en este sentido. Algunos de estos autores, como Hutchison24, en sus últimas publicaciones realizan biopsia en menos del 60% de los pacientes.
Al principio no consideramos imprescindible la realización de biopsia renal para iniciar tratamiento, por ello no se realizó biopsia a 4 de los 6 primeros pacientes. A partir del séptimo caso nos mostramos mucho más exigentes y se realizó biopsia a todos los pacientes lo más pronto posible, pues creemos que aporta una información importante tanto para el diagnóstico como para el pronóstico25.
Hasta ahora solo se indicaba el tratamiento con filtros de HCO en casos de nefropatía por cilindros. Nosotros hemos dializado 3 casos cuya lesión principal eran los depósitos glomerulares y los 3 pacientes recuperaron la función renal. Por ello, queremos plantear las siguientes preguntas: ¿debemos tratar a los pacientes que presenten depósitos glomerulares, dada la buena respuesta conseguida en nuestra corta experiencia?, ¿cuántos de los pacientes tratados y no biopsiados (más del 40%) presentarían depósitos glomerulares y los hemos dializado, probablemente con buenos resultados?
Tres son los métodos que hasta la fecha se han utilizado para eliminar las CLLs:
1. Los primeros pasos para el tratar de eliminar las CLLs se llevaron a cabo con la plasmaféresis, pero esta técnica resultó poco eficaz por varias razones: escasa eliminación de CLL debido a que el 80% es extravascular, corta duración de las sesiones, pérdida de albúmina debido al gran tamaño del poro del plasmafiltro26, el intercambio de 3,5 L de plasma tendría un beneficio pequeño27, etc. Se precisarían tratamientos de 2 o más meses y aun así no lograríamos disminuir el nivel de CLLs de forma significativa19.
El estudio con mayor número de pacientes tratados con plasmaféresis es el de Clark (97 pacientes) y en él la plasmaferesis no se mostró superior en los parámetros de FG, dependencia de la diálisis y muerte16.
2. Otro método utilizado ha sido la hemofiltración con regeneración de ultrafiltrado (HFR), esta técnica pretende combinar las 3 propiedades de las membranas de diálisis (difusión, convección y adsorción).
Se emplea un dializador de doble cámara, el primero de alta permeabilidad, que permite el paso de las CLLs, especialmente de las más pequeñas, las kappa. Se realiza una ultrafiltración y este ultrafiltrado pasa por un cartucho de una resina adsortiva, donde quedarían pegadas las CLLs, pero no la albúmina, que se reinfunde entre los 2 dializadores18, el segundo dializador es de baja permeabilidad y realiza la difusión.
No existen publicaciones que puedan demostrar su utilidad, ofrecen como ventaja la no pérdida de albúmina y un menor coste, pero no eliminan en cantidad suficiente las cadenas lambda, por lo que solo podría plantearse su utilización en los mielomas kappa. Además, la poca bibliografía encontrada habla de 3 sesiones semanales y una media de 52 sesiones, lo que supondría más de 3 meses de tratamiento19. Algunos estiman un coste de 8 a 9 veces inferior a la diálisis con filtro de HCO, pero no tienen en cuenta los costes del personal ni otros aspectos, como la diferencia que supone estar 3 semanas (HCO) o 3 meses en tratamiento (HFR).
3. La diálisis con filtros de HCO Theralite de Gambro se ha mostrado altamente eficaz para eliminar las CLLs tanto kappa como lambda. Ya explicamos anteriormente cómo se realizaba está técnica, por lo que no insistiremos en ello.
En nuestra experiencia de 13 casos hemos conseguido una mejoría de la función renal suficiente como para permitir vivir al paciente sin la dependencia de la diálisis en 10 de los 13 casos (77%), que se ha mostrado efectiva tanto para las cadenas kappa como lambda, con un porcentaje de eliminación por diálisis del 58%, similar a la obtenida por otros autores que hablan de una pérdida de entre el 53 y 57% y una reducción final de cadenas superior al 93%21.
Martín Reyes habla de un 60% de reducción de CLLs a las 3 semanas y comenta que esto comportaba una probabilidad de recuperación del 80%. Nosotros a los 6 días de tratamiento (6 sesiones) ya teníamos una eliminación del 71% de CLL; los pacientes que se recuperaron muestran una mayor eliminación, un 74%, frente a los que no se recuperaron, un 63%15.
Respecto a la pérdida de albúmina pudimos comprobar en nuestros pacientes que la infusión de 2 viales de albúmina humana al 20% hacia el final de la diálisis permitía mantener unos niveles aceptables de 2,58 g/dL de media después de 6 sesiones de tratamiento, frente a los 2,94 del inicio. Al finalizar el tratamiento, la albúmina había mejorado hasta niveles de 2,75 g/dL. A los 3 meses de finalizado, teníamos unos valores totalmente normales de 3,85 g/dL, solo un paciente de los 6 de los que disponemos de datos presentaba una cifra inferior a los 3,5 g/dL.
Referente a las complicaciones que pueden aparecer durante las sesiones de diálisis, los estudios encontrados se centran en valorar el porcentaje de reducción de cadenas y la efectividad del tratamiento, pero no registran apenas las complicaciones. En varios artículos no aparece ningún tipo de complicación al realizar este tratamiento, porque no se registraban en el estudio28 o porque no aparecieron29–31.
En el artículo de Martín Reyes6, con 6 pacientes y 60 sesiones, el problema más frecuente descrito fue la coagulación del sistema, que ocupó la mitad de las complicaciones, seguido de mal funcionamiento del catéter.
En el estudio de Muñoz aparecen 2 episodios de coagulación en 9 pacientes32; y en el de Mallol, con un paciente, casi en todas las sesiones se coaguló el circuito de diálisis33.
En nuestras sesiones las complicaciones más frecuentes fueron los problemas de flujo en 20 sesiones, la coagulación del circuito o los episodios de hipotensión; en cualquier caso, la incidencia de complicaciones parece baja y en ningún caso de gravedad.
Discusión sobre el coste del tratamientoEn el año 2007 se inicia el tratamiento de la insuficiencia renal aguda secundaria al MM mediante filtros de HCO, al principio con un filtro de Gambro HCO 1100 de 1,1 m2 de superficie, para pasar posteriormente al Theralite de Gambro de 2,1 m2.
Grima publicó en 2011 un estudio basado en un modelo de coste-efectividad que comparaba el tratamiento con filtros de HCO respecto al tratamiento con diálisis convencional34. Este estudio se desarrolla con pacientes del Reino Unido y es valorado en libras esterlinas, teniendo en cuenta el coste del filtro de HCO, el coste de la albúmina y el tiempo extra de trabajo de la enfermera (2 h por sesión de diálisis).
El ahorro de costes se basaba en evitar la hemodiálisis crónica y el modelo predecía una supervivencia de 20 meses de los pacientes en diálisis estándar, frente a una supervivencia de 34 meses que se obtenía con el tratamiento con el filtro de HCO. Además, esta supervivencia era con mejoría de calidad de vida, pues los pacientes permanecían sin necesidad de diálisis. El ahorro de costes que obtuvo Grima fue de 6.000 libras, unos 8.000 euros34.
Nosotros hemos seguido un modelo similar para evaluar el coste, pero sin tener en cuenta las 2 h extra de enfermera, pues en nuestra unidad no se requería ningún incremento de plantilla: esos pacientes eran considerados como un agudo más. La supervivencia de nuestros pacientes hay que evaluarla a largo plazo, pero podemos decir que 3 pacientes llevan más de 3 años de supervivencia sin diálisis. Para poder comparar los resultados hemos optado por aceptar la supervivencia estimada por Grima.
Así pues, al realizar la evaluación económica nos hemos basado fundamentalmente en el coste del filtro de HCO y de la albúmina, ya que consideramos que el coste del resto del material es muy similar al de una hemodiálisis convencional, por lo que no ha sido tenido en cuenta.
El coste del filtro de HCO Theralite de Gambro en nuestro hospital es 825 euros, el coste de cada vial de albúmina humana al 20% de 50mL es de 17,68 euros, por lo que el coste de una diálisis con filtro de HCO es de unos 860,36 euros. Por otra parte, hemos sumado el total de las sesiones realizadas durante los 13 tratamientos (151 sesiones) y nos da una media de 11,53 sesiones por paciente, lo que hace un total de 9.919,95 euros de gasto por cada tratamiento.
El coste por sesión de diálisis en nuestro hospital, sumados los gastos de farmacia y suministro (material de diálisis, líneas, líquidos, dializadores, ultrafiltros, catéteres, desinfectantes, guantes, apósitos gasas, etc.), es de 85 euros de media por sesión, datos que pueden recogerse de las memorias del servicio. Un paciente habitualmente precisa 3 sesiones semanales, 156 sesiones anuales, cuyo coste total estimamos en 13.260 euros.
Si atendemos al trabajo de Grima, la media de supervivencia de los pacientes con MM en diálisis es de 20 meses, lo que representa un coste de 260 sesiones×85 euros, 22.100 euros en total; por tanto, el ahorro que obtendríamos sería de 12.181 euros. Si tuviéramos en consideración los costes de personal, transporte y otros diversos gastos que conllevan los pacientes en hemodiálisis, el ahorro sería mucho mayor.
Queremos también hacer una comparación con la HFR, esta técnica es más cara que la hemodiálisis convencional, pero más barata que la hemodiálisis con filtros de HCO. En la publicación del grupo de Córdoba sobre 3 pacientes19, realizan una media de 52 sesiones de diálisis frente a las 11,53 que precisamos en nuestro estudio, es decir, el tratamiento se prolongó casi 3 meses más y se realizó un número de sesiones 5 veces superior a las realizadas a nuestros pacientes tratados mediante filtro de HCO. Por ello, entendemos que se diluye el ahorro económico que se pudiera obtener con la HFR. No obstante, se precisan estudios con un mayor número de pacientes tratados para poder sacar conclusiones tanto en eficacia como en coste. Lo que sí está demostrado es la menor pérdida de albúmina durante las diálisis con HFR.
Conclusiones- 1.
El tratamiento combinado con quimioterapia más diálisis largas con filtros de HCO resultó eficaz para reducir el nivel de CLLs y recuperar un nivel de función renal suficiente en el 77% de los casos.
- 2.
Con filtros de HCO se consigue un ahorro significativo, en contraposición a lo descrito previamente en la literatura, el ahorro es superior a los 12.000 euros por paciente, aun sin tener en cuenta factores indispensables como el coste del personal, el transporte, etc.
Los autores declaran no tener ningún conflicto de intereses.