El mieloma múltiple (MM) consiste en la proliferación incontrolada de células plasmáticas con producción de cantidades variables de inmunoglobulinas o sus cadenas. La insuficiencia renal aguda puede ser un síntoma del MM, y a veces su forma de presentación. Las cadenas ligeras libres circulantes (CLL) pueden dar lugar al fallo renal por la precipitación intratubular de ellas, causando una nefropatía por cilindros. El tratamiento del mieloma, una adecuada hidratación y la eliminación de CLL mediante técnicas de aféresis son los tratamientos admitidos actualmente para esta entidad. Se han intentado diversas técnicas de aféresis para intentar eliminar las CLL, siendo la hemodiálisis de larga duración con filtros para eliminar dichas cadenas ligeras (alto cut-off) la que se postula como el tratamiento más eficaz para la nefropatía del mieloma. Métodos: Presentamos cinco casos de nefropatía de mieloma: tres con nefropatía por cilindros (NC) diagnosticada por biopsia renal y dos con alta probabilidad de NC (niveles de CLL > 500 mg/l) tratados con hemodiálisis larga con membrana de alto cut-off. Todos presentaban insuficiencia renal aguda, en cuatro de ellos con necesidad de terapia sustitutiva y uno en situación de insuficiencia renal avanzada. En todos ellos los niveles de CLL fueron muy elevados. Recibieron tratamiento específico para el mieloma más hemodiálisis de alto cut-off hasta alcanzar niveles de CLL < 500 mg/l. Resultados: Cuatro de los cinco pacientes recuperaron función renal, quedando independientes de diálisis. El tiempo de evolución del mieloma desde el inicio de la clínica fue variable (1-6 m). El número de sesiones varió entre 8-16. El paciente de más tiempo de evolución precisó más sesiones y no recuperó función renal. Conclusiones: La hemodiálisis larga con filtros de alto cut-off más tratamiento con quimioterapia del mieloma parece ser un tratamiento eficaz en la insuficiencia renal aguda debida a nefropatía del mieloma. La precocidad en el inicio del tratamiento puede ser un factor determinante de la respuesta.
Multiple myeloma (MM) is the uncontrolled proliferation of plasma cells with variable amounts of production of immunoglobulins or their chains. Acute renal failure can be a symptom of MM, and it is sometimes its form of presentation. Circulating free light chains (FLC) could lead to renal failure due to their intratubular precipitation, causing a cast nephropathy. The treatment of myeloma, adequate hydration and the removal of FLC by apheresis techniques are currently the treatments that are accepted for this disease. Several apheresis techniques have been attempted for the removal of FLC, with long haemodialysis sessions with filters for the removal of these light chains (high cut-off filters) being proposed as the most effective treatment for myeloma nephropathy. Methods: We report 5 cases of myeloma nephropathy: three had cast nephropathy (CN) diagnosed by renal biopsy and the other two had a high probability of CN (FLC levels >500mg/l). They were treated with long haemodialysis sessions with a high cut-off membrane. All patients had suffered acute renal failure; four required renal replacement therapy and one patient had advanced renal failure. In all patients, FLC levels were very high. They received specific treatment for myeloma in addition to high cut-off haemodialysis until they achieved FLC levels of <500mg/l. Results: Four of the five patients recovered renal function, and became independent of dialysis. The progression time for myeloma from the time the first symptoms appeared varied (1-6 months). The number of treatment sessions ranged from 8-16. The patient with the longest progression time required more sessions and did not recover renal function. Conclusions: Long haemodialysis sessions with high cut-off filters in addition to specific myeloma chemotherapy seems to be an effective treatment for acute renal failure due to myeloma nephropathy. The early initiation of treatment could be a determining factor for the response.
El mieloma múltiple (MM) es una enfermedad neoplásica que consiste en la proliferación clonal de las células plasmáticas de la médula ósea que producen de forma descontrolada cantidades variables de inmunoglobulinas o sus cadenas (pesadas o ligeras), que quedan circulantes en sangre en forma de cadenas ligeras libres (CLL) y que pueden eliminarse por la orina (proteinuria de Bence-Jones [B-J]). Estas proteínas a nivel intratubular pueden dar lugar a un fallo renal por su precipitación (nefropatía por cilindros [NC]). Las cadenas ligeras son moléculas medianas con dos isotipos: cadenas kappa que principalmente son formas monoméricas (22,5 kDa) y cadenas lambda que frecuentemente se presentan en forma de dímeros (45 kDa).
El mieloma representa un 1 % de las neoplasias en el mundo occidental, con una incidencia anual de 5-6/100 000 habitantes/año. Más de un tercio de los pacientes es menor de 65 años1. La presencia de insuficiencia renal aguda puede darse hasta en un 50 % de los casos de MM, siendo en muchas ocasiones reversible con tratamiento habitual a base de hidratación y manejo de iones2, pero en hasta un 10 % de los casos van a terminar necesitando terapia renal sustitutiva.
La leucemia de células plasmáticas es una variante rara del MM3, que constituye el 2-3 % de todos los mielomas. Se trata de un MM de alta agresividad con una supervivencia corta. La leucemia de células plasmáticas puede clasificarse en dos subtipos: 1. Leucemia de células plasmáticas primaria: cuando la leucemización está presente ya en el momento diagnóstico. 2. Leucemia de células plasmáticas secundaria: cuando aparece como consecuencia de la transformación de un MM previo. La presencia de insuficiencia renal es común.
Las causas de disfunción renal en pacientes con mieloma incluyen una alteración tubular proximal y distal por daño celular por las cadenas ligeras filtradas, NC de mieloma, amiloidosis, enfermedad por depósito de cadenas ligeras o pesadas, crioglobulinemia, infiltración intersticial por células plasmáticas y en raras ocasiones una glomerulonefritis proliferativa o una nefritis intersticial. La NC ocurre en un 40-60 % de los casos de mieloma asociados a disfunción renal y puede provocar fallo renal agudo4.
Así, la insuficiencia renal aguda es una forma de presentación no infrecuente de esta patología y su presencia va a ensombrecer el pronóstico y reducir la esperanza de vida del paciente. En los últimos años la introducción de nuevas estrategias de tratamiento como el trasplante autólogo de medula ósea y la disponibilidad de nuevos agentes terapéuticos como la talidomida, la lenalidomida y el bortezomib han cambiado el manejo del mieloma y mejorado su supervivencia. Otros avances terapéuticos que han cambiado el pronóstico del mieloma han sido la aparición de técnicas de aféresis para la eliminación de las cadenas ligeras y así revertir el daño tubular renal.
La eliminación de sustancias a través de las membranas de diálisis depende del peso molecular de estas y del tamaño del poro de la membrana. Las nuevas generaciones de membranas de diálisis con cut-off cercano al riñón nativo (65 kDa) ofrecen la posibilidad de aplicarlas para el tratamiento de diferentes patologías con afectación renal, entre ellas la rabdomiólisis y el riñón de mieloma2.
El daño renal agudo es común en pacientes con MM, frecuentemente causado por NC, que resultan de la precipitación intratubular de las cadenas ligeras. Este daño renal agudo puede hacerse irreversible y generalmente necesita tratamiento con diálisis. La reducción de las CLL plasmáticas se asocia con mejoría y a veces recuperación de la función renal. Se ha utilizado la plasmaféresis para eliminar cadenas ligeras, encontrando algunos autores mejoría de la función renal4,5, aunque para otros su eficacia no está clara6. Trabajos recientes han demostrado que la eliminación de las CLL, junto con tratamiento con quimioterapia, mejora la supervivencia del mieloma7. La precocidad en esta eliminación va a ser decisiva para la recuperación de la función renal8. También la forma de eliminación de las cadenas parece influir en la recuperación. Así, la eliminación de las CLL mediante plasmaféresis se muestra menos eficaz9 que cuando dicha eliminación se realiza con hemodiálisis larga con filtros de alto cut-off (HD-HCO). Esta diferencia parece deberse fundamentalmente a la menor duración de la técnica de plasmaféresis, que no permite eliminar las cadenas que se incrementan como consecuencia de la redistribución intercompartimental de estas10. Los actuales dializadores de alto cut-off, con tamaño de poro de la membrana superior a 60 kDa, permiten eliminar tanto las cadenas lambda como las kappa.
Está demostrado que la recuperación de la función renal influye de forma positiva en la supervivencia de los pacientes. Igualmente, el tipo de cadena ligera producida va a tener influencia pronóstica, de forma que la presencia de cadenas kappa, de menor peso molecular, tiene mejor pronóstico que los casos en los que la cadena producida es lambda. La diferencia en cuanto a la tasa de eliminación de cadenas kappa y lambda parece ser más evidente cuando se utiliza plasmaféresis, mientras que con la hemodiálisis larga la eliminación no es muy diferente. Recientemente han comenzado a utilizarse técnicas de hemodiafiltración con reinfusión de ultrafiltrado y paso por cartucho de resinas, que parece tener una buena eliminación de cadenas ligeras, fundamentalmente para las tipo kappa11, con menor coste económico, pero sin suficiente experiencia en la literatura médica que avale su uso, por lo que habrá que esperar a ver resultados.
Con los conocimientos actuales se puede decir que la mayor duración de la técnica y la mayor superficie del filtro van a conseguir mejores aclaramientos de CLL, y también parece claro, para la mayoría de los autores12, que la eliminación de dichas CLL, bien con HD-HCO de forma más eficaz o bien mediante plasmaféresis, debe ser precoz13 y estar asociada a un tratamiento de quimioterapia específico para frenar la producción de estas cadenas anómalas. En pacientes con función renal normal, el uso de un tratamiento quimioterápico apropiado va a reducir los niveles de CLL circulantes hasta cifras bajas. Sin embargo, en pacientes con función renal alterada, el aclaramiento de CLL está disminuido, permaneciendo sus niveles plasmáticos elevados de forma prolongada, con lo que se mantiene su toxicidad a nivel tubular y se ocasiona un daño que puede llegar a ser irreversible, aun cuando el tratamiento quimioterápico sea el adecuado. Actualmente las terapias con dexametasona y regímenes de quimioterapia basados en bortezomid se perfilan como unos de los más eficaces para tratar el mieloma14-16. Además, con el uso de dializadores de alto cut-off podemos acelerar la eliminación de CLL, limitando su daño tubular en el mieloma17,18.
MÉTODOS
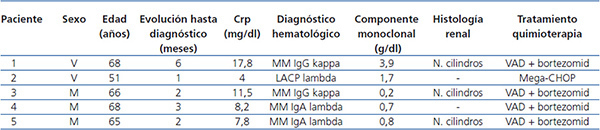
Pacientes: presentamos cinco pacientes, dos varones y tres mujeres, con rango de edad entre 51 y 68 años, diagnosticados de gammapatía monoclonal con niveles muy elevados de CLL en sangre y en todos los casos con insuficiencia renal aguda. En tres de los casos se demostró por biopsia renal la presencia de NC de cadenas ligeras (nefropatía de mieloma) y, en los dos en que no se pudo realizar biopsia renal (por trombopenia grave en un caso y por antiagregación sistémica en el otro), los niveles de cadenas ligeras en orina y de CLL en sangre eran muy elevados, lo que junto con la clínica hacía que el cuadro fuese muy sugerente de NC. Cuatro de los pacientes se diagnosticaron de MM (dos casos IgG y dos IgA), mientras que en uno de ellos el diagnóstico fue de leucemia aguda de células plasmáticas. Cuatro enfermos debutaron clínicamente con insuficiencia renal aguda e ingresaron directamente en Nefrología. Todos los casos fueron gammapatías de nuevo diagnóstico y todos recibieron tratamiento con quimioterapia de forma simultánea al tratamiento con diálisis. El tratamiento quimioterápico recibido se muestra en la tabla 1.
En todos los casos se inició tratamiento con hidratación y corrección de las alteraciones iónicas, previamente a establecer el diagnóstico de sospecha de riñón de mieloma, sin que se obtuviera mejoría significativa en ninguno de ellos. En cuatro de los casos fue necesaria la realización de hemodiálisis aguda debido al grado de insuficiencia renal, mientras que un paciente tenía insuficiencia renal moderada y se indicó la técnica para eliminar cadenas ligeras. El tiempo de evolución de la clínica hasta el ingreso había sido variable, entre dos y seis meses (tabla 1).
Consentimiento: una vez informados, todos los pacientes firmaron el consentimiento específico para el acceso vascular y la técnica de diálisis con filtro de alto cut-off.
Protocolo de tratamiento: HD-HCO de 6-8 horas: Theralite® (Gambro) de 1,1 m2 (primer paciente) y 2 m2, hasta alcanzar cifras de CLL en sangre < 500 mg/l o recuperar función renal capaz de ser independiente de diálisis, hasta un máximo de 16 sesiones. Durante las sesiones se administraron suplementos de albúmina (200 ml de albúmina al 20 % ml/sesión), fósforo (1 vial de Fosfoevac® en líquido de diálisis/sesión), magnesio (1500 mg/sesión, sulfato de magnesio al 15 % una ampolla durante la última hora de diálisis) y potasio (20-40 mEq/sesión), estableciendo ajustes posteriores según la analítica.
Líquido de diálisis: Dialsol 313-A (Ca++ 3 mEq/l y K+ 1,5 mEq/l).
Heparinización del circuito: heparina sódica 0,5 mg/kg de inicio más 10 mg/hora.
Acceso vascular: a todos los pacientes les fue colocado de inicio un catéter venoso central transitorio para hemodiálisis. Posteriormente, en el caso número 1, a la vista de la evolución, se realizó una FAV autóloga y, en el caso número 4, se colocó un catéter tunelizado.
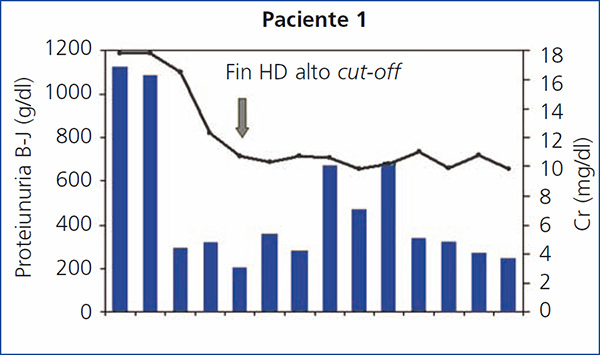
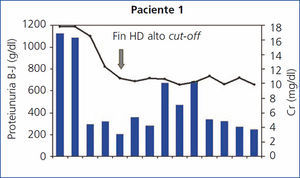
Monitorización: se monitorizó la función renal, los niveles de calcio, fósforo, magnesio, potasio y albúmina pre y posdiálisis, y se determinaron las CLL pre y posdiálisis en cada sesión. En el primero de los pacientes, la determinación de CLL no estaba disponible en nuestro centro, por lo que se monitorizó a través de los niveles de proteinuria de B-J en orina.
Respuesta al tratamiento: la respuesta renal se clasificó según los criterios del grupo europeo de Bone Marrow Transplantation Group: 1) respuesta completa, si el paciente queda con un índice de filtración glomerular (GFR) ≥ 60 ml/min; 2) respuesta parcial, cuando el GFR aumenta > 100 % o pasa de GFR < 15 ml/min a GFR entre 30-60 ml/min); o 3) respuesta menor, si el GFR aumenta > 50 % o pasa de filtrado < 15 ml/min a filtrado de 15-30 ml/min o bien de un filtrado de entre 15-30 ml/min a un filtrado de 30-60 ml/min.
RESULTADOS
Todos los pacientes recibieron tratamiento específico para la patología hematológica, según protocolo de hematología (tabla 1). El paciente 2, que fue diagnosticado de leucemia aguda de células plasmáticas primaria, recibió tratamiento con pauta mega-CHOP y, una vez normalizada la función renal y tras respuesta medular al tratamiento quimioterápico, fue sometido a un trasplante de médula ósea con resultados satisfactorios.
En los pacientes 1, 3 y 5 se realizó biopsia renal percutánea que en los tres mostró una NC, mientras que en los pacientes 2 y 4 no se realizó biopsia por el elevado riesgo de sangrado (tabla 1).
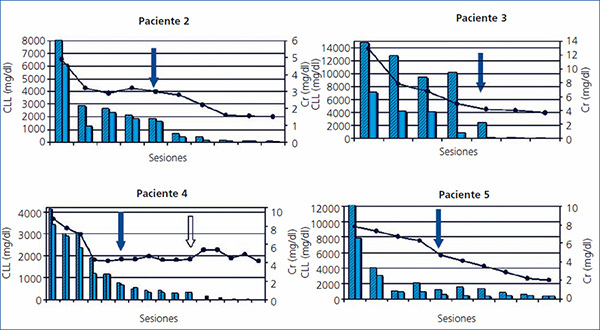
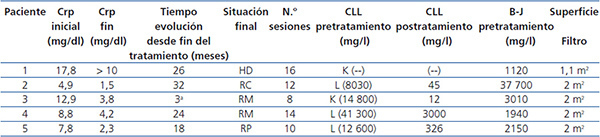
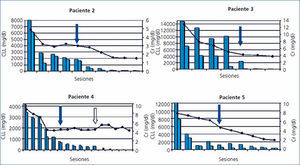
Los cinco pacientes fueron tratados con HD-HCO de 6 horas. La media de sesiones fue de 12 ± 3,1 (8-16). El primero recibió 7 sesiones diarias y 9 en días alternos con filtro de Theralite® (Gambro) de 1,1 m2, mientras que los otros cuatro recibieron 5 sesiones diarias, seguidas de un número variable (7, 3, 9 y 5) de sesiones en días alternos con filtros de Theralite® (Gambro) de 2 m2, hasta alcanzar cifras de CLL en sangre < 500 mg/l, salvo en el paciente número 4, en el que se suspendió la técnica, después de 14 sesiones, al observar la estabilidad en las cifras de CLL pre y posdiálisis, aunque no había llegado a los 500 mg/l deseados. En este caso, dado que la eficacia en la eliminación de las cadenas fue menor, aumentamos el tiempo de duración de la diálisis a 8 horas, pese a lo cual no mejoró la eficacia y ante la escasa efectividad de la técnica se decidió suspender el tratamiento depurativo. En este momento presentaba función renal estable (creatinina sérica de 4 mg/dl) y los niveles de cadenas ligeras en 3000 mg/l (figura 1). Los niveles de CLL, una vez suspendida la HD-HCO, siguieron disminuyendo de forma muy lenta hasta alcanzar cifras inferiores a 500 mg/l, un mes más tarde, como consecuencia de la respuesta al tratamiento del mieloma.
En todos los pacientes los niveles de CLL en sangre disminuyeron durante el tratamiento de HD-HCO, de forma más llamativa en las cinco primeras sesiones (diarias), al final de las cuales en 2 de los 4 pacientes las CLL estaban por debajo de 1000 mg/l, en otro de los pacientes en 1600 mg/l y en la paciente número 4 el descenso fue más lento (figura 1). En el paciente 1, que se monitorizó por niveles de proteinuria B-J, al no disponer de CLL en sangre, igualmente los niveles de esta disminuyeron (figura 2). En algunos de los pacientes observamos un claro rebote interdiálisis de las cifras de CLL; el caso más llamativo, el del paciente número 3, mientras que en el resto este fenómeno fue más larvado.
La creatinina plasmática fue mejorando de forma paralela al descenso de los niveles de CLL, estabilizándose cuando los niveles bajaron de 500 mg/l en los pacientes 2, 3, 4 y 5, mientras que en el paciente 1, aunque la creatinina plasmática descendió como consecuencia de la diálisis, se mantuvo en cifras que precisaron terapia renal sustitutiva.
La evolución de la función renal se muestra en la tabla 2 y de forma individual en las figuras 1 y 2. En cuatro de los pacientes (pacientes 2, 3, 4 y 5) la función renal se recuperó de forma satisfactoria, lo que permitió la suspensión de la terapia sustitutiva una vez completado el tratamiento con HD-HCO. Se consideró que en un caso la respuesta fue completa, en otro parcial y en los otros dos menor. Esta recuperación se ha mantenido hasta el fallecimiento en un paciente, y hasta el momento actual, en el resto (26, 18 y 12 meses).
Analicemos individualmente a los cinco pacientes:
El paciente número 1 debutó con un cuadro muy florido, con anemia importante, 20 % de células plasmáticas en aspirado de médula ósea, insuficiencia renal grave (creatinina sérica al diagnóstico de 18 mg/dl), un componente monoclonal alto (3,6 g/dl), y cuando fue derivado a nuestro centro la evolución del proceso era de al menos seis meses. Se inició hemodiálisis convencional, antes de confirmar el diagnóstico. En ese momento no disponíamos de determinación de CLL en sangre, pero al encontrar una eliminación de cadenas ligeras en orina muy elevada se planteó la realización de una biopsia renal que confirmó el diagnóstico de sospecha de NC y además la presencia de un epitelio tubular deteriorado con infiltrado inflamatorio mixto e importante fibrosis intersticial. Ante el diagnóstico de NC, se inició tratamiento con HD-HCO con filtro de 1,1 m2 (una semana después del ingreso) sin lograr recuperación de la función renal. Aunque los niveles de proteinuria de B-J disminuyeron con la HD-HCO más el tratamiento específico del mieloma (vincristina, doxorrubicina y dexametasona [VAD] más bortezomid), la función renal no se recuperó y permaneció con necesidad de terapia sustitutiva (figura 1); no disponemos de los niveles de CLL de este paciente por problemas de infraestructura del centro. Posteriormente este paciente ha presentado una progresión del mieloma y en la actualidad está recibiendo una nueva línea de tratamiento (bortezomid más adriamicina) a la espera de respuesta.
El paciente número 2 fue diagnosticado de leucemia aguda de células plasmáticas de tipo primario, con componente monoclonal de tipo lambda y con una elevada producción y eliminación renal de estas cadenas ligeras lambda (proteinuria de B-J > 37 000 mg/l), así como niveles elevados de CLL en sangre (8030 mg/l). Dado que el paciente estaba tomando tratamiento antiagregante sistémico, con un riesgo muy importante de sangrado si se realizaba una biopsia renal en ese momento, se desestimó la realización de esta para establecer el diagnóstico histológico de NC y se optó por iniciar el tratamiento con HD-HCO teniendo en cuenta la presencia en sangre de niveles elevados de CLL de tipo lambda. La respuesta al tratamiento fue completa, con normalización de la función renal. Posteriormente se realizó trasplante autólogo de médula ósea, tras el cual ha mantenido una función renal normal (creatinina sérica 0,8 mg/dl), con ausencia de proteinuria.
En el paciente número 3, el tiempo de evolución desde el comienzo del cuadro hasta que fuimos consultados fue de dos meses. Se inició tratamiento con medidas de hidratación y presentó mejoría de la función renal, pero posteriormente empeoró de nuevo, presentando cifras muy elevadas de CLL (14 800 mg/l), y se planteó la biopsia renal, que mostró NC, por lo que se decidió iniciar el tratamiento con filtro alto cut-off. La respuesta al tratamiento fue favorable. En este caso apreciamos un importante rebote en las cifras de CLL en sangre durante las primeras sesiones (figura 1). La función renal mejoró, una vez completado el tratamiento con HD-HCO, mantuvo creatinina estable (creatinina 3 mg/dl), quedando independiente de diálisis, aunque con un filtrado glomerular próximo a 20 ml/min. Posteriormente, ante la presencia de una recaída del mieloma, hubo que intensificar el tratamiento quimioterápico y como consecuencia de este el paciente presentó una complicación infecciosa por la que causó exitus.
La paciente número 4 contaba una evolución de al menos tres meses de clínica cuando ingresó. Presentaba insuficiencia renal avanzada y anemia en rango transfusional. El aspirado de médula ósea demostró la presencia de un 56 % de células plasmáticas y la determinación de CLL en sangre demostró la presencia de unas CLL lambda muy elevadas (mayor de 41 000 mg/l). Se inició tratamiento sin estudio histológico por riesgo hemorrágico. La respuesta al tratamiento con HD-HCO fue buena, con un descenso importante de los niveles de cadenas ligeras tras las primeras sesiones, como puede apreciarse en la figura 1, y posteriormente se observó una estabilización de los niveles en torno a 3000 mg/l. Tras la suspensión de la diálisis la paciente presentó una reducción progresiva en las cifras de CLL en sangre hasta valores inferiores a 500 mg/l después de un mes de seguimiento. La función renal se mantiene estable hasta la actualidad y permanece independiente de diálisis. Desde el punto de vista hematológico, pese a la agresividad inicial del cuadro, la paciente está actualmente en remisión.
La paciente número 5 debutó con un cuadro de insuficiencia renal, con una historia de al menos dos meses de anemia. Con la presencia de CLL elevadas y la biopsia renal con presencia de NC, iniciamos la HD-HCO. La respuesta clínica desde el punto de vista hematológico ha sido buena con VAD más bortezomid. La reducción de CLL fue paralela a la recuperación de la función renal, permitiendo la suspensión de la técnica, tras 10 sesiones, con filtrado glomerular superior a 20 ml/min. Actualmente, casi 1,5 años después del diagnóstico, está en remisión hematológica y con creatinina estable en 1,8 mg/dl.
Todos los pacientes presentaron una excelente tolerancia clínica a la técnica. Todas las sesiones transcurrieron con una buena estabilidad hemodinámica. Según el protocolo, se suplementaron con albúmina, fósforo, magnesio y potasio, ajustados en función de los controles analíticos realizados. No asistimos a ninguna complicación derivada de la técnica extracorpórea ni relacionada con el acceso vascular.
DISCUSIÓN
Presentamos cinco casos de gammapatía monoclonal con insuficiencia renal debido a nefropatía de cadenas ligeras. Cuatro de ellos fueron diagnosticados de MM y uno de leucemia aguda de células plasmáticas primaria.
En el caso del paciente 1, pensamos que el hecho de no haber sido un tratamiento precoz, con seis meses de evolución antes de la realización de la biopsia renal, pudo influir en la evolución, aunque algunos autores recientemente19 han encontrado mejoría de la función renal en pacientes con evolución más larga. Además, en nuestro caso pensamos que la presencia de daño tubular y fibrosis intersticial renal en la biopsia puede ser la razón fundamental para explicar la ausencia de recuperación de la función renal. Por otro lado, el filtro utilizado fue de menor superficie (1,1 m2), hecho que también pensamos que pudo influir en la respuesta, si bien, al no disponer de la determinación de CLL en sangre en ese momento, no pudimos evaluar el grado de eficacia en la eliminación de las CLL. Según algunos autores como Hutchinson, el tipo de cadena ligera puede influir en el pronóstico, de forma que los mielomas productores de cadenas kappa tienen mejor respuesta al tratamiento al tratarse de formas monoméricas de menor peso molecular, que se podrían eliminar más fácilmente con las distintas técnicas empleadas20. En nuestro paciente número 1 la cadena producida era tipo kappa y evidenciamos que disminuyó su excreción en orina muy significativamente, pero es posible que el daño renal ya fuera irreversible (la biopsia renal así lo hacía previsible). El paciente actualmente persiste en hemodiálisis y con progresión de la enfermedad, y ha iniciado una nueva línea de tratamiento quimioterápico.
El paciente número 2 se diagnosticó de leucemia de células plasmáticas primaria, con gran agresividad clínica y niveles muy elevados de CLL, por lo que se inició tratamiento para eliminar estas cadenas, sin confirmación histológica. La leucemia de células plasmáticas3 primaria se caracteriza por aparecer en pacientes más jóvenes, como en nuestro caso, que es el más joven de los cinco tratados. El pronóstico parece mejor que en los secundarios y en nuestro caso fue el que mejor respuesta tuvo. Las lesiones óseas y la hipercalcemia son menos frecuentes en las leucemias de células plasmáticas primarias, que presentan con una mayor frecuencia organomegalias y adenopatías. En nuestro paciente existía hepatoesplenomegalia e infiltración cutánea. El componente M sérico suele ser de menor cuantía que en los MM típicos, dato que también se constata en nuestro paciente, al igual que la presencia de insuficiencia renal, que igualmente es frecuente.
En este caso la respuesta al tratamiento fue muy buena. No hemos encontrado en la literatura casos de leucemia de células plasmáticas que hayan sido sometidos a técnicas de depuración extracorpórea para eliminación de CLL. Nuestro paciente evolucionó favorablemente, recuperando la función renal ad integrum, lo que permitió el trasplante de médula ósea.
El paciente 3, cuando fuimos consultados por la presencia de insuficiencia renal en un paciente con diagnóstico de mieloma en tratamiento, ya presentaba una trombopenia grave secundaria al tratamiento quimioterápico que estaba recibiendo, y por ello no se realizó biopsia renal en ese momento, ante el riesgo hemorrágico. Inicialmente, con tratamiento médico mejora, pero tras un nuevo empeoramiento de la función renal, y tras recuperación de la trombopenia, se realizó la biopsia renal sin complicaciones. La respuesta al tratamiento con diálisis de alto cut-off fue favorable, pudiendo apreciar un mayor rebote en las cifras de CLL en sangre durante las primeras cuatro sesiones, lo que creemos indicativo de una importante generación de CLL a nivel de las células plasmáticas, que mantenían aún una elevada actividad a pesar del tratamiento quimioterápico. Partimos de cifras muy elevadas de CLL en sangre, que son igualmente indicativas de una elevada actividad del clon de células plasmáticas. La función renal mejoró, quedando independiente de diálisis, aunque el mieloma evoluciona desfavorablemente, siendo exitus por complicaciones infecciosas.
La paciente número 4, pese a la larga evolución de la clínica en el momento del diagnóstico, tuvo una buena respuesta al tratamiento con HD-HCO, con un descenso inicial importante de los niveles de cadenas ligeras. Posteriormente asistimos a una estabilización de los niveles de CLL en torno a 3000 mg/l y encontramos que la técnica no resultaba eficaz en la eliminación de estas a pesar de aumentar el número de horas de cada sesión (8 horas). En este punto, y dado que la función renal había mejorado, manteniéndose en cifras que no precisaban de terapia sustitutiva, decidimos interrumpir la hemodiálisis. Tras analizar la situación, pensamos que la escasa eficacia en la eliminación podría deberse a la formación de polímeros de cadenas lambda con un mayor peso molecular y que por tanto no se eliminaban con la HD-HCO. Este fenómeno está descrito en la literatura21, aunque este punto no lo pudimos demostrar. En este caso, como en el número 1, hubo cierto retardo en el diagnóstico hematológico que pensamos que ha podido influir en la evolución y la no recuperación completa de la función renal, a la vista de los datos de que hoy disponemos, en los que la eliminación precoz de las CLL es una urgencia para mejorar el pronóstico de la enfermedad22. En este caso no se pudo realizar una biopsia renal en el momento del diagnóstico, ya que estaba recibiendo tratamiento antiagregante con ácido acetilsalicílico. Se inició la técnica depurativa a la vista de las cifras de CLL en sangre y se suspendió la antiagregación para poder realizar la biopsia pasados 10 días. Finalmente no fue posible ante la presencia de trombopenia secundaria a la administración de tratamiento quimioterápico (VAD más bortezomid), por lo que dada la buena respuesta al tratamiento se desestimó su realización. Tras casi dos años de seguimiento mantiene una creatinina sérica de 3,6 mg/dl y desde el punto de vista hematológico está en remisión completa.
La paciente número 5 presentaba una historia de al menos dos meses de anemia, por lo que entendemos que ese debe ser como mínimo el tiempo de evolución del proceso. La respuesta al tratamiento fue buena, con reducción de CLL paralela a la recuperación de la función renal, como se refleja en la literatura23. Una vez que se inició el tratamiento en días alternos, evidenciamos cierto grado de rebote en los niveles de CLL interdiálisis, que finalmente se hizo inapreciable. Creemos que la más corta evolución, en este caso, pudo favorecer la buena respuesta al tratamiento.
En nuestra experiencia los mielomas productores de cadenas ligeras lambda, tres de los casos, han tenido en general una buena respuesta al tratamiento, con una adecuada recuperación de la función renal, salvo en el caso de la paciente 4, en el que la recuperación no fue completa probablemente en relación más con el tiempo de evolución de la enfermedad hasta el inicio de la HD-HCO que con el tipo de cadena anómala producida. Hay autores que recientemente han encontrado una igual eficacia en la remoción de los dos tipos de cadenas24. En cuanto a los otros dos pacientes, los que presentaban mielomas de tipo kappa, en uno de ellos no hubo respuesta al tratamiento (mucho tiempo de evolución y daño renal intersticial asociado) y en el otro no podemos establecer la evolución dado su precoz fallecimiento tras el cese de la técnica.
De forma general, al comienzo del tratamiento con filtros de alto cut-off, los distintos autores8 eran más selectivos en su indicación y precisaban la demostración de NC mediante biopsia renal para el inicio de la técnica, mientras que los autores que realizaban plasmaféresis a veces la iniciaban sin demostración histológica25. Con el paso del tiempo se está siendo más permisivo en este sentido. Algunos de estos autores, como Hutchison17, en sus últimas publicaciones realizan biopsia en menos del 60 % de los pacientes, dado que, como en nuestro caso, a veces no es técnicamente posible hacerla en el contexto clínico en que nos encontramos. Por un lado, esto permite un abordaje terapéutico más precoz, sin necesidad de esperar a los resultados histológicos, pero, por otro lado, los datos de la biopsia pueden predecir el pronóstico26 y así, si solo existen datos de NC, las perspectivas de una buena evolución son mayores que en el caso de que exista más daño crónico, lo cual nos permitiría no prolongar innecesariamente un tratamiento con un coste económico elevado. Nuestro criterio es que, mientras técnicamente sea posible, se debería realizar la biopsia renal, con una finalidad diagnóstica y también pronóstica. Dado que la precocidad en el tratamiento nos parece prioritaria, pensamos que, una vez determinados unos niveles de CLL en sangre elevados, no se debería demorar el inicio de la técnica en espera de la posibilidad de realizar la biopsia renal o de obtener su resultado, si bien siempre que sea posible técnicamente se debería hacer una biopsia renal.
En algunos artículos publicados recientemente27, los autores encuentran complicaciones en hasta un 28 % de las sesiones, muchas de ellas relacionadas con la coagulación; nosotros no tuvimos que hacer frente a ninguna complicación importante y solo en un caso hubo una coagulación del circuito que obligó al cambio de filtro. Tampoco tuvimos ninguna complicación hemorrágica ni infecciosa relacionada con la técnica ni con el acceso vascular. La técnica fue muy bien tolerada en todos los casos.
En resumen, pensamos que el pronóstico de vida de los pacientes con mieloma viene dado por la propia enfermedad hematológica, si bien la afectación renal va a modificarlo sustancialmente. El pronóstico renal está, según nuestra experiencia, claramente relacionado con el tiempo de evolución hasta el inicio de la HD-HCO. Si se realiza un tratamiento precoz, eliminando las CLL circulantes con este tipo de hemodiálisis, a la vez que disminuye la producción de estas por el clon de células plasmáticas y se logra recuperar la función renal, aunque sea de forma parcial, el pronóstico a largo plazo parece muy bueno, pudiendo mantener la estabilidad en la función renal al menos a medio plazo.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Figura 1. Evolución de función renal y cadenas ligeras libres
Figura 2. Evolución de función renal y proteinuria Bence-Jones
Tabla 1. Datos epidemiológicos y datos clínicos iniciales
Tabla 2. Datos clínicos y evolutivos