Introducción y objetivos: El tratamiento de la anemia en hemodiálisis (HD) con hierro y agentes estimulantes de la eritropoyesis (AEE) no siempre consigue un control adecuado de esta, habiéndose relacionado con la inflamación. El efecto antiinflamatorio de la pentoxifilina (PTX) podría resultar beneficioso en estos casos. El objetivo fue estudiar el posible efecto de la PTX en la anemia de pacientes en hemodiálisis. Pacientes y métodos: Estudio observacional retrospectivo de 18 casos (reciben PTX) y 18 controles (sin PTX, emparejados por edad y sexo) en HD (Clínica Universidad de Navarra). Cuatro pacientes tomaban PTX por vasculopatía y 14 por anemia resistente (definición: hemoglobina [Hb] < 11 g/dl en los últimos 3 meses a pesar de dosis altas de AEE y saturación de transferrina > 20 %). Hb, dosis de MIRCERA® y proteína C reactiva fueron recogidas antes del tratamiento con PTX (basal), a los 3 meses y al final del seguimiento. Resultados: En los pacientes con PTX hubo aumento de la Hb (p < 0,001) en 3 meses y descenso de las dosis de AEE al final del estudio (p = 0,002). Las diferencias basales en Hb (menor en casos) (p < 0,001) y en dosis de AEE (mayor en casos) (p = 0,006) entre grupos desaparecieron a los 3 meses. Al final del estudio 11/18 (61,1 %) de los tratados con PTX tenían Hb en rango deseado y recibían dosis de AEE equiparables al control. Conclusiones: PTX en dosis de 800 mg/día mejora significativamente y a corto plazo (3 meses) la Hb de pacientes en HD (respuesta en torno al 61 %) y permite la reducción de dosis de AEE a medio-largo plazo. El efecto se mantiene en el tiempo y el tratamiento es bien tolerado.
Introduction and objectives: Treatment of anaemia in haemodialysis (HD) with iron and erythropoiesis-stimulating agent (ESA) does not lead to adequate anaemia control and has been associated with inflammation. The anti-inflammatory effect of pentoxifylline (PTX) may be beneficial in these cases. Our aim was to study the potential effect of PTX on anaemia in haemodialysis patients. Patients and method: Retrospective observational case-control study on 18 patients (treated with PTX) and 18 controls (without PTX matched by age and sex) on HD (Clínica Universidad de Navarra). Four patients received PTX due to vascular disease and 14 due to refractory anaemia (which was defined as haemoglobin [Hb] <11g/dl in the last three months despite high doses of ESA and transferrin saturation of >20%). Hb, MIRCERA® dose and C-reactive protein were recorded before starting PTX treatment (baseline), at 3 months and at the end of the study. Results: In patients who received PTX, there was an increase in Hb (P<.001) over three months and a decrease in the ESA dose at the end of the study (P=.002). The baseline differences in Hb between groups (lowest of all cases) (P<.001) and ESA dose (highest of all cases) (P=.006), disappeared at 3 months. At the end of the study, 11/18 (61.1%) of patients treated with PTX had adequate Hb levels and received doses of ESA comparable with those of the controls. Conclusions: In HD patients, PTX in doses of 800mg/day improves Hb significantly and in the short term (3 months) in HD patients (around 61% response) and allows the required ESA dose to be reduced in the medium-long term. This effect is sustained over time and treatment is tolerated well.
INTRODUCCIÓN Y OBJETIVOS
La anemia, complicación de la enfermedad renal crónica (ERC) atribuida al déficit de eritropoyetina (EPO), tiene una incidencia por encima del 70 % en estadios avanzados de esta enfermedad1. El tratamiento médico incluye la administración de agentes estimulantes de la eritropoyesis (AEE) y suplementos periódicos de hierro. La alta tasa de respuestas a este tratamiento ha permitido no solo evitar la transfusión de hematíes a pacientes en hemodiálisis (HD), sino también mejorar su calidad de vida de forma importante. Sin embargo, desde los inicios del uso de EPO se ha observado que existe un grupo de pacientes con resistencia a los AEE. En algunos casos es atribuible a factores fácilmente tratables, como déficit de hierro, hiperparatiroidismo grave, diálisis ineficaz, pérdidas hemáticas, déficits vitamínicos, etc.; y en otros, se ha propuesto como mecanismo implicado la inflamación2,3. De hecho, todo enfermo en diálisis tiene cierto grado de inflamación que se ha relacionado en mayor o menor medida con la anemia, según los casos2,4. La inflamación puede condicionar no solo menor producción de EPO, sino también menor respuesta de las células progenitoras de eritropoyesis a dicho tratamiento5.
La pentoxifilina (PTX), derivada de la metilxantina, es un inhibidor no específico de las fosfodiesterasas que, además de tener propiedades reológicas6 y utilizarse como tratamiento en la enfermedad vascular periférica, tiene actividad antiinflamatoria. De hecho, se ha descrito que disminuye los niveles de interleucina 6 (IL-6) y otros parámetros de inflamación en pacientes en HD7. En cuanto al posible beneficio de su acción antiinflamatoria en la anemia del paciente renal, algunos estudios muestran que mejora la hemoglobina (Hb) en pacientes con ERC8-10, pero no hay datos tan claros en pacientes en programa regular de HD11.
El objetivo principal de este trabajo fue evaluar el cambio en el nivel de Hb y en la dosis de AEE en pacientes en HD tratados con PTX, comparados con un grupo control sin dicho tratamiento.
Los objetivos secundarios fueron: 1) estudiar los niveles de proteína C reactiva (PCR) como marcador de inflamación en estos pacientes; y 2) analizar la tolerancia y seguridad de la PTX en el grupo tratado.
MATERIAL Y MÉTODOS
Pacientes
Se estudiaron 36 pacientes en programa regular de HD de la Clínica Universidad de Navarra, Pamplona, de los cuales 18, considerados casos, recibían tratamiento con PTX, y 18 no (controles). La inclusión de pacientes se realizó en marzo del año 2011, previa obtención del consentimiento informado y de la aprobación del estudio por el comité ético del hospital.
Los criterios de inclusión para todos (casos y controles) fueron dos: tener una edad superior a 17 años y estar en programa regular de HD desde al menos tres meses antes. Los casos estaban además tomando PTX por vía oral. Se registró si la indicación de la toma de PTX había sido enfermedad vascular periférica o resistencia al tratamiento habitual de la anemia. El AEE utilizado en el tratamiento de la anemia, tanto en casos como en controles, era MIRCERA® (methoxy polyethylene glycol-epoetin beta). La falta de respuesta al tratamiento de la anemia en nuestra unidad estaba definida como niveles de Hb inferiores a 11 g/dl en los últimos tres meses a pesar de recibir dosis de AEE superior a 1,5 veces la dosis media habitual en nuestros enfermos (dosis habitual: 100 μg/mes) y tener un índice de saturación de transferrina (IST) superior al 20 %. Los criterios de exclusión fueron: diagnóstico de neoplasia o enfermedad hematológica; tratamiento con esteroides; cirugía mayor, hemorragia, ingreso prolongado (superior a 15 días), transfusión de hemoderivados en los últimos tres meses, cambios en la frecuencia o modalidad de diálisis durante el período de observación, hipotensión arterial sintomática frecuente en HD (más de 1 sesión/semana).
Todos los pacientes se dializaban con una membrana de helixona de permeabilidad media (1,4 o 1,8 m2, según los casos), un flujo de diálisis de 500 ml/min y con bicarbonato. Además todos recibían tratamiento con un inhibidor de la enzima de conversión de angiotensina II (IECA) en dosis baja e inhibidor de la HMG-CoA reductasa (estatina), como parte del protocolo de tratamiento habitual de nuestra unidad de HD.
Métodos
Se trata de un estudio observacional retrospectivo de casos y controles que realizó la recogida y análisis de datos en marzo-abril de 2011. Los pacientes incluidos fueron estudiados entre agosto de 2008 y marzo de 2011, siendo un espacio de tiempo prolongado por la diferente fecha de inicio de tratamiento en cada caso. Los controles fueron seleccionados desde la misma unidad de HD que los tratados, siendo emparejados por sexo y edad. De la historia clínica de todos los pacientes (casos y controles), se recogieron los siguientes datos (en las mismas fechas para casos y controles): nivel de Hb, dosis de MIRCERA®, niveles de PCR y hormona paratiroidea (PTH) intacta. Estos datos se recogieron en tres momentos distintos: antes de iniciar el tratamiento con PTX, a los tres meses y al finalizar el seguimiento (momento de inclusión de los pacientes). Al inicio y al final del período de observación se registraron también los niveles de ferritina. El IST medio basal en los pacientes que tomaban PTX por anemia resistente al tratamiento fue 35,5 % (desviación estándar [DE]: 2,9). No se dispuso de datos evolutivos (a los tres meses y al final del estudio) del IST en todos los pacientes.
Además se recogieron las siguientes variables de cada paciente: peso seco, índice de masa corporal (IMC), volumen de distribución calculado por la fórmula de Watson12, índice de comorbilidad de Charlson, diabetes, causa de ERC, tipo de acceso vascular, modalidad de HD, frecuencia y duración de las sesiones, tiempo de permanencia en HD y, como parámetro de eficacia de diálisis, el valor de Kt.
El análisis estadístico se realizó utilizando el programa SPSS v17 (SPSS Inc, Chicago), considerando significativa una p < 0,05. Las variables cuantitativas se expresaron como media y DE, y las cualitativas como número y porcentaje. La comparación entre grupos se realizó mediante la t de Student o Χ2, según el tipo de variable. Para valorar la evolución de las variables estudiadas en el tiempo (basal, tres meses y final) se utilizó un modelo lineal de medidas repetidas.
RESULTADOS
La inclusión de pacientes se realizó en marzo de 2011. El rango de tiempo de toma de PTX de los 18 pacientes tratados hasta esa fecha estaba entre 6 y 32 meses, con un tiempo medio total de seguimiento de 16,6 meses. De los 18 pacientes, 4 tomaban PTX por vasculopatía y 14 por anemia sin respuesta adecuada al tratamiento habitual. La pauta de dosis de PTX más frecuente, tanto inicial como final, fue de 400 mg/12 horas. Con estas dosis no se registraron efectos adversos o intolerancias que llevaran a reducir la dosis o tener que suspender el fármaco.
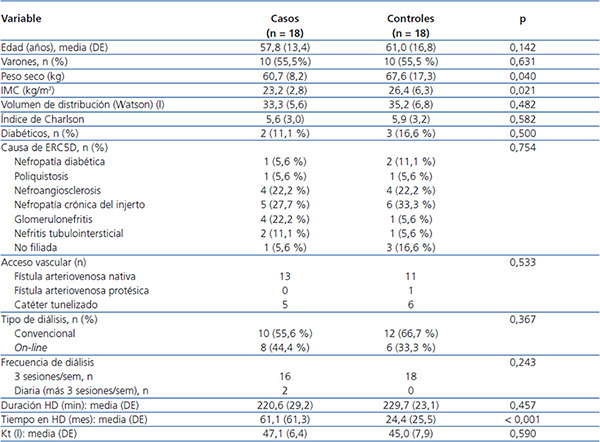
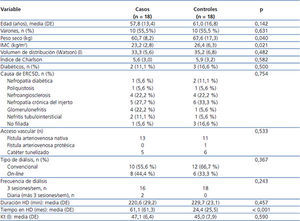
Las características demográficas y clínicas de los casos y controles, así como las variables relacionadas con la diálisis, se describen comparativamente en la tabla 1. No hubo diferencias en cuanto a: edad, sexo, frecuencia de diabetes, causa de ERC, tipo de acceso vascular, modalidad de diálisis, frecuencia y duración de la sesión de HD ni tampoco en el valor de Kt. Se observaron valores medios de Kt en ambos grupos en el límite bajo de la normalidad. Este dato es explicable si se tiene en cuenta que el tiempo medio de duración de la sesión de HD fue inferior a 240 minutos debido a que algunos pacientes (2 casos y 4 controles) mayores de 75 años, y con más comorbilidades asociadas, no aceptaban un tiempo más prolongado de diálisis. Resultaron significativamente menores los valores de peso seco (p = 0,04) e IMC (p = 0,021) en el grupo tratado. Sin embargo, puesto que la media del IMC (23,5 kg/m2) no se corresponde con un valor de malnutrición, no parece que pudiera influir en el control de la anemia de estos pacientes. El tiempo que llevaban dializándose fue significativamente superior en el grupo tratado (p < 0,001), siendo este un hallazgo exclusivamente observacional (los casos y controles se emparejaron solo por edad y sexo), pero de cierto interés para comentar los resultados.
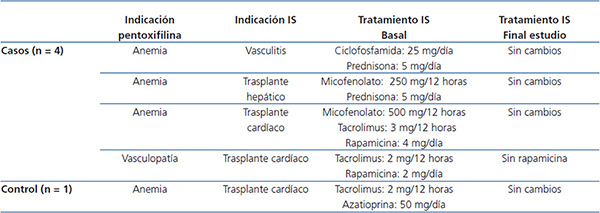
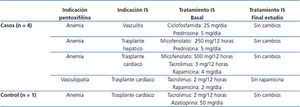
De los 36 pacientes incluidos, aunque en 11 (5 casos y 6 controles) la causa de ERC era una pérdida del injerto renal, los resultados no están influidos por la toma de inmunosupresión o inflamación asociada al injerto por los siguientes datos: de los 5 controles, 3 ya no portaban el injerto (trasplantectomía) y, de los otros 2, uno solo recibía esteroides y el otro no tomaba inmunosupresores, por llevar en diálisis 10 meses. En cuanto a los 6 controles, 3 tampoco tenían ya injerto (trasplantectomía) y los otros 3, que llevaban un tiempo en diálisis superior a 6 meses, estaban sin inmunosupresión. Al revisar los tratamientos que recibía el resto de los pacientes, se encontró que durante el período de estudio estaban tomando inmunosupresores, por distintas causas, 4 casos y 1 control. En la tabla 2 se incluye de esos pacientes la causa por la que tomaban PTX, la indicación del tratamiento inmunosupresor, los fármacos con sus dosis, así como los cambios registrados en el tratamiento durante el estudio. De todos ellos solo en uno de los casos (trasplante cardíaco) hubo cambio en el tratamiento inmunosupresor, observando que en el control de los tres meses ya no tomaba rapamicina. No obstante, en este paciente se había iniciado la PTX por vasculopatía periférica, y no para optimizar el control de la anemia refractaria.
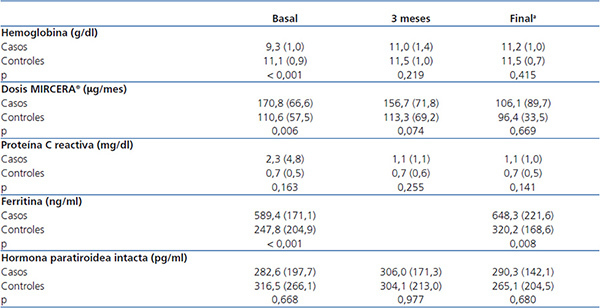
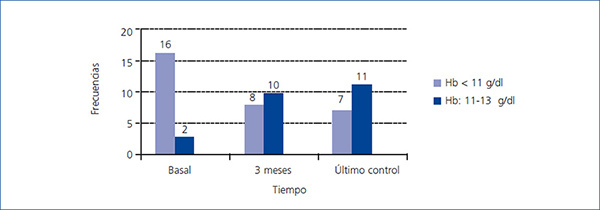
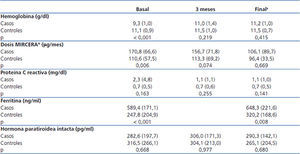
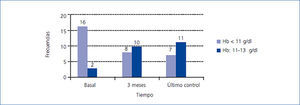
El cambio en los niveles de Hb, PCR, dosis de MIRCERA®, ferritina y PTH intacta por grupos se incluye en la tabla 3, con las diferencias entre grupos (casos-controles). Respecto a las diferencias intragrupo de las variables analizadas, se observó que en el grupo tratado había un aumento significativo de la Hb a los tres meses (p < 0,001) y al final del estudio (p < 0,001) respecto al valor basal. En el mismo grupo hubo un descenso en las dosis de AEE no significativo a los tres meses (p = 0,226), pero que alcanzó la significación estadística al final del estudio (p = 0,002). Aun cuando numéricamente se apreció un descenso en las dosis de AEE en el grupo control a lo largo del estudio, este descenso no fue significativo (p > 0,05). Tampoco se encontraron diferencias significativas en el tiempo para el resto de las variables estudiadas tanto en casos como controles. Se estudió el número de pacientes tratados con PTX que alcanzaban el nivel de Hb recomendado (11-13 g/dl) en los distintos tiempos de estudio: basal (antes de iniciar el tratamiento), a los tres meses y en el final de seguimiento. En la figura 1 se representan los resultados, observando que, mientras al inicio del tratamiento con PTX solo 2 de 18 (11,1 %) estaban en el rango de Hb objetivo (11-13 g/dl), a los tres meses ya eran 10 de 18 (55,5 %) y al final del seguimiento fueron 11 de 18 (61,1 %). En ningún caso se superó el valor máximo de Hb recomendada. De los 7 que no alcanzaron el nivel de Hb recomendado con PTX respecto a los 11 que sí lo hicieron, no hubo diferencias en cuanto a frecuencia de diabéticos y vasculopatía periférica (ninguno de los 7 que no alcanzaron el nivel recomendado de Hb era diabético ni tenía vasculopatía periférica), catéter venoso central tunelizado (28,6 % en los no respondedores frente a 27,3 % en los respondedores; p = 0,676) y HD on-line (57,1 % en los no respondedores frente a 36,4 % en los respondedores; p = 0,352). Sin embargo, en el grupo que no alcanzó el rango de Hb recomendado, el 49,2 % estaba tomando inmunosupresores, frente al 9,1 % en el que sí lo alcanzó (p = 0,137). Tampoco hubo diferencia significativa entre los que no alcanzaron el nivel de Hb recomendado y los que sí lo hicieron en los valores de PCR al final del estudio (1,5 frente a 0,9 mg/dl, p = 0,223) y de PTH (316,1 frente a 272,2 pg/ml, p = 0,291). Como era de esperar, los que no tenían la Hb en rango adecuado al final del estudio recibieron una dosis media de PTX mayor que los que la tenían (914,3 frente a 763,6 mg/día, p = 0,047).
DISCUSIÓN
Aunque existen publicaciones sobre el uso de PTX en la enfermedad renal en general, nuestro estudio de casos y controles muestra beneficio del uso de este fármaco en el control de la anemia en pacientes en HD, que se observa en tres meses. La PTX produjo un aumento de Hb a corto plazo y descenso en las dosis de AEE a medio-largo plazo, de tal forma que alrededor del 61 % de los pacientes (algunos de ellos catalogados en nuestra unidad como resistentes a los AEE) llegaron al nivel de Hb recomendado. Estos efectos se mantuvieron en el tiempo y se consiguieron con una dosis media de PTX de 400 mg/12 horas que fue bien tolerada.
Respecto al efecto de la PTX en la anemia del paciente renal, hay publicados estudios observacionales con dosis de 400 mg/día. Uno de ellos8 incluye 7 pacientes con filtrado glomerular estimado (FGe) inferior a 30 ml/min y otro10 incluye 16 pacientes en HD. Ambos describen un aumento de la Hb en seis meses. En cuanto a ensayos clínicos, hay referencia del inicio de uno en 2008 en Australia con previsión de incluir 110 pacientes con FGe inferior a 30 ml/min, algunos en HD13, pero sin publicación de los resultados por el momento, y en otro11, publicado más recientemente, no se encontraron diferencias en Hb y dosis de AEE tras seis meses de tratamiento con 400 mg/día de PTX frente a placebo en 50 pacientes en HD. En nuestro estudio de casos y controles se apreció una mejora de la anemia con la PTX, si bien la dosis media inicial y final fue mayor (800 mg/día aproximadamente) que en los estudios referidos. Esto podría explicar que el efecto se observe ya a los tres meses, aun tratándose de pacientes en HD, a diferencia de lo descrito por el ensayo publicado11. Quizá la dosis de 400 mg/día pueda no resultar suficiente para algunos pacientes en HD, si bien habría que confirmarlo en estudios posteriores de búsqueda de dosis.
En paralelo con el aumento de Hb hubo un descenso significativo en la dosis de AEE, haciéndose equiparable a la que estaba recibiendo el grupo control. En uno de los estudios citados8, solo en 1 de los 14 pacientes que completan el estudio y con aumento de la Hb se reducen las dosis de AEE. Puesto que es un estudio de solo cuatro meses de tratamiento, resulta acorde con nuestros resultados, ya que tampoco nosotros encontramos descenso en la dosis de AEE al tercer mes aun cuando ya hubo aumento de Hb. El posible efecto de la PTX sobre la reducción de dosis de AEE se hizo evidente a medio-largo plazo (final del estudio). La reducción de AEE observada, aun siendo lógica consecuencia del aumento mantenido de Hb, tiene gran interés, no solo por los riesgos que pueden tener dosis altas de AEE en determinadas condiciones (hipertensión y alteración plaquetar)14-17, sino también por el ahorro en costes que puede suponer el evitar dichas dosis, asunto de gran importancia en la situación económica actual.
La mejoría de la anemia con PTX se ha relacionado, entre otros mecanismos, con sus propiedades antiinflamatorias9,18,19. De hecho, un estudio reciente en 18 pacientes en HD describe un descenso de parámetros de inflamación como son la IL-6 y la PCR tras cuatro meses de tratamiento con PTX (400 mg/día)7, y otro, en ERC sin diálisis, describe descensos del factor de necrosis tumoral alfa, la PCR y el fibrinógeno tras doce meses de tratamiento con dosis de 800 mg/día20. En nuestro estudio no disponemos de los niveles de citocinas, pero sí registramos los niveles de PCR. Se ha demostrado la utilidad de la PCR en los pacientes en HD, no solo como marcador de inflamación, sino como posible mediador de la menor biodisponibilidad del hierro y resistencia al tratamiento de la anemia4. Aunque no se observó descenso significativo de PCR en el grupo tratado ni hubo diferencias entre grupos, la consistencia de las publicaciones previas respecto al impacto de la PTX en los niveles de PCR7 y la tendencia numérica observada en nuestro grupo tratado (descenso de PCR), con una gran variabilidad basal (DE basal de 4,8 en el grupo con PTX) observada, nos lleva a sospechar que este resultado se deba a limitaciones del tamaño muestral. Respecto a la ferritina, marcador indirecto de inflamación con correlación positiva con el nivel de IL-6 en algún estudio21, presentó diferencias entre casos y controles, sin apreciarse cambios con el tratamiento. Tampoco en otro estudio de pacientes con ERC que tomaron PTX (800 mg/día) encontraron descenso significativo de ferritina21. En nuestro estudio, los niveles de ferritina basales más altos en el grupo tratado que en el control pueden considerarse como expresión indirecta del nivel mayor de inflamación, y al igual que en la publicación referida no descienden con la PTX, posiblemente por la influencia de otros factores y por el complejo metabolismo de la ferritina22.
Respecto al posible papel de otros factores clínicos identificables3 de la anemia resistente en el grupo tratado, hay que señalar que basalmente no presentaban mayor comorbilidad medida por el índice de Charlson ni vasculopatía, ni peor control del hiperparatiroidismo. En cuanto al estado nutricional, aunque el peso seco y el IMC eran más bajos en el grupo de estudio, no tenían un nivel de malnutrición. Tampoco hubo diferencias en cuanto a la causa de la ERC y factores relativos a la diálisis23, como número de pacientes con catéteres (factor asociado a inflamación y anemia), casos en HD convencional frente a hemodiafiltración on-line24 y eficacia de la HD25. Incluso a pesar de que en ambos grupos la estimación media del Kt como índice de diálisis adecuada estaba en el límite bajo de la normalidad por sesiones cortas en algunos pacientes (edad avanzada, comorbilidad y negativa del paciente a diálisis más largas), esta situación no impidió una mejoría en la Hb de los pacientes tratados con PTX. Únicamente el tiempo en diálisis fue muy superior en el grupo tratado y este factor podría explicar cierto impacto negativo en la anemia a través de mecanismos como la inflamación crónica.
Por último, una referencia a algunos de los fármacos que tomaban los pacientes, como son el IECA y la estatina. Aunque se ha descrito un posible impacto negativo en la eritropoyesis relacionada con el bloqueo de la angiotensina II, y en alguna publicación se demuestra que es dependiente de la dosis26, estudios más recientes no muestran dicho efecto27. En cuanto a la estatina, se ha descrito un beneficio potencial en el control de la anemia28 por disminuir los niveles pro-hepcidina (precursor de hepcidina y mediador de la anemia inflamatoria)29. Sin embargo, todos nuestros pacientes, tratados y controles, estaban con IECA en dosis bajas y estatina durante todo el estudio, sin modificación en las dosis y, por tanto, los cambios observados no pueden atribuirse a este fármaco.
Respecto al porcentaje de pacientes en los que no se consigue un nivel de Hb recomendado (en torno al 39 %) al final del estudio, puede que el tratamiento inmunosupresor juegue algún papel en los resultados, aunque no alcanza diferencia significativa (en ese subgrupo había más casos con tratamiento inmunosupresor). Este dato podría tenerse en cuenta para futuros estudios como factor predictivo de mala respuesta a la PTX en la optimización del control de la anemia en HD o quizá plantearse que este subgrupo de pacientes responda a dosis superiores de PTX. Aunque la dosis estándar de este fármaco es 400 mg tres veces al día y no parece que en insuficiencia renal haya acumulación significativa con la toma de dos o tres veces al día, convendría realizar más estudios de seguridad en pacientes en HD, sobre todo en tratamientos a largo plazo si se deciden dosis superiores.
CONCLUSIONES
Aunque el estudio tiene limitaciones (unicéntrico, observacional retrospectivo y con una n limitada), podemos plantear que el tratamiento con PTX en dosis de 400 mg/12 horas en pacientes en HD puede optimizar el control de la anemia (mejora la Hb y reduce la dosis de AEE), consiguiendo aproximadamente un 60 % de respuesta incluso en pacientes con cierta resistencia al tratamiento habitual. Además, el efecto observado se mantiene en el tiempo, sin problemas de tolerancia o toxicidad. Convendría confirmar estos resultados en algún estudio multicéntrico aleatorizado antes de incluir la PTX de forma rutinaria en el tratamiento del paciente en HD con falta de respuesta al tratamiento habitual y una vez descartada la presencia de causas tratables.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Tabla 2. Datos descriptivos de los pacientes del estudio que tomaban tratamiento inmunosupresor
Tabla 3. Niveles de hemoglobina, dosis de MIRCERA®, proteína C reactiva, ferritina y hormona paratiroidea intacta por grupos
Figura 1. Distribución de los pacientes tratados con pentoxifilina según rango de hemoglobina en los distintos tiempos
Tabla 1. Características demográficas y clínicas del grupo tratado y control