Introducción: El fracaso renal agudo (FRA) en el mieloma múltiple (MM) se presenta entre el 12-20% de los casos y la supervivencia de estos pacientes depende de la recuperación de la función renal. El 75% de los pacientes dependientes de diálisis no recuperan la función renal y su supervivencia media en situación de tratamiento sustitutivo es inferior al año. La nefropatía por cilindros es la causa más frecuente de fracaso renal y acontece en más del 55% de los casos, y en el 75% de aquellos que requieren diálisis. Para facilitar la recuperación de la función renal es imprescindible la disminución rápida de los niveles en sangre de cadenas ligeras. Una medida coadyuvante al tratamiento específico de la enfermedad ha sido la reducción de estas cadenas ligeras con plasmaféresis, sin que se haya demostrado claramente su eficacia, por lo que se ha propuesto el uso de hemodiálisis largas con filtros de alto poro (HCO), consiguiendo una tasa de recuperación superior al 60%. Presentamos la evolución en seis casos de pacientes con mieloma y fracaso renal agudo que fueron tratados con dichos filtros HCO, las complicaciones con este tipo de hemodiálisis y revisamos los pros y los contras de esta técnica. Metodología: Seis pacientes diagnosticados de MM y FRA con necesidad de diálisis y niveles circulantes de cadena ligera por encima de 500 mg/l fueron tratados con hemodiálisis de 8 horas con filtro HCO. Al comienzo y al final de cada sesión se medían las cadenas ligeras séricas por nefelometría, así como otros parámetros. Al mismo tiempo los pacientes fueron tratados con quimioterapia según protocolos. Resultados: A tres hombres y tres mujeres diagnosticados de MM y FRA, con inicio de los síntomas muy variable, desde 7 días a más de un año, se les realizó 90 sesiones de hemodiálisis largas con filtros HCO con un rango de entre 6 y 40 sesiones. El porcentaje de reducción de las cadenas ligeras desde el inicio del tratamiento hasta su finalización fue el 65% de media, excepto en un paciente, que fue del 12,6%. La media del porcentaje de reducción de la cadena ligera por sesión fue de 54,98 ± 17,27%. En el 28% de las sesiones se registró alguna complicación. El 48% de las complicaciones se debieron a la coagulación del sistema. No hubo grandes cambios en los niveles de albúmina prediálisis, calcio, fósforo y magnesio, aunque en algún caso se registraron valores disminuidos que no comportaron relevancia clínica. En tres pacientes la función renal se recuperó y permanecen vivos e independientes de la diálisis. En los casos biopsiados y que recuperaron función renal, la nefropatía por cilindros fue pura. Los pacientes que tardaron más en ser diagnosticados fueron los pacientes que no recuperaron función renal, y cuando se les efectuó biopsia el diagnóstico fue de nefropatía por cilindros más enfermedad por depósitos. Conclusión: En nuestra experiencia, la hemodiálisis larga con filtros HCO es una alternativa razonable en el FRA causado por nefropatía por cilindros, alcanzando en nuestros casos una tasa de recuperación del 50%. En la recuperación influyeron: el tiempo transcurrido desde el inicio de los síntomas al diagnóstico de mieloma, los hallazgos histológicos, la rapidez de instauración del tratamiento quimioterápico y su respuesta y la eficacia en la extracción de cadenas ligeras. En cualquier caso, son necesarios nuevos estudios con nuevos agentes quimioterápicos y las nuevas técnicas de extracción directa de cadenas ligeras.
Introduction: Acute renal failure (ARF) occurs in 12%-20% of all multiple myeloma (MM) cases, and the survival of these patients depends on renal function recovery. Renal function is not recovered in 75% of dialysis-dependent patients, and their mean survival with replacement therapy is less than one year. Renal tubular disease is the most frequent cause of renal failure. It is present in more than 55% of renal failure cases and in 75% of those requiring dialysis. Rapid reduction of free light chain levels in the blood is necessary in order to recover renal function. One coadjuvant measure in treating the disease is reducing light chain levels with plasmapheresis, but its efficacy has not yet been clearly proven. Our proposal was therefore to use extended haemodialysis sessions with high cut-off dialysers (HCO-HD), obtaining a recovery rate of more than 60%. We present the progress of 6 patients with myeloma and acute renal failure who were treated with HCO-HD and the complications associated with using this type of haemodialysis. Then, we review the pros and cons of this technique. Method: Six patients diagnosed with MM and ARF requiring dialysis and with serum free light chain levels above 500mg/l were treated with 8-hour haemodialysis sessions with an HCO-HD filter. Before and after each session, serum free light chain levels were measured by nephelometry; other parameters were recorded as well. At the same time, patients underwent chemotherapy according to protocols. Results: The symptom onset times of the 3 men and 3 women diagnosed with MM and ARF were highly variable, from 7 days to more than 1 year. We performed 90 extended sessions with HCO-HD filters, and each patient underwent between 6 and 40 sessions. Free light chain levels decreased by a mean of 65% between treatment onset and completion, except in one patient who experienced a 12.6% reduction. The mean percentage of reduction of light chain levels per session was 54.98%±17.27%. A complication occurred during 28% of the sessions. Of these complications, 48% were due to system coagulation. There were no major changes in pre-dialysis albumin, calcium, phosphorous or magnesium levels, although lower values that were not clinically relevant were recorded in one case. Renal function was recovered in 3 patients, they are alive and dialysis-free. In biopsied cases that recovered renal function, the specimen showed tubular nephropathy only. Those patients who took longer to be diagnosed did not recover their renal function, and when biopsied, they were diagnosed with renal tubular disease and light chain deposition disease. Conclusion: We found extended haemodialysis with HCO-HD filters to be a reasonable alternative in ARF caused by renal tubular disease, and achieved a recovery rate of 50% in our cases. Function recovery was influenced by the elapsed time between symptom onset and myeloma diagnosis, histological findings, promptness of starting chemotherapy, response to chemotherapy, and effectiveness of light chain extraction. In any case, further studies are needed to examine new chemotherapy agents and new direct free light chain removal techniques.
INTRODUCCIÓN
El mieloma múltiple (MM) es una neoplasia de células plasmáticas en la que se presenta fracaso renal agudo (FRA) entre el 12-20% de los casos, bien como presentación inicial del mieloma o en el transcurso de su evolución una vez diagnosticado1. La supervivencia de estos pacientes va a depender de la recuperación de la función renal, no sólo por las complicaciones derivadas del propio fracaso renal, sino también por la menor posibilidad de acceso a tratamientos más efectivos2,3. El 75% de los pacientes dependientes de diálisis no recuperan la función renal4-7 y su supervivencia media en situación de tratamiento sustitutivo es inferior al año8.
La nefropatía por cilindros es la causa más frecuente de FRA y acontece en más del 55% de los casos y en el 75% de aquellos que requieren diálisis9,10. La formación de cilindros en los túbulos distales, ocasionados por el depósito de cadenas ligeras junto a la proteína de Tamm-Horsfall, es la causante de la mayor parte de los fracasos renales en estos pacientes11-14; por tanto, resulta imprescindible, para facilitar la recuperación de la función renal, la disminución rápida de los niveles en sangre de estas cadenas15.
El tratamiento quimioterápico del MM ha mejorado mucho en la última década y pautas con bortezomib, melfalán, talidomida o lenalidomida han mejorado el pronóstico de los pacientes16. Una medida coadyuvante al tratamiento de la enfermedad ha sido la reducción de cadenas ligeras por técnicas de depuración extracorpóreas. La plasmaféresis ha sido utilizada durante muchos años para reducir los niveles circulantes de cadenas ligeras aunque no ha demostrado claramente su eficacia en la recuperación de la función renal17. Apoyados en esta circunstancia se han buscado nuevas técnicas para depurar eficazmente las cadenas ligeras y tratar de mejorar la tasa de recuperación de la función renal. Así, Hutchison et al., utilizando filtros de alto poro (HCO) y hemodiálisis largas (ocho horas), han conseguido buenos resultados en estos pacientes, con una tasa de recuperación por encima del 60%18.
Presentamos la evolución de seis pacientes con mieloma y fracaso renal agudo que fueron tratados con estos filtros HCO, así como las complicaciones con este tipo de hemodiálisis, y revisamos los pros y los contras de esta técnica.
MATERIAL Y MÉTODOS
Seis pacientes diagnosticados de MM y FRA con necesidad de diálisis y niveles séricos de cadenas ligeras libres por encima de 500 mg/l fueron tratados con hemodiálisis con filtro de alto poro HCO 1100® de 1 m2 o Theralite® 2,1 m2 de poliariletersulfona/polivinilpirrolilidona (Gambro Dyalisatorem, Henchingen, Germany)19. Estos filtros están diseñados para incrementar la permeabilidad de sustancias por debajo de 60 kD. Sólo se diferencian en la mayor superficie de la membrana, lo que conlleva mayor eficacia en la depuración de cadenas ligeras aunque también mayor pérdida de albúmina. Se utilizó Theralite® 2,1 m2 cuando comercialmente estuvo disponible. Las sesiones de hemodiálisis fueron realizadas con monitores de hemodiálisis estándar, con una duración de 8 horas, flujo sanguíneo de 200 a 250 ml/min, flujo de líquido de diálisis ultrapuro de 500 ml/min. La heparinización se realizó con heparina sódica 3000 UI al inicio y 500 UI cada hora. Al finalizar la sesión se reponía albúmina al 20% (100 cc), fosfato monosódico (10 ml) y sulfato de magnesio 1 M (10 ml) siguiendo las pautas marcadas por Hutchison et al.20. El propósito fue realizar 5 sesiones consecutivas con frecuencia diaria y posteriormente sesiones a días alternos hasta la recuperación de la función renal o cuando los niveles de cadena ligera descendieran por debajo de 500 mg/l. La ultrafiltración se programó según las necesidades clínicas.
Al comienzo y al final de cada sesión se medía el nivel de cadenas ligeras libres por nefelometría expresados en mg/l (FREELITE®; The Binding Site, Birmingham, UK)21, así como creatinina, albúmina, fósforo, calcio y magnesio al comienzo de cada diálisis. En el primer paciente también se determinaron al finalizar las sesiones. En los casos en que se realizó biopsia renal, ésta se procesó por microscopía óptica e inmunofluorescencia con las técnicas convencionales, incluyendo en la inmunofluorescencia anticuerpos anticadena ligera Kappa y Lambda; se realizó asimismo tinción con rojo Congo.
Al mismo tiempo, los pacientes fueron tratados con quimioterápicos según protocolos del Departamento de Hematología.
RESULTADOS
Tres hombres y tres mujeres ingresaron en el Servicio de Nefrología por FRA de causa no determinada y finalmente fueron diagnosticados de MM. Las características de los pacientes están reflejadas en la tabla 1. Tres pacientes eran menores de 60 años y los otros tres superaban los 70. Los síntomas de inicio fueron dolores óseos en cuatro de los casos, otra paciente ingresó por síndrome constitucional y en el sexto el diagnóstico de ingreso fue pancreatitis no confirmada y fracaso renal. El inicio de los síntomas fue muy variable, desde 7 días a más de un año en el caso de la paciente número 6. En esta paciente, al revisar su historial previo se había detectado gammapatía monoclonal e infartos óseos un año antes, cuando precisó asistencia sanitaria, sin llegar a completar el estudio. Los pacientes que tardaron más en ser diagnosticados fueron los pacientes que no recuperaron función renal.
Tres pacientes presentaron mieloma de cadenas ligeras Kappa; dos pacientes, mieloma IgG Lambda; un paciente, mieloma IgA Kappa. La médula ósea estaba infiltrada en grado variable por células plasmáticas con fenotipo anómalo propio de la enfermedad. En cuatro pacientes se realizó biopsia renal: en dos de ellos se diagnosticó nefropatía por cilindros y en los otros dos, nefropatía por cilindros más enfermedad por depósitos. La inmunofluorescencia fue positiva en los glomérulos para la cadena ligera causante en los dos casos de enfermedad por depósito, y en los túbulos y cilindros en los cuatro casos. La afectación intersticial fue leve y la reactividad tubular con marcados cambios regenerativos fue similar en todos los casos, y en ninguno la tinción rojo Congo fue positiva. Un paciente rehusó realizarse la biopsia (caso 3) y el estado de la otra paciente lo desaconsejó (caso 4). La proteinuria osciló entre 6680 mg/dl y 570 mg/dl sin que hubiera correlación entre los niveles séricos de cadenas ligeras libres ni los hallazgos anatomopatológicos.
El número de días de ingreso, días al diagnóstico, días al comienzo de hemodiálisis con filtros HCO, así como los días transcurridos desde el ingreso al inicio de quimioterapia se reflejan en la tabla 2. Los tres primeros pacientes fueron tratados con vincristina, adriamicina y dexametasona, y los tres últimos con pautas de bortezomib más melfalán y/o prednisona según protocolos del Servicio de Hematología.
En los seis pacientes se realizaron 90 sesiones de hemodiálisis con un rango de entre 6 y 40 sesiones. La interrupción de las hemodiálisis con HCO vino motivada por: a) la recuperación de la función renal en los tres casos en que esto sucedió (casos 1, 3 y 5); b) en el caso 2, en el que el comienzo de la hemodiálisis con HCO se retrasó unos días por presentar la paciente un gran hematoma en región inguinal tras canalización de la vena femoral, se comprobó a posteriori que los niveles de cadena ligera habían descendido por debajo de 500 mg/l; c) en el caso 4, se interrumpió el tratamiento al comprobar que, tras 7 sesiones de hemodiálisis, las cadenas ligeras de la paciente permanecían por encima de 700 mg/l y se mantenía en anuria; d) en el caso 6, también se interrumpió el tratamiento tras 40 sesiones de hemodiálisis con HCO y tres ciclos de bortezomib más prednisona sin obtener respuesta, permaneciendo las cadenas ligeras en 2760 mg/l y oliguria.
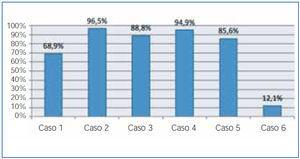
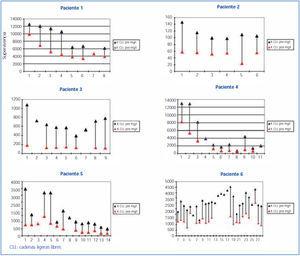
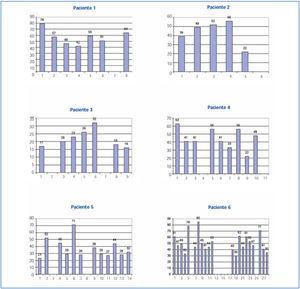
El porcentaje de reducción de las cadenas ligeras desde el inicio de tratamiento hasta su finalización en cada paciente se refleja en la figura 1 y fue muy elevado en todos los pacientes, excepto en el paciente 6, que no respondió al tratamiento quimioterápico y la reducción de las cadenas ligeras fue pequeña (12,6%); en los otros cinco, la reducción fue superior al 65%. En 56 sesiones en las que se midió la cadena ligera pre y poshemodiálisis, la media del porcentaje de reducción de la cadena ligera fue de 54,98 ± 17,27% (figura 2 y figura 3). No hubo diferencias para la reducción de cadena ligera Kappa o Lambda (Kappa 53,52 ± 18,6% vs. Lambda 57,82 ± 14,2%) ni cuando se usó el filtro HCO de 1,1 m2 o Theralite® 2,2 m2 (56 ± 19% vs. 53 ± 15%, respectivamente).
En 25 sesiones de hemodiálisis (28%) se registró alguna complicación o incidencia. Éstas se describen en la tabla 3. En 12 ocasiones (48%) las complicaciones se debieron a la coagulación del sistema (8 episodios correspondieron al paciente 6), lo que obligó a suspender la sesión en tres ocasiones. Poco flujo y obstrucción del catéter acontecieron en otros 8 episodios (32%). Otras complicaciones fueron irrelevantes.
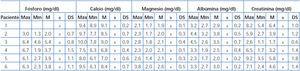
No hubo grandes cambios en los niveles de albúmina prediálisis cuando utilizamos esta técnica, aunque en los dos pacientes en los que se usó el filtro Theralite® de 2,1 m2 se observó un mayor descenso de la albúmina que obligó a aumentar la dosis administrada al finalizar la diálisis (casos 5 y 6). En cuanto a los niveles de calcio, fósforo y magnesio, aunque en algún caso se registraron valores disminuidos, no comportaron relevancia clínica (tabla 4). Otras complicaciones en la evolución de los pacientes fueron: dos infecciones (en uno de ellos, hemocultivo positivo a Echerichia coli, el otro hemocultivo negativo) y un accidente cerebrovascular con recuperación completa.
En tres pacientes la función renal se recuperó (casos 1, 3 y 5) y los pacientes permanecen vivos e independientes de la diálisis. El caso 1 fue trasplantado de medula ósea y su evolución es favorable después de tres años y medio; el caso 3 lleva un seguimiento de dos años y 8 meses, y el caso 5, de 8 meses. De los tres casos que no recuperaron función, un paciente falleció a los 4 meses de su ingreso en hemodiálisis; en los otros dos casos, los pacientes permanecen vivos, aunque dependientes de diálisis (caso 2: 2 años y 10 meses, caso 6: 4 meses). En los dos casos en que no se recuperó la función renal y se había realizado biopsia renal, la nefropatía por cilindros se acompañó de enfermedad por depósitos, mientras que los dos casos en que recuperaron la función renal y se realizó biopsia la nefropatía de cilindros era pura.
DISCUSIÓN
Con la experiencia que presentamos demostramos que en pacientes con MM y FRA con nefropatía por cilindros, con un tratamiento combinado de quimioterápicos y hemodiálisis larga con filtros de HCO, es posible la recuperación de la función renal, como sucedió en al menos el 50% de los pacientes de nuestra pequeña serie.
Trabajos recientes han demostrado que la reducción rápida de los niveles de cadenas ligeras con quimioterapia y procedimientos extracorpóreos se asocia a la recuperación de la función renal15,22-24. Varios estudios han evaluado la eficacia de la plasmaféresis en el tratamiento del fracaso renal del mieloma. El estudio de Zuchelli23 y, con menor importancia, el de Johnson24 demostraban una mejor evolución en aquellos pacientes que fueron tratados con plasmaféresis frente a los que no lo hicieron; pero el pequeño tamaño de la muestra, el hecho de que no todos los pacientes tuvieran nefropatía por cilindros y el uso de diferentes modalidades de diálisis fueron limitaciones significativas de estos estudios. Posteriormente Clark publicó un ensayo aleatorizado y controlado con 97 pacientes, la serie más larga de la bibliografía17. En este estudio, la plasmaféresis no fue superior con respecto al resultado compuesto de muerte, dependencia de diálisis y baja tasa de filtrado glomerular (< 30% ml/min/1,73 m2). No obstante, Leung15 afirma que la plasmaféresis es eficaz para la recuperación de la función renal (tiempo medio: 2 meses) si el daño renal es debido a nefropatía por cilindros y el nivel de cadenas ligeras libres se reduce en al menos el 50%. En resumen, la eficacia de la plasmaféresis en el riñón del mieloma es incierta y no probada a la luz de los datos contradictorios de un pequeño número de trabajos con pocos pacientes. La razón para que esto sea así es que la plasmaféresis sólo aclara el espacio intravascular (17%) y no la cantidad necesaria para beneficiar a muchos pacientes, así la reducción de los niveles de cadena ligera dependen principalmente del grado de producción5 y además la plasmaféresis no se puede prolongar por mucho tiempo.
Desde 2007 se ha propuesto el uso de hemodiálisis largas con membranas permeables a las proteínas para aumentar la extracción de cadenas ligeras hasta un 90% en un espacio de tiempo de tres semanas20. En este estudio, filtros HCO (Gambro), con tamaño de poro de 45 kD fueron superiores en aclarar las cadenas ligeras (22,5-31 kD) a cuatro dializadores de alto flujo (10 kD) y dos de superflujo (20 kD). En este mismo estudio el filtro HCO fue probado en 11 pacientes con mieloma y necesidad de hemodiálisis que recibieron distintas quimioterapias. De los 11 pacientes con biopsia renal diagnóstica de nefropatía por cilindros, 5 se dializaron diariamente durante una semana y a días alternos posteriormente; recuperaron la función renal 3 pacientes. En los 2 que no la recuperaron, episodios de infección obligaron a interrumpir la quimioterapia con el consiguiente rebote en los niveles de cadena ligera. Posteriormente estos mismos autores refrendaron la experiencia con 19 pacientes cuyas biopsias eran de nefropatía por cilindros y recuperaron la función renal 13 de ellos. En 6 pacientes en los que hubo que suspender la quimioterapia sólo uno recuperó función renal, lo que parece indicar que la extracción de cadenas ligeras con este método no es útil si no se acompaña de la respuesta a la quimioterapia18.
Acogiéndonos a la primera experiencia de Hutchison el al., nosotros comenzamos a tratar a pacientes con MM y FRA por nefropatía por cilindros con esta modalidad de hemodiálisis, siendo los resultados similares a los de aquellos autores. En nuestros seis pacientes, la extracción de cadenas ligeras en cada sesión de hemodiálisis larga con HCO redujo las cadenas ligeras en una proporción de entre el 53-57%, similar a la proporción de los pacientes de Hutchison. Al finalizar los tratamientos, en nuestros pacientes se habían reducido los niveles por encima del 70% del inicial, excepto en el paciente número 6, en el que, aunque las hemodiálisis eran efectivas en reducir las cadenas ligeras, no respondió a la quimioterapia y no recuperó la función renal tal y como ocurrió en los pacientes de Hutchison18.
No tuvimos complicaciones graves durante las sesiones de hemodiálisis, y con el reemplazo de albúmina, calcio, fosfatos y magnesio los niveles de estos parámetros fueron aceptables. Sí es cierto que, cuando usamos filtros de 2,1 m2, la pérdida de albúmina fue mayor y tuvimos que aumentar la dosis administrada al finalizar la diálisis y, como era esperable, usando un filtro de doble superficie25. Las dos complicaciones infecciosas tampoco fueron importantes y no obligó a interrumpir el tratamiento quimioterápico.
Respecto a la recuperación de la función renal, nuestros resultados son similares a los de Hutchison18; alrededor del 60% de los pacientes recuperan la función renal con esta técnica22. Varios son los factores que influyen en ello: 1) El tiempo transcurrido desde el inicio de los síntomas al diagnóstico de mieloma. En nuestros casos los tres pacientes que no recuperaron fueron los que llevaban más tiempo con síntomas (60, 120 días y 1 año). 2) Los hallazgos histológicos: los 2 pacientes en los que se realizó biopsia renal y que no recuperaron función renal presentaban enfermedad por depósitos, además de nefropatía por cilindros. Esta situación conlleva mal pronóstico y una supervivencia acortada26. 3) La rapidez de instauración del tratamiento quimioterápico y la respuesta a éste. 4) La eficacia en la extracción de cadenas ligeras con la hemodiálisis con filtros de alto poro. Un 60% de reducción de niveles en la cadena ligera a las tres semanas de comienzo del tratamiento comporta un 80% de posibilidades de recuperación18.
Aún no hay evidencia probada de que esta técnica contribuya claramente a una mejoría de resultados en la supervivencia de pacientes con MM y nefropatía por cilindros y que sea superior a la plasmaféresis, la cual tampoco tiene demostrada su eficacia. De hecho, está en marcha un estudio aleatorizado y controlado (EuLITE) en el que se reclutarán 90 pacientes nuevos diagnosticados de mieloma con nefropatía por cilindros y fracaso renal dependiente de diálisis. Todos los pacientes recibirán bortezomib y serán aleatorizados a tratamiento con hemodiálisis estándar o con hemodiálisis con filtro HCO. La variable principal es la independencia de diálisis a los tres meses del reclutamiento27. Si los resultados son favorables a la técnica, se plantea la comparación con plasmaféresis.
Además, una de las limitaciones para el uso de esta técnica es su elevado coste. Grima ha presentado recientemente un modelo de coste-efectividad comparando el tratamiento del riñón del mieloma con filtros HCO y hemodiálisis estándar28. Este estudio encontró que el tratamiento del riñón del mieloma usando hemodiálisis larga con filtro de HCO puede sustancialmente mejorar la recuperación renal en pacientes con mieloma múltiple comparado con hemodiálisis estándar, lo que resulta en mayor esperanza de vida y ahorro de costes basado en la evitación de hemodiálisis crónica. El modelo predice una media de supervivencia de 19,92 meses para pacientes con hemodiálisis estándar frente a 33,9 meses con la nueva terapia y un ahorro de 6000 libras esterlinas por paciente.
En conclusión, nosotros pensamos que, dado el mal pronóstico de los pacientes con MM y FRA por nefropatía de cilindros con necesidad de diálisis, la relación existente entre la reducción de cadenas ligeras y la recuperación de la función renal, es necesario instaurar precozmente tratamiento combinado de quimioterapia y un método de extracción extracorpórea de cadenas ligeras eficaz y que se pueda prolongar en el tiempo. La hemodiálisis larga con filtros HCO es una alternativa razonable, aunque son necesarios nuevos estudios con los nuevos agentes quimioterápicos y las nuevas técnicas de extracción directa de cadenas ligeras.
Conflictos de interés
Los autores declaran conflictos de interés potenciales:
- Honorarios por ponencias
- Bolsas de viaje o financiación para viajar
Tabla 1. Características de los seis pacientes diagnosticados de mieloma múltiple
Tabla 2. Días al diagnóstico y al tratamiento con HCO, quimioterapia empleada en seis pacientes diagnosticados de mieloma múltiple
Tabla 3. Complicaciones de hemodiálisis con HCO
Tabla 4. Valores máximos, mínimos, media y desviación estándar de fósforo, calcio, magnesio, albúmina y creatinina pre-sesiones de hemodiálisis
Figura 1. Porcentaje de reducción de cadenas ligeras libres en seis pacientes tratados con HCO al finalizar el tratamiento
Figura 2. Niveles de cadenas ligeras libres en suero pre y poshemodiálisis en los seis pacientes
Figura 3. Porcentaje de reducción de cadenas ligeras libres en suero en las sesiones de hemodiálisis en los seis pacientes