Antecedentes: El fracaso renal agudo (FRA) es una complicación frecuente tras la cirugía cardíaca y la angiografía coronaria que ensombrece el pronóstico de estos pacientes. El diagnóstico se basa en el ascenso de la creatinina sérica, que es tardío. Es necesaria la identificación y validación de nuevos biomarcadores precoces que permitan intervenciones más tempranas y eficaces. Objetivos: Evaluar la sensibilidad y especificidad de interleuquina-18 (IL-18) en orina, neutrophil gelatinase-associated lipocalin en orina (uNGAL) y cistatina C en suero para la detección precoz del FRA en una población de pacientes con síndrome coronario agudo o fallo cardíaco y sometidos a cirugía cardíaca o cateterismo. Métodos: Se incluyeron en el estudio 135 pacientes ingresados en una unidad de cuidados intensivos por síndrome coronario agudo o fallo cardíaco por patología coronaria o valvular y a los que se realizaron una angiografía cardíaca o una cirugía cardíaca de revascularización o recambio valvular. Se determinaron los biomarcadores a las 12 horas de la intervención y se monitorizó la creatinina sérica durante los siguientes seis días para el diagnóstico del FRA. Resultados: Para NGAL se obtuvo un área bajo la curva ROC (AUC) de 0,983 y para cistatina C e IL-18 de 0,869 y 0,727, respectivamente. Para un punto de corte de NGAL en orina de 31,9 ng/ml la sensibilidad fue del 100% y la especificidad del 91%. Conclusiones: uNGAL es un marcador precoz de FRA en pacientes con síndrome coronario o fallo cardíaco agudo y sometidos a cirugía cardíaca y angiografía cardíaca, con una capacidad predictiva superior a cistatina o a IL-18.
Background: Acute kidney injury (AKI) is a common complication in cardiac surgery and coronary angiography, which worsens patients’ prognosis. The diagnosis is based on the increase in serum creatinine, which is delayed. It is necessary to identify and validate new biomarkers that allow for early and effective interventions. Aims: To assess the sensitivity and specificity of neutrophil gelatinase-associated lipocalin in urine (uNGAL), interleukin-18 (IL-18) in urine and cystatin C in serum for the early detection of AKI in patients with acute coronary syndrome or heart failure, and who underwent cardiac surgery or catheterization. Methods: The study included 135 patients admitted to the intensive care unit for acute coronary syndrome or heart failure due to coronary or valvular pathology and who underwent coronary angiography or cardiac bypass surgery or valvular replacement. The biomarkers were determined 12 hours after surgery and serum creatinine was monitored during the next six days for the diagnosis of AKI. Results: The area under the ROC curve (AUC) for NGAL was 0.983, and for cystatin C and IL-18 the AUCs were 0.869 and 0.727, respectively. At a cut-off of 31.9ng/ml for uNGAL the sensitivity was 100% and the specificity was 91%. Conclusions: uNGAL is an early marker of AKI in patients with acute coronary syndrome or heart failure and undergoing cardiac surgery and coronary angiography, with a higher predictive value than cystatin C or IL-18.
INTRODUCCIÓN
El fracaso renal agudo (FRA) es una complicación frecuente tras la cirugía cardiovascular, con una incidencia comunicada variable, que depende tanto de la definición de FRA utilizada como de la población estudiada, pero que en la mayoría de las estimaciones se acerca al 30%1-3. El FRA prolonga la estancia hospitalaria y aumenta el riesgo de mortalidad entre tres y nueve veces en función de la gravedad del mismo2,3. Se ha demostrado que incluso pequeños aumentos de la creatinina empeoran el pronóstico de estos pacientes4. Los mecanismos que contribuyen al fracaso renal incluyen toxinas exógenas y endógenas, factores metabólicos, isquemia y reperfusión, activación neurohumoral, inflamación y estrés oxidativo5. El diagnóstico del FRA se basa en la detección del aumento de la creatinina sérica, que es tardío y no refleja bien el filtrado glomerular en el paciente agudo6. Sin embargo, estudios experimentales han demostrado que, aunque el FRA se puede prevenir o tratar con distintas intervenciones, éstas deben iniciarse precozmente tras la lesión renal7. La falta de eficacia de estas intervenciones en los ensayos clínicos con humanos se ha atribuido al retraso significativo en el diagnóstico del FRA. Por tanto, está claro que el tratamiento del FRA, para ser eficaz, debería ser precoz.
Respecto al FRA que aparece tras las intervenciones coronarias percutáneas, su incidencia puede situarse, en función de la definición y de la población estudiada, entre un 5 y un 20%, y constituye una complicación potencialmente grave8,9. El pico de la creatinina sérica suele ocurrir en los primeros cinco días posteriores a la intervención y vuelve a su valor basal (si bien puede suceder que quede un daño permanente) en una a tres semanas. Al igual que ocurre en el FRA tras la cirugía cardíaca, el ascenso de la creatinina sérica es un marcador tardío del daño renal.
Para intentar resolver estos problemas, en los últimos años diferentes grupos han intentado identificar nuevos marcadores para el diagnóstico temprano y estratificación del riesgo del FRA. Pese al esfuerzo invertido y los progresos realizados, en la actualidad aún no está bien establecida la utilidad real de los distintos marcadores en diferentes contextos clínicos de FRA10,11. Los marcadores más estudiados son cistatina-C, que en realidad no es un marcador de daño renal, sino de filtrado glomerular, Neutrophil Gelatinase-Associated Lipocalin (NGAL), interleukina-18 (IL-18), Kidney Injury Molecule-1 (KIM-1), y Liver Fatty Acid-Binding Protein (L-FABP), en suero o en orina.
El objetivo de este trabajo es evaluar la sensibilidad y especificidad de e IL-18 en orina, NGAL en orina (uNGAL) y cistatina en suero para la detección precoz del fracaso renal agudo en una población de pacientes con síndrome coronario agudo o fallo cardíaco y sometidos a cirugía cardíaca o cateterismo.
MATERIAL Y MÉTODOS
Sujetos de estudio
Se incluyeron en el estudio 135 pacientes ingresados entre mayo de 2008 y diciembre de 2009 en la Unidad de Cuidados Intensivos del Hospital Clínico Universitario de Valencia por síndrome coronario agudo o fallo cardíaco por patología coronaria o valvular y a quienes se les realizó una angiografía cardíaca con o sin angioplastia y/o implantación de endoprótesis (grupo 1, n = 89) o una cirugía cardíaca de revascularización o recambio valvular (grupo 2, n = 46). Los criterios de exclusión fueron: edad menor de 18 años, enfermedad renal crónica preexistente en tratamiento sustitutivo con diálisis o trasplante e insuficiencia renal aguda por shock cardiogénico en el momento del ingreso. También se excluyeron los pacientes a los que se había realizado angiografía y cirugía consecutivas para evitar confusión.
Todos los pacientes fueron seguidos de manera prospectiva desde la inclusión. Se monitorizó la creatinina desde el día previo de la intervención hasta seis días después y se siguió la evolución clínica del paciente hasta el alta. Se recogieron muestras de suero y orina a las 12 horas de finalizada la intervención para la determinación de los biomarcadores. La creatinina basal se definió como el valor de la creatinina el día anterior a la intervención.
Las muestras de sangre y orina se centrifugaron durante 10 minutos a 1.500 g. De cada una de las muestras de suero y orina se guardaron varias alícuotas de 0,5 ml para almacenarlas a –80 ºC para su posterior ensayo. Se recogieron muestras de orina de 20 voluntarios sanos para obtener los valores normales de NGAL en orina.
Se recogieron en todos los casos: datos demográficos y de comorbilidad, parámetros de la cirugía y complicaciones durante o tras el cateterismo o la cirugía cardiaca (tabla 1 y tabla 2). El criterio de valoración primario del estudio fue la aparición de FRA definido como un aumento de la creatinina igual o mayor del 50%, siguiendo los criterios de la clasificación RIFLE (Risk, Injury, Failure, Loss, End-stage renal disease)12. Los criterios de valoración secundarios fueron mortalidad durante la estancia hospitalaria y duración de la estancia en UCI y en el hospital.
Medición de los biomarcadores
Determinación de NGAL e IL-18 en orina
La medida de NGAL en muestras de orina se realizó con un ensayo ELISA (Human NGAL ELISA, Hycult biotechnology b.v.). Las muestras de orina se diluyeron 1:20 en tampón de dilución suministrado por el proveedor, y de esta dilución se tomaron 0,1 ml para el ensayo. El nivel mínimo de detección del ensayo es de 0,4 ng/ml.
La determinación de IL-18 en muestras de orina se realizó mediante un ensayo ELISA (Human IL-18 ELISA, Bender MedSystems), y se utilizaron 50 µl de cada muestra de orina para el ensayo. El límite de detección de este ensayo era de 9 pg/ml.
Determinación de cistatina-C en suero
La determinación de cistatina-C se realizó en muestras de suero mediante un ensayo estandarizado por inmunonefelometría en un nefelómetro BNII (Siemens Healthcare Diagnostics).
Análisis estadístico
Los resultados se analizaron utilizando los programas SPSS 17.0 y GraphPad PRISM 4.0. Se realizó un test de Kolmogorov-Smirnov para verificar que las variables seguían una distribución normal. Para la comparación de medias de más de dos variables, se realizó un ANOVA de un factor con análisis post-hoc de Bonferroni y para comparación de dos medias el test de Student o el test de Mann-Whitney en el caso de distribución no normal. Para estudiar la relación entre las diferentes variables se realizaron correlaciones de Pearson. El nivel de probabilidad aceptado como significativo fue de p <0,05. La sensibilidad y especificidad de los distintos marcadores se evaluó mediante curvas ROC (Receiver Operating Characteristic).
RESULTADOS
Características clínicas
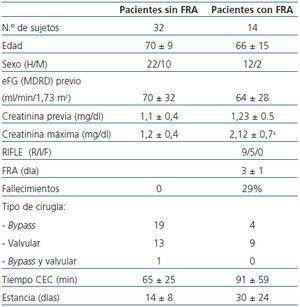
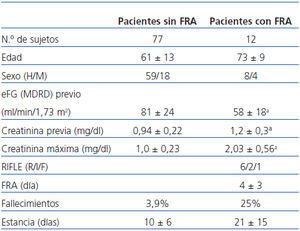
Las características clínicas y demográficas de los pacientes se exponen en la tabla 1 y en la tabla 2. Ventiséis pacientes desarrollaron FRA, de los cuales 12 pertenecían al grupo de angiografía (13%, 12/89) y 14 al grupo de cirugía cardíaca (30%, 14/46). Respecto a la mortalidad, seis pacientes sometidos a cateterismo fallecieron, tres de ellos habían dearrollado un FRA y cuatro pacientes fallecidos del grupo de cirugía cardíaca pertenecían todos ellos al grupo con FRA. Los pacientes con FRA presentaron una media de estancia hospitalaria mayor que los que no desarrollaron FRA en los dos grupos de pacientes.
En el grupo de cateterismo, los valores de creatinina previa en los pacientes FRA eran significativamente más altos que en los pacientes sin FRA (p <0,001) (tabla 1), y no se observaron diferencias significativas en el grupo de pacientes tratados con cirugía cardíaca.
Valores de NGAL en orina de controles sanos y pacientes
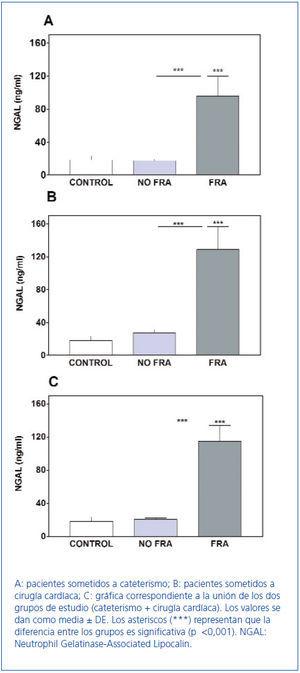
Los resultados obtenidos mostraron una diferencia significativa (p <0,001) de NGAL en orina entre los pacientes que desarrollaron FRA y los pacientes sin FRA, lo que permite distinguir claramente los dos grupos (figura 1).
Los valores de NGAL en orina en el grupo control (voluntarios sanos) eran de 18 ± 5 ng/ml. Se observaba una diferencia significativa (p <0,001) de NGAL en los pacientes con FRA (cateterismo: 96 ± 24; cirugía cardíaca: 129 ± 28) (figura 1A, figura 1B y tabla 3), con respecto a los valores del grupo control.
Los valores de NGAL de los pacientes sin FRA no diferían significativamente de los del grupo control (cateterismo: 17,4 ± 1,5; cirugía cardíaca: 27,4 ± 3,7) (figura 1A, figura 1B y tabla 3). En la figura 1C se observa que en los pacientes sin FRA los resultados conjuntos de NGAL en orina no presentaban diferencias significativas con respecto a los de los controles.
Valores de cistatina-C en suero
Los valores de cistatina-C en suero diferenciaban significativamente (p <0,001) los pacientes FRA de los que no tenían FRA. En cateterismo la media de los pacientes con FRA fue de 1,22 ± 0,16 mg/dl y de los que no tenían FRA de 0,71 ± 0,02 mg/dl. En cirugía cardíaca los valores de los pacientes con FRA y sin FRA fueron de 1 ± 0,1 mg/dl y 0,78 ± 0,04 mg/dl, respectivamente. Los resultados conjuntos fueron de 1,1 ± 0,09 mg/dl y 0,7 ± 0,02 mg/dl, en los pacientes con FRA y sin FRA, respectivamente (tabla 3).
Valores de IL-18 en orina
En el caso del marcador inflamatorio IL-18, los pacientes FRA presentaban niveles significativamente más elevados que los pacientes sin FRA (tabla 3).
Tanto en cateterismo como en cirugía cardíaca se observaba una diferencia significativa entre los pacientes con FRA y sin FRA (p <0,05). Esta diferencia significativa se acentuó al analizar los resultados conjuntos (p <0,001).
Asociación entre cistatina, IL-18 y NGAL
Se han realizado correlaciones entre estos parámetros y se observa una correlación significativa entre NGAL en orina y cistatina en suero (r = 0,311; p = 0,001) y entre NGAL e IL-18 en orina (r = 0,448; p <0,001)
Curvas ROC de NGAL, cistatina-C e IL-18
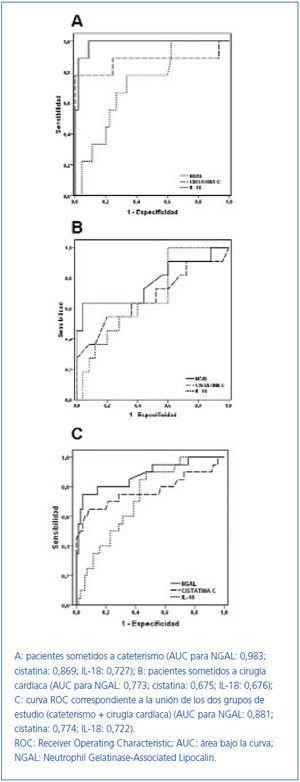
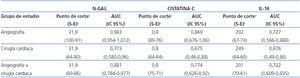
Para determinar si estos marcadores son buenos predictores de la aparición de FRA en pacientes sometidos a cateterismo o a cirugía cardiaca de revascularización, se hizo un análisis de sensibilidad y especificidad utilizando curvas ROC (figura 2). En la figura 2A se expone la curva ROC de los tres marcadores analizados en el grupo de cateterismo. NGAL, cistatina-C e IL-18 son buenos marcadores de FRA, siendo el NGAL el más predictivo, con un área bajo la curva (AUC) de 0,983, respecto a la cistatina-C e IL-18, con AUC de 0,869 y 0,727, respectivamente (tabla 4). Para un punto de corte de NGAL en orina de 31,9 ng/ml, la sensibilidad fue del 100% y la especificidad del 91%. Para la cistatina-C, un punto de corte de 0,8 mg/l en suero ofreció una sensibilidad del 89% y una especificidad del 76%. En el caso de la IL-18 se obtuvo una sensibilidad del 67% y especificidad del 73% para un punto de corte de 202 pg/ml.
La curva ROC de los pacientes sometidos a cirugía cardíaca se expone en la figura 2B. En estos pacientes, aunque la incidencia de FRA era más alta que en el grupo de pacientes con cateterismo (v. tabla 1 y tabla 2), las AUC ROC eran menores para los tres marcadores (tabla 4). NGAL seguía siendo el mejor predictor (AUC: 0,773), con valores de sensibilidad y especificidad del 64% y del 80%, respectivamente, considerando un punto de corte de 31,9 ng/ml de NGAL en orina. La cistatina-C presentaba un AUC de 0,675, con sensibilidad y especificidad del 64% para un punto de corte de 0,8 mg/l, y en la curva ROC para IL-18 se observaba un AUC de 0,676, siendo el mejor punto de corte de 249 pg/ml de IL-18 en orina, con sensibilidad del 64% y especificidad del 60% (tabla 4).
En la figura 2C se expone la curva ROC de los tres marcadores considerando el conjunto de pacientes de los dos grupos estudiados. NGAL presentaba un AUC de 0,881, y fue capaz de detectar el 80% de los casos con FRA, con una especificidad del 86%, considerando un punto de corte de 31,9 ng/ml de NGAL en orina. La cistatina-C presentaba un AUC de 0,774, detectando el 75% de los casos de FRA y con especificidad del 71% para un punto de corte de 0,8 mg/l de cistatina-C en suero. El punto de corte para la IL-18 sería de 201 pg/ml, con una sensibilidad y una especificidad menores que en el caso de los otros dos marcadores (70% y 61%, respectivamente), con un AUC de 0,722 (tabla 4).
DISCUSIÓN
En este trabajo se ha evaluado la utilidad de NGAL e IL-18 en orina y cistatina-C en suero para la detección precoz (a las 12 horas de la intervención) del FRA en una población de pacientes ingresados de forma urgente en una unidad de cuidados intensivos por síndrome coronario agudo o fallo cardíaco y sometidos a cirugía cardíaca o angiografía coronaria con o sin angioplastia o implantación de endoprótesis y se ha obtenido los siguientes resultados:
uNGAL es útil para la detección precoz del FRA con un AUC de 0,881.
Cistatina en suero e IL-18 en orina también ofrecen un buen rendimiento (AUC 0,774 y 0,722, respectivamente), aunque inferior.
De entre los 46 pacientes de cirugía cardíaca, 14 (30%) presentaron FRA, de los cuales, siguiendo la clasificación del sistema RIFLE nueve fueron «R» y cinco fueron «I». Este 30% se corresponde bien con los datos publicados en la bibliografía. De los 89 pacientes sometidos a angiografía, 12 (13%) presentaron FRA, seis en estadio «R», dos en estadio «I» y uno en estadio «F», una cifra también dentro de lo esperable. El FRA tardó en diagnosticarse por la creatinina una media de 3 ± 1 días en el grupo de cirugía cardíaca y 4 ± 3 días en el de angiografía.
De entre todos los biomarcadores de FRA que se están explorando, NGAL es probablemente el que más interés ha despertado. Es una proteína de 25 kD unida covalentemente a la gelatinasa de los neutrófilos. Se expresa en condiciones normales en muy bajas concentraciones en diversos tejidos como riñón, pulmones, estómago y colon, pero aumenta de forma considerable en el riñón en presencia de daño isquémico o tóxico13-15. Donde más extensivamente se ha estudiado su utilidad es en el FRA tras cirugía cardíaca. En un trabajo publicado en The Lancet en 200516, Mishra, et al. demostraron, en una población de pacientes pediátricos sometidos a cirugía cardíaca con circulación extracorpórea, que NGAL es útil tanto en suero como en orina para detectar precozmente (en las primeras horas del postoperatorio) y con una altísima sensibilidad y especificidad, a aquellos pacientes que desarrollarán en los días posteriores un FRA. La utilidad de la NGAL (en orina o sangre) para detectar precozmente el FRA tras la cirugía cardíaca se ha confirmado posteriormente tanto en niños17,18, como en adultos19-24 aunque en este último grupo con resultados variables y claramente inferiores. En otros trabajos, sin embargo, NGAL era predictiva de FRA en orina, pero no en suero25,26, e incluso se han publicado resultados negativos con NGAL urinaria27. Probablemente la causa de la menor especificidad en adultos que en niños esté relacionada con la existencia de otras condiciones acompañantes. Así, se ha comunicado que los valores de NGAL son superiores en hipertensos28 y en diabéticos29, y, además, aumentan con la edad30. También la presencia de sepsis puede afectar a sus valores31. Se ha descrito, asimismo, que la relación entre NGAL y FRA tras la cirugía cardíaca varía en función del filtrado glomerular basal, desapareciendo la capacidad discriminatoria de NGAL en pacientes con filtrado glomerular estimado (eGFR) por debajo 60 ml/min32. Respecto al rendimiento de la prueba en sangre u orina, si bien los resultados son variables, en general parece ser mayor en orina25,26. Por último, tampoco está bien definido cuál es el mejor momento para la obtención de la muestra y la determinación.
Tras angiografía coronaria, NGAL también ha demostrado ser útil para el diagnóstico precoz del FRA33-38, si bien los trabajos publicados son menos y tampoco está bien establecidos la capacidad predictiva, el punto de corte ni el momento idóneo de la determinación.
En nuestro trabajo, los resultados del grupo completo muestran para uNGAL a las 12 horas de la intervención un buen rendimiento, con un AUC de 0,881. En los pacientes de cirugía el AUC fue 0,773, algo superior a los resultados publicados en adultos sometidos a cirugía cardíaca (0,62-0,72)19-25. En los pacientes sometidos a angiografía coronaria el AUC fue también de 0,983. El punto de corte para una mejor sensibilidad y especificidad en el grupo completo estaría en 31,9 ng/ml, con una sensibilidad del 80% y una especificidad del 86%.
La IL-18 urinaria también ha sido estudiada como posible marcador precoz de FRA en pacientes sometidos a cirugía cardíaca con resultados tanto positivos39 como negativos40 y tras angiografía coronaria36, si bien en general ha despertado menor interés como posible biomarcador de FRA.
A diferencia de NGAL e IL-18, cistatina no es un marcador de daño renal sino de filtrado glomerular. La cistatina-C es una proteína endógena de pequeño tamaño que se filtra libremente en el glomérulo, y se reabsorbe y cataboliza en el túbulo proximal, de manera que sólo una pequeña cantidad se excreta en orina. En los últimos años se ha explorado su utilidad como posible sustituto de la creatinina para la determinación del filtrado glomerular, tanto en enfermedad renal crónica como aguda, por su menor dependencia de la masa muscular. Sin embargo, su valor sí depende de otras variables como la edad, el sexo, la raza y la presencia de diabetes o inflamación41. En pacientes sometidos a cirugía cardíaca los resultados obtenidos son, una vez más, variables, habiéndose comunicado resultados positivos21, modestos42 y negativos26, si bien en este último trabajo la cistatina urinaria, a diferencia de la plasmática, sí era capaz de predecir la aparición del FRA. Tras cateterismo cardíaco tampoco los resultados publicados permiten extraer conclusiones claras, puesto que los son variables y a menudo opuestos35,43-45. En este estudio, el AUC para cistatina fue 0,774 para el total de pacientes, 0,869 para el grupo de angiografía coronaria y 0,675 para el grupo de cirugía cardíaca. Se obtuvieron resultados bastante similares para IL-18 (tabla 4).
Por tanto, en la búsqueda del biomarcador ideal para la detección precoz del FRA quedan importantes cuestiones por resolver:
1. El mejor biomarcador (o combinación de biomarcadores) y el punto de corte que ofrece mejor sensibilidad y especificidad.
2. La conveniencia de determinarlos en sangre o en orina y el mejor momento para la obtención de la muestra.
3. Los factores extrínsecos que pueden influir en los resultados y el rendimiento en distintos contextos clínicos.
4. La capacidad pronóstica además de la diagnóstica.
En este estudio hemos intentado contribuir a responder algunas de estas cuestiones. Este trabajo se diferencia de los previamente publicados en que incluye tanto a pacientes sometidos a cirugía cardíaca como a cateterismo y, además, en que todos los pacientes estaban ingresados en la unidad de cuidados intensivos por síndrome coronario o por fallo cardíaco agudo, es decir, no se trataba de pacientes estables. Esto es importante porque interesa conocer cómo se comportan los biomarcadores en grupos amplios de población y no sólo en grupos homogéneos y además, como se ha dicho, otros factores pueden influir en la determinación.
Las muestras se recogieron a las 12 horas de la intervención. Interesaba comprobar el rendimiento en ese momento por ser el más sencillo para la recogida y procesamiento de las muestras en un contexto clínico normal (si la intervención se realiza por la tarde la muestra se recoge a primera hora de la mañana).
Se decidió no recoger muestra para la determinación de los biomarcadores antes de la intervención, ya que el objetivo último es disponer de un marcador fiable en una situación determinada, independientemente de sus valores basales. Así, cuando se determinan troponina o dímero D en la práctica clínica no disponemos de valores basales. De todas formas se ha determinado NGAL en una población de individuos sanos y con función renal normal para disponer de un valor de referencia y poder comparar con los grupos estudiados.
Los resultados de los marcadores en orina no se han ajustado a creatinina urinaria, porque, si bien algunos autores defienden dicha normalización, en la mayoría de trabajos publicados se prefiere no realizarla porque la evidencia es poco clara.
Hemos preferido determinar NGAL en orina que en suero porque, aunque en estos momentos existe un equipo rápido de NGAL en sangre y se ha observado una buena correlación con los resultados obtenidos en sangre por ELISA16, como ya se ha dicho, los resultados publicados en los distintos estudios indican un mejor rendimiento en orina.
En conclusión, NGAL en orina a las 12 horas de la intervención es un buen marcador precoz de FRA en pacientes adultos con síndrome coronario o fallo cardíaco agudo y sometidos a cirugía cardíaca y angiografía cardíaca, con un capacidad predictiva superior a cistatina o a IL-18.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Figura 1. Determinación de los valores de NGAL en orina de controles, pacientes sin fracaso renal (sin FRA) y pacientes con fracaso renal (FRA) en los grupos de estudio
Figura 2. Curvas ROC de los marcadores estudiados en cada grupo de sujetos
Tabla 2. Características clínicas y demográficas de los pacientes sometidos a cirugía cardíaca
Tabla 1. Características clínicas y demográficas de los pacientes sometidos a angiografía coronaria
Tabla 4. Capacidad diagnóstica de los marcadores estudiados para la detección del fracaso renal agudo en los diferentes grupos de pacientes
Tabla 3. Valores de los tres marcadores estudiados