Introducción y objetivo: La definición y clasificación actual de insuficiencia renal aguda se basa en criterios de consenso (sistemas RIFLE y AKIN). De los parámetros recomendados (creatinina, tasa de filtración glomerular y diuresis), la creatinina es el más empleado. En ausencia de valor basal conocido se recomienda su estimación a partir de la ecuación MDRD simplificada, asumiendo en el cálculo una tasa de filtración de 75 ml/min/1,73 m2. El objetivo del presente trabajo fue evaluar la repercusión diagnóstica del empleo de la creatinina basal estimada frente al valor real medido en pacientes operados de cirugía cardíaca. Métodos: Análisis de pacientes operados de cirugía cardíaca mayor incluidos de forma prospectiva en una base de datos. Para cada paciente se calculó el estadio RIFLE máximo alcanzado usando la creatinina basal medida y la estimada. Se analizó la repercusión sobre el diagnóstico mediante coeficientes de correlación intraclase, análisis de concordancia y gráficas de Bland y Altman. Resultados: La incidencia de insuficiencia renal aguda postoperatoria en 2.103 casos operados entre 2002 y 2007 fue del 29,1% al utilizar la creatinina estimada (14,3% con la medida). Esto supone una sobrestimación del 104%, y la correlación intraclase es de 0,12. Excluyendo a los pacientes con insuficiencia renal crónica conocida (tasa de filtrado glomerular [TFG] <60 ml/min/1,73 m2), tanto la sobrestimación (2,4%) como la correlación (0,57) mejoraron. Conclusiones: El cálculo de la creatinina basal a partir de la ecuación MDRD sobrestima la incidencia de insuficiencia renal aguda tras la cirugía cardíaca, y es un método inadecuado para su detección cuando el valor basal se desconoce.
Introduction and objectives: The current definition and classification of acute kidney injury is based on consensus criteria (RIFLE and AKIN systems). Creatinine is the most commonly used of the recommended parameters (creatinine, glomerular filtration rate and diuresis). If the baseline value is not known, it can be calculated based on the simplified MDRD equation, assuming a filtration rate of 75ml/min/1.73m2 for the calculation. The aim of this study was to evaluate the diagnostic impact of using estimated baseline creatinine compared to the actual value measured in patients undergoing cardiac surgery. Methods: Analysis of patients undergoing major cardiac surgery, who were prospectively included in a database. The maximum RIFLE stage reached was calculated for each patient using the measured and estimated baseline creatinine levels. The impact on the diagnosis was analysed using intraclass correlation coefficients, concordance analysis and Bland-Altman plots. Results: The incidence of postoperative acute kidney injury in 2103 cases between 2002 and 2007 was 29.1%, according to estimated creatinine (14.3% with the measure). This represents an overestimation of 104%, with an intraclass correlation of 0.12. By excluding patients with known chronic kidney disease (glomerular filtration rate [<60ml/min/1.73m2), both the overestimation (2.4%) and the correlation (0.57) improved. Conclusions: The calculation of baseline creatinine using the MDRD equation overestimates the incidence of acute kidney injury after cardiac surgery, and is an inadequate method for detection when the baseline value is unknown.
INTRODUCCIÓN
La insuficiencia renal aguda (IRA) es una complicación frecuente en el postoperatorio de la cirugía cardíaca. Su aparición conlleva un incremento notable tanto en la morbimortalidad como en la estancia hospitalaria. Su frecuencia varía dependiendo de la definición utilizada, y oscila entre el 2 y el 5% en las formas más graves que precisan tratamiento renal sustitutivo (TRS)1. En los últimos años hemos asistido a la aparición de nuevas definiciones de consenso del síndrome y a un cambio en la nomenclatura2,3. El término inglés acute renal failure, tradicionalmente traducido por insuficiencia o fracaso renal agudo ha sido sustituido por acute kidney injury buscando ampliar el espectro del síndrome para incluir casos más leves. Liaño, et al. han sugerido que dicho término se traduzca por alteración renal aguda (ARA)4. Desde los trabajos de Lassnigg en pacientes operados de cirugía cardíaca se sabe que incluso elevaciones muy discretas (0,3 mg/dl) de la creatinina sérica (Crs) con respecto al valor basal suponen un aumento de la morbilidad y mortalidad postoperatorias5,6. Estos resultados han sido validados en pacientes hospitalizados7.
Por lo que atañe a las definiciones, la Acute Dialysis Quality Initiative (ADQI) propuso en 2004 la utilización del sistema RIFLE (acrónimo de Risk, Injury, Failure, Loss y End stage renal disease) basado en tres categorías diagnósticas (R, I y F) y dos pronósticas (L y E). El diagnóstico se hace considerando bien elevaciones porcentuales con respecto a la Crs basal, bien descensos porcentuales de la tasa de filtrado glomerular (TFG) o descensos absolutos de la diuresis2. Para diagnosticar y clasificar a un paciente se utiliza el criterio que le sitúe en el estadio de mayor gravedad. En 2007 los criterios fueron revisados y modificados por la Acute Kidney Injury Network (AKIN) admitiéndose esta última clasificación como la vigente en la actualidad3. Pese a ello, y tal vez por motivos acientíficos8, la clasificación RIFLE goza de gran popularidad. El número de trabajos publicados sobrepasa los 150 y en una revisión sistemática no demasiado reciente se incluyeron 24 estudios que agrupaban a más de 70.000 pacientes9. Entre los problemas que plantea dicha clasificación está el de diagnosticar y clasificar a pacientes cuya Crs basal se desconoce. Este hecho se da con cierta frecuencia en pacientes que ingresan en unidades de críticos por problemas agudos (shock séptico, síndrome coronario agudo, insuficiencia cardíaca, etc.) con un valor de Crs ya alterado. La recomendación propuesta por la ADQI consiste en asumir que estos pacientes con función renal previa desconocida, pero sin nefropatía conocida, presentan una TFG de 75 a 100 ml/min/1,73 m2 y a partir de ella calcular «hacia atrás» el valor de Crs mediante la ecuación MDRD simplificada10. Este método ha sido empleado en varios estudios epidemiológicos pese a no haber sido validado11,12.
El objetivo del presente trabajo es doble: 1) evaluar la concordancia entre la Crs basal estimada (Crs est) frente a la Crs basal conocida en pacientes intervenidos de cirugía cardíaca, y 2) analizar la repercusión que posibles diferencias en los valores basales de Crs tuvieran en la frecuencia de ARA y en la gravedad de esos episodios que pueden observarse en cirugía cardíaca.
MATERIAL Y MÉTODOS
Se recogen datos relativos al período perioperatorio de los pacientes operados de cirugía cardíaca en nuestro centro de manera prospectiva en una base de datos mantenida por el servicio de anestesia y reanimación. Para el presente trabajo se utilizaron los datos correspondientes a pacientes operados entre los años 2002-2007. Se incluyeron todos los pacientes mayores de 14 años intervenidos de cirugía cardíaca mayor con o sin circulación extracorpórea. Se excluyeron los pacientes en tratamiento dialítico previo a la cirugía, los receptores de algún trasplante renal, los fallecidos antes de las primeras 24 horas del postoperatorio y los sometidos a una segunda cirugía mayor durante el mismo ingreso.
Se consideró como Crs basal medida (Crs med) la última Crs medida antes de la cirugía, normalmente durante las 24 horas previas en los pacientes operados de de forma electiva. Para su medición se utilizó el método Jaffe cinético. La estimación de la TFG se hizo a partir de la versión simplificada de la fórmula MDRD que utiliza cuatro variables (Crs, edad, sexo y raza). Para el cálculo de la Crs basal (Crs est) a partir de dicha ecuación, e igualando la TFG a 75 ml/min/1,73 m2 (límite bajo de la normalidad), se siguieron las recomendaciones de la ADQI aplicando la siguiente fórmula:
Crs estimada = (75/[186 x (edad-0,203) x (0,742 si mujer) x (1,21 si raza negra)])-0,887
Los pacientes fueron asignados al estadio más alto de la clasificación RIFLE en función de las determinaciones de Crs medidas durante la primera semana del postoperatorio. No se utilizó el criterio basado en descensos porcentuales de la TFG por su falta de linealidad y consistencia cuando se compara con los incrementos en Crs13, ni el de diuresis por falta de datos.
El grado de acuerdo entre la Crs med y la Crs est se evaluó mediante el coeficiente de correlación intraclase14 y el método gráfico de Bland y Altman15. Se calculó, además, el sesgo como la media global de las diferencias entre Crs med y Crs est, y la precisión como el valor de la desviación estándar del sesgo. El error en la estimación se calculó como el porcentaje de pacientes diagnosticados de ARA al usar la Crs est (ARAest) con respecto a los diagnosticados basándose en la Crs med (ARAmes) mediante la fórmula:
(ARAest – ARAmed)/ARAmed
Un valor positivo indica sobrestimación mientras que uno negativo implica infraestimación. Se realizaron un primer análisis con la muestra global y un segundo análisis excluyendo a los pacientes con insuficiencia renal crónica (IRC) grado 3 o superior según la clasificación K/DOQI de la National Kidney Foundation16. Como medidas de tendencia central y dispersión para las variables cuantitativas estudiadas se emplearon la media y desviación estándar o la mediana y el rango intercuartílico según su distribución. El análisis estadístico de los datos y las representaciones gráficas se realizaron con el programa SPSS versión 18.0.
RESULTADOS
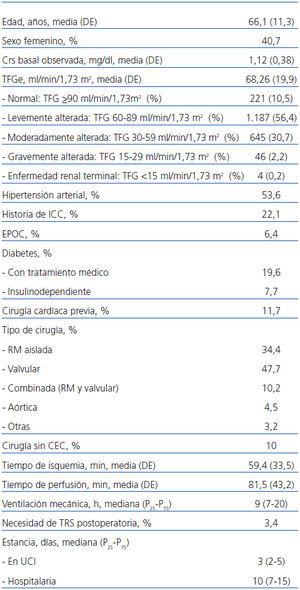
Durante el período analizado se realizaron 2.167 cirugías en 2.131 pacientes. Se excluyeron 31 pacientes (32 cirugías) por presentar diálisis preoperatoria o ser receptores de trasplante renal, 27 pacientes por fallecimiento precoz (<24 horas), y cinco segundas cirugías durante el mismo ingreso. La muestra final se compuso de 2.103 cirugías correspondientes a 2.067 pacientes. Las características principales aparecen en la tabla 1.
En la tabla 2 se exponen el número y el porcentaje de pacientes que alcanzaron cada estadio RIFLE durante la primera semana del postoperatorio, según el tipo de Crs basal empleada: medida y estimada, la correlación entre ambas, el sesgo y la precisión. La sobrestimación global fue del 104% (29,1 frente al 14,6%). El diagnóstico de ARA a partir de la Crs est arrojó una tasa de falsos positivos del 14,8%. Tras excluir los pacientes con una TFG <60 ml/min/1,73 m2, se observa una mejor correlación, reduciéndose la sobrestimación al 2,4%, con una tasa de falsos positivos del 0,28%.
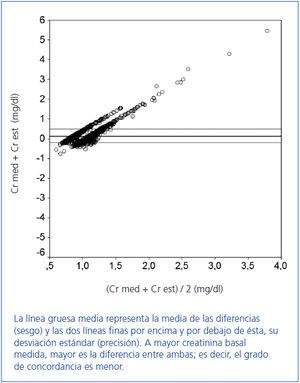
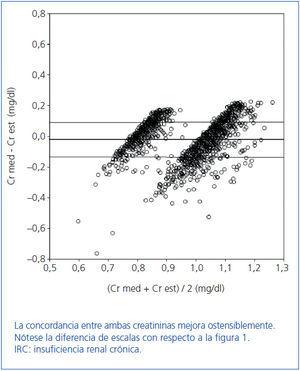
En la figura 1 se expone, mediante un gráfico de Bland y Altman, la concordancia entre Crs med y Crs est. La disposición de la nube de puntos indica que el grado de concordancia disminuye cuanto mayor es la Crs basal medida. Gráficamente se observa una mayor concordancia entre ambas creatininas cuando se excluyen los pacientes con algún grado de IRC previa a la cirugía (figura 2).
DISCUSIÓN
En el presente estudio hemos comprobado que la recomendación de calcular la Cr basal a partir de la ecuación MDRD-4 asumiendo una TFG de 75 ml/min/1,73 m2 sobrestima la incidencia de ARA en pacientes operados de cirugía cardíaca. Con anterioridad varios autores han llegado a una conclusión similar en cohortes más heterogéneas que la nuestra. Bagshaw17, en el estudio BEST Kidney que incluyó de forma prospectiva a más de 1.300 pacientes de 54 unidades de cuidados intensivos (UCI) en 23 países, se encontró una sobrestimación del 42% usando la misma fórmula para calcular la Crs basal. Siew18, en una cohorte de casi 5.000 pacientes hospitalizados a lo largo de un año, comparó la influencia de utilizar tres métodos distintos para estimar la Crs basal (la Crs calculada a partir de MDRD considerando una TFG de 75 ml/min, el valor mínimo de Crs durante el ingreso y la Crs al ingreso) con valores obtenidos a partir de la función renal preingreso, en el diagnóstico de ARA. Mientras que los dos primeros métodos sobrestimaron la incidencia en cifras cercanas al 50%, el uso de la Crs al ingreso infraestimó el diagnóstico en un 46%. Más recientemente, Závada19 encontró resultados similares al comparar tres métodos distintos, incluyendo el recomendado por la ADQI, en pacientes no seleccionados de UCI procedentes de tres centros distintos. Por último, Pickering y Endre20, al analizar de forma prospectiva a 224 pacientes de dos UCI generales que fueron incluidos como controles en el estudio EARLYRAF, hallaron una sobrestimación global del 35,7% cuando se asumió una TFG de 75 ml/min, que ascendió hasta 92,8% cuando se consideró que la TFG basal era de 100 ml/min. A diferencia de nuestra cohorte, sólo un 23% de los pacientes eran postoperados de cirugía cardíaca, y el resto se distribuían entre cirugía torácica, cirugía vascular, sepsis, traumatismos y paradas cardíacas. Nuestro trabajo es el primero que se centra en pacientes postoperados de cirugía cardíaca, por lo que no es posible establecer comparaciones directas con otros trabajos.
Tanto la prevalencia de IRC o disfunción renal preoperatoria como la incidencia de ARA tienen clara repercusión en el porcentaje de sobrestimación. La primera puede, hasta cierto punto, verse influida tanto por la edad (en general superior en los pacientes quirúrgicos), como por otros factores de riesgo cardiovascular (fundamentalmente hipertensión arterial y diabetes) bastante prevalentes en nuestra muestra. En este sentido, conviene señalar que en pacientes operados de cirugía cardíaca la mejor definición de disfunción renal preoperatoria ha sido establecida por Wijeysundera21 como un aclaramiento de creatinina (ClCr) inferior a 60 ml/min. La odds ratio para desarrollar ARA grave (necesidad de TRS) en una muestra aleatoria de 2.000 pacientes operados a lo largo de un período de 16 meses, cuando presentaban dicho grado de disfunción fue de cinco (intervalo de confianza [IC] 95%, 2-12,6). La prevalencia de disfunción renal preoperatoria en dicha muestra fue del 27%. En el estudio de Pickering ya citado, la prevalencia de IRC moderada o grave (TFG <60 ml/min/1,73 m2) fue del 28%, mientras que en el de Bagshaw fue del 46%, situándose la nuestra en valores intermedios (33,1%). En los tres estudios, la exclusión de estos pacientes disminuyó la sobrestimación. Este efecto es fácilmente explicable ya que se extrae un importante número de casos en los que se adjudica al paciente una TFG por encima de la real. Otro concepto desarrollado también por Wijeysundera y que merece la pena comentar es el de insuficiencia renal oculta22, definida como una función renal preoperatoria con un ClCr <60 ml/min, pero acompañado de una Crs basal preoperatoria inferior a 1,13 mg/dl. En una cohorte superior a 10.000 pacientes operados de cirugía cardíaca la prevalencia de insuficiencia renal oculta fue del 9%, y en nuestra muestra es muy similar (8,5%). Este concepto subraya la importancia que tiene en la evaluación analítica preoperatoria acompañar el valor de Crs basal de una estimación de la TFG o del ClCr.
Por lo que respecta a la incidencia de ARA, en el contexto de la cirugía cardíaca los factores de riesgo han sido ampliamente estudiados, y se han desarrollado varios sistemas de puntuación para calcular el riesgo preoperatorio de TRS23-25. Entre los factores considerados aparece de forma constante la función renal previa. La incidencia de ARA fue del 14,2% en nuestra muestra, inferior tanto a la de Pickering (31,2%) como a la del estudio BEST (44,9%). Dado que el número de casos diagnosticados constituye el denominador para el cálculo de la sobrestimación, cuanto menor sea aquél mayor será ésta. Este hecho, junto con la distinta prevalencia de IRC, podría explicar nuestros hallazgos.
Consideramos que la principal limitación del presente estudio reside en el hecho de utilizar como Crs basal la extraída como parte de la evaluación preoperatoria. Dicho valor no tiene por qué reflejar necesariamente la Crs del sujeto en condiciones basales. Un número importante de pacientes quirúrgicos ingresan a través de los servicios de urgencias con clínica de cardiopatía isquémica o de insuficiencia cardíaca y son intervenidos varios días después, una vez estabilizado el cuadro. Sin embargo, aproximaciones similares se han usado en los estudios anteriormente mencionados. Aunque la recomendación actual es emplear una Crs obtenida en los últimos tres meses antes del ingreso, se desconoce el mejor método para calcular la Crs basal cuando no se ha podido realizar una medición en condiciones basales. En el estudio de Pickering y Endre20, la asignación aleatoria de valores de Crs a partir de una curva de distribución «lognormal» ajustada a los parámetros de tendencia central y dispersión de la población origen fue el método que más se aproximó a la incidencia real (infraestimación de ARA del 2,9%). En su defecto, y como método más práctico, los autores recomiendan usar la Crs más baja de las observadas durante los primeros siete días de estancia (sobrestimación de ARA del 5,7%). Esta recomendación, lógicamente, sólo se hace de cara a análisis epidemiológicos, ya que desde el punto de vista asistencial no es aceptable un retraso de tal magnitud en el diagnóstico.
Una segunda limitación de este estudio es utilizar solamente el criterio de la Crs para hacer el diagnóstico de ARA, excluyendo a los pacientes diagnosticados a partir del descenso en la diuresis. Este problema es común a los análisis retrospectivos en los que se usa el sistema RIFLE, que son la inmensa mayoría de los publicados. Esto se debe a que este parámetro rara vez se recoge en las bases de datos con suficiente detalle (esto es, de forma horaria) como para poder ser aplicado. Por dicho motivo, hemos evitado dar valores de sensibilidad y especificidad, ya que para hacer el diagnóstico de forma fiable y clasificar a los pacientes en el peor estadio de gravedad deberían usarse todos los criterios.
CONCLUSIONES
El uso de una creatinina basal calculada a partir de la ecuación MDRD en el diagnóstico de ARA sobrestima su incidencia en pacientes operados de cirugía cardíaca. Este hecho es común a aquellas poblaciones con prevalencia aumentada de IRC leve, dependiendo su intensidad tanto de este factor como de la incidencia de ARA. En cambio, sí es aceptable en pacientes en los que la TFG premórbida sea normal o casi normal. Esta observación debe tenerse en cuenta sobre todo en estudios epidemiológicos de base hospitalaria.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Tabla 1. Principales variables demográficas, comorbilidades, variables quirúrgicas, postoperatorias y estancia de la cohorte estudiada (n = 2.103)
Tabla 2. Función renal estratificada según la categoría RIFLE
Figura 1. Gráfico de Bland y Altman para la cohorte global (n = 2.103) en el que se observa el grado de concordancia entre ambas creatininas.
Figura 2. Gráfica de Bland y Altman tras excluir los pacientes con función renal alterada (IRC grado 3) (n = 1.408).