La desensibilización es un método empleado en trasplante renal para tratar de trasplantar a pacientes que presentan una prueba cruzada positiva frente a su donante. El objetivo del estudio es mostrar los resultados de nuestro hospital en pacientes trasplantados renales con donantes vivos HLA incompatibles, tras un protocolo de desensibilización.
Estudiamos a 32 pacientes de 46±14 años que presentaban una intensidad media de fluorescencia (MFI) frente a HLA de clase I de 7.979±4.089 y de 6.825±4.182 para MFI frente a clase II y relative intensity scale (RIS) de 8,9±7,6. La prueba cruzada fue positiva por citotoxicidad dependiente del complemento (CDC) en 18 pacientes, citometría de flujo (CF) en 7 y anticuerpos donante específicos (ADE) en 7. El protocolo empleado fue: rituximab, plasmaféresis/inmunoadsorción, inmunoglobulinas, tacrolimus, derivados ácido micofenólico y prednisona.
Tras 8±3 sesiones de plasmaféresis/inmunoadsorción se trasplantó a 23 pacientes (71,9%) y resultó ineficaz en 9. Existían diferencias basales en MFI clase I (p<0,001), RIS (p=0,008) y cross-match por CDC, ADE o CF (p=0,05). El MFI de clase I y el RIS resultaron predictores de eficacia en curvas COR. Tras un seguimiento de 43±30 meses, 13 pacientes (56%) presentaron sangrado postoperatorio, 3 (13%) función retrasada injerto, 4 (17,4%) rechazo agudo, 6 (26%) viremia CMV y uno (4%) viremia BK. Al 5.° año, la supervivencia del paciente fue del 90% y la supervivencia renal del 86%. En ese mismo año, la creatinina fue de 1,5±0,4 y la proteinuria de 0,5±0,7.
ConclusionesEl trasplante renal de donante vivo HLA incompatible tras la desensibilización fue posible en el 71,9% de los pacientes. MFI de clase I y RIS predicen ineficacia de la desensibilización. La supervivencia renal (86% al 5.° año) es aceptable con baja incidencia de rechazo agudo (17,4%), aunque con una mayor tendencia al sangrado postoperatorio.
Desensitisation is a procedure undergone by the recipient of a kidney transplant from a donor who is cross-match positive. The aim of this study was to present the outcomes from our hospital of kidney transplant recipients from HLA-incompatible live donors after desensitisation.
We studied 32 patients aged 46±14 years with a mean fluorescence intensity (MFI) versus class I HLA of 7979±4089 and 6825±4182 MFI versus class II and relative intensity scale (RIS) of 8.9±7.6. The complement-dependent cytotoxicity (CDC) cross-matching test was positive in 18 patients, flow cytometry was positive in 7 patients and donor-specific antibodies (DEA) were detected in 7. The protocol used was rituximab, plasmapheresis/immunoadsorption, immunoglobulins, tacrolimus, mycophenolic acid derivatives and prednisone.
After 8±3 sessions of plasmapheresis/immunoadsorption, 23 patients were trasplanted (71.9%) and desensitisation was ineffective in 9. There were baseline differences in MFI class I (P<.001), RIS (P=.008), and CDC cross-matching, DSA and flow cytometry (P=.05). MFI class I and RIS were predictors of inefficiency in ROC curves. After follow-up of 43±30 months, 13 patients (56%) presented postoperative bleeding, 3 (13%) delayed graft function, 4 (17.4%) acute rejection, 6 (26%) CMV viraemia and 1 (4%) BK viraemia. Five-year patient survival was 90%, with 86% allograft survival. Five-year creatinine was 1.5±0.4 and proteinuria was 0.5±0.7.
ConclusionsKidney transplantation from HLA-incompatible live donors after desensitisation was possible in 71.9% of patients. MFI class I and RIS predict the inefficiency of desensitisation. Five-year allograft survival (86%) was acceptable with a low incidence of acute rejection (17.4%), although with a greater trend towards postoperative bleeding.
Los pacientes hipersensibilizados (HI) tienen cada vez más difícil el acceso al trasplante renal debido la elevada incidencia de cross-match positivo pretrasplante. En EE. UU., un 35% de los pacientes que están en lista de espera para trasplante renal están sensibilizados y un 15%, altamente sensibilizados1. Se ha comunicado de manera reciente que un 6% de los pacientes en lista de espera tienen una reactividad calculada frente al panel del 100%2. En España, en 2014, un 11,5% de los pacientes en lista de espera para trasplante estaban HI. La solución en estos pacientes es emplear técnicas de desensibilización (DS), inclusión en listas de trasplante cruzado (donante vivo) o exclusivas para pacientes sensibilizados de donante cadáver3-6. La supervivencia es mejor en los pacientes sometidos a DS que en aquellos que permanecen en lista de espera y se trasplantan con un donante compatible y mejor todavía frente a los que permanecen en diálisis 7. Dos revisiones comparan los resultados de las distintas técnicas de DS: inmunoglobulinas (IgV), IgV en dosis elevadas, plasmaféresis (PF) o inmunoadsorción (IA) con o sin IgV, ritiximab (RTX), bortezomib, con una gran heterogeneidad en cuanto a la selección de pacientes (donante vivo versus cadáver), técnica de selección de cross-match (citotoxicidad dependiente del complemento [CDC], citrometría de flujo [CF], anticuerpos donante específicos [ADE] por Luminex), seguimiento y tipo de monitorización de la respuesta a la desensibiización. La tasa de rechazo en estos pacientes es variable —desde 0 hasta el 100%— y depende del tratamiento empleado y de los criterios de selección. La supervivencia del paciente oscila entre 80 y 100% y la supervivencia del injerto entre 69 y 100%1,8. En 2014, Riella et al., empleando un protocolo basado en PF, IgV y RTX, comunicaron una frecuencia de rechazo mediado por anticuerpos del 61%, una supervivencia del paciente del 86% al 5.° año y una supervivencia renal del 84% también al 5.° año9. En nuestra área sanitaria, en el año 2012, solo habíamos trasplantado a 24 pacientes, que presentaban una reactividad frente al panel del 70%. Este grupo de pacientes es el que había permanecido un mayor tiempo en lista de espera para trasplante10. El programa de trasplante renal cruzado solo consiguió trasplantar a 3pacientes y no existía en España el Plan Nacional de Intercambio Renal para Pacientes Hiperinmunizados (PATHI), que comenzó a implantarse en 2015. Por ello, y valorando los resultados de otras series como las descritas anteriormente, iniciamos un programa de DS en 2007, con el fin de poder ofertar un posible trasplante a este grupo de pacientes. El objetivo del presente estudio es mostrar los resultados en el Hospital Universitario A Coruña en pacientes con donantes vivos HLA incompatibles tras DS.
MétodosEl período de tiempo estudiado se inicia en enero 2007 y finaliza en 2014. En ese tiempo, 100 pacientes recibieron un trasplante renal procedente de donante vivo. Estudiamos a 32 pacientes, que iniciaron protocolo de DS pretrasplante; 21 de ellos recibían tratamiento sustitutivo renal mediante hemodiálisis, 5 diálisis peritoneal y 6 se encontraban en situación de prediálisis. Todos los pacientes presentaban una prueba cruzada positiva frente a su donante por CDC, por CF o por Luminex. Previamente al inicio de la DS, los pacientes y sus donantes eran informados del proceso y otorgaban su consentimiento según el documento habilitado por nuestro centro. Además, los donantes firmaban el consentimiento en el juzgado, según protocolo de actuación en donación de vivo.
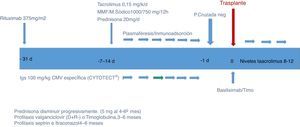
DesensibilizaciónEl protocolo DS consistía en que un mes antes del trasplante se administraba RTX 375mg/m2 (Roche Farma AG, Grenzach-Wyhlen, Alemania). Una semana antes de comenzar la PF/IA se iniciaban tacrolimus, MMF o MFS y prednisona. Las PF o IA no específica (Therasorb) se realizaban en la unidad de aféresis inicialmente de forma diaria, excepto los domingos. Se realizó IA con columnas de Therasorb en 19 pacientes, PF en 12 y ambas en uno. Después de cada sesión de PF/IA los pacientes recibían IgV anti-CMV específica 100mg/kg (Cytotect Biotest Pharma GmbH, Alemania). Los pacientes bajo tratamiento sustitutivo renal realizaban la sesión de hemodiálisis cada 48 h tras la sesión de aféresis o 4 sesiones de intercambio al día en diálisis peritoneal. Una vez iniciadas las sesiones de aféresis, se monitorizaba la cifra de anticuerpos o se realizaba una prueba cruzada. Cuando la prueba cruzada por CDC o CF era negativa y los niveles de ADE alcanzaban una MFI inferior a 1.000, se aceptaba al paciente para trasplante. Una vez trasplantados, se realizaban PF o IA los días +3, +5 y +8.
InmunosupresiónSe realizó inducción con basiliximab en 13 pacientes (56,5%). Los niveles de tacrolimus se establecieron en 10-12ng/ml la primera semana, con reducción progresiva para alcanzar 7-8 desde el 6.° mes. La dosis inicial de MMF (Cellcept) era de 2g/día, seguida de reducción a 1g/día al mes. La dosis de MFS (Myfortic) era de 1.440mg al día, que se reducía a 720mg/día al mes. La prednisona, tras un inicio de 20mg/día, era reducida progresivamente hasta 5mg al 6.° mes. Se realizó profilaxis con cotrimoxazol durante 6meses, con itraconazol 4-6 meses y con valganciclovir (Valcyte; Roche Farma, Madrid, España) en pacientes CMV donante positivo, CMV receptor negativo (fig. 1).
SeguimientoLos pacientes, tras el alta, fueron seguidos en consulta con monitorización de función renal, niveles de tacrolimus, seguimiento de CMV, primero con antigenemia pp55 y en la actualidad mediante PCR de CMV y virus BK.
Si se evidenciaba deterioro de la función renal, se le realizaban al paciente una biopsia y una determinación de ADE. En nuestro hospital no se realizan biopsias de protocolo ni seguimiento sistemático de ADE.
Para el diagnóstico de rechazo en la biopsia se emplearon los criterios de la clasificación de Banff, en función del tiempo en que esta clasificación era publicada11,12.
El tratamiento del rechazo mediado por anticuerpos se realizó con esteroides (3 bolos de 500mg durante 3días consecutivos), PF o IA, IgV, RTX y eculizumab (en casos refractarios). Para el tratamiento del rechazo mediado por células T, se emplearon bolos de esteroides (3 bolos de 500mg durante 3días consecutivos).
Variables estudiadas: eficacia de la DS, función retrasada del injerto, rechazo agudo, supervivencia renal y del paciente, función renal, sesiones de PF/IA, MFI frente a clase I y II pre- y postaféresis, n.° de anticuerpos frente a clase I y II, relative intensity scale (RIS) descrita por Jordan et al.10, infecciones (CMV y BK), diabetes postrasplante, neoplasias y complicaciones urológicas.
Estadística: Se utilizaron la t de Student y ANOVA para comparar las variables cuantitativas; la prueba de Mann-Whitney cuando la distribución no era normal; la chi cuadrado y el test de Fisher para variables cualitativas. Se calculó la supervivencia según Kaplan-Meier y log rank test. Para el estudio multivariado se empleó la regresión de Cox y para el análisis de sensibilidad y especificidad, las curvas COR. Todo ello, con el programa SPSS (versión 15.0.1 Chicago, III, EE. UU.).
ResultadosEstudiamos a 32 pacientes (15 varones), con una edad media de 46±14 años. El parentesco entre donante y receptor fue: padre/madre (9), esposo/a (14), hermano/a (5), hijo/a (1) y otros (3).
Basalmente, los pacientes presentaban un n.° de anticuerpos frente a especificidades de clase I: 0,9±0,7 (0-3) con MFI 7.979±40 y frente a clase II: 0,6±0,5 (0-2) con MFI 6.825±4.182; RIS 8,9±7,6 (2-30). El cross-match por CDC fue positivo en 18 pacientes; por CF, en 7. Otros 7 pacientes solo presentaban ADE mediante técnicas de fase sólida (Luminex, One Lambda, Thermo Fisher Scientific; Canoga Park, CA, EE. UU.). La DS se consideró eficaz cuando las pruebas cruzadas por CDC y CF fueron negativas y la MFI inferior a 1.000 (tabla 1).
Variables de eficacia en la desensibilización
| Eficacia: n=23 | Sin eficacia: n=9 | p | |
|---|---|---|---|
| Edad del donante (años) | 50,3±9 | 49,6±6 | NS |
| Edad del receptor (años) | 48,6±14 | 38,6±12 | 0,07 |
| Tiempo en diálisis (meses) | 84,9±77 | 39,3±46 | 0,07 |
| N.° de anticuerpos clase I y II | 1,47±0,79 | 1,66±0,70 | NS |
| MFI de clase I | 5.840±3.002 | 12.258±2.044 | 0,001 |
| MFI de clase II | 6.048±4.145 | 9.169±3.725 | NS |
| RISa | 6,2±6,6 | 15±7 | 0,005 |
| Embarazos | 0,86±1 | 0,33±0,7 | NS |
| N.° de incompatibilidades HLA | 3,7±11 | 3,3±1,6 | NS |
| N.° de sesiones PFS/IA | 8,1±2,7 | 8,7±3,3 | NS |
| Cross-match: CDC/CF/ADE (n°)b | 10/7/6 | 8/0/1 | 0,02 |
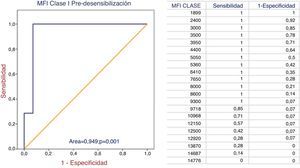
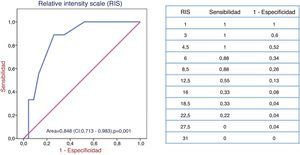
Tras 8±3 sesiones de PF/IA4-15, se consiguió trasplantar a 23 pacientes (71,9%), de los que resultó ineficaz en 9. De los 9 pacientes que no fue posible desensibilizar, 8 presentaban un cross-match previo por CDC y otro por ADE (p=0,02). El MFI clase I y el RIS son predictores de eficacia en curvas COR (área de 0,949 y 0,848, respectivamente). Se estableció un punto de corte de MFI en 9.300 y 8,5 puntos, respectivamente, con 100% de sensibilidad y 93% de especificidad para el primero y 88% de sensibilidad y 74% de especificidad para el segundo, por encima de los cuales no resulta eficaz la DS (figs. 2 y 3).
En el período postoperatorio, 13 pacientes presentaron hematoma-hemorragia, con necesidad de reintervención en 6 (26%) y con necesidad de transfusión en 16 (69%). En 3 pacientes (13%) se objetivó retraso en la función inicial del injerto.
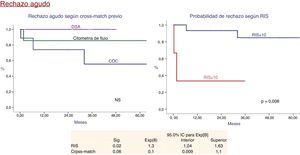
Tras un seguimiento de 43±30 meses (rango 0,1-104), 4 pacientes (17,4%) presentaron rechazo agudo, en uno mediado por anticuerpos, en 2 mediados por células T y en uno mixto (mediado por anticuerpos y células T). Los pacientes que presentaron rechazo tenían una MFI basal más elevada, un RIS mayor y un cross-match positivo por CDC (fig. 4), aunque en un análisis de Cox, el RIS fue el único que alcanzó significación estadística.
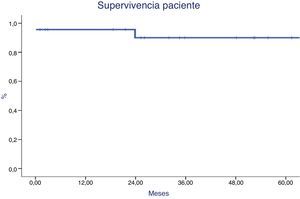
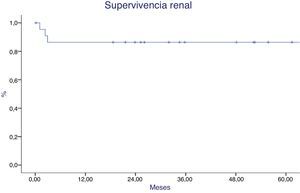
La supervivencia del paciente fue del 96% al año y del 90 al 5.° año (fig. 5). Un paciente falleció de sepsis de origen urinario (en la primera semana) y otro de hemorragia subaracnoidea (al 2.° año). La supervivencia del injerto fue del 86% al año y al 5.° año (fig. 6), siendo peor en los pacientes con rechazo agudo mediado por anticuerpos (p=0,02). Las causas de la pérdida de injerto fueron rechazo mediado por anticuerpos en 2(uno de ellos, además, presentaba rechazo mediado por células T), nefropatía crónica en un paciente y trombosis arterial en otro.
La creatinina al año fue de 1,2±0,3mg/dl, al 3.er año de 1,4±0,4 y de 1,5±0,4 al 5.° año. La proteinuria fue 0,3±0,3g/24h al año, de 0,2±0,2 al 3.° y de 0,5±0,7 al 5.° año.
Se registraron 6 infecciones CMV (26%) y una viremia BK (4%). La frecuencia de diabetes postrasplante fue del 26% (6), de linfocele del 13% (3) y de estenosis de arteria renal del 4% (1).
Se registraron 2 neoplasias postrasplante, una leucemia linfática crónica y un carcinoma epidermoide cutáneo.
DiscusiónEl trasplante renal es la mejor opción terapéutica en los pacientes con insuficiencia renal crónica14. Los pacientes HI tienen una tasa baja de trasplante (en EE. UU.<6,5% anual hasta hace un año), lo que hace que permanezcan tiempo en lista de espera, con elevada mortalidad. Las opciones de un paciente con un donante vivo incompatible son la DS, incorporarse a programas de donación renal cruzada, opciones válidas cuando se dispone de un donante vivo, o ser incluidos en programas especiales de intercambio y priorizacion3-6.
Nuestro protocolo de DS resulta similar a los empleados por distintos grupos en los últimos años, aunque existe mucha heterogeneidad en las series, en especial a la hora de definir los criterios de selección para desensibilizar y trasplantar1,8. En nuestra serie, el cross-match fue positivo por CDC en 18 de los 32 pacientes y no fue posible desensibilizarlos en el 44%. Los resultados fueron mejores en los que presentaban una prueba cruzada positiva por CF o solo con ADE por Luminex, ya que conseguimos trasplantar al 100 y al 86%, respectivamente. Orandi et al. demostraron que la DS mejora el pronóstico de los pacientes frente a los que permanecen en lista de espera y son trasplantados y frente a los que permanecen en diálisis. Asimismo, estas diferencias se mantenían para cualquier nivel de DS basal (CDC+, CF+ o solo ADE+ por Luminex), aunque el pronóstico era peor en aquellos en los que la prueba cruzada positiva era por CDC7, lo que podría significar que estos pacientes que son positivos por CDC tienen mayor n.° de anticuerpos o mayor afinidad y esto permite que sean detectados por técnicas que son menos sensibles respecto a la CF o Luminex3
Otro factor que podría influir en los resultados es la cantidad de anticuerpos, interpretando como tal el nivel de MFI, que es poco conocido en la mayor parte de las series. Utilizamos RIS para tratar de homogenizar el n.° de anticuerpos de cada paciente y su MFI, tal y como describen Jordan et al.13. Los resultados que presentamos demuestran que la DS no resultó eficaz en pacientes con MFI superiores a 9.300 en clase I, ni en aquellos que presentaban un RIS mayor de 8,5.
Al 5.° año, la supervivencia del paciente (90%) y del injerto (86%) es similar a la comunicada en otras revisiones y vendría a corroborar la posibilidad de realizar este tipo de tratamiento en pacientes HI, que de otro modo permanecerían mucho tiempo en lista de espera. Marfo1 refleja una supervivencia del paciente del 95% y del injerto del 85%; Orandi a los 3 años, del 91,7% y del 76,5% al 8.° año6; Yang et al. en Taiwán15, a los 5 años reportan el 100% del paciente y el 92,3% del injerto y De Sousa et al., 95,9% del paciente y 85% del injerto a los 5 años16. Morath et al.17, usando PF o IA, reportan un 95,8% de supervivencia del paciente y un 92,4% de supervivencia del injerto, al año. Bentall et al.18 reportan supervivencia del paciente a 5 años de 83,5%, menor que en el grupo control (92,5%) y una supervivencia del injerto del 70,7%, menor también que en el grupo control (88%), y Thielke et al.19 reflejan una supervivencia al año de 95% del paciente y del 93% del injerto.
La incidencia de rechazo agudo fue del 17%, en 2casos mediado por anticuerpos (RMA), uno de los 2presentaba, además, rechazo mediado por células T, sin respuesta al tratamiento y en 2, hubo rechazos mediados solo por células T, Banff IA, con buena respuesta a esteroides. En nuestra serie la probabilidad de rechazo es mayor en pacientes con cross-match positivo por CDC y en aquellos que tienen mayor RIS. Esta baja frecuencia contrasta con la de otras series y oscila entre un 17 y un 80%, empleando diversos protocolos y distintos grados de DS (CDC, CF, ADE)1,8. Nosotros no realizamos biopsias de protocolo y solo monitorizamos ADE cuando existe sospecha de rechazo mediado por anticuerpos, por lo que podríamos no detectar rechazos subclínicos o rechazos crónicos mediados por anticuerpos, lo que podría explicar esta diferencia. Una serie que se asemeja a la nuestra por el protocolo de DS empleado es la serie de Riella et al.9 en la que encuentran un 61% de rechazo. El porcentaje de pacientes con cross-match positivo por CDC era del 100% pretrasplante y la monitorización de los títulos difiere de la nuestra en que nosotros empleamos MFI y ellos utilizan títulos de anticuerpos; además, solo 21 de 39 recibieron RTX. Tras DS con bortezomib, Aubert et al.20 no encontraron rechazo agudo a los 18 meses y Woodle et al.21 reportaron un 31%. Recientemente, Moreno Gonzales et al.2, empleando 32 dosis de bortezomib solo encontraron escasas reducciones de anticuerpos sin negativización del cross-match que, además, no fue bien tolerado.
Existe poca información sobre la incidencia de ADE postrasplante en las series de pacientes desensibilizados. Morath et al.17 monitorizaron los anticuerpos durante un año y estos permanecieron positivos en títulos bajos. De Sousa et al.16 monitorizaron los anticuerpos en 18 pacientes, que resultaron positivos en uno de ellos, que desarrolló RMA. Kauke et al.22 demostraron que en 6 de 8 pacientes desensibilizados persistían los anticuerpos y 3 de ellos desarrollaron RMA. Stegall et al.23, en pacientes tratados con eculizumab, encontraron que un 50% de los pacientes desarrollaban ADE con MFI>10.000, si bien la incidencia de rechazo agudo fue del 7,7% frente a un 41,1% del grupo sin eculizumab. En nuestra serie, 8 pacientes tenían ADE en el seguimiento: en 3de ellos fue positivo, 2 desarrollaron RMA y otro paciente una glomerulopatía de trasplante.
A pesar de la carga elevada de inmunosupresión, la tasa de complicaciones infecciosas fue aceptable en nuestros pacientes, con una viremia CMV del 26% y de BK del 4%. Vo et al.24 comunicaron un 16,5% de infección CMV y un 0% de viremia BK. Kauke et al.22, 2/8 (25%) BK. Yang et al.15, 3 casos de nefropatía BK (13,6%) y 2 neumonitis CMV (9%). De Sousa et al.16, 3 reactivaciones de CMV (13%) y un caso de BK (4,3%). Morath et al.17, 10% de CMV y 0% de BK. Thielke et al.19, un 7% de CMV y un 4,9% de BK. Stegall et al.23 utilizaron eculizumab sin comunicar infecciones por CMV ni virus BK.
La incidencia de neoplasias está poco reportada. Dos pacientes de nuestra serie presentaron una neoplasia de novo (una leucemia linfática crónica y un carcinoma epidermoide de piel). El grupo de Taiwán comunicó 3 casos de cáncer urotelial. Stegall et al., en pacientes desensibilizados con eculizumab, comunicaron un caso de linfoma de Burkitt.
Una complicación relativamente frecuente tras el trasplante es la presencia de hematoma/hemorragia, complicaciones comunicadas en series tras PF o IA en trasplantes ABO incompatibles que se relacionan con la técnica, por la pérdida intrínseca de factores de coagulación, entre ellos el factor XIII, descenso en el n.° de plaquetas o por el uso de anticoagulantes para perfundir el injerto25-27. En nuestros pacientes no encontramos ningún factor aislado (aunque no medimos el factor XIII), por lo que, debido al escaso tamaño muestral, pueden ser una suma de circunstancias las que propicien este exceso de hematoma/hemorragia.
Nuestro estudio presenta las limitaciones propias del tamaño muestral, la ausencia de biopsia de protocolo y el escaso número de ADE monitorizados. A pesar de ello, los resultados son aceptables en un grupo de pacientes que tendría que permanecer mucho tiempo en la lista de espera para poder trasplantarse. Detectamos marcadores que identifican a pacientes en los que la DS es poco efectiva, como son la MFI clase I o la RIS, lo que evitaría iniciar un tratamiento costoso y con potenciales efectos adversos. Concluimos que la DS HLA con el protocolo mostrado es una opción para valorar en aquellos pacientes sensibilizados frente a un donante vivo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.