La presencia de trombocitopenia es una marca distintiva del síndrome urémico hemolítico asociado a diarrea (SUH D+); sin embargo, puede ser transitoria y, por lo tanto, no ser detectada. Existe limitada información sobre la prevalencia y el curso de la enfermedad en niños con SUH D+ sin trombocitopenia.
ObjetivoDeterminar la prevalencia de SUH D+ sin trombocitopenia y describir las características clínicas de una serie de niños con esta particularidad.
Pacientes y métodosFueron revisadas las historias clínicas de los pacientes con SUH D+ internados entre 2000 y 2016 para identificar a aquellos sin trombocitopenia (>150.000mm3). De los casos seleccionados se recolectaron las variables demográficas, clínicas y de laboratorio, las cuales fueron analizadas descriptivamente.
ResultadosDe 161 pacientes internados durante el periodo de estudio se identificaron 9 sin trombocitopenia (5,6%). La mediana de la edad al diagnóstico fue de 17 meses (7-32) y la de la duración del periodo prodrómico, de 15 días (7-21). Ocho pacientes mantuvieron diuresis normal y uno requirió diálisis. Ningún paciente presentó compromiso extrarrenal severo y/o hipertensión arterial.
ConclusionesLa prevalencia de SUH D+ sin trombocitopenia fue del 5,6% y la mayoría de los casos fueron leves; sin embargo, el requerimiento de diálisis en uno de ellos señala que la normalización del recuento de plaquetas no siempre es un marcador preciso de resolución de la enfermedad. Nuestros resultados también confirman que el momento de presentación de los pacientes con SUH D+ sin trombocitopenia está usualmente alejado de los primeros síntomas intestinales, por lo que es necesario un alto índice de sospecha diagnóstica.
Thrombocytopenia is a hallmark of postdiarrhoeal haemolytic uraemic syndrome (D+ HUS), although it can be transient and therefore undetected. There is scarce information regarding the prevalence and the course of the disease in children with D+ HUS without thrombocytopenia.
ObjectiveTo determine the prevalence of D+ HUS without thrombocytopenia and to describe the clinical characteristics of a series of children with this condition.
Patients and methodsThe medical records of patients with D+ HUS hospitalised between 2000 and 2016 were reviewed to identify those without thrombocytopenia (>150,000mm3). Demographic, clinical and laboratory parameters of the selected cases were collected and descriptively analysed.
ResultsNine cases (5.6%) without thrombocytopenia were identified among 161 patients hospitalised during the study period. Median age at diagnosis was 17 months (7-32) and median prodromal symptom duration was 15 days (7-21). Eight patients maintained normal urine output while the remaining one required dialysis. No patient presented with severe extrarenal compromise and/or hypertension.
ConclusionsThe prevalence of non-thrombocytopenic D+ HUS was 5.6% and most cases occurred with mild forms of the disease; however, the need for dialysis in one of them indicated that normalisation of platelet count is not always an accurate marker for disease remittance. Our results also confirm that the time of onset of D+ HUS in patients without thrombocytopenia is usually delayed with respect to the initial intestinal symptoms; thus, heightened diagnostic suspicion is necessary.
El síndrome urémico hemolítico asociado a diarrea (SUH D+) es una de las principales causas de daño renal agudo en pediatría1,2. Es mediado por cepas de Escherichia coli productoras de toxina Shiga (STEC), la cual produce daño endotelial directo induciendo agregación plaquetaria y formación de trombos que ocluyen la microvascultura de órganos vitales como el riñón1,2. El diagnóstico de SUH D+ se basa en la presencia de pródromo diarreico asociado a anemia hemolítica microangiopática, trombocitopenia y daño renal agudo1–3. En raras ocasiones, la trombocitopenia puede ser transitoria y, por lo tanto, no ser detectada en los exámenes de laboratorio4. Dado que existe escasa información sobre las características clínicas de los niños con SUH D+ sin trombocitopenia, el objetivo de este estudio es describir el curso clínico de una serie de pacientes con esta particularidad.
Pacientes y métodosSe revisaron las historias clínicas de todos los niños internados con diagnóstico de SUH D+ en el Hospital General de Niños Pedro de Elizalde entre los años 2000 y 2016 para identificar a aquellos sin trombocitopenia. Posteriormente, de las historias clínicas seleccionadas se extrajeron las siguientes variables: edad, género, días de evolución entre el primer síntoma y el diagnóstico de SUH D+, signos y síntomas de la fase prodrómica, hemograma al ingreso (recuento de glóbulos blancos y de plaquetas, hematocrito y hemoglobina), recuento mínimo de plaquetas y su porcentaje de descenso en relación con el valor inicial, creatinina sérica máxima y severidad del daño renal agudo, número de transfusiones de glóbulos rojos recibidas, necesidad y días de diálisis, presencia de manifestaciones extrarrenales severas y/o de hipertensión arterial, y aislamiento etiológico. Además, se registró el tiempo de seguimiento luego de la etapa aguda y la situación renal en el momento del último control.
El estudio fue aprobado por los comités de investigación y de ética de nuestra institución.
DefinicionesSe definió SUH D+ como la presencia de pródromo diarreico asociado a trombocitopenia (<150.000mm3), anemia hemolítica microangiopática aguda (hemoglobina<percentil 3 para edad y sexo con presencia de esquistocitos en el extendido de sangre periférica, prueba de Coombs negativa y aumento de lactato deshidrogenasa) y compromiso renal expresado por hematuria y proteinuria con o sin aumento de creatinina para la edad1–3. Se consideraron casos sin trombocitopenia aquellos que en ninguna determinación durante la internación presentaron un recuento plaquetario<150.000mm3 pero que reunían los restantes criterios5. Los recuentos de plaquetas en todos los casos fueron determinados por métodos automatizados y posteriormente confirmados por visualización directa del extendido de sangre periférica por hematólogos pediátricos de nuestro hospital.
El diagnóstico etiológico se basó en la identificación de STEC o de toxina Shiga en materia fecal y/o en la positividad de anticuerpos contra polisacáridos de los serotipos de STEC más comunes6. Dado que nuestro país presenta la mayor incidencia mundial de SUH D+ y que la identificación etiológica en nuestro medio varía entre el 32 y el 54%, también fueron considerados como mediados por STEC aquellos que presentaron pródromo diarreico aun sin rescate de germen6,7. Fueron excluidos los pacientes con SUH familiar o recurrente y los asociados a causas específicas, como desregulación del sistema del complemento, sida, fármacos e infección neumocócica8.
Se consideró compromiso extrarrenal grave la presencia de manifestaciones neurológicas como depresión del sensorio, convulsiones o coma, e intestinales como invaginación intestinal, perforación o colitis isquémica9–11.
Se consideró hipertensión arterial el registro con esfigmógrafo de tensión sistólica y/o diastólica mayor al percentil 95 para edad, talla y sexo según los valores de referencia12.
Las indicaciones de diálisis fueron anuria>24h, alteraciones electrolíticas intratables e hipervolemia13,14.
La determinación de creatinina se realizó con el método colorimétrico de Jaffé y se estimó el filtrado glomerular (FGe) con la fórmula de Schwartz utilizando el valor máximo de creatinina15. La severidad del daño renal agudo fue estratificada de acuerdo con los criterios de RIFLE pediátricos (riesgo descenso del FGe>25%; lesión>50% y fracaso>75%), asumiendo como FGe basal 100ml/min/1,73m2 ya que, como suele suceder en niños con daño renal agudo, se desconocía la función renal previa a la internación16.
Se consideró ritmo diurético normal la diuresis>1ml/kg/h17.
Se consideró hematuria la presencia de más de 5 hematíes por campo (con objetivo de 400 aumentos) en orina fresca centrifugada18.
La presencia de proteinuria se determinó mediante tira reactiva, considerando como resultado positivo la presencia de 1+ o más en la escala colorimétrica18.
Análisis estadísticoSe realizó un análisis descriptivo de las variables recolectadas; las continuas se expresaron, según el tipo de distribución (test de Shapiro-Wilk), como mediana (intervalo) o media (desviación estándar), y las categóricas, como frecuencia de presentación. Se utilizó el programa Statistix ver. 7 (IBM version; Analytical Software, Tallahassee, FL, EE. UU.).
ResultadosDurante el periodo comprendido entre los años 2000 y 2016 se internaron en nuestro hospital 161 niños con SUH D+, entre los que se identificaron 9 sin trombocitopenia (prevalencia 5,6%).
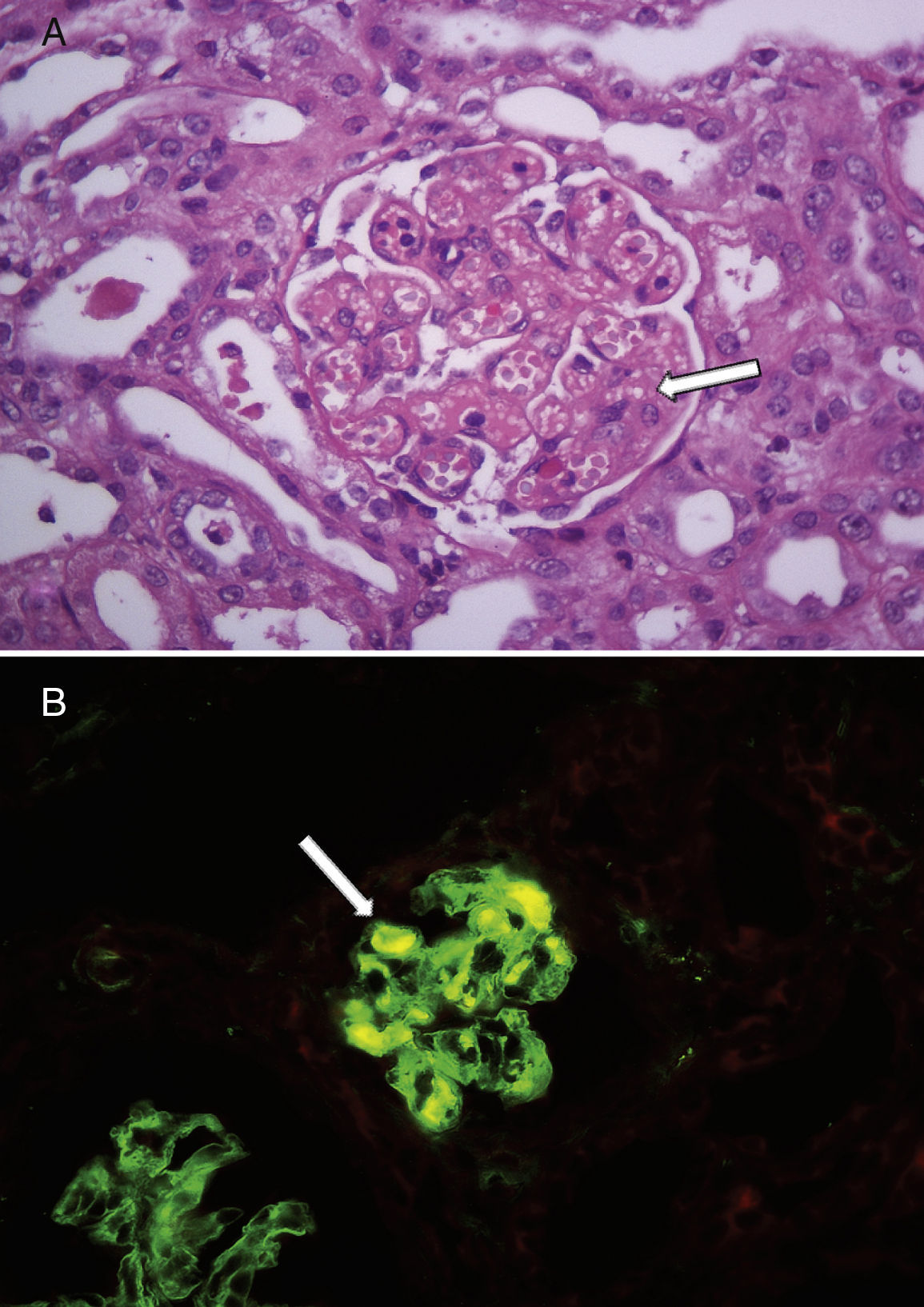
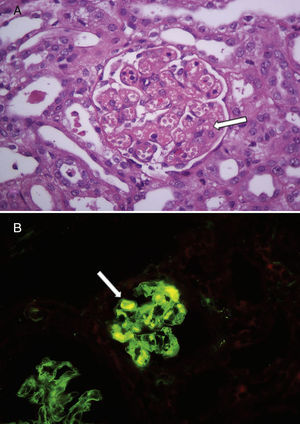
La mediana de la edad al diagnóstico fue de 17 meses (7-32), y la de la duración del periodo prodrómico, de 15 días (7-21). Cuatro pacientes no presentaron descenso del recuento plaquetario en relación con el del ingreso y en los 5 restantes la media de descenso fue de 30±17%); pero todos mantuvieron valores superiores a 150.000mm3 durante toda la internación. La mediana de transfusiones de glóbulos rojos fue de 1 (0-2) y ningún paciente presentó compromiso extrarrenal severo y/o hipertensión arterial. En cuanto a la severidad del fallo renal de acuerdo con los criterios de RIFLE pediátrico, en 3 casos no se observó daño renal agudo (aunque presentaron hematuria y proteinuria como expresión de afección renal), 2 correspondieron a la categoría riesgo, 2 a lesión y 2 a la de fracaso. Ocho presentaron ritmo diurético normal y una niña que se presentó con anuria y fallo renal severo (creatinina 8,1mg/dl al ingreso) necesitó diálisis peritoneal. Esta no tenía antecedentes de enfermedad renal ni había recibido fármacos durante la fase prodrómica; sus niveles de C3 (89mg/dl) y C4 (20mg/dl) fueron normales y no se detectaron agentes bacterianos ni virales en sangre. Asimismo, la búsqueda de toxina Shiga y el cultivo de materia fecal resultaron negativos. La ecografía reveló riñones hiperecogénicos de tamaño normal. Dada la ausencia de trombocitopenia junto con la severidad del fallo renal y ante la falta de identificación etiológica se realizó una biopsia renal que confirmó el diagnóstico de microangiopatía trombótica. Sus principales hallazgos fueron engrosamiento y disrupción de las paredes capilares glomerulares, mesangiolisis focal y dilatación aneurismática de los capilares glomerulares; necrosis tubular aguda parcheada y edema intersticial que comprometía menos del 5% de la muestra. Las arterias y las arteriolas no presentaban cambios. Por inmunofluorescencia se identificaron trombos de fibrina (fig. 1). Necesitó 7 días de diálisis y 2 transfusiones de glóbulos rojos durante la internación, siendo dada de alta en buen estado clínico y con función renal en progresiva mejoría (creatinina 1,19mg/dl). Durante el seguimiento ambulatorio se recibió el resultado positivo para anticuerpos polisacáridos contra Escherichia coli O145 y se normalizó la función renal (creatinina 0,3mg/dl). La tabla 1 detalla las características demográficas y clínicas de los pacientes descritos y la tabla 2, los hallazgos de laboratorio durante la fase aguda.
Hallazgos en la histología renal de un niño con síndrome urémico hemolítico asociado a diarrea sin trombocitopenia.
A: glomérulos renales con dilatación de capilares y mesangiolisis (flecha blanca). Hematoxilina y eosina, ×400. B: la inmunofluorescencia mostró trombos de fibrina en algunos glomérulos (flecha blanca), ×400.
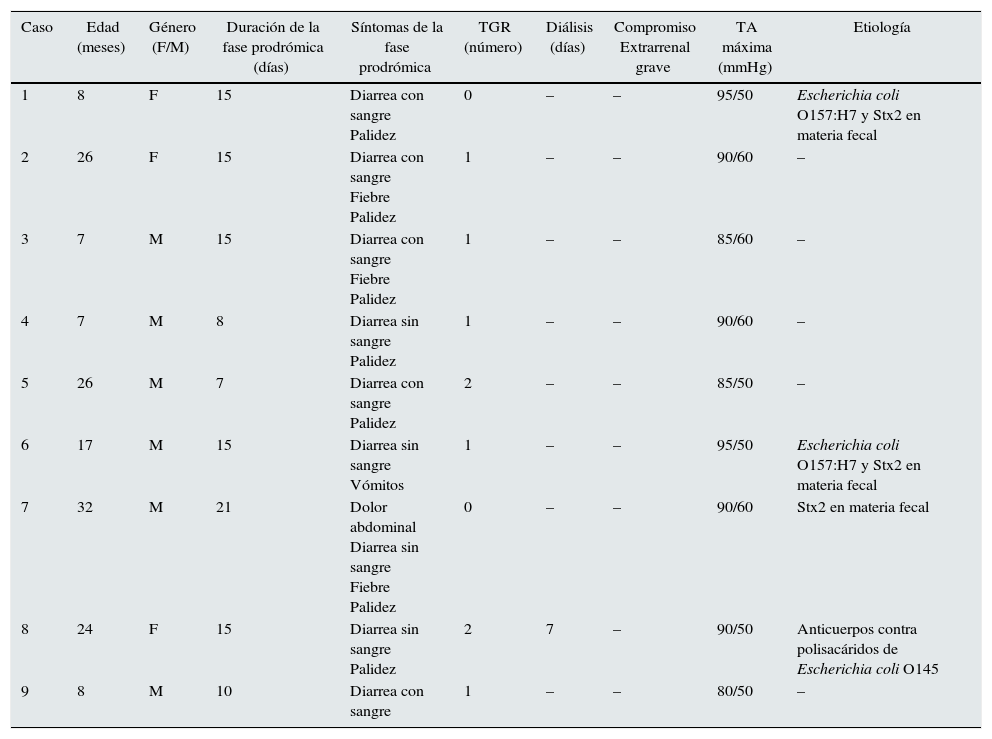
Características demográficas y clínicas de niños con síndrome urémico hemolítico asociado a diarrea sin trombocitopenia
| Caso | Edad (meses) | Género (F/M) | Duración de la fase prodrómica (días) | Síntomas de la fase prodrómica | TGR (número) | Diálisis (días) | Compromiso Extrarrenal grave | TA máxima (mmHg) | Etiología |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 8 | F | 15 | Diarrea con sangre Palidez | 0 | – | – | 95/50 | Escherichia coli O157:H7 y Stx2 en materia fecal |
| 2 | 26 | F | 15 | Diarrea con sangre Fiebre Palidez | 1 | – | – | 90/60 | – |
| 3 | 7 | M | 15 | Diarrea con sangre Fiebre Palidez | 1 | – | – | 85/60 | – |
| 4 | 7 | M | 8 | Diarrea sin sangre Palidez | 1 | – | – | 90/60 | – |
| 5 | 26 | M | 7 | Diarrea con sangre Palidez | 2 | – | – | 85/50 | – |
| 6 | 17 | M | 15 | Diarrea sin sangre Vómitos | 1 | – | – | 95/50 | Escherichia coli O157:H7 y Stx2 en materia fecal |
| 7 | 32 | M | 21 | Dolor abdominal Diarrea sin sangre Fiebre Palidez | 0 | – | – | 90/60 | Stx2 en materia fecal |
| 8 | 24 | F | 15 | Diarrea sin sangre Palidez | 2 | 7 | – | 90/50 | Anticuerpos contra polisacáridos de Escherichia coli O145 |
| 9 | 8 | M | 10 | Diarrea con sangre | 1 | – | – | 80/50 | – |
F: femenino; M: masculino; TA: tensión arterial; TGR: transfusión de glóbulos rojos; Stx: toxina Shiga.
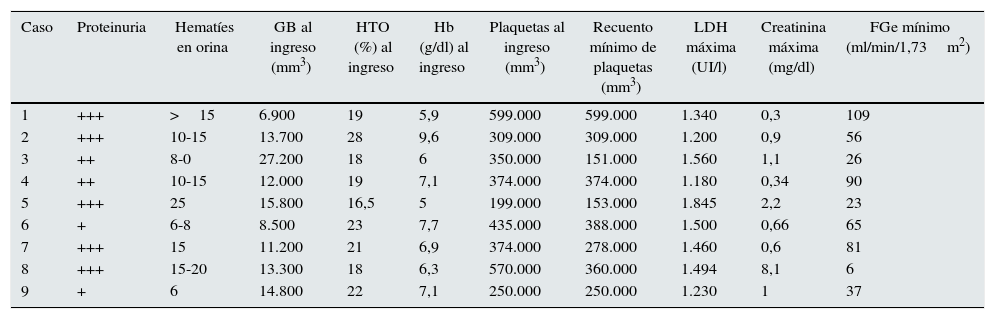
Parámetros de laboratorio durante el periodo agudo en niños con síndrome urémico hemolítico asociado a diarrea sin trombocitopenia
| Caso | Proteinuria | Hematíes en orina | GB al ingreso (mm3) | HTO (%) al ingreso | Hb (g/dl) al ingreso | Plaquetas al ingreso (mm3) | Recuento mínimo de plaquetas (mm3) | LDH máxima (UI/l) | Creatinina máxima (mg/dl) | FGe mínimo (ml/min/1,73m2) |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | +++ | >15 | 6.900 | 19 | 5,9 | 599.000 | 599.000 | 1.340 | 0,3 | 109 |
| 2 | +++ | 10-15 | 13.700 | 28 | 9,6 | 309.000 | 309.000 | 1.200 | 0,9 | 56 |
| 3 | ++ | 8-0 | 27.200 | 18 | 6 | 350.000 | 151.000 | 1.560 | 1,1 | 26 |
| 4 | ++ | 10-15 | 12.000 | 19 | 7,1 | 374.000 | 374.000 | 1.180 | 0,34 | 90 |
| 5 | +++ | 25 | 15.800 | 16,5 | 5 | 199.000 | 153.000 | 1.845 | 2,2 | 23 |
| 6 | + | 6-8 | 8.500 | 23 | 7,7 | 435.000 | 388.000 | 1.500 | 0,66 | 65 |
| 7 | +++ | 15 | 11.200 | 21 | 6,9 | 374.000 | 278.000 | 1.460 | 0,6 | 81 |
| 8 | +++ | 15-20 | 13.300 | 18 | 6,3 | 570.000 | 360.000 | 1.494 | 8,1 | 6 |
| 9 | + | 6 | 14.800 | 22 | 7,1 | 250.000 | 250.000 | 1.230 | 1 | 37 |
FGe: filtrado glomerular estimado; GB: glóbulos blancos; Hb: hemoglobina; HTO: hematocrito; LDH: lactato deshidrogenasa.
Superada la etapa aguda, los pacientes fueron seguidos durante 2 años (1,5-4) y todos presentaban FGe normal, orina sin proteinuria ni hematuria y tensión arterial normal.
DiscusiónLa presencia de trombocitopenia es una marca distintiva del SUH D+; sin embargo, puede ser transitoria y, por lo tanto, no ser detectada4. Existe limitada información sobre la prevalencia de SUH D+ sin trombocitopenia y además el curso de la enfermedad en estos pacientes no ha sido descrito en detalle. Schifferli et al.19 encontraron en una cohorte de 102 pacientes con SUH D+ que 7 de ellos (6,8%) carecían de trombocitopenia, una prevalencia similar (6%) a la observada por Siegler et al.20 en 157 casos (89% con pródromo diarreico). De forma coincidente, en nuestra serie de 161 niños la prevalencia de formas atrombocitopénicas fue del 5,6%. Estos resultados difieren de lo observado por Giménez Llort et al.21, quienes notaron una prevalencia menor (un caso entre 51 niños, 2%), y con lo comunicado por Ardissino et al.22, quienes encontraron esta condición en el 11% de sus casos, aunque debe aclarase que en este último estudio dicho porcentaje corresponde al de los pacientes con recuentos de plaquetas>150.000mm3 en el momento del ingreso, pero no especifica si disminuyeron posteriormente durante el curso de la enfermedad. Finalmente, en Argentina, López et al.5 encontraron entre 254 niños con diarrea sanguinolenta que 6 desarrollaron SUH y que 14 presentaron «formas incompletas» (no reunían los 3 criterios diagnósticos), siendo en 3 de ellos la ausencia de trombocitopenia el criterio ausente. Es interesante, además, el caso comunicado por Meier et al. de un niño con diarrea por STEC, quien desarrolló anemia microangiopática sin compromiso renal ni trombocitopenia. Los autores especularon que la toxina Shiga podría producir daño directo en la membrana del eritrocito como una posible explicación de dicha presentación23.
Según nuestro conocimiento, esta es la primera serie de casos que describe específicamente el curso de la enfermedad de los pacientes con SUH D+ sin trombocitopenia. La mediana de edad del grupo estudiado (17 meses) es consistente con la de los niños que reúnen todos los criterios diagnósticos6. Una característica a destacar es que la mediana de días entre el primer síntoma y el diagnóstico (15 días) fue mayor de lo habitual (la mediana es aproximadamente de 7 días)24. El diagnóstico tardío podría explicar la ausencia de trombocitopenia; es posible que los niños aquí estudiados hayan presentado trombocitopenia de forma transitoria, pero que en el momento de realizarse las pruebas de laboratorio se haya detectado el rebote del recuento plaquetario24. Aún más, en ningún paciente se observó un descenso por debajo de 150.000mm3 ni tampoco hubo reducciones bruscas del recuento plaquetario en relación con el valor inicial (el promedio de descenso fue del 30%). Además, el diagnóstico tardío también pudo haber sido responsable del bajo aislamiento de STEC en materia fecal en nuestros pacientes3, que solo fue posible en 3 de 9 casos, aunque la tasa de rescate se encuentra dentro de la habitual en nuestro medio6,7.
En el SUH D+ la normalización del recuento de plaquetas comúnmente precede a la recuperación de la función renal; de hecho, el momento de alcanzar un recuento>150.000mm3 fue propuesto como un marcador indirecto de resolución del proceso microangiopático8. En concordancia, ha sido postulado que estos casos tardíos sin trombocitopenia son usualmente leves24. Nuestros resultados confirman dicho supuesto: ningún paciente presentó compromiso extrarrenal grave y, si bien la severidad del daño renal agudo fue variable, 8 de 9 conservaron un adecuado ritmo diurético sin necesidad de diálisis; una tasa menor a la previamente comunicada en niños con SUH D+13,14,25. Además, ningún paciente presentaba signos de secuela renal en el momento del último control.
En conclusión, la prevalencia de SUH D+ sin trombocitopenia fue del 5,6% y la mayoría de los casos fueron leves; sin embargo, dado que un paciente requirió diálisis merece destacarse que la normalización del recuento de plaquetas no siempre es un marcador preciso de resolución de la enfermedad. Adicionalmente, nuestros resultados demuestran que el momento de presentación de los casos de SUH D+ con recuentos de plaquetas normales está usualmente alejado de los primeros síntomas intestinales, por lo que es necesario un alto índice de sospecha diagnóstica.
Conflicto de interesesLos autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.