A pesar del uso de estrategias de prevención y la mejora en los métodos diagnósticos, el citomegalovirus (CMV) continúa siendo la complicación viral más frecuente después del trasplante renal y su impacto en los resultados a largo plazo se sigue debatiendo.
ObjetivoConocer la incidencia de infección/enfermedad por CMV bajo estrategias de prevención y analizar su asociación con la supervivencia del paciente y del injerto y con otros eventos clínicos relacionados con el CMV.
MétodosRevisión de las historias clínicas de 377 pacientes trasplantados de riñón entre enero de 1998 y diciembre del 2008. Se analizó la supervivencia por el método de Kaplan-Meier en función de la presencia o ausencia de infección/enfermedad CMV y se usó el modelo de Cox para identificar factores asociados con infección/enfermedad por CMV y para evaluar su impacto en la mortalidad y la pérdida del injerto.
ResultadosLa incidencia de infección por CMV fue del 34,7% y de enfermedad del 9,5%. La supervivencia del paciente y del injerto fue significativamente inferior en los pacientes con infección/enfermedad CMV. La infección/enfermedad por CMV se asoció de forma significativa a mayor riesgo de pérdida del injerto (HR 1,91, IC del 95% 1,09-3,36, p=0,023) pero no con más riesgo de mortalidad (HR 1,29, IC del 95% 0,7-2,38, p=0,4).
ConclusiónLa replicación viral después del trasplante es un factor de riesgo de pérdida del injerto pero no de mortalidad a largo plazo. Las estrategias de prevención disminuyen la incidencia de infección y enfermedad por CMV postrasplante.
Despite the use of prevention strategies, cytomegalovirus (CMV) infection is the most common viral complication after renal transplant and its impact on long-term outcomes is still open to debate.
ObjectiveTo evaluate the incidence of CMV infection and disease during the use of prevention strategies in our centre and to analyse the association between CMV infection and long-term patient and graft survival and other potentially clinical events related with CMV.
MethodsWe reviewed the medical records of 377 recipients of kidney transplants performed between January 1998 and December 2008. Kaplain-Meier survival curve analysis was performed to analyse graft and patient survival by CMV infection/disease and Cox proportional hazards regression was used to identify factors associated with CMV infection/disease, graft loss and mortality.
ResultsThe incidence of CMV infection was 34.7% and CMV disease was 9.5%. Patient and graft survival was significantly lower in patients with CMV infection/disease. CMV infection/disease was associated with a higher risk of graft loss (HR 1.91, 95% CI 1.09-3.36, p=0.023), but not with a higher mortality (HR 1.29, 95% CI 0.7-2.38, p=0.4).
ConclusionCMV replication after renal transplant is a risk factor for long-term graft loss but not mortality. Prevention strategies decrease post-transplant CMV infection and disease.
La infección por citomegalovirus (CMV) continúa siendo una complicación frecuente en los pacientes que reciben un trasplante renal. Suele aparecer en el primer año postrasplante y cuando aparece tiene consecuencias directas e indirectas sobre el paciente y el injerto, tanto a corto como a largo plazo1. Los efectos directos son bien conocidos, se relacionan con altas tasas de replicación viral y se presentan en forma de infección o enfermedad por CMV. Sin embargo, los efectos indirectos son más difíciles de reconocer y se deben a la interacción de bajas tasas de replicación viral con el sistema inmunitario2.
En la era en la que las estrategias de prevención y monitorización viral no se usaban de forma generalizada la incidencia de infección y enfermedad por CMV eran elevadas (60% infección y 30% enfermedad)3 y tanto la combinación serológica frente al CMV entre el donante y el receptor como el uso de anticuerpos antilinfocitarios se comportaban como importantes factores de riesgo de enfermedad por CMV4. Esto sirvió para definir el riesgo de infección de los pacientes y clasificarlos en pacientes de alto, moderado o bajo riesgo de infección. Esta clasificación se sigue empleando actualmente para definir la estrategia de prevención5.
Los efectos indirectos se han asociado a un incremento de la morbilidad (infecciones oportunistas), pérdida del injerto y mortalidad a largo plazo6-13.
La aparición de fármacos antivirales eficaces en el control del CMV, como son el ganciclovir y el valganciclovir, la mejora de los métodos diagnósticos y el empleo de estrategias de prevención frente al CMV (profilaxis universal y terapia anticipada) han supuesto un hito importante en la mejora de los cuidados y de los resultados del trasplante, consiguiendo disminuir el riesgo de infección y enfermedad por CMV6,14, el riesgo de rechazo agudo y el riesgo de mortalidad y pérdida del injerto a largo plazo6,7,12,15-17.
Con este estudio nos proponemos conocer la incidencia acumulada de infección/enfermedad por CMV en nuestro medio, teniendo en cuenta las diferencias en las estrategias de prevención a lo largo del tiempo y analizar si existe asociación no solo entre la replicación viral y la supervivencia del paciente y del injerto a largo plazo, sino también con otros eventos adversos potencialmente relacionados con el CMV, como son la enfermedad cardiovascular, las neoplasias y las infecciones.
Pacientes y métodosDiseño del estudioRealizamos un estudio observacional, retrospectivo y unicéntrico, en el que la infección o enfermedad por CMV después del trasplante renal fue la variable principal de interés. Se crearon 2 cohortes de pacientes basadas en la existencia o no de infección o enfermedad por CMV después del trasplante (grupo CMV y grupo no CMV, respectivamente). Se analizaron los resultados de forma global y según la estrategia de prevención utilizada (profilaxis universal o terapia anticipada).
Población de estudioPacientes que recibieron un injerto renal en nuestro centro entre enero de 1998 y diciembre del 2008. Se excluyó del análisis a aquellos pacientes que perdieron el injerto renal, fallecieron o se perdió el seguimiento antes de los 3 meses postrasplante (en ninguno de estos casos el hecho fue secundario a enfermedad por CMV). La figura 1 muestra la distribución de los casos en relación con las estrategias de prevención y la replicación de CMV.
Se incluyó a 377 pacientes, de los cuales 344 (91,2%) fueron primeros trasplantes y 33 (8,8%) retrasplantes. Doscientos cuarenta y cuatro (64,7%) pacientes eran varones y 133 (35,3%) mujeres. La edad media ± desviación estándar (DE) de los receptores y los donantes en el momento del trasplante fue de 48,6±13,4 y 46,9±14,3 años, respectivamente. El 93,9% (N=354) de los pacientes recibieron un injerto renal de donante cadáver, el 5% (N=19) de donante vivo relacionado y el 1,1% (N=4) de donante en asistolia.
Los pacientes se siguieron hasta el fallecimiento, la pérdida de seguimiento o la finalización del estudio en diciembre del 2013. A los pacientes que perdieron el injerto (vuelta permanente a diálisis), se les siguió durante el periodo de diálisis hasta su fallecimiento o hasta la finalización del estudio en diciembre del 2013.
Los datos de los donantes y los receptores se recogieron de las historias clínicas del hospital. La selección de los donantes fue homogénea a lo largo de todo el periodo de estudio y no se realizó estudio histológico al injerto renal pretrasplante.
El estudio fue aprobado por el Comité Ético de Investigación Clínica del hospital.
InmunosupresiónEl 64,7% (N=244) de los pacientes recibieron triple terapia con inducción y el 35,3% (N=133) solo triple terapia sin inducción.
Para la inducción se utilizaron anticuerpos monoclonales en 232 pacientes (95,1%) (ILR2: 181, OKT3: 51) y anticuerpos policlonales en 12 pacientes (4,9%) (timoglobulina: 8 y ATEGE: 4).
La triple terapia incluyó un inhibidor de calcineurina (ciclosporina en 98 pacientes o tacrolimús en 277), prednisona (N=377) y micofenolato mofetilo (MMF, N=358) o rapamicina (N=17). Dos pacientes recibieron rapamicina en lugar de inhibidor de calcineurina y 2 pacientes recibieron azatioprina en lugar de MMF.
Infección/enfermedad por citomegalovirus: estrategias de prevención, diagnóstico y tratamientoEstrategias de prevenciónProfilaxis universal:se utilizó en receptores seronegativos y en receptores seropositivos que recibieron tratamiento de inducción con OKT3 o con anticuerpos policlonales. Antes de octubre del 2003 la profilaxis antiviral se realizó con ganciclovir (N=78 pacientes) y a partir de octubre del 2003 con valganciclovir (N=43 pacientes). La duración de la profilaxis fue de 3 meses (media±DE: 3,0±0,84 meses).
Terapia anticipada: se utilizó en receptores seropositivos que no recibieron tratamiento de inducción con anticuerpos policlonales ni OKT3. En estos pacientes se realizaba monitorización virológica mediante antigenemia pp65 de forma semanal en el primer mes, quincenal el 2.° y el 3.er mes, y mensual del 4.° al 12.° mes. Cuando se detectaba replicación viral se iniciaba tratamiento con ganciclovir (hasta octubre del 2003, N=128) o valganciclovir (a partir de octubre del 2003, N=128).
Diagnóstico: el seguimiento virológico y el diagnóstico se realizaron mediante la evaluación de la antigenemia pp65. Se consideró que había replicación por CMV cuando la antigenemia pp65 era>5 células positivas/2×105 polimorfonucleares. Los pacientes con infección por CMV presentaban antigenemia pp65 positiva sin síntomas y los pacientes con enfermedad por CMV presentaban síntomas (síndrome viral o enfermedad invasiva), además de la antigenemia positiva.
Tratamiento: para los casos de infección por CMV se empleó en la mayor parte de los casos tratamiento antiviral con ganciclovir (antes de octubre del 2003) o valganciclovir (a partir de octubre del 2003) ajustado a función renal. En algunos casos, además del tratamiento antiviral, se redujo la dosis de MMF y en otros solo se redujo la dosis de MMF sin utilizar fármaco antiviral.
Los casos severos de enfermedad por CMV se trataron con ganciclovir iv (5mg/kg cada 12 h, 2-3 semanas), disminución de la dosis de MMF y continuación con ganciclovir o valganciclovir por vía oral 2-3 semanas más.
El antiviral se suspendía habitualmente después de 2 controles de antigenemia pp65 negativos consecutivos.
Definición de otras variablesRetraso en la función inicial del injerto: definida como la necesidad de diálisis en la primera semana postrasplante.
Complicaciones quirúrgicas en los primeros 6 meses postrasplante: definidas como hemorragia que requiere reintervención, trombosis vascular, fístula urinaria o linfocele que requiere intervención quirúrgica, obstrucción de la vía urinaria por estenosis distal del uréter y otras.
Rechazo agudo: se consideraron para el análisis los rechazos diagnosticados por biopsia que aparecieron en cualquier momento después del trasplante.
Eventos clínicos postrasplante: se recogieron los siguientes eventos clínicos: infecciones bacterianas que requirieron ingreso hospitalario después del trasplante, existencia de neoplasia postrasplante, diabetes mellitus postrasplante (definida por la toma de antidiabéticos orales o insulina) y enfermedad cardiovascular postrasplante: cardiopatía isquémica (infarto agudo de miocardio o angina inestable), enfermedad isquémica cerebral (accidente cerebrovascular o isquémico transitorio) o enfermedad arterial periférica (amputación de algún miembro o colocación de stent arterial).
Análisis estadísticoLa descripción de las variables cuantitativas se expresaron como media±DE o como mediana y rango intercuartílico (RIC). Se empleó el test de la chi al cuadrado para estudiar la asociación entre variables cualitativas y el test t de Student para comparar medias de variables cuantitativas.
Análisis de supervivenciaSe realizó un análisis de supervivencia del paciente y del injerto por el método de Kaplan-Meier. Se compararon las curvas de supervivencia con la prueba del log-rank. En el análisis de supervivencia del paciente se consideró evento a la muerte del paciente por cualquier causa y se consideraron censuras los casos de pérdidas de seguimiento y los casos en los que no ocurrió el evento al finalizar el estudio (31 de diciembre del 2013). Los pacientes que perdieron el injerto fueron seguidos hasta su muerte o finalización del estudio.
En el análisis de supervivencia del injerto se consideró evento a la pérdida del injerto por cualquier causa, definida como la vuelta definitiva a diálisis y se consideraron censuras los casos de pérdidas de seguimiento, los casos en los que no ocurrió el evento al finalizar el estudio (31 de diciembre del 2013) y la muerte con injerto funcionante.
Para estudiar posibles factores asociados al riesgo de infección/enfermedad por CMV, mortalidad y pérdida del injerto, se realizó un estudio univariable y multivariable con modelos de regresión de riesgos proporcionales o modelo de Cox. Aquellas variables con efectos clínicos y un valor de p<0,2 en el análisis univariable se incluyeron en el modelo multivariable. Se consideró significativo cuando la p<0,05. Estos análisis se realizaron por duplicado, por un lado considerando la infección y la enfermedad CMV como variable agregada (modelo 1), y por otro teniendo en cuenta de manera separada la infección de la enfermedad CMV (modelo 2).
ResultadosInfección/enfermedad por citomegalovirusSe incluyó a 377 pacientes (fig. 1). El tiempo mediano de seguimiento fue de 8 años (RIC 3,7 meses-15,9 años).
La incidencia acumulada, en el primer año, de infección por CMV fue del 34,7% (N=131) y de enfermedad del 9,5% (N=36) (síndromes virales). El resto de los pacientes (55,7%, N=210) no tuvieron replicación CMV postrasplante.
En la tabla 1 se muestran las características demográficas basales de los receptores y donantes sobre la base de la presencia de infección/enfermedad por CMV.
Características demográficas de receptores, donantes y datos del trasplante según replicación CMV postrasplante
| Receptores | CMV (N=167) | No CMV (N=210) | p |
|---|---|---|---|
| Edad, años (DE) | 50,5 (13,2) | 47 (13,2) | 0,006 |
| Sexo varón, n (%) | 107 (64,1) | 137 (65,2) | NS |
| Etología ERC, n (%) | NS | ||
| Diabetes mellitus | 11 (6,8) | 8 (3,8) | |
| No diabetes mellitus | 156 (93,2) | 201 (96,2) | |
| Tipo de diálisis pre-Tx, n (%) | NS | ||
| HD | 97 (58,1) | 112 (53,3) | |
| DP | 68 (40,7) | 90 (42,9) | |
| No diálisis pre-Tx | 2 (1,2) | 8 (3,8) | |
| IMC, kg/m2(DE) | 24,9 (3,72) | 24,7 (4,50) | NS |
| Tiempo en diálisis, meses (DE) | 31 (30,4) | 36 (52,6) | NS |
| HTA pre-Tx, n (%) | 121 (73,8) | 154 (77,8) | NS |
| DM pre-Tx, n (%) | 17 (10,2) | 14 (7,1) | NS |
| Dislipidemia pre-Tx, n (%) | 59 (37,3) | 73 (38) | NS |
| Donantes | CMV (N=167) | No CMV (N=210) | p |
|---|---|---|---|
| Edad, años (DE) | 49,4 (13,3) | 45 (14,7) | 0,003 |
| Sexo varón, n (%) | 100 (60,2) | 131 (63,9) | NS |
| Datos trasplante | CMV (N=167) | No CMV (N=210) | p |
|---|---|---|---|
| Incompatibilidades HLA DR, n (%) | NS | ||
| 0 incompatibilidades | 48 (28,9) | 58 (28,3) | |
| 1 incompatibilidad | 88 (53) | 116 (56,6) | |
| 2 incompatibilidades | 30 (18) | 31 (15,1) | |
| Tiempo isquemia fría, h (DE) | 15,3 (6,3) | 15 (6,6) | NS |
| Tiempo isquemia templada, min (DE) | 52,5 (18,7) | 52,4 (16,3) | NS |
| IS de inducción, n (%) | NS | ||
| Anticuerpos monoclonales (anti-CD25) | 80 (47,9) | 101 (48,1) | |
| Anticuerpos policlonales (OKT3, timoglobulina, ATEGE) | 22 (13,2) | 41 (19,6) | |
| No inducción | 65 (38,9) | 68 (32,4) | |
| IS de mantenimiento, n (%) | NS | ||
| Tacrolimús | 114 (68,3) | 163 (77,6) | |
| Ciclosporina A | 51 (30,5) | 47 (22,4) | |
| Rapamicina | 2 (1,2) | – | |
| RFI, n (%) | 32 (20,8) | 27 (12,9) | NS |
| Rechazo agudo por biopsia, n (%) | 35 (21) | 33 (15,7) | NS |
| Complicaciones quirúrgicas, n (%) | 33 (19,9) | 35 (16,7) | NS |
DE: desviación estándar; DM: diabetes mellitus; DP: diálisis peritoneal; ERC: enfermedad renal crónica; HD: hemodiálisis; HTA: hipertensión arterial; IMC: índice de masa corporal; IS: inmunosupresión; RFI: retraso en la función inicial del injerto (necesidad de diálisis en la primera semana); Tx: trasplante.
En la tabla 2 se muestra la incidencia acumulada de infección y enfermedad por CMV y la incidencia de no replicación viral teniendo en cuenta la estrategia de prevención utilizada, así como el fármaco antiviral. La infección por CMV (N=131) se presentó de media a los 2,4±1.9 meses después del trasplante (RIC 0,5-12 meses) y la enfermedad (N=36) a los 2 meses (RIC 1-36 meses) después del trasplante.
Incidencia acumulada, en el primer año, de infección y enfermedad CMV
| Profilaxis con ganciclovir (N=78) | Profilaxis con valganciclovir (N=43) | Terapia anticipada con ganciclovir (N=128) | Terapia anticipada con valganciclovir (N=128) | |
|---|---|---|---|---|
| Infección CMV, n (%) | 23 (29,5) | 14 (32,5) | 44 (34,4) | 54 (42,2) |
| Enfermedad CMV, n (%) | 12 (15,4) | 3 (7,0) | 14 (10,9) | 7 (5,5) |
| No replicación viral, n (%) | 43 (55,1) | 26 (60,5) | 70 (54,7) | 67 (52,3) |
Los factores predictores de infección/enfermedad por CMV se muestran en la tabla 3.
Análisis de factores de riesgo de infección/enfermedad por CMV
| Análisis univariante | Análisis multivariante | |||||
|---|---|---|---|---|---|---|
| Variable | HR | IC del 95%I | p | HR | IC del 95% | p |
| Edad receptor, por año | 1,01 | 1,01-1,03 | 0,00 | 1,02 | 1,008-1,03 | 0,00 |
| CMV D+/R- | 2,27 | 1,19-4,32 | 0,01 | 2,46 | 1,28-4,73 | 0,00 |
| CMV D+/R+ | 2,04 | 1,17-3,55 | 0,01 | 1,89 | 1,08-3,29 | 0,02 |
| Diabetes mellitus | 1,31 | 0,78-2,21 | 0,29 | |||
| IMC receptor (kg/m2) | 1,01 | 0,97-1,05 | 0,46 | |||
| Tipo donante (vivo vs. cadáver) | 0,75 | 0,35-1,61 | 0,46 | |||
| Tratamiento IS (Tacro vs. CyA) | 0,64 | 0,46-0,89 | 0,00 | 1,51 | 1,08-2,09 | 0,01 |
| Tiempo en diálisis pre-Tx (meses) | 0,99 | 0,99-1,00 | 0,34 | |||
| Rechazo agudo (por biopsia) | 11,34 | 0,95-1,90 | 0,09 | |||
Los pacientes con infección/enfermedad por CMV presentaron una mayor tendencia a desarrollar enfermedad cardiovascular postrasplante (grupo CMV: N=33 [19,8%] vs. grupo no CMV: N=24 [11,6%], p=0,06) y diabetes mellitus postrasplante (grupo CMV: N=47 [28,3%] vs. grupo no CMV: N=41 [19,8%], p=0,05); sin embargo, no se encontraron diferencias estadísticamente significativas con infecciones bacterianas y neoplasias postrasplante.
Un 21% (N=35) de los pacientes con infección/enfermedad por CMV presentaron rechazo agudo por biopsia renal vs. el 15,7% (N=33) de los pacientes sin infección/enfermedad por CMV (p=0,18).
Supervivencia del paciente y predictores de mortalidad globalSesenta pacientes (15,9%) fallecieron a lo largo del periodo de seguimiento (44 pacientes murieron con injerto funcionante y 16 pacientes tras la pérdida del injerto, estando en diálisis).
Treinta y tres pacientes (8,7%) tuvieron infección por CMV y veintisiete (7,2%) no tuvieron replicación viral. Las causas de muerte fueron similares en los 2 grupos: de causa cardiovascular fallecieron 6 pacientes en el grupo CMV y 7 en el grupo no CMV, de causa infecciosa fallecieron 6 pacientes en el grupo CMV y 2 en el grupo no CMV y de causa neoplásica fallecieron 6 pacientes en el grupo CMV y 9 en el grupo no CMV. Por otras causas, fallecieron 5 en el grupo CMV y 3 en el grupo no CMV.
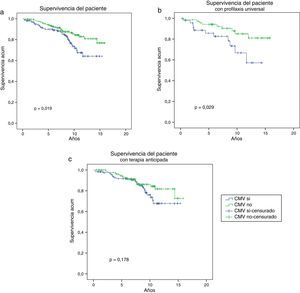
En la figura 2 a se muestra la supervivencia del paciente a largo plazo, esta fue significativamente mejor en los pacientes que no tuvieron infección/enfermedad por CMV (grupo CMV: 64,2% vs. grupo no CMV: 76,9% a los 15,8 años, p=0,019). Cuando se tiene en cuenta la estrategia de prevención, la supervivencia fue significativamente inferior solo en los pacientes que recibieron profilaxis universal y que presentaron infección/enfermedad por CMV (57,2% grupo CMV+profilaxis universal vs. 81% grupo no CMV+profilaxis universal a los 14 años, p=0,03) (fig. 2 b), mientras que los pacientes que recibieron terapia anticipada no presentaron diferencias estadísticamente significativas en la supervivencia del paciente tuvieran o no infección/enfermedad por CMV (67,7% grupo CMV+terapia anticipada vs. 72,6% grupo no CMV+terapia anticipada a los 15,3 años, p=0,178).
Supervivencia del paciente según la presencia o ausencia de infección/enfermedad CMV. La supervivencia del paciente en la cohorte global del estudio fue superior en los pacientes que no presentaron infección/enfermedad por CMV (a), al igual que en aquellos que recibieron profilaxis universal (b). Los pacientes con terapia anticipada presentaron una supervivencia del paciente similar en ambos grupos (c).
El estudio de posibles factores asociados al riesgo de mortalidad se muestra en la tabla 4.
Análisis de factores de riesgo de mortalidad a largo plazo
| Modelo 1 | Análisis univariante | Análisis multivariante | ||||
|---|---|---|---|---|---|---|
| Variable | HR | IC del 95% | p | HR | IC del 95% | p |
| Infección+enfermedad por CMV | 1,74 | 1,04-2,89 | 0,03 | 1,29 | 0,70-2,38 | 0,40 |
| Edad receptor, por año | 1,07 | 1,05-1,10 | 0,00 | 1,09 | 1,05-1,13 | 0,00 |
| Diabetes mellitus | 3,99 | 2,09-7,58 | 0,00 | 1,38 | 0,53-3,58 | 0,50 |
| IMC receptor | 1,14 | 1,07-1,21 | 0,00 | 1,08 | 1,01-1,17 | 0,02 |
| Edad donante, por año | 1,03 | 1,01-1,04 | 0,00 | 0,98 | 0,96-1,01 | 0,30 |
| Tiempo de isquemia fría (h) | 1,04 | 1,00-1,08 | 0,04 | 1,07 | 1,02-1,11 | 0,00 |
| Función inicial del injerto | 0,58 | 0,34-0,97 | 0,04 | 1,03 | 0,50-2,10 | 0,93 |
| Enfermedad cardiovascular | 1,69 | 0,95-3,01 | 0,07 | 0,93 | 0,46-1,89 | 0,84 |
| Pérdida del injerto | 2,85 | 1,60-5,07 | 0,00 | 2,78 | 1,30-5.92 | 0,00 |
| Modelo 2 | Análisis univariante | Análisis multivariante | ||||
|---|---|---|---|---|---|---|
| Variable | HR | IC del 95% | p | HR | IC del 95% | p |
| Enfermedad CMV | 2,53 | 1,25-5,11 | 0,00 | 1,26 | 0,52-3,04 | 0,59 |
| Infección CMV | 1,60 | 0,91-2,82 | 0,10 | 1,26 | 0,64-2,49 | 0,49 |
| Edad receptor, por año | 1,07 | 1,05-1,10 | 0,00 | 1,09 | 1,05-1,13 | 0,00 |
| Diabetes mellitus | 3,99 | 2,09-7,58 | 0,00 | |||
| IMC receptor | 1,14 | 1,07-1,21 | 0,00 | 1,08 | 1,01-1,17 | 0,03 |
| Edad donante, por año | 1,03 | 1,01-1,04 | 0,00 | |||
| Tiempo de isquemia fría (h) | 1,04 | 1,00-1,08 | 0,04 | 1,01 | 0,95-1,07 | 1,01 |
| Función inicial del injerto | 0,58 | 0,34-0,97 | 0,04 | 1,05 | 0,52-2,15 | 0,87 |
| Enfermedad cardiovascular | 1,69 | 0,95-3,01 | 0,07 | 1,08 | 0,52-2,22 | 0,83 |
| Pérdida del injerto | 2,85 | 1,60-5,07 | 0,00 | 3,00 | 1,42-6,35 | 0,00 |
Los pacientes con infección/enfermedad por CMV perdieron el injerto renal con mayor frecuencia que los pacientes que no presentaron CMV: 30 (18%) vs. 26 (12,4%), respectivamente. Las causas de pérdida del injerto fueron similares en los 2 grupos. En el grupo CMV se perdió el injerto por rechazo agudo en 4 casos, rechazo crónico en 21 casos, recidiva de enfermedad de base en un caso y otras causas en 4 casos. En el grupo no CMV las causas fueron: rechazo agudo en 2 casos, rechazo crónico en 18 casos, recidiva de enfermedad de base en 2 casos y por otras causas en 4 casos.
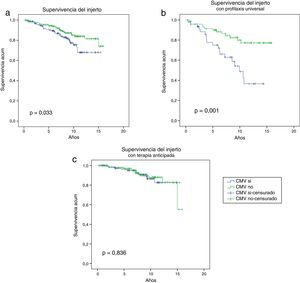
En la figura 3 a se muestra la supervivencia del injerto a largo plazo, que fue significativamente mejor en los pacientes sin infección/enfermedad por CMV (grupo CMV: 68% vs. grupo no CMV: 74,1% a los 15,8 años, p=0,034). Cuando se analizó la supervivencia teniendo en cuenta la estrategia de prevención utilizada (fig. 3 b), vimos que de nuevo la supervivencia del injerto fue significativamente inferior solo en los pacientes con infección/enfermedad por CMV que recibieron profilaxis universal (36,6% grupo CMV+terapia profilaxis universal vs. 77,2% grupo CMV no+profilaxis universal a los 14,3 años, p=0,001), no habiendo diferencias estadísticamente significativa en la supervivencia del injerto entre los pacientes con o sin infección/enfermedad por CMV que recibieron terapia anticipada (82,6% grupo CMV+terapia anticipada vs. 55,2% grupo CMV no+terapia anticipada, p=0,84).
Supervivencia del injerto según la presencia o ausencia de infección/enfermedad CMV. La supervivencia del injerto en la cohorte global de estudio fue superior en los pacientes que no presentaron infección/enfermedad por CMV (a), al igual que en aquellos que recibieron profilaxis universal (b). Los pacientes con terapia anticipada presentaron una supervivencia del injerto similar en ambos grupos (c).
El estudio de posibles factores asociados al riesgo de pérdida del injerto se muestra en la tabla 5.
Análisis de factores de riesgo de pérdida del injerto a largo plazo
| Modelo 1 | Análisis univariante | Análisis multivariante | ||||
|---|---|---|---|---|---|---|
| Variable | HR | IC del 95% | p | HR | IC del 95% | p |
| Infección+enfermedad CMV | 1,80 | 1,06-3,06 | 0,03 | 1,92 | 1,03-3,36 | 0,02 |
| Edad receptor, por año | 0,96 | 0,94-0,98 | 0,00 | 0,95 | 0,93-0,98 | 0,00 |
| Diabetes mellitus | 1,68 | 0,66-4,27 | 0,27 | |||
| IMC receptor | 1,03 | 0,96-1,11 | 0,36 | |||
| Edad donante, por año | 1,01 | 0,99-1,03 | 0,10 | |||
| Tiempo de isquemia fría (h) | 1,04 | 1,00-1,09 | 0,03 | 1,05 | 1,00-1,09 | 0,05 |
| Retraso en la función inicial del injerto | 2,03 | 1,20-3,44 | 0,00 | 1,54 | 0,83-2,84 | 0,16 |
| Rechazo agudo (por biopsia) | 1,80 | 1,03-3,13 | 0,04 | 2,44 | 1,33-4,47 | 0,00 |
| Profilaxis universal | 2,80 | 1,64-4,76 | 0,00 | 1,85 | 1,03-3,34 | 0,04 |
| Complicaciones quirúrgicas | 1,80 | 1,06-3,06 | 0,03 | 2,17 | 1,21-3,91 | 0,01 |
| Modelo 2 | Análisis univariante | Análisis multivariante | ||||
|---|---|---|---|---|---|---|
| Variable | HR | IC del 95% | p | HR | IC del 95% | p |
| Enfermedad por CMV | 2,70 | 1,33-5,48 | 0,00 | 2,60 | 1,21-5,85 | 0,01 |
| Infección por CMV | 1,46 | 0,80-2,65 | 0,21 | 1,73 | 0,91-3,29 | 0,09 |
| Edad receptor, por año | 0,96 | 0,94-0,98 | 0,00 | 0,96 | 0,93-0,98 | 0,00 |
| Tiempo de isquemia fría | 1,04 | 1,00-1,09 | 0,03 | 1,05 | 1,01-1,10 | 0,01 |
| Rechazo agudo (por biopsia) | 1,80 | 1,03-3,13 | 0,04 | 2,57 | 1,38-4,77 | 0,00 |
| Profilaxis universal | 2,80 | 1,64-4,76 | 0,00 | 1,77 | 0,98-3,20 | 0,05 |
| Complicaciones quirúrgicas | 1,80 | 1,06-3,06 | 0,03 | 2,17 | 1,19-3,94 | 0,01 |
La incidencia acumulada, en el primer año postrasplante, de infección por CMV fue del 34,7% y de enfermedad del 9,5%. Nuestros datos son concordantes con lo descrito previamente por otros grupos que utilizan estrategias de prevención6,14 y reflejan un importante descenso de la incidencia de infección y enfermedad por CMV tras el uso de las mismas. Sin embargo, existen diferencias entre las estrategias de prevención, demostradas en nuestro trabajo y por otros autores18-21. Los pacientes de alto riesgo, que recibieron profilaxis universal, tuvieron más enfermedad por CMV que los pacientes con terapia anticipada, favorecido por la ausencia de inmunidad celular específica frente al CMV que los proteja adecuadamente frente a la reactivación viral. Por el contrario, los pacientes con terapia anticipada presentaron tasas de infección por CMV superiores a los pacientes con profilaxis universal, hecho que es inherente a la propia estrategia.
El cambio de ganciclovir por valganciclovir disminuyó la incidencia de enfermedad, lo que pone de manifiesto la eficacia del valganciclovir en la prevención de la enfermedad por CMV. Este comportamiento ya fue comunicado por Paya et al.22 y es atribuible al mayor grado de exposición a ganciclovir alcanzado con valganciclovir (aproximadamente 1,7 veces mayor). Sin embargo, el efecto del fármaco empleado en cada periodo de tiempo no influyó de forma diferente en la supervivencia global del paciente ni en la del injerto tras realización de análisis de Cox estratificado por periodo de tiempo (datos no mostrados).
El principal resultado de nuestro estudio es la asociación significativa entre la presencia de infección/enfermedad por CMV en los primeros meses después del trasplante y la pérdida del injerto a largo plazo, siendo la mediana de seguimiento de 8 años.
El análisis multivariable demostró que los pacientes con infección CMV presentaron 1,7 veces más riesgo de perder el injerto que los pacientes sin infección por CMV y que los pacientes con enfermedad por CMV presentaron 2,6 veces más riesgo de perder el injerto que aquellos que no presentaron enfermedad por CMV. Otros autores también demostraron este efecto negativo de la replicación viral en la supervivencia del injerto17,23-26.
Pero este mayor riesgo de pérdida del injerto es matizable en función de la estrategia de prevención empleada, de forma que el mayor riesgo de pérdida del injerto está asociado a la replicación viral postrasplante cuando, habiendo recibido profilaxis universal, esta no es efectiva y se produce la infección o enfermedad CMV. Esto demuestra que el efecto deletéreo del CMV a largo plazo sobre el injerto alcanza su máxima expresión en los pacientes considerados como de alto riesgo.
Hay otros trabajos, incluyendo metaanálisis, que no encontraron asociación entre la replicación de CMV y la supervivencia del injerto21,27-29, posiblemente porque el tiempo de seguimiento de dichos estudios fue muy inferior al nuestro y cuando se trata de evaluar el éxito del trasplante la importancia del largo plazo es incuestionable.
La infección/enfermedad por CMV disminuye la supervivencia del paciente; sin embargo, no mostró asociación con la mortalidad a largo plazo, hecho similar a lo descrito en otros trabajos29-31. Desde hace años hay evidencias de una posible asociación entre el CMV y la enfermedad cardiovascular32,33. En nuestro estudio, cuando analizamos la asociación entre el CMV y los eventos cardiovasculares no encontramos diferencias estadísticamente significativas, aunque sí se vio que había una mayor tendencia a presentar un evento cardiovascular postrasplante entre los pacientes con infección/enfermedad por CMV.
La activación del CMV postrasplante produce un daño en el injerto y en el paciente que se asocia con mayor riesgo de pérdida del injerto a largo plazo, por lo que los intentos por mejorar su prevención ayudarían a progresar en los resultados a largo plazo. El primer hito en el control y manejo de esta complicación fue la aparición de fármacos antivirales potentes y el uso de estrategias de prevención. A día de hoy, son las piedras angulares de la prevención del CMV y deben mantenerse, sin embargo no son suficientes para evitar la replicación viral. Durante las 2 últimas décadas se ha puesto de manifiesto que la inmunidad innata y la específica frente al CMV desempeñan un papel crucial en el control del CMV y su monitorización está demostrando ser un avance importante en la capacidad de predecir qué pacientes tienen más riesgo de desarrollar infección/enfermedad por CMV postrasplante34-36, por tanto, la monitorización inmunológica antes del trasplante en los pacientes de moderado riesgo y antes de finalizar la profilaxis en los pacientes de alto riesgo podría ser de utilidad en el control del CMV postrasplante.
Así mismo, con los datos que se derivan de este y otros estudios, habría que considerar a los pacientes que tienen infección o enfermedad por CMV como pacientes con mayor riesgo de pérdida del injerto y mortalidad, por lo que deberían ser seguidos de forma cercana desde el punto de vista clínico en general y de la función renal, extremando las alertas sobre adherencia al tratamiento inmunosupresor y realizando una monitorización clínica cardiovascular más estrecha. Esto podría ayudar a mejorar la supervivencia a largo plazo.
Nuestro estudio tiene algunas limitaciones; por un lado, su naturaleza unicéntrica, que aunque puede favorecer la uniformidad de las acciones, limita la extrapolación de resultados. Esto no reduce la validez de los mismos, pero su interpretación requiere considerar las condiciones y circunstancias locales. Y por otro lado, su condición retrospectiva que solo nos permite especular sobre potenciales razones que expliquen las diferencias observadas entre los 2 grupos. Sin embargo, el estudio tiene el valor del largo periodo de seguimiento (mediana de 8 años de seguimiento), fundamental cuando se analiza el éxito del trasplante y la homogeneidad del equipo médico que se encargaba del cuidado de los pacientes.
En resumen, nuestro estudio demuestra que la replicación viral tras el trasplante disminuye la supervivencia del injerto y del paciente, comportándose como un factor de riesgo de pérdida del injerto pero no de mortalidad a largo plazo. Una monitorización clínica más estrecha a los pacientes con infección o enfermedad por CMV ayudaría a disminuir el daño provocado por el virus sobre el injerto y el paciente a largo plazo. Y confirma en población española que las estrategias de prevención frente al CMV disminuyen la incidencia de infección y enfermedad por CMV postrasplante, aunque sigue existiendo un porcentaje de replicación viral no despreciable que debemos mejorar y perseguir. La monitorización inmunológica es una herramienta útil que puede ayudar en el control del CMV postrasplante, aunque se necesitan estudios prospectivos que lo confirmen.
AutoríaMaría O. López-Oliva, Rafael Selgas, Teresa Bellón y Carlos Jiménez han participado en el diseño del estudio. María O. López-Oliva, Julio Flores y Carlos Jiménez han recogido los datos procedentes de las historias clínicas de los pacientes. Rosario Madero ha realizado el análisis estadístico de los datos. M.ª José Santana y Fernando Escuin han participado en el cuidado de los pacientes incluidos y María O. López-Oliva y Carlos Jiménez son responsables de la escritura del manuscrito.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.