La arteriolopatía urémica calcificante (CUA), también llamada calcifilaxis, es un trastorno vascular poco frecuente pero potencialmente mortal que afecta casi exclusivamente a pacientes con insuficiencia renal crónica. El objetivo de este estudio fue analizar los diferentes factores de riesgo para el desarrollo de CUA y su posterior evolución según la terapia recibida.
Material y métodosEstudio retrospectivo que recoge aquellos pacientes con diagnóstico de CUA desde diciembre de 1999 hasta diciembre de 2015. Se analizaron diferentes factores de riesgo, evolución y diferentes opciones terapéuticas.
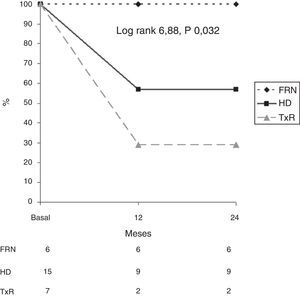
ResultadosSe incluyeron 28 pacientes (53,6% mujeres) con una edad media de 67,2±11,8 años (38-88). En el momento del diagnóstico, el 53,6% estaba en hemodiálisis, un 25% eran pacientes con un trasplante renal y el 21,4% presentaba función renal normal. En los pacientes trasplantados, el consumo de esteroides (100%; p=0,001) fue el principal factor de riesgo. La resolución de lesiones cutáneas se produjo en el 60,7% (especialmente en los que recibieron tratamiento multitarget). La supervivencia de los pacientes a los 12meses fue de 29, 57 y 100% en los pacientes trasplantados, hemodiálisis y con función renal normal respectivamente (log-rank 6,88; p=0,032). La presencia de insuficiencia renal crónica (p=0,03) e hipoalbuminemia (p=0,02) fueron los principales factores de riesgo de mortalidad CUA.
ConclusiónAunque la incidencia de la CUA sigue siendo baja, su mortalidad es muy elevada, por lo que debe prestarse especial atención a la presentación de la CUA en los trasplantados renales y en las formas «no renales». Los anticoagulantes orales y los esteroides aparecen como principales factores de riesgo. La CUA es un reto: necesitamos un registro de nuestros pacientes y establecer una terapia estándar.
Calcific uraemic arteriolopathy (CUA), also called calciphylaxis, is a rare but potentially fatal vascular disorder that almost exclusively affects patients with chronic renal failure. The objective of this study was to analyse various risk factors for developing CUA and its subsequent clinical course according to the treatment received.
Materials and methodsA retrospective study that included patients diagnosed with CUA from December 1999 to December 2015. Various risk factors, clinical course and treatment options were analysed.
ResultsA total of 28 patients (53.6% females) with a mean age of 67.2±11.8 (38–88) years were included. At the time of diagnosis, 53.6% were on haemodialysis, 25% were kidney transplant patients and 21.4% had normal renal function. The use of steroids (100%, P=.001) was the main risk factor in renal transplant patients. Skin lesions resolved in 60.7% (especially in those receiving multitargeted therapy). Patient survival at 12 months was 29% in transplant patients, 57% in haemodialysis patients and 100% in normal renal function patients (log-rank 6.88, P=.032). Chronic renal failure (P=.03) and hypoalbuminaemia (P=.02) were the main risk factor for CUA mortality.
ConclusionsAlthough the incidence of CUA remains low, CUA mortality is very high, Special attention to its occurrence in kidney transplant patients and «non-renal» CUA forms is required. Oral anticoagulants and steroids appear to be the main risk factors, CUA is a challenge; a registry of patients and determining standard therapy are required.
La calcifilaxis, también denominada arteriolopatía urémica calcificante (CUA), es una entidad poco común, aunque grave y con elevada mortalidad1,2.
La CUA se desarrolla en la dermis y el tejido celular subcutáneo, generalmente en áreas de adiposidad. Se caracteriza por lesiones cutáneas pruriginosas o dolorosas, nódulos violáceos, úlceras y escaras que evolucionan a necrosis isquémica de la piel3. La histología puede revelar calcificación de la media y proliferación de la íntima en los pequeños vasos, con o sin fibrosis endovascular, calcificación extravascular y vasooclusión trombótica4.
Aparece con mayor frecuencia en pacientes con enfermedad renal crónica avanzada en diálisis o en pacientes trasplantados renales; sin embargo, se han descrito casos de calcifilaxis en sujetos con función renal normal, recogidas en las clasificaciones como las CUA «no renales»5.
La patogenia de esta vasculopatía es compleja y no bien conocida, aunque se defienden varios mecanismos para su desarrollo. A los factores tradicionales del metabolismo mineral-óseo (hiperparatiroidismo, hipercalcemia e hiperfostatemia) y su elevada prevalencia en pacientes con bajo remodelado óseo6,7, se han ido sumando a lo largo de estos años otros factores de riesgo: sexo femenino, diabetes, obesidad, trauma local, hipoalbuminemia, estados de hipercoagulabilidad y exposición a vitamina D activa, quelantes cálcicos, corticoesteroides y antagonistas de la vitamina K8–11. Esta amalgama de factores ha generado un nuevo fenotipo de paciente que presenta lesiones de calcifilaxis alejado de la imagen clásica de esta entidad.
A pesar del mal pronóstico de esta entidad, el empleo del tratamiento multidisciplinar en los últimos años (tratamiento del dolor y de las sobreinfecciones, intensificación de hemodiálisis, bifosfonatos, tiosulfato sódico, quelantes no cálcicos, cinacalcet, vitamina K y pentoxifilina) ha conseguido que la supervivencia haya aumentado en estos pacientes12–14.
El objetivo de este estudio fue analizar la epidemiología actual de la calcifilaxis en el área del Hospital 12 de Octubre, los factores de riesgo para su desarrollo, así como la evolución de los pacientes en función del tratamiento recibido.
Material y métodosSe realizó un estudio observacional y retrospectivo de una serie de pacientes diagnosticados de calcifilaxis entre diciembre de 1999 y diciembre de 2015 en el Hospital Universitario 12 de Octubre de Madrid.
Se registraron los siguientes datos: sexo, edad, índice de comorbilidad de Charlson, situación al diagnóstico (pacientes en hemodiálisis, con trasplante renal normofuncionante o sin enfermedad renal), etiología de la insuficiencia renal crónica (IRC), tiempo de tratamiento renal sustitutivo (tanto hemodiálisis como trasplante renal), factores de riesgo cardiovascular (hipertensión arterial, diabetes mellitus, obesidad), síndrome de isquemia crónica, enfermedad arterial coronaria, fibrilación auricular, presencia de virus de hepatitis C, parámetros del metabolismo óseo (PTH, calcio, fósforo, y fosfatasa alcalina), albúmina sérica, tipo de afectación (distal o proximal), tratamiento habitual de los pacientes antes del desarrollo de la calcifilaxis, diagnóstico de calcifilaxis (mediante la clínica, la realización de biopsia o ambas), estrategias terapéuticas (tratamiento convencional–intensificación de la hemodiálisis, medidas de soporte o amputación del miembro afecto–vs. tratamiento multitarget–tratamiento convencional junto con tiosulfato sódico, bifosfonatos, cinacalcet, quelantes no cálcicos o pentoxiflina), evolución de las lesiones, seguimiento, supervivencia, muerte en relación con la calcifilaxis (para establecer esta conexión, el punto de corte se estableció en los primeros 6 meses desde el desarrollo de la calcifilaxis) y otras causas de muerte.
En el análisis estadístico, las variables cuantitativas se expresaron como media y desviación estándar y rango, mientras que las variables cualitativas se expresaron como número absoluto y porcentaje. Para la comparación de variables cuantitativas se empleó el test estadístico t de Student y para las variables cualitativas se utilizó el test de la Chi-cuadrado. La evolución desde el diagnóstico hasta el fallecimiento fue descrita mediante el método de Kaplan-Meier. Se consideraron como estadísticamente significativos aquellos valores con una p < 0,05. El análisis estadístico se realizó mediante el programa SPSS (versión 20 para Windows).
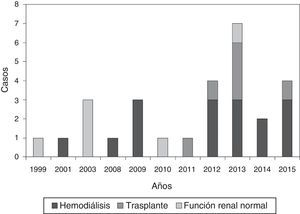
ResultadosDatos epidemiológicos generalesSe identificaron 28 pacientes con diagnóstico de calcifilaxis, de los cuales el 53,6% eran mujeres, todos de raza caucásica. La edad media fue de 67,2±11,8 años (38-88). La figura 1 muestra la distribución de casos por año.
Al diagnóstico, el 53,6% (n=15) recibía terapia sustitutiva mediante hemodiálisis (HD), el 25% (n=7) era portador de un trasplante renal normofuncionante (Tx) y un 21,4% (n=6) no presentaba enfermedad renal: fueron etiquetados como sujetos con «función renal normal» (FRN).
Las causas más frecuentes de IRC (tanto en los pacientes en HD como en los que habían recibido trasplante renal) fueron nefroangioesclerosis (22,7%; n=5), nefropatía diabética (18,2%; n=4) y enfermedad glomerular (18,2%; n=4).
El tiempo medio de tratamiento renal sustitutivo (incluyendo HD y trasplante renal) fue de 133,7±102,8 (10-324) meses.
Se recogieron diferentes variables respecto a la comorbilidad y al tratamiento habitual de los pacientes y las diferencias respecto a los 3tipos de tratamiento (HD, TR, FRN) antes de que se desarrollasen las lesiones por calcifilaxis (tabla 1). Es importante destacar que no hubo significación estadística entre las distintas variables y el desarrollo de la calcifilaxis, salvo con los esteroides (p=0,001). La toma de anticoagulantes en los pacientes que no estaban en hemodiálisis (trasplantados renales y pacientes con función renal normal) presentan una tendencia próxima a la significación estadística (p=0,07).
Factores de riesgo previo al desarrollo de la calcifilaxis
| HD (n=15) | Tx (n=7) | FRN (n=6) | Total (n=28) | |
|---|---|---|---|---|
| HTA n (%) | 13 (87,6) | 6 (85,7) | 4 (66,7) | 23 (82,5) |
| DM n (%) | 5 (33,3) | 4 (57,1) | 4 (66,7) | 13 (46,4) |
| Obesidad n (%) | 6 (40) | 4 (57,1) | 2 (33,3) | 12 (42,9) |
| EAC n (%) | 7 (46,7) | 2 (28,6) | 2 (33,3) | 11 (39,3) |
| SIC n (%) | 10 (66,7) | 3 (42,9) | 3 (50) | 16 (57,1) |
| FA n (%) | 5 (33,3) | 2 (28,6) | 2 (33,3) | 9 (32,1) |
| VHC n (%) | 3 (20) | 2 (28,6) | 0 (0) | 5 (17,9) |
| Tratamiento habitual previo a calcifilaxis | ||||
| Carbonato cálcico n (%) | 3 (20) | 1 (14,3) | 2 (33,3) | 6 (21,4) |
| Esteroides n (%) | 2 (13,3) | 7 (100)* | 1 (16,7) | 10 (35,7) |
| Vitamina D activa n (%) | 9 (60) | 2 (28,6) | 2 (33,3) | 13 (46,4) |
| Hierro intravenoso n (%) | 4 (26,7) | 0 (0) | 2 (33,3) | 6 (21,4) |
| ACO n (%) | 8 (53,3) | 6 (85,7) | 5 (83,3) | 19 (67,9) |
| Antiagregantes n (%) | 6 (40) | 1 (14,3) | 2 (33,3) | 9 (32,1) |
ACO: anticoagulantes orales; DM: diabetes mellitus; EAC: enfermedad arterial coronaria; FA: fibrilación auricular; FRN: función renal normal; HD: hemodiálisis; HTA: hipertensión arterial; Tx: trasplantados renales; VHC: virus de la hepatitis C.
En el 82,1% de los casos (n=23) las lesiones tuvieron una distribución distal, con afectación proximal el 17,9% restante (n=5).
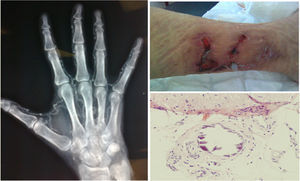
El diagnóstico se basó en la sospecha clínica junto con realización de biopsia en 22 pacientes (78,6%), que únicamente fue clínico en los 6 restantes (21,4%). En la figura 2 se muestran algunas imágenes representativas de las lesiones por calcifilaxis.
Lesión cutánea en miembro inferior secundaria a calcifilaxis (arriba derecha). Lesiones histológicas en el tejido celular subcutáneo con áreas de calcificación, algunas de ellas perivasculares, compatibles con calcifilaxis (abajo derecha). Radiografía de mano izquierda en la que se observan calcificaciones vasculares (izquierda).
Se recogieron valores del metabolismo óseo y albúmina sérica al diagnóstico, los cuales quedan reflejados en la tabla 2. Cabe destacar que no hubo diferencias significativas entre grupos, excepto al comparar los valores de PTH entre pacientes en HD vs. FRN (p=0,002) y entre pacientes trasplantados vs. FRN (p=0,03). En cuanto a la albuminemia, en pacientes con IRC también se observaron cifras por debajo del límite de la normalidad.
Parámetros bioquímicos del metabolismo óseo y albúmina sérica
| HD (n=15) | Tx (n=7) | FRN (n=6) | Total (n=28) | |
|---|---|---|---|---|
| PTH (pg/ml) | 433,5±627,4 (12-2613)* | 269,1±235,6 (3-617) | 34,8±15 (21-50,8) | 339,6±552 (3-2613) |
| Calcio (mg/dl) | 9,2±0,5 (8-10,2) | 8,6±1,4 (6,3-9,9) | 9,4±1,1 (8-11,1) | 9,1±0,9 (6,3-11,1) |
| Fósforo (mg/dl) | 4,3±1,5 (2,2-6,5) | 4,2±1 (2,6-5,7)** | 3,1±0,2 (2,9-3,4) | 4,0±1,3 (2,2-6,5) |
| Fosfatasa alcalina (UI/l) | 156,8±107,4 (45-423) | 102,5±48,9 (64-205) | 103±59,2 (63-171) | 130,2±91,4 (45-423) |
| Producto Ca×P | 39,1±12,1 (21,3-58,5) | 36,1±10,9 (24,4-56,4) | 29,8±5,1 (23,2-37,7) | 36,3±10,9 (21,3-58,5) |
| Albúmina sérica (g/dl) | 3,2±0,7 (1,7-4,5) | 3,2±0,7 (2,1-4,4) | 3,8±0,7 (2,5-4,3) | 3,3±0,7 (1,7-4,5) |
FRN: función renal normal; HD: hemodiálisis; Tx: trasplantados renales.
En cuanto a las opciones terapéuticas, el 71,4% (n=20) recibió un tratamiento combinado (multitarget), mientras que el 28,6% restante (n=8) recibió tratamiento convencional.
Centrándonos en el tratamiento combinado, en la tabla 3 se exponen todas las opciones terapéuticas que se emplearon (por grupos y en total). Cabe destacar que respecto al tratamiento multitarget se observaron diferencias significativas entre los distintos grupos. Las sesiones de hemodiálisis se realizaron con baños bajos en calcio; los bifosfonatos empleados fueron ibandronato o alendronato y los quelantes no cálcicos fueron sevelámero o lantano.
Opciones terapéuticas empleadas
| HD (n=15) | Tx (n=7) | FRN (n=6) | Total (n=28) | |
|---|---|---|---|---|
| Intensificación HD n (%) | 13 (86,7)* | 4 (57,1)** | 0 (0) | 17 (60,7) |
| Tiosulfato sódico n (%) | 10 (66,7)* | 6 (85,7)** | 1 (16,6) | 17 (60,7) |
| Bifosfonatos n (%) | 11 (73,3)* | 5 (71,4)** | 1 (16,6) | 17 (66,7) |
| Cinacalcet n (%) | 9 (60)* | 3 (42,9)** | 0 (0) | 12 (42,9) |
| Quelantes no cálcicos n (%) | 8 (53,3)* | 1 (14,3) | 0 (0) | 9 (32,1) |
| Vitamina K n (%) | 5 (33,3) | 0 (0) | 1 (16,6) | 6 (21,4) |
| Pentoxifilina n (%) | 5 (33,3) | 1 (14,3) | 0 (0) | 6 (21,4) |
| Amputación n (%) | 1 (7,1) | 1 (14,3) | 0 (0) | 2 (7,4) |
FRN: función renal normal; HD: hemodiálisis; Tx: trasplantados renales.
El seguimiento de los pacientes se realizó durante una media de 26,29 meses (1-192).
La resolución de las lesiones se produjo en el 60,7% de los pacientes (n=17), mientras que en el 39,3% restante (n=11) estas no desaparecieron. Respecto a la mortalidad, el 39,3% (n=11) falleció por la propia calcifilaxis: el 40% de los pacientes en HD (n=6/15) y el 71,4% de los trasplantados (n=5/7).
La principal causa de mortalidad fue infecciosa (64%), seguida de la cardiovascular (27,2%).
Se realizó un análisis de los diferentes factores de riesgo en relación con la mortalidad relacionada con la calcifilaxis (tabla 4); fueron estadísticamente significativas la presencia de IRC (p=0,03) y la distribución central de las lesiones (p=0,04).
Influencia de diferentes factores sobre la mortalidad relacionada con calcifilaxis
| Factores | Fallecimiento N=11 (%) | Vivos N=17 (%) | p |
|---|---|---|---|
| >70 años | 4 (36,4) | 8 (47,1) | 0,57 |
| CCI >7 | 9 (81,8) | 8 (47,1) | 0,06 |
| IRC | 11 (100) | 11 (64,7) | 0,03 |
| HTA | 9 (81,8) | 14 (82,4) | 0,97 |
| DM | 5 (45,5) | 8 (47,1) | 0,93 |
| Obesidad | 5 (45,5) | 7 (41,2) | 0,82 |
| SIC | 6 (54,5) | 10 (58,8) | 0,81 |
| EAC | 4 (36,4) | 7 (41,2) | 0,81 |
| FA | 3 (27,3) | 6 (35,3) | 0,65 |
| ACO | 7 (63,6) | 12 (70,6) | 0,77 |
| Lesión central | 4 (36,4) | 1 (5,9) | 0,04 |
| Tratamiento multitarget | 9 (81,8) | 11 (64,7) | 0,31 |
ACO: anticoagulación oral; CCI: índice de comorbilidad de Charlson; DM: diabetes mellitus; FA: fibrilación auricular; HTA: hipertensión arterial; IRC: insuficiencia renal crónica; SIC: síndrome isquemia crónica.
Se analizaron las diferencias de las principales variables del metabolismo mineral-óseo en función de la presencia o no de IRC y de la mortalidad relacionada con la calcifilaxis (tabla 5), y se encontró una significación estadística entre esta última, el hiperparatiroidismo (p=0,02) y la hiperfosforemia (p=0,05).
Diferentes variables en relación con la presencia o no de IRC y la mortalidad por calcifilaxis
| IRC (n=18) | FRN (n=6) | p | Mortalidad por CUA Sí (N=11) | Mortalidad por CUA No (N=17) | p | |
|---|---|---|---|---|---|---|
| PTH (pg/ml) | 381,2±553,3 (3-2613) | 34,9±15 (21-50,8) | 0,02 | 281,3±202,1 (3-617) | 385,4±688,9 (21-2613) | 0,62 |
| Calcio (mg/dl) | 9±0,9 (6,3-10,1) | 9,4±1,1 (8-11,1) | 0,31 | 8,9±1,1 (6,3-9,9) | 9,3±0,8 (8-11,1) | 0,31 |
| Fósforo (mg/dl) | 4,3±1,3 (2,2-6,5) | 3,1±0,2 (2,9-3,4) | 0,05 | 4,3±1,4 (2,2-6,5) | 3,8±1,2 (2,6-6,4) | 0,27 |
| Fosfatasa alcalina (UI/l) | 139,6±95,1 (45-423) | 103±59,2 (63-171) | 0,52 | 147,2±112,7 (45-423) | 125,8±73,6 (47-187) | 0,57 |
| Albúmina sérica (g/dl) | 3,3±0,7 (1,7-4,4) | 3,8±0,7 (2,5-4,3) | 0,16 | 2,9±0,6 (1,7-3,7) | 3,6±0,6 (2,2-4,4) | 0,02 |
CUA: arteriolopatía urémica calcificante; FRN: función renal normal; IRC: insuficiencia renal crónica; PTH: Hormona paratiroidea.
Por otra parte, se analizó la supervivencia en relación con la muerte por calcifilaxis en función de los grupos diagnósticos (fig. 3). Al cabo de 12 meses, el 56% de los pacientes en HD, el 23% de los trasplantados renales y el 100% de los pacientes con FRN permanecían vivos. Al cabo de 24 meses, el 56% de los pacientes en HD, el 100% de los pacientes con FRN y el 23% de los trasplantados renales permanecían vivos, respectivamente (log rank 6,88; p=0,032).
DiscusiónLa calcifilaxis es una entidad poco frecuente generalmente asociada a IRC, con una prevalencia entre el 1 y el 4% en los pacientes en diálisis1,15. En nuestra serie, fueron diagnosticados 28 pacientes en un periodo de 16 años, lo cual invita a pensar que, a pesar de su baja incidencia, debe tenerse en cuenta en el diagnóstico diferencial.
En contra de lo esperable, el perfil del paciente ha cambiado: la calcifilaxis no es exclusiva de sujetos con IRC en diálisis, sino que también se da en trasplantados renales con función normal del injerto e incluso en pacientes sin enfermedad renal16,17 (en nuestro estudio, hasta el 21,4% presentaba función renal normal).
En general es más prevalente en mujeres obesas2, como se pudo apreciar en nuestra serie de casos. La mayoría de los pacientes presentaba factores de riesgo cardiovascular (hipertensión arterial, diabetes mellitus, obesidad), enfermedad coronaria y síndrome de isquemia crónica, lo cual conduce a la hipoperfusión de los tejidos8,10,18. Estos factores están desplazando a los protagonistas clásicos de la calcifilaxis, como son los atribuidos al metabolismo mineral-óseo19,20. Un ejemplo de lo expuesto anteriormente lo encontramos en nuestra serie, en la que solo se evidenció hiperparatiroidismo, hiperfosforemia y calcio normal en los pacientes con IRC, Sin embargo, toman protagonismo otros factores de riesgo, como pueden ser los esteroides (en el grupo de trasplantados renales, el 100% consumía dichos fármacos) como causantes de la aparición de esta entidad. Este hallazgo es de suma importancia y de gran interés clínico para reconsiderar la indicación de estos tratamientos en pacientes de alto riesgo. Con todas estas apreciaciones, podemos dibujar un nuevo fenotipo del paciente con calcifilaxis al que debemos prestar especial interés: un sujeto con insuficiencia renal (paciente en diálisis o trasplantado renal) con importante comorbilidad, entre la que destaca un acusado perfil cardiovascular (hipertenso, diabético y con enfermedad vascular periférica), en tratamiento con anticoagulantes orales y con hipoalbuminemia debido a inflamación crónica o malnutrición3,8.
En todos los casos, las lesiones cutáneas presentaron evolución tórpida y fueron muy sugestivas de calcifilaxis, que se pudo comprobar con biopsia en el 78,6% de los casos, Incluso, en algunos pacientes, se realizaron radiografías en las que se pudo apreciar la calcificación de los vasos.
Un aspecto fundamental que ha cobrado extraordinaria importancia en el mundo de la calcifilaxis es el uso de un tratamiento combinado o multitarget. Existe una fuerte evidencia que confirma la mejora de las lesiones cutáneas y el aumento de la supervivencia cuando se emplea este13,21,22. Aunque no existe una terapia estandarizada, se recomienda suspender los quelantes cálcicos, los anticoagulantes orales (pasando a heparina de bajo peso molecular) y la vitamina D, así como aumentar la frecuencia de las diálisis (en los casos necesarios) a 5-6 sesiones semanales con baño bajo en calcio23, Además, se pueden utilizar fármacos como los quelantes no cálcicos24–26 (por ejemplo, el sevelámero, que inhibe las calcificaciones ectópicas y reduce el colesterol), el cinacalcet27,28 (reduce la PTH, el calcio y el fósforo en pacientes en diálisis con hiperparatiroidismo secundario), el tiosulfato sódico29 (antioxidante y antiinflamatorio que moviliza los depósitos cálcicos de los vasos) y los bifosfonatos30,31 (inhibidores de la formación de calcificaciones ectópicas con efecto antiinflamatorio). Debemos considerar la administración de vitamina K en los casos de deficiencia32. Existe controversia respecto al empleo de cámara hiperbárica33 (podría ser beneficiosa en lesiones distales) y de la paratiroidectomía en los casos de hiperparatiroidismo severo, ya que no parecen mejorar el pronóstico en estos pacientes2.
El pronóstico de esta enfermedad es nefasto, pues presenta una mortalidad de hasta el 60-80%, con la sepsis relacionada con calcifilaxis como la causa más frecuente2,4, como ocurrió en el 64% de nuestros pacientes. En concreto, las lesiones proximales tienen una mortalidad mayor que las distales (p=0,04)9. En esta serie, los principales factores de riesgo para la mortalidad relacionada con la calcifilaxis fueron la presencia de IRC (p=0,03) y la hipoalbuminemia (p=0,02).
Además, es importante señalar que los pacientes con función renal normal presentan un pronóstico vital excelente con relación a la calcifilaxis (ninguno de ellos falleció por este motivo), frente a los pacientes con IRC (especialmente los trasplantados renales), los cuales tienen una probabilidad de fallecimiento muy elevada a los pocos meses (p=0,032).
Es un estudio con importantes limitaciones, es retrospectivo, unicéntrico y con un número reducido de casos, sin la realización de un análisis comparativo con un grupo control de sujetos sin calcifilaxis, pero refleja la realidad que ocurre en la actualidad en los diferentes centros de Nefrología.
En conclusión, aunque la calcifilaxis es una entidad poco frecuente, tiene una elevada mortalidad. El perfil del paciente ha cambiado: no es exclusiva de situaciones urémicas, también ocurre en pacientes con trasplante renal normofuncionante o en sujetos sin enfermedad renal. Los factores de riesgo cardiovascular (diabetes, obesidad, enfermedad vascular periférica, anticoagulación con antagonistas de la vitamina K, esteroides) desplazan a los clásicos del metabolismo mineral-óseo. Se debería establecer un «score de riesgo» para diagnóstico precoz, así como un tratamiento estándar. Es necesario realizar estudios multicéntricos que permitan unificar el tratamiento en esta entidad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.