La glomerulonefritis membranosa (GNM) se caracteriza por el depósito de complejos autoinmunes a nivel subepitelial1,2. Aproximadamente el 75% de los casos de GNM son primarias o idiopáticas, mientras que el resto, formas secundarias, se asocian a enfermedades sistémicas, infecciones, neoplasias y fármacos2. Un 70-80% de los pacientes adultos con GNM primaria presentan anticuerpos circulantes frente al receptor tipo M de la fosfolipasa A2 (anti-PLA2R), presente en la membrana podocitaria. Estos anticuerpos, que no se han descrito en otras glomerulopatías, tienen valor diagnóstico para la GNM primaria, y se correlacionan con la actividad clínica y la respuesta al tratamiento3,4.
Describimos a un paciente con GNM, test positivos para anti-PLA2R mediante 2 técnicas y patrón histológico de causa secundaria, probablemente lúpica.
Varón de 77 años remitido por síndrome nefrótico. Dentro de sus antecedentes destacaban: epilepsia diagnosticada hace 40-50 años en tratamiento con difenilhidantoína. Ocho meses antes comenzó con edemas de miembros inferiores y cifras de presión arterial elevadas. Refería nicturia de 2-3 veces, sin otros síntomas sistémicos. En tratamiento con difenilhidantoína, amlodipino, furosemida y enoxaparina. Exploración física: presión arterial 143/86mmHg, edema de miembros inferiores con fóvea hasta rodillas; resto de la exploración anodina.
Exploraciones complementarias: hemoglobina: 10,3g/dl, leucocitos 6.310/mm3 (linfocitos 1.300/mm3); VCM y CHCM: normales, plaquetas: 276.000, hierro 82microg/dl, ferritina 29,2ng/ml, Coombs directo negativo, urea 32mg/dl, creatinina 1,20mg/dl, albúmina 2,3g/dl; la coagulación, los iones y el resto de la bioquímica elemental eran normales. IgG 461mg/dl, IgM 34mg/dl, IgA normal. Electroforesis de alta resolución en suero: débil componente monoclonal IgG kappa (cadenas kappa 52,6mg/l, cadenas lambda 27,2mg/l, relación kappa/lambda 1,94). Anticuerpos anti-PLA2R positivos por inmunofluorescencia indirecta y por ELISA 274U/ml (valor de referencia<20), (inmunofluorescencia indirecta y ELISA: Medizinische Labordiagnostika, EUROINMUN AG, Luebeck, Alemania). ANA+1/1.280; C3, C4, anti-ADN, antihistonas, ENA, anticardiolipinas, ANCA, anti-TPO y crioglobulinas normales/negativos. Enzima convertidora de angiotensina, hormonas tiroideas y PSA normales. Orina: proteinuria 8.920g/24h (electroforesis de alta resolución: patrón glomerular no selectivo, débil componente monoclonal IgG kappa). Cultivo de orina negativo. Mantoux y quantiferon negativos. Serología negativa para VHB, VHC, VIH, Parvovirus B19 y CMV; EBV infección pasada. PCR VHB y PCR VHC negativas. RPR negativo.
Radiografía de tórax y ecocardiografía sin alteraciones; TAC tórax-abdomen-pelvis: derrame pleural laminar bilateral, sin otras alteraciones; RMN de venas renales: no signos de trombosis, gastro/colonoscopia: pólipos de colon que se resecan (biopsia: adenomas tubulares con displasia de bajo grado).
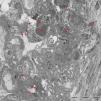
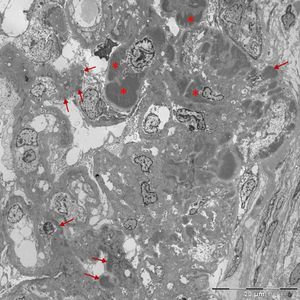
Se realizó biopsia renal percutánea (18 glomérulos, 2 de ellos esclerosados) que mostraba engrosamiento de las membranas basales con aspecto vacuolizado y proliferación mesangial; la inmunofluorescencia reveló IgG y C3 con patrón granular difuso en paredes capilares y mesangio, C1q negativo, kappa y lambda positivas (+++); en el estudio de microscopia electrónica se observaron depósitos masivos subendoteliales, subepiteliales y mesangiales y fusión podocitaria.(fig. 1). En conjunto compatible con GNM secundaria.
Durante la colonoscopia con sedación, que se preparó con senósidos y enema fisiológico, el paciente sufrió una hipotensión y la creatinina se elevó hasta 1,69mg/dl. Se desestimó utilizar IECA/ARA2, al menos inicialmente, y se trató con prednisona y micofenolato de mofetilo.
Nuestra primera impresión diagnóstica fue una GNM primaria. Sin embargo, la presencia de proliferación mesangial y de depósitos subendoteliales y mesangiales indica una forma secundaria de GNM. Descartamos razonablemente hepatitis B, C y neoplasia. No había restricción de cadena ligera por lo que no parece tratarse de una gammapatía monoclonal con afectación renal. Consideramos que nuestro paciente puede tener un lupus eritematoso sistémico latente. La GNM lúpica puede cursar con pocas manifestaciones clínicas y serológicas de lupus eritematoso sistémico5. Por otra parte, de acuerdo con los criterios de la SLICC, este paciente podría ser diagnosticado de lupus eritematoso sistémico 6. Parece poco probable que la difenilhidantoína haya desempeñado algún papel, porque en el lupus inducido por fármacos la nefropatía es rara y suelen ser positivos los anticuerpos antihistonas.
Los anti-PLA2R representan un biomarcador útil para el diagnóstico de la GNM primaria; en algunos estudios las técnicas para su detección tuvieron una sensibilidad del 94,4% (inmunofluorescencia indirecta) y del 97,2% (ELISA) y una especificidad del 100%7. Se han descrito anti-PLA2R positivos en la nefropatía membranosa secundaria a cáncer, lupus, hepatitis B y sarcoidosis1. Qin et al.8 estudiaron a 20 pacientes con nefropatía membranosa lúpica y en uno de ellos los anti-PLA2R fueron positivos. Otra publicación9 recoge 25 pacientes, de origen predominantemente europeo, diagnosticados de nefropatía membranosa lúpica y en ningún caso se detectó anti-PLA2R. Por tanto, la positividad de anti-PLA2R en la GNM lúpica es infrecuente, de significado dudoso y puede ser una mera coincidencia. Sin embargo, en la nefropatía membranosa secundaria a VHB y sarcoidosis con anti-PLA2R positivos, sí podrían desempeñar estos anticuerpos un papel patogénico10,11.
Se ha sugerido que en un síndrome nefrótico con anti-PLA2R positivos se puede asumir el diagnóstico de GNM sobre todo en casos de riesgo para realizar biopsia renal1. Como ilustra este paciente, salvo que exista contraindicación importante, la biopsia aporta información adicional necesaria.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al Dr. Jerónimo Forteza (Unidad Mixta de Patología Molecular, Instituto Valenciano de Patología, Universidad Católica de Valencia) por el estudio de microscopia electrónica.