Sr. director:
El síndrome de leucoencefalopatía posterior reversible (SLPR) consiste en un cuadro de alteraciones del nivel de conciencia, visuales y convulsiones asociado a múltiples causas que incluyen la uremia, la hipertensión arterial (HTA), el tratamiento inmunosupresor y el síndrome de Goodpasture, entre otros. Presentamos un caso en el que se dan todas estas condiciones conjuntamente.
Se trata de una mujer de 22 años que debutó 4 meses antes con insuficiencia renal severa. Se objetivan anticuerpos anti-MBG positivos y se realiza biopsia renal con diagnóstico de glomerulonefritis extracapilar tipo I secundaria a síndrome de Goodpasture. Es tratada mediante 3 bolos de metilprednisolona de 1 gramo y después prednisona a dosis de 60 mg/día junto con 9 sesiones de plasmaféresis y ciclofosfamida (CP) oral a dosis de 1 mg/kg/día. No desarrolla hemorragia pulmonar. No recupera función renal, por lo que debe iniciar hemodiálisis mediante catéter venoso central tunelizado. Mantiene buen estado general, con HTA mal controlada pese a tratamiento con amlodipino, captopril y atenolol.
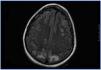
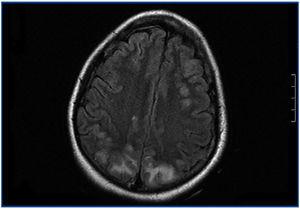
En el período interdiálisis presenta malestar general, desorientación temporal y nivel de conciencia fluctuante. Es trasladada al Servicio de Urgencias, donde presenta dos crisis convulsivas tónico-clónicas generalizadas, que ceden con benzodiazepinas, con recuperación del nivel de conciencia entre las crisis. En la exploración física se muestra afebril, con tensión arterial (TA): 151/108, apertura ocular espontánea, respuesta verbal correcta. Pupilas isocóricas y normorreactivas. Pares craneales normales; fuerza y sensibilidad conservada en las cuatro extremidades. Signos meníngeos negativos. No presenta otros hallazgos de interés. Se realiza radiografía de tórax y tomografía computarizada craneal, sin hallazgos. Ante una tercera crisis y el empeoramiento progresivo de su estado general, ingresa en la Unidad de Cuidados Intensivos, donde precisa sedación, intubación orotraqueal y ventilación mecánica inducida (VMI). En la analítica destaca leucocitosis con desviación izquierda, acidosis láctica severa, negatividad de anticuerpos antimembrana basal, anticuerpos antinucleares, anticuerpos anticitoplásmicos de neutrófilos, inmunocomplejos, anti-DNA, anti-SS-A. anti-SS-B, anti-RNP, anti-Scl-70, con complemento e inmunoglobulinas normales. Hemocultivos y urocultivos negativos. Estabilidad iónica. Fibrobroncoscopia sin hallazgos. Punción lumbar normal. Cultivo de líquido cefalorraquídeo para bacterias, hongos y virus negativo. Electroencefalograma con ritmo basal lento en rango delta con ondas de actividad theta de predominio en regiones temporales bilaterales. Dos descargas epileptiformes en zona parietal derecha. Resonancia magnética nuclear (RMN) craneal con hiperintensidad de señal en secuencias potenciadas en T2 y FLAIR, sugerente de edema vasogénico, de localización corticosubcortical en las porciones posteriores de ambos lóbulos parietales, occipitales y frontal derecho que en la secuencia de difusión no muestra restricción significativa (figura 1). Ante estos hallazgos, se llega al diagnóstico de SLPR. Se inicia tratamiento con fenitoína, antibioterapia empírica y hemodiafiltración venovenosa continua. Mantiene severa HTA que precisa tratamiento con 6 fármacos (captopril, amlodipino, doxazosina, atenolol, nitroglicerina y urapidilo). En los siguientes días, mejora, sin recurrencia de las crisis y manteniendo TA correctas, por lo que se puede retirar la VMI y puede ser dada de alta a los 18 días de ingreso, con atenolol y captopril como tratamiento de base.
DISCUSIÓN
El SLPR1-3 es un cuadro de edema cerebral vasogénico generalmente asociado a HTA que condiciona hiperaflujo sanguíneo cerebral y provoca alteración endotelial y de la autorregulación circulatoria cerebral. Afecta principalmente a la sustancia blanca por su densidad tisular y a los lóbulos posteriores por su escasa inervación simpática, que los hace más vulnerables a la HTA. Se reconocen múltiples causas de éste (tabla 1). Cursa con cefalea, alteración del nivel de conciencia, alteraciones visuales (visión borrosa, escotomas, ceguera cortical) y convulsiones generalizadas tónico-clónicas. Se trata mediante el control de la HTA, preferentemente usando nicardipino o labetalol (se recomienda precaución con el nitroprusiato por la posibilidad de desencadenar vasodilatación cerebral paradójica que acentúe el edema cerebral), y de las convulsiones mediante fenitoína o benzodiazepinas, y presenta un curso generalmente benigno hacia la resolución, aunque son marcadores de pobre pronóstico la presencia de insuficiencia renal (la uremia y la inmunosupresión acentúan la neurotoxicidad de la encefalopatía hipertensiva) y los datos a la RMN de hiperintensidad o daño cerebral extenso que afecte al tallo cerebral.
En la literatura médica sólo existen dos casos descritos en el que el SLPR coexista con el síndrome de Goodpasture. El primero4 corresponde a un varón de 27 años en tratamiento con CP y prednisona, con clínica renal y pulmonar que debutó durante una crisis hipertensiva y que se resolvió en 48 horas al controlar la TA y sustituir la CP por rituximab. El segundo5 es el de una mujer de 22 años también con clínica renopulmonar, en tratamiento con hemodiálisis y plasmaféresis, no con CP, que precisó VMI. En los tres casos la clínica fue severa, con alteraciones visuales, cefalea y convulsiones, pero se resolvieron en un máximo de 3 semanas sin secuelas ni recidivas al controlar la TA y, en el primer caso, modificar el tratamiento inmunosupresor. En nuestro caso, la paciente debutó a los 4 meses de haber presentado la enfermedad, cuando sus anticuerpos anti-MBG se habían negativizado y sin tratamiento inmunosupresor activo.
En este contexto resulta especialmente importante el control de la HTA para prevenir un cuadro grave que, aunque de curso generalmente benigno, puede provocar una encefalopatía potencialmente severa.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Figura 1. Resonancia magnética nuclear craneal
Tabla 1. Causas del síndrome de leucoencefalopatía posterior reversible