El síndrome de Goodpasture (SGP) es una rara entidad de base inmunológica, caracterizada por la asociación de una glomerulonefritis rápidamente progresiva (GNRP) y hemorragia alveolar en presencia de anticuerpos antimembrana basal. La afectación del sistema nervioso central (SNC) en el SGP es extremadamente infrecuente en ausencia de ANCA. Presentamos el caso de un paciente de 20 años que comenzó con una GNRP acompañada de esputos hemoptoicos y dos episodios de crisis convulsivas tónico-clónicas generalizadas, en presencia de elevados títulos de anticuerpos antimembrana basal glomerular (Ac-anti-MBG). Tras tratamiento inmunosupresor asociado con plasmaféresis, el paciente presentó descenso de los títulos de Ac-anti-MBG, así como mejoría de los síntomas neurológicos y respiratorios, aunque sin recuperación de la función renal, permaneciendo en programa de hemodiálisis. Veinte meses más tarde, con la enfermedad en remisión, el paciente recibió un trasplante renal de cadáver.
Goodpasture´s syndrome is a rare autoimmune disorder characterized by rapidly progressive glomerulonephritis (RPGN) and alveolar hemorrhage in the presence of anti-glomerular basement membrane (anti-GBM) antibodies. Central nervous system involvement is highly unusual in the absence of anti-neutrophil cytoplasmic antibodies. We report the case of a 20-year-old man with RPGN accompanied by bloody sputum, tonic-clonic seizure and high titers of anti-GBM antibody. After treatment with immunosuppressants and plasmapheresis, the patient showed reduced anti-GBM antibody titers and improved neurologic and respiratory symptoms, but renal failure persisted, requiring hemodialysis. Twenty months later, with the disease in remission, he underwent deceased-donor renal transplantation.
INTRODUCCIÓN
La enfermedad por anticuerpos antimembrana basal glomerular es un trastorno inmunológico caracterizado por la presencia de anticuerpos circulantes, que actúan directamente contra un antígeno intrínseco de la membrana basal glomerular, provocando una glomerulonefritis rápidamente progresiva (GNRP).
El síndrome de Goodpasture (SGP) ha sido generalmente usado como sinónimo de la enfermedad por anticuerpos antimembrana basal glomerular y se caracteriza por la asociación de una GNRP y hemorragia alveolar en presencia de anticuerpos antimembrana basal (Ac anti-MBG). La afectación del sistema nervioso central (SNC) en el SGP es bastante excepcional en ausencia de anticuerpos anticitoplasma de neutrófilo (ANCA) y sólo se han descrito 4 casos en la bibliografía médica1-4.
Presentamos el caso de un paciente de 20 años que comenzó con una GNRP, acompañada de esputos hemoptoicos y dos episodios de crisis convulsivas tónico-clónicas generalizadas, en presencia de elevados títulos de Ac anti-MBG.
CASO CLÍNICO
Varón de 20 años, fumador y ex-consumidor de cocaína y cannabis, que acude al hospital por hematuria macroscópica y fracaso renal agudo oligúrico (FRAO). Doce días antes de su ingreso, presentó astenia, anorexia, vómitos y disuria, por lo que acudió a su médico de cabecera, siendo diagnosticado de infección urinaria, pautándole tratamiento con ciprofloxacino. Cuatro días más tarde presenta fiebre de 38 ºC, hematuria macroscópica y disminución subjetiva de diuresis.
En la exploración física destacaban los siguientes datos: presión arterial: 140/90 mmHg, temperatura: 37 ºC. Deterioro del estado general, palidez cutáneo-mucosa e hipoventilación bibasal. Al ingreso se objetiva FRAO, que requirió hemodiálisis en las primeras 24 horas. Cuarenta y ocho horas más tarde presenta esputos hemoptoicos, seguidos de dos episodios de crisis convulsiva tónico-clónica generalizada.
Los datos de laboratorio al ingreso mostraron: Hto, 25,5%, Hb, 8,9 g/l, leucocitos, 16.700/mm3, plaquetas, 344.000/mm3, VSG, 96 mm/h, creatinina, 11,8 mg/dl, BUN, 90 mg/dl, glucosa, 97 mg/dl, proteínas totales, 5,3 g/dl, albúmina, 4,5 g/dl, calcio, 8,2 mg/dl, sodio, 134 mEq/l, potasio, 5,2 mEq/l. Proteinograma, inmunoglobulinas y cadenas ligeras kappa/lambda normales. La serología de virus hepatotropos, VIH, así como las pruebas de función hepática no revelaron alteraciones. Las determinaciones de tóxicos en sangre y orina, incluyendo los metabolitos de cocaína, fueron negativas. El estudio inmunológico, consistente en las determinaciones de ANA, ANCA, Ac antifosfolípidos, Ac anticardiolipina, así como los niveles de complemento, fueron negativos. Sin embargo, los Ac anti-MBG fueron positivos (72,5 ug/ml, rango normal <10 U). El análisis de orina (24 h) mostró una proteinuria de 850 mg. Se observó una intensa hematuria en el sedimento urinario. En la radiografía de tórax se observó un infiltrado alvéolo-intersticial bilateral indicativo de hemorragia alveolar. En la ecografía renal se observaron unos riñones de tamaño normal, con aumento de la ecogenicidad cortical. El electroencefalograma, la resonancia magnética nuclear (RMN) cerebral y la angio-RMN cerebral fueron normales.
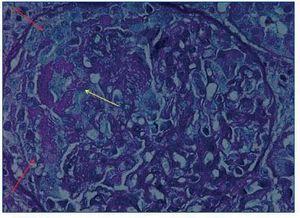
Cuatro días después del ingreso se le realizó una biopsia renal percutánea, en la que se observó una glomerulonefritis extracapilar (100% de semilunas), con colapso del ovillo glomerular, focos de necrosis fibrinoide, moderado infiltrado inflamatorio e incipiente fibrosis intersticial y atrofia tubular (figura 1). La inmunofluorescencia evidenció depósitos lineales de inmunoglobulina G (IgG) alrededor de la membrana basal glomerular.
El paciente fue diagnosticado de SGP asociado con probable vasculitis del SNC ANCA negativo. Al ingreso, el paciente fue tratado con 3 bolos de 500 mg de metilprednisolona durante 3 días consecutivos. Posteriormente, se asoció ciclofosfamida oral a dosis de 1,5 mg/kg/día y 15 sesiones de plasmaféresis. Además, recibió tratamiento con ácido valproico. Los síntomas respiratorios y neurológicos desaparecieron con el tratamiento pautado, pero desafortunadamente la función renal no se recuperó, permaneciendo en programa de hemodiálisis al alta.
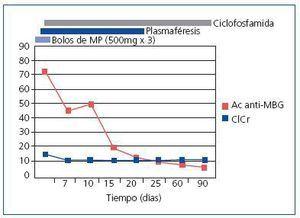
A los 25 días de su ingreso, el paciente fue dado de alta, con títulos de Ac anti-MBG negativos, lo que permitió reducir lentamente la inmunosupresión, sin presentar datos de recaída. La ciclofosfamida fue suspendida a los 3 meses del ingreso, permaneciendo el paciente con dosis bajas de esteroides (2,5 mg/día) y en programa de hemodiálisis (figura 2).
Evolución posterior
Seis meses después del alta, tras abandonar el tratamiento hipotensor, el paciente reingresa por una urgencia hipertensiva (presión arterial de 220/120 mmHg y hematoma intraparenquimatoso temporal derecho que precisó drenaje quirúrgico). En ese momento las determinaciones seriadas de Ac anti-MBG fueron negativas y a pesar de la gravedad de las lesiones, el paciente no presentó déficit neurológico al alta.
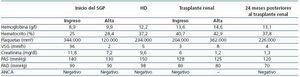
Veinte meses más tarde, recibió un trasplante renal de donante cadáver, además de tratamiento inmunosupresor con tacrolimus, micofenolato mofetil y prednisona. La evolución del injerto ha sido satisfactoria y no ha presentado recidiva de la enfermedad (tabla 1).
DISCUSIÓN
El SGP es un raro trastorno inmunológico caracterizado por la tríada de GNRP, presencia de Ac circulantes anti-MBG y hemorragia pulmonar. Aunque factores genéticos se han asociado con el aumento de la susceptibilidad para desarrollar este síndrome, otros factores como la exposición ambiental (infecciones virales, exposición a hidrocarburos volátiles y humo del tabaco) pueden desencadenar la enfermedad en individuos predispuestos, particularmente en aquellos con lesiones pulmonares subyacentes5. Además, el consumo de cocaína también se ha relacionado con la enfermedad por Ac anti-MBG6. Nuestro paciente tenía el antecedente de ser fumador, así como el consumo previo de cocaína, factores que pudieron influir en el desencadenante de la enfermedad.
Entre un 10 y un 30% de los casos, la enfermedad por Ac anti-MBG se asocia con ANCA y la mayoría de los pacientes tienen títulos bajos de Ac anti-mieloperoxidasa (MPO). Este subgrupo de pacientes probablemente presente una variante de vasculitis asociada7. Sin embargo, aunque no se ha esclarecido cuál es la causa exacta del desarrollo de ANCA en la enfermedad por Ac anti-MBG, algunos autores han sugerido que un mecanismo de activación policlonal podría ser el responsable8.
El SGP se caracteriza por la presencia de autoanticuerpos contra la epítope de la cadena alfa 3 del colágeno tipo 4 (alfa-3 [IV] NCI), denominado antígeno Goodpasture9 . Aunque este antígeno posee una amplia distribución, se expresa fundamentalmente en la membrana basal glomerular y alveolar, siendo menos frecuente en la membrana basal tubular, cóclea, retina y plexo coroideo.
La afectación cerebral en el SGP es extremadamente rara en ausencia de ANCA y sólo se han descrito 4 casos en la bibliografía médica1-4. Todos los casos comunicados presentaron crisis convulsivas recurrentes relacionadas con vasculitis cerebral con o sin hemoptisis. Rydel, et al.1 describieron el primer caso de vasculitis cerebral ANCA negativa asociado con SGP, demostrando infiltrados vasculíticos en la biopsia meníngea. Aunque la biopsia cerebral y meníngea constituye el patrón oro (gold standard) para el diagnóstico de vasculitis cerebral, actualmente su realización puede estar limitada sólo a pacientes con diagnósticos dudosos debido a la naturaleza agresiva del procedimiento. Además, en la mayoría de los casos descritos de SGP con afectación cerebral, el diagnóstico de vasculitis cerebral ANCA negativa asociado con SGP se realizó basándose en el cuadro clínico y en los hallazgos de las pruebas de imagen2-4. Nuestro paciente comenzó con una GNRP con necesidad de diálisis desde el inicio, seguida de hemorragia pulmonar y de dos episodios de crisis convulsiva tónico-clónico generalizada, coincidiendo con títulos elevados de Ac anti-MBG. Las determinaciones repetidas de ANCA fueron negativas y otras posibles causas desencadenantes de las crisis convulsivas como trastornos metabólicos, crisis hipertensiva, deprivación de drogas, etc., fueron excluidas. Aunque la RMN cerebral fue normal en nuestro paciente, no podemos descartar que lesiones vasculíticas de pequeño vaso pudieran haber contribuido a la afectación cerebral en nuestro enfermo. De hecho, hasta un 35% de los casos de pacientes con vasculitis cerebral, la RMN cerebral es negativa10. La angiografía cerebral no se realizó porque los síntomas neurológicos desaparecieron con el tratamiento descrito previamente. Asimismo, también se observó una mejoría de los síntomas respiratorios, aunque la función renal no se recuperó. Levy, et al. describieron que la insuficiencia renal avanzada estimada por la creatinina plasmática (>5,7 mg/dl) o la necesidad de diálisis al inicio del cuadro, así como un porcentaje de semilunas mayor del 50% encontrado en la biopsia renal, son factores de mal pronóstico para la recuperación de la función renal11.
En esta enfermedad es posible realizar un trasplante renal, aunque existe el riesgo de recidiva de la misma, por lo que se ha sugerido un tiempo de espera de, al menos, 6 meses y realizarlo cuando los títulos de Ac anti-MBG sean indetectables. Ésta es una estrategia prometedora en la mayoría de los casos, como ocurrió en nuestro paciente, quien recibió un trasplante renal de cadáver 20 meses más tarde, presentando una buena evolución clínica posterior y sin datos de recidiva de la enfermedad.
Finalmente, concluimos que el SGP con afectación neurológica es extremadamente infrecuente, en especial con ANCA negativo. Los hallazgos de una RMN cerebral normal, no excluyen una Vasculitis Cerebral de pequeño vaso, por lo que SGP requiere un diagnóstico y tratamiento agresivo y precoz en aras de mejorar su pronóstico.
AGRADECIMIENTO
Los autores agradecen al Dr. Eduardo Salido su asesoramiento como patólogo renal y como revisor del manuscrito.
Figura 1. Glomerulonefritis extracapilar (flechas rojas) con focos de necrosis fibrinoide
Figura 2. Evolución de los títulos de anticuerpos anti-MBG y de la función renal tras el inicio del tratamiento con esteroides, ciclofosfamida oral y plasmaféresis
Tabla 1. Datos evolutivos desde el inicio del SGP hasta el trasplante renal