Objetivo: Analizar la relación entre la velocidad de la onda de pulso (VOP) y la presión arterial central valorada con el índice de aumento (IA) en personas hipertensas con enfermedad renal. Métodos: Se incluyeron 406 hipertensos con función renal normal y 72 con enfermedad renal. La rigidez arterial se estimó con la VOP y con el IA. Se siguieron los criterios de la Guía Europea de Hipertensión de 2007 para valorar la existencia o no de enfermedad renal. Resultados: La VOP fue 8,98 ± 2,15 y 10,17 ± 3,01 m/s (p <0,05) y el IA 30,06 ± 12,46% y 30,23 ± 12,56% (p >0,05) en hipertensos con función renal normal y con enfermedad renal, respectivamente. El análisis de regresión múltiple reveló la función renal como determinante importante de VOP, pero no del IA. Conclusión: En hipertensos con enfermedad renal la VOP está aumentada la VOP, pero no el IA. Consideramos que el IA no es una medida fiable de la rigidez arterial en hipertensos con enfermedad renal.
Objective: To analyze the relationship between pulse wave velocity (PWV) and central blood pressure evaluated by augmentation index (AIx) in hypertensive patients with kidney disease. Methods: 406 hypertensive patients with normal renal function and 72 with kidney disease. Arterial stiffness was estimated with the PWV and the AIx. We followed the 2007 European Guidelines of Hypertension criteria to assess the presence or absence of kidney disease. Results: PWV was 8.98 ± 2.15 and 10.17 ± 3.01 m/sec (p <0.05) and AIx 30.06% ± 12.46 and 30.23% ± 12.56 (p >0.05) in hypertensive patients with normal renal function and kidney disease, respectively. Multiple regression analysis showed the renal function as an important determinant of PWV, but not AIx. Conclusion: In hypertensive patients with renal disease PWV is increased, but not the AIx. We believe that the AIx is not a reliable measure of arterial stiffness in hypertensive patients with kidney disease.
INTRODUCCIÓN
El aumento de rigidez arterial se asocia con mayor morbimortalidad cardiovascular1.
El patrón oro aceptado actualmente para evaluar la rigidez arterial es la velocidad de la onda del pulso carótido femoral (VOP)2. Este parámetro se asocia con la edad y con la presión arterial en todos los estudios realizados3, y está relacionado con el aumento de morbimortalidad tanto en sujetos con patología cardiovascular como en sujetos sanos4-6.
El índice de aumento de la presión arterial central o augmentation index (IA%), definido como la ratio entre el incremento de la presión arterial sistólica (PAS) central y la presión de pulso central, es un indicador de la rigidez arterial central, relacionado con la edad y la hipertensión arterial3. El IA, al ser técnicamente más fácil de medir que la VOP, se ha propuesto como una alternativa para valorar la rigidez arterial sistémica7. Sin embargo, no está claro su uso en la práctica clínica como medidas superponibles e intercambiables con la VOP. Un estudio realizado en diabéticos concluye que la presión de pulso y la VOP se incrementan en las personas con diabetes, pero esto no se asocia con aumento del IA8. Otro trabajo que compara diferentes medidas, entre ellas la VOP y el IA, para valorar la rigidez arterial, concluye que no son intercambiables estas medidas en la práctica clínica9. La rigidez arterial valorada con la VOP está aumentada en los pacientes con enfermedad renal10 y se ha relacionado de forma independiente con los eventos cardiovasculares en este grupo de pacientes11, pero el valor del IA en este grupo de población no se conoce. El objetivo de este estudio es analizar la relación de la VOP y el IA en personas hipertensas con enfermedad renal.
MATERIAL Y MÉTODO
Diseño y población
Estudio descriptivo transversal realizado en el ámbito de atención primaria, en la Unidad de Investigación de la Alamedilla. Mediante muestreo consecutivo se incluyeron 478 sujetos, procedentes de una población de 46.000 personas de dos centros de salud, derivadas por 15 médicos de familia, desde diciembre de 2006 a diciembre de 2009, de 30 a 80 años de edad, con el diagnóstico clínico de hipertensión arterial. El protocolo fue aprobado por el comité ético de investigación clínica del Hospital Universitario de Salamanca y todos los participantes firmaron el consentimiento informado.
Variables analizadas
Se analizaron edad, sexo, antecedentes familiares de enfermedad vascular prematura, y personales de tabaquismo, diabetes mellitus, enfermedad cerebrovascular y cardiopatía isquémica.
Las determinaciones de los valores lipídicos, de creatinina y de glucosa en sangre de pacientes, tras al menos 8 horas de ayuno, y cociente microalbuminuria/creatinina, en una muestra de orina de la primera hora de la mañana, fueron realizadas de manera ciega en el laboratorio de referencia.
Las exploraciones realizadas fueron: peso, talla con estimación del índice de masa corporal (IMC), frecuencia cardíaca, circunferencia de la cintura y determinación de presión arterial con un esfigmomanómetro modelo OMRON M7 (Omron Health Care, Kyoto, Japón) validado y siguiendo las recomendaciones de la Guía de la Sociedad Europea de Hipertensión y Cardiología12.
La estimación del filtrado glomerular (FG) se realizó con la ecuación de Modification of Diet in Renal Disease-Isotopic Dilution Mass Spectrometry (MDRD-IDMS) en la que FG = 175 x (creatinina sérica)—1,154 x edad—0,203 x (0,742 en mujeres)13 y la Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI): con las siguientes ecuaciones para raza blanca14: mujeres con creatinina ≤0,7 mg/dl (62 mmol) FG = 144 × (cr/0,7)—0,329 × (0,993)edad y con creatinina >0,7 mg/dl (62 mmol) FG = 144 × (cr/0,7)—1,209 × (0,993)edad. Hombres con creatinina ≤0,9 mg/dl (80 mmol), FG = 141 × (cr/0,9)—0,411 × (0,993)edad y con creatinina >0,9 mg/dl (80 mmol) FG = 141 × (cr/0,9)—1,209 × (0,993)edad.
El IA y la VOP se han medido con el Sphigmo cor System (Atcor Medical, Australia). Con el paciente sentado con el brazo apoyado en una superficie rígida, mediante un sensor en la arteria radial se determinó la onda del pulso aórtico. A partir de la morfología de la onda aórtica se estimaron la presión arterial central (aórtica), el incremento de presión, la presión de pulso central y el IA definido como: aumento de presión sistólica aórtica * 100/presión de pulso aórtico. Con el paciente en decúbito supino, se determinó la onda del pulso en carótida y femoral, estimando el retraso con respecto a la onda del ECG y calculando la VOP. Las medidas de espacio se tomaron con una cinta métrica desde la horquilla esternal a la carótida y femoral en el lugar del sensor. Más datos sobre el procedimiento de medición han sido publicados previamente15.
En este estudio se ha considerado que había afectación renal si los pacientes presentaban lesión de órgano diana y/o enfermedad renal clínica, siguiendo los criterios establecidos en la Guía de las Sociedades Europeas de Hipertensión y de Cardiología12 (definidos en la base de la tabla 1).
Análisis estadístico
Las variables continuas se han expresado como media ± desviación estándar y en las variables cualitativas se ha utilizado su distribución de frecuencias. La diferencia de medias entre variables cualitativas de dos categorías ha sido analizada con la prueba de la t de Student para muestras independientes. Mediante el coeficiente de correlación de Pearson se estimó la relación entre las variables cuantitativas del estudio y para la asociación de las variables cualitativas se utilizó el test de la ji cuadrado. En el análisis multivariante se realizó un modelo de regresión lineal múltiple por pasos para cada una de las variables consideradas como respuesta o dependientes: VOP (velocidad de onda de pulso) e IA (índice de aumento). En ambos casos, en el primer paso mediante el método «enter» se incluyeron las variables independientes: edad, sexo y frecuencia cardíaca, y en el segundo, mediante el método «stepwise»: creatinina, cociente microalbuminuria/creatinina, FG, PAS periférica, presión arterial diastólica (PAD) periférica, presión arterial media (PAM) periférica, presión de pulso periférica, circunferencia de la cintura, IMC, presión sistólica central, presión diastólica central, presión de pulso central y presión media central. En los contrastes de hipótesis se ha fijado un riesgo de 0,05 como límite de significación estadística. El programa estadístico utilizado ha sido el SPSS/PC+, versión 17.0 (SPSS Inc., Chicago, Illinois, EE.UU).
RESULTADOS
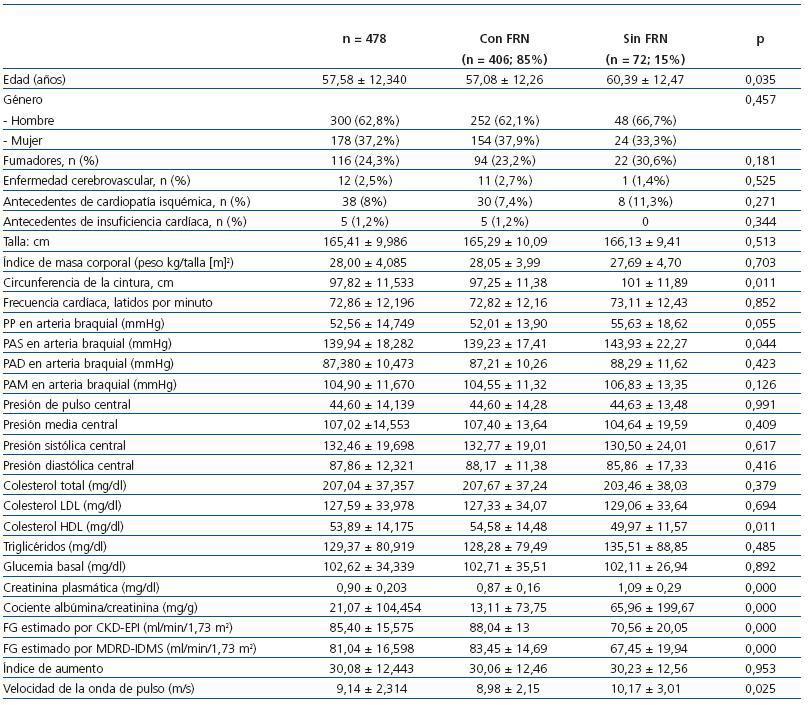
Las características demográficas, clínicas y hemodinámicas de los participantes del estudio se exponen en la tabla 1. Los pacientes que presentan la función renal alterada son más viejos y tienen valores más elevados en la circunferencia de la cintura, la PAS en arteria braquial, y la VOP y menores de HDL. No existen diferencias entre los dos grupos en el IA.
La VOP presenta una correlación positiva con la presión de pulso central (r = 0,279), presión sistólica central (r = 0,273), PAM central (r = 0,214) y con la creatinina (r = 0,165), e inversa con el FG valorado con la fórmula de CKDEPI (r = —0,209). No hay correlación con el cociente microalbumina/creatinina (r = —0,029; p = 0,713).
El IA presenta una correlación inversa con el FG valorado con el CKDEPI (r = —0,209), la presión de pulso central (r = —0,233), creatinina (r = —0,210) y frecuencia cardíaca (r = —0,438) y correlación positiva con la presión de pulso central (r = 0,514), presión sistólica central (r = 0,410) y presión media central (r = 0,217). No hay correlación con el cociente microalbumina/creatinina (r = —0,080; p = 0,311).
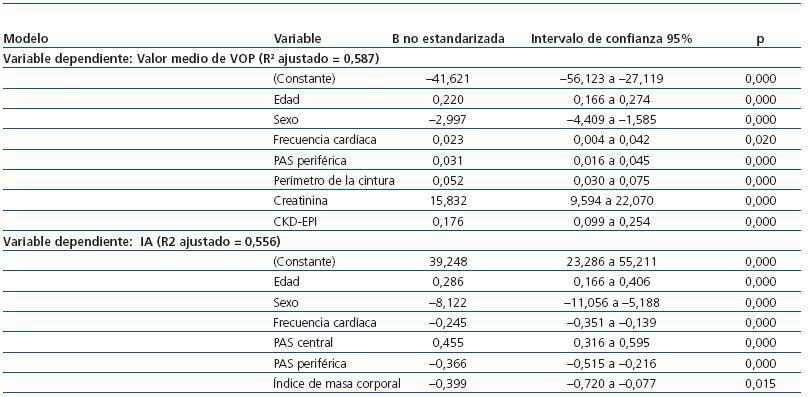
En el modelo de regresión múltiple (tabla 2), el 58,7% de la variabilidad de la VOP se explicó por la edad, el sexo, la frecuencia cardíaca media, la PAS periférica, el perímetro de la cintura, la creatinina y el FG estimado con CKDEPI. Cuando la IA se utilizó como variable dependiente en el mismo modelo, los parámetros que valoran la enfermedad renal ya no aparecían como factores determinantes de la variabilidad, explicando el 55,6% de ésta la edad, el sexo, la frecuencia cardíaca media, la PAS periférica, la PAS central y el IMC.
También hemos encontrado una mayor asociación del IA con el sexo femenino (B = —8,122) que la VOP (B = —2,997). Asimismo, por cada unidad que aumenta la presión arterial periférica el IA disminuye en un 36,6% y la VOP se incrementa en un 3,2%.
DISCUSIÓN
En este trabajo encontramos que la VOP presenta valores significativamente mayores en hipertensos con afectación renal que en aquellos que tienen una función renal normal; sin embargo, cuando utilizamos el IA como indicador de rigidez arterial no encontramos diferencias entre ambos. Del mismo modo, las variables que valoran la existencia de enfermedad renal se mantienen en el modelo de regresión múltiple explicando la variabilidad de la VOP. Pero cuando se utilizó el IA como variable dependiente en el mismo modelo, dichas variables desaparecían como factores determinantes de la misma.
Como ya ha sido descrito en otros estudios3, tanto la VOP como el IA se correlacionan con la presión arterial del paciente, pero al ajustarlos por edad y sexo la asociación de la presión arterial es positiva con la VOP y con el IA es negativa, hecho que confirma los datos publicados por otros autores en pacientes con enfermedad renal16.
En diversos estudios ya se ha descrito que los pacientes con enfermedad renal presentan valores de VOP más elevados3,10,17, hecho concordante con los hallazgos de este trabajo. La asociación del IA con el género es mayor con el sexo femenino que la asociación de la VOP, al igual que ocurre en pacientes hipertensos y diabéticos3.
En el trabajo Raymond, et al.17 publicado recientemente y en el que se medía la VOP en 2.564 pacientes que presentaban enfermedad renal crónica, los factores que presentaron asociación positiva con la VOP son la edad, las concentraciones de glucosa en sangre, la raza, circunferencia de la cintura, PAM, el sexo y asociación negativa con el nivel de función renal. Variables similares a las de este trabajo, salvo que la glucemia no entra en el modelo regresión múltiple, y sí se incluye la frecuencia cardíaca.
La frecuencia cardíaca presenta una correlación negativa con el IA en pacientes hipertensos, hecho también descrito en pacientes con enfermedad renal18, pero no ocurre lo mismo con la VOP. Como se recoge en la revisión publicada en 2009 por Cecelja, et al.3, la frecuencia cardíaca puede asociarse de diferente forma con los parámetros que evalúan la rigidez arterial.
Por último, un trabajo publicado por Temmar, et al.19 que valora la rigidez arterial con la VOP y la presencia de calcificaciones arteriales concluye que pacientes con enfermedad renal crónica tanto la rigidez vascular valorada con la VOP como la calcificación vascular aparecen pronto, pero sólo empeora la calcificación vascular con la evolución de la enfermedad.
En conclusión, la rigidez arterial es mayor en hipertensos con enfermedad renal valorada con la VOP. Sin embargo, la enfermedad renal no se asoció con la rigidez arterial cuando ésta fue valorada con el IA. Esto confirma que las dos medidas para valorar la rigidez en la práctica clínica no son intercambiables en este grupo de pacientes, como ya ha quedado demostrado en hipertensos y en diabéticos8,9.
A la vista de los datos presentados, la enfermedad renal puede ser otro factor de confusión cuando se emplea el IA como sustituto para medir la rigidez arterial. Esto apoya los hallazgos que indican que la VOP es el único índice de rigidez arterial asociado de forma independiente con los resultados de morbimortalidad cardiovascular en pacientes con enfermedad renal11.
Por último, consideramos que son necesarios estudios de seguimiento para poder establecer la fuerza relativa de la predicción del riesgo cardiovascular con cada una de estas dos medidas y poder valorar si la realización conjunta produce algún beneficio adicional.
Tabla 2. Análisis de regresión múltiple
Tabla 1. Características demográficas, antropométricas y hemodinámicas de los 478 pacientes estudiados