Presentamos un caso de seroconversión excepcionalmente tardía al VHC en un paciente en hemodiálisis. El caso clínico ilustra la dificultad que existe en aislar adecuada y prontamente a un paciente infectado por el VHC, y demuestra la necesidad de considerar a todos los pacientes en diálisis como potencialmente infecciosos. La aplicación de las precauciones estándar en hemodiálisis ha de hacerse de forma rutinaria con todos los pacientes, por que el diagnóstico de infección por VHC es muchas veces tardío y, en ocasiones existe dificultad en interpretar correctamente los tests diagnósticos disponibles.
INTRODUCCIÓN
Desde que se conoce la existencia del Virus de la hepatitis C (VHC), se han publicado numerosos trabajos sobre las posibles vías de transmisión de este virus en las unidades de hemodiálisis. Las transfusiones tuvieron importancia, fundamentalmente, en la era preeritropoyetina y antes de la determinación rutinaria del VHC en los bancos de sangre1,2. En la actualidad, aunque se sabe que existe una vía de transmisión inherente a la propia técnica de hemodiálisis, no se conoce con exactitud en que medida interviene la transmisión directa paciente a paciente a través del personal sanitario o los monitores de diálisis3-6. Las dudas en este sentido hace que persista la controversia sobre las medidas preventivas que deberían utilizarse en las unidades de hemodiálisis: ¿Aislamiento si o no? ¿en base a qué?
Presentamos un caso de seroconversión al VHC en hemodiálisis, que si bien no aporta grandes novedades desde el punto de vista científico, en nuestra opinión tiene interés por varios motivos. Por un lado por que se trata de una seroconversión excepcionalmente tardía al VHC en un paciente en hemodiálisis, y por otro lado porque ilustra la dificultad cotidiana que existe en aislar de forma adecuada a los pacientes infectados por el VHC apoyando la necesidad de aplicar de forma exhaustiva las precauciones estándar.
CASO CLÍNICO
Varón de 27 años con insuficiencia renal crónica en hemodiálisis secundaria a enfermedad de Alport en programa de hemodiálisis desde marzo de 1996. En diciembre de ese mismo año fue trasplantado con injerto de donante cadáver y presentó como complicación la rotura del polo inferior del injerto y shock hemorrágico secundario, por lo que se realizó trasplantectomía y recibió 16 unidades de concentrado de hematíes. La biopsia renal demostró rechazo vascular agudo grado III y reinició hemodiálisis en enero de 1997.
En la unidad de hemodiálisis existía aislamiento en salas independientes de los pacientes infectados por el VHC de acuerdo con la presencia o no de anticuerpos frente al virus. Durante toda su estancia en hemodiálisis, tanto antes como después del trasplante, el enfermo se dializó en una sala destinada a pacientes con Anticuerpos frente al VHC (Ac-VHC) negativos. No tenía antecedentes de ADVP, tatuajes ni otras cirugías. Los familiares directos del paciente y la pareja eran VHC negativos. El donante no presentaba enfermedad hepática conocida y la determinación de Ac-VHC de este fue negativa.
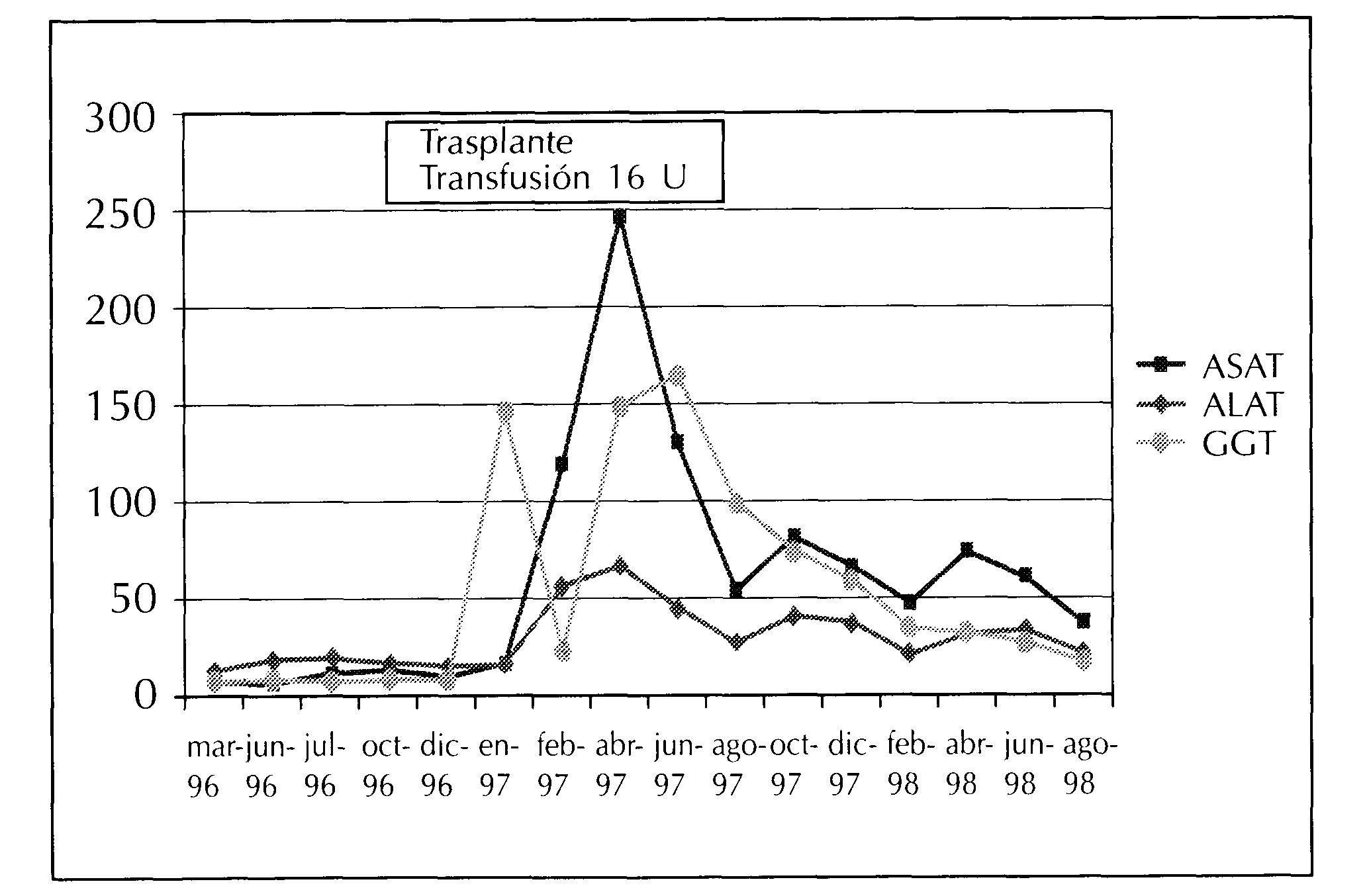
En la etapa previa al trasplante renal las cifras de aminotransferasas fueron persistente normales (AST 15, ALT 8 y GGT 7) con Ac-VHC (ELISA 3 y RIBA 3) medidos cada 2 meses negativos. A su regreso a la unidad tras el trasplante, en enero de 1997, se constató discreta elevación de las aminotransferasas (AST 56, ALT 120, GGT 147 y F Alcalina 138) (figura 1) que se había iniciado durante el postrasplante inmediato. Se determinaron AgHBs, serología para otros virus hepatotropos (CMV, Virus del herpes simple, Virus de Ebstein Barr) y Ac-VHC cada 2 meses, siendo persistentemente negativos hasta abril de 1998 en que presentó seroconversión asociada a PCR-RNA positivo con alta replicación viral (genotipo 3).
En este momento se procedió a su aislamiento en la sala destinada a pacientes con Ac-VHC, se realizó biopsia hepática que demostró infección por VHC y se inició tratamiento con interferón alfa 2 b a dosis de 3 millones de unidades 3 veces a la semana. Seis meses después del inicio del tratamiento la determinación de Ac-VHC seguía siendo positiva y la PCR-RNA se negativizó. Las aminotransferasas se mantuvieron en valores similares a los previos al trasplante. Ningún paciente de los que compartieron sala y monitor con él presentaron elevación de las aminotransferasas, seroconversión al VHC ni positividad de la PCR-RNA.
DISCUSIÓN
La separación en unidades independientes de los pacientes infectados por el VHC sigue siendo objeto de discusión y la realidad es, que aunque los CDC no aconsejan el aislamiento de estos pacientes7, los centros que tienen posibilidad aíslan y su número se ha incrementado en los últimos años8. Aunque el razonamiento en el que se sustentan las prácticas de separación es sustancialmente verdadero «los pacientes separados es más difícil que se contagien», la táctica del aislamiento debe discutirse con más profundidad ya que entraña problemas económicos, logísticos, de organización, y principalmente, es difícil definir en base a qué separar los pacientes.
El caso clínico ilustra la dificultad que existe en aislar adecuada y prontamente a un paciente infectado por el VHC, y demuestra la necesidad de considerar a todos los pacientes en diálisis como potencialmente infecciosos. La aplicación de las precauciones estándar en hemodiálisis ha de hacerse de forma rutinaria con todos los pacientes, por que el diagnóstico de infección por VHC es muchas veces tardío y, en ocasiones existe dificultad en interpretar correctamente los tests diagnósticos disponibles.
El paciente que se presenta mostró una hepatitis C de diagnóstico tardío tras un trasplante renal. Existen tres posibles vías de contagio en este paciente. La vía transfusional, ya que aunque el screening de los productos sanguíneos para el VHC ha disminuido el riesgo de adquisición del VHC a menos de 1 por 3.000 unidades de productos sanguíneos transfundidos9, es un factor de riesgo todavía a tener en cuenta. Otra posibilidad es el contagio durante el trasplante, bien a través del órgano10, aunque el donante presentaba Ac-VHC negativos, o por el mismo acto quirúrgico11. No se puede descartar el contagio previo al trasplante en la unidad de hemodiálisis y su reactivación durante el trasplante aunque parece improbable dado que ningún paciente dializado en la sala de pacientes negativos presentó seroconversión, o su contagio en la misma unidad de agudos en el postrasplante inmediato.
Hemos de considerar que el tiempo de seroconversión al VHC es variable y hay estudios en los que oscila entre O y 20 meses12. En nuestro paciente el diagnóstico de hepatopatía por VHC se realizó 16 meses después de su contagio y a su regreso a hemodiálisis compartió monitor y sala con pacientes negativos. Este intervalo tan prolongado entre la infección por VHC y la detección serológica de este virus en sangre nos hace pensar que aunque los niveles de aminotransferasas se consideren un mal indicador de infección por VHC, sobre todo en los pacientes en diálisis, es un dato a tener en cuenta para extremar las precauciones con esos pacientes y considerarlos potenciales transmisores del VHC, en especial en los pacientes trasplantados, que se encuentran en un estado de inmunosupresión13.
Los test que se utilizan habitualmente para el diagnóstico de infección por el VHC detectan anticuerpos no neutralizantes para antígenos recombinantes de este virus. Los pacientes inmunodeprimidos, como es el caso de los hemodializados y receptores de trasplante, tienen alterada la respuesta de producción frente a antígenos del VHC14, como resultado, la falta de detección de anticuerpos frente al VHC en suero no necesariamente implica la inexistencia de infección por este virus.
Las técnicas diagnósticas actualmente disponibles presentan dos combinaciones de Ac-VHC y RNAVHC que pueden producir dificultad en su interpretación. El RNA del VHC puede no estar presente en el plasma en el momento del test aunque los AcVHC sean positivos. Esta situación puede ser debida a secuestro del VHC en otros lugares distintos a la sangre, como el hígado o las células sanguíneas mononucleares, a la existencia de una viremia intermitente, a que el número de copias de RNAVHC sea inferior a su límite de detección, y a la persistencia de los Ac-VHC incluso después de que el RNA del virus haya desaparecido, representando pacientes que han sido infectados con el virus, pero no recientemente. Por otro lado, aunque más del 90% de los individuos no inmunodeprimidos con infección por VHC tienen Ac-VHC, algunos pacientes son negativos a pesar de tener positivo el RNA-VHC. Esto puede ser consecuencia de que el test para detectar Ac-VHC no sea sensible por presentar un bajo titulo de anticuerpos, que sea un falso positivo de la técnica de la PCR, que el paciente esté en el período ventana entre infección y seroconversión, y varias enfermedades o la inmunosupresión farmacológica pueden suprimir o modificar la respuesta a los anticuerpos. Se ha descrito entre un 2,5 y un 12% de pacientes en hemodiálisis con Ac-VHC negativos y RNA-VHC positivos15 y en receptores de trasplante renal los Ac-VHC fueron detectados con ELISA 1, ELISA 2 y RIBA 2 en el 35%, 75% y 52% respectivamente16.
El paciente durante el tratamiento con interferón negativizó la PCR pero mantuvo los Ac-VHC positivos. La separación de los pacientes se realiza fundamentalmente en base a la presencia de anticuerpos. La determinación de RNA-PCR no es una determinación de rutina en muchos hospitales, y todavía presenta problemas de falsos positivos. Pero ¿qué actitud hay que tener con el paciente tratado con interferón en el que se negativiza la PCR? ¿Se mantiene aislado en la sala de VHC positivos manteniendo la posibilidad de contagio por otras cepas de VHC, o se pasa a la sala de los pacientes VHC negativos. Las dos opciones tienen problemas: el mantenimiento del paciente en la sala de infecciosos hace que la posibilidad de un nuevo contagio sea muy elevada, ya que la prevalencia de infección por VHC en una sala VHC positiva es del 100% y, por otro lado la respuesta al interferón con las dosis habituales se mantiene a largo plazo sólo en el 1025% de los pacientes17, pudiendo pasar a ser de nuevo VHC positivo.
Por tanto, la separación de los pacientes considerados infecciosos para el VHC tiene, por un lado la dificultad de realizar un diagnóstico seguro y precoz, y por otro lado existen cambios de situación en lo que se refiere a infectividad a lo largo del tiempo, según sean o no tratados con interferón o que exista viremia intermitente. Es fundamental la correcta aplicación de las precauciones estándar en cualquier situación y considerar a todos los pacientes dializados como posible contagiosos, estén o no en salas separadas.
Figura 1. Niveles de aminotransferasas y seroconversión al VHC