Antecedentes: No hay suficiente evidencia sobre la frecuencia de rechazo agudo y la función del injerto en los pacientes con retiro temprano de esteroides (RTE). El objetivo del presente estudio es comparar el efecto del RTE sobre la tasa de filtrado glomerular (TFG), la supervivencia/rechazo del injerto en receptores de una cohorte de tratados con tacrolimus/mofetil micofenolato, comparada con un grupo control. Material y métodos: Cohorte retrospectiva en 60 receptores de bajo riesgo inmunológico entre diciembre de 2005 y julio de 2010. Cohorte del estudio (C-RTE; N = 32), el RTE se hizo el 5º día mientras recibían tacrolimus/mofetil micofenolato. La cohorte control (C-C, N = 28) recibió prednisona/tacrolimus/mofetil micofenolato. Las variables clínicas, bioquímicas e histológicas fueron evaluadas al inicio del estudio, y a los 3, 6 y 12 meses de seguimiento. Se utilizó Kaplan-Meier y el modelo de riesgos proporcionales de Cox para evaluar la supervivencia. Las comparaciones entre cohortes fueron hechas por la t de Student y c2. Resultados: Durante el seguimiento, la C-C muestra presión sanguínea significativamente mayor tanto sistólica (125 ± 10 frente a 114 ± 8) como diastólica (81 ± 8 frente a 72 ± 7), glucosa sérica (96 ± 13 frente a 86 ± 10), triglicéridos (177 ± 61 frente a 129 ± 34), colesterol total (183 ± 43 frente a 148 ± 34) y colesterol LDL (100 ± 22 frente a 87 ± 25). La C-C presentó una mayor proporción de uso de antihipertensivos (57 frente a 13 %) y de estatinas (27 frente a 9 %). La TFGe fue mejor en la C-RTE que en la C-C (85,4 ± 20,6 frente a 70,6 ± 17,0, p = 0,004). La frecuencia de rechazo agudo fue menor en la C-RTE. Conclusiones: La supervivencia del injerto, la TFG, la tasa de rechazo agudo y el perfil metabólico fueron mejores en la C-RTE que en la C-C.
Background: Acute rejection and graft function have not been completely clarified in early-steroid-withdrawal (ESW) patients. The objective of this study was to compare the effect of early steroid withdrawal on GFR, graft survival/rejection in recipients in a cohort treated with tacrolimus/mycophenolate mofetil compared to a control cohort. Material and method: Retrospective cohort, in 60 low immunological risk recipients between December 2005 and July 2010. Study cohort (ESW-C N=32), steroid withdrawal was carried out after 5 days, while they were receiving tacrolimus/mycophenolate mofetil. The control cohort (C-C, N=28) received prednisone/tacrolimus/mycophenolate mofetil. Clinical, biochemical and histological variables were assessed at baseline and after 3, 6, and 12 months of follow-up. Kaplan-Meier and the Cox proportional hazards model were used to assess survival. Comparisons between cohorts were carried out by the Student’s t and c2 tests. Results: At follow-up, C-C displayed significantly higher systolic (125±10 vs. 114±8) and diastolic (81±8 vs. 72±7) blood pressure, serum glucose (96±13 vs. 86±10), triglycerides (177±61 vs. 129±34), total (183±43 vs. 148±34) and LDL-cholesterol (100±22 vs. 87±25). C-C had a higher proportion of antihypertensive (57 vs. 13%), and statins (27 vs. 9%) use. eGFR was better in ESW-C than in C-C (85.4±20.6 vs. 70.6±17.0, p=.004). AR frequency was lower in ESW-C. Conclusions: Graft survival, GFR, AR rate and metabolic profile were better in the ESW-C than in C-C.
INTRODUCCIÓN
Uno de los grandes retos en el manejo del trasplante renal es el rechazo agudo (RA) y con los nuevos esquemas de inmunosupresión la frecuencia de RA se ha reducido en las últimas décadas, además de observarse mejoría significativa a largo plazo en la supervivencia del injerto y del paciente1,2. En México, la supervivencia del injerto y del paciente es comparable a la reportada en otros países3,4. Sin embargo, aún prevalece una considerable pérdida de injertos renales por muerte del paciente con injerto funcional (hasta 40 %)5, donde destaca la enfermedad cardiovascular como la causa principal de mortalidad, y desafortunadamente los corticosteroides (como base de la inmunosupresión postrasplante) han sido directamente asociados como uno de los factores de riesgo cardiovascular más importantes6,7.
La prevalencia de diabetes mellitus, obesidad y síndrome metabólico en la población general es cada vez mayor8,9, y el riesgo de desarrollarlas después del trasplante con el uso de corticosteroides podría ser mayor y con ello incrementar la morbi-mortalidad. De hecho, el uso de estos fármacos está asociado con diabetes de novo después del trasplante renal10. Una estrategia encaminada a reducir estas comorbilidades es evitar el uso o el retiro de los corticosteroides (ya sea tardío o temprano) después del trasplante, siempre y cuando el riesgo de RA y la supervivencia del injerto no se comprometan; sin embargo, los resultados en este sentido han sido controversiales11-13.
Nuestra población y probablemente algunas otras tienen mayor riesgo para el desarrollo de diabetes mellitus y otras complicaciones después del trasplante renal, por lo que son necesarias estrategias para evitar o reducir los factores de riesgo en este tipo de pacientes. Por lo tanto, el objetivo de este estudio fue comparar el efecto del retiro temprano de esteroides (RTE) sobre la tasa de filtrado glomerular estimada (TFGe), la supervivencia del injerto, la frecuencia de RA, así como el perfil metabólico en una cohorte de trasplante renal (C-RTE) tratada con tacrolimus (TAC) y mofetil micofenolato (MMF), en comparación con un grupo control (C-C) tratado con el triple esquema inmunosupresor recomendado internacionalmente (TAC, MMF y PDN).
MATERIAL Y MÉTODOS
Se realizó una cohorte retrospectiva en 32 receptores de injerto renal a quienes se les retiraron los corticosteroides, en el Hospital de Especialidades, CMNO, IMSS, trasplantados entre diciembre de 2005 y julio de 2009, que fueron seguidos hasta julio de 2010. Durante el período de estudio se realizaron un total de 989 trasplantes de riñón (48 de donante fallecido), en su mayoría de donante vivo relacionado. La mayoría de los pacientes seleccionados fueron de donación viva (58/60) y todos con riesgo inmunológico bajo (panel reactivo de anticuerpos contra el HLA clase I y II < 30 %). El RTE es una intervención que se realiza con poca frecuencia en nuestro hospital y la decisión de retirarlos fue tomada por el médico nefrólogo de acuerdo con las características del paciente y su experiencia. Fueron incluidos todos los pacientes a quienes se les retiró el corticosteroide durante este período (C-RTE); la C-C fue formada con receptores que habían compartido el tiempo de trasplante, el esquema de inmunosupresión y el riesgo inmunológico. Los pacientes con antecedentes de uso de corticoides pretrasplante, diabetes mellitus, función retardada del injerto (aquellos requirientes de tratamiento sustitutivo de la función renal en el postrasplante inmediato) y trasplante de órganos múltiple fueron excluidos.
Todos recibieron el mismo esquema de inmunosupresión de inducción habitual de nuestro hospital basado en: TAC 0,18 mg/kg/día (dividido en dos dosis), MMF 2 g/día (dividido en dos dosis), metilprednisolona intravenosa (MPD) 500 mg (transquirúrgica) y 20 mg de basiliximab en el transquirúrgico y al cuarto día después del trasplante. La terapia de mantenimiento oral fue con MMF 2 g/día y TAC 0,15 mg/kg/día, con ajuste de acuerdo a los niveles séricos (9-15 ng/ml en los primeros 30 días y 8-10 ng/ml durante el seguimiento).
El RTE fue de la siguiente manera: un día antes y durante el trasplante (transquirúrgico), los pacientes recibieron MPD 500 mg/día, seguido de 250, 125, 60 y 30 mg/día en los días 1, 2, 3 y 4, respectivamente. El retiro total de esteroides se realizó al quinto día postrasplante. La C-C recibió inmunosupresión de mantenimiento con prednisona, de acuerdo a las recomendaciones internacionales, asociada al uso de TAC y MMF.
Las siguientes variables clínicas y bioquímicas se obtuvieron de los registros médicos en la etapa pretrasplante: edad, sexo, antecedentes familiares de diabetes mellitus, antecedente personal de embarazo (mujeres), causa de la enfermedad renal, tipo y tiempo de terapia de reemplazo renal, peso, talla, presión arterial, glucosa, colesterol total, colesterol ligado a lipoproteínas de alta densidad (HDL) y colesterol ligado a lipoproteínas de baja densidad (LDL), triglicéridos, antígenos del HLA, riesgo para infección por citomegalovirus (CMV), tiempo de isquemia y uso de fármacos antihipertensivos y/o estatinas.
Todas las evaluaciones fueron a los 3, 6, 12 meses, y posteriormente cada año en el período postrasplante, y se recabó información como: tiempo de trasplante, dosis de mantenimiento de inmunosupresores, episodios de RA, tipo y dosis de la terapia antirrechazo (MPD o anticuerpos policlonales), medicamentos (antihipertensivos, estatinas, hipoglucemiantes). La clasificación de riesgo para infección por CMV se hizo de acuerdo con el resultado serológico de ELISA para CMV (IgG): riesgo alto: donador positivo/receptor negativo; riesgo intermedio: donador positivo/receptor positivo; riesgo bajo: donador negativo/receptor negativo14,15.
La TFGe fue mediante la fórmula MDRD-416 (MDRD [ml/min/1,73 m2] = 186x [creatinina/88,4]-1,154 x edad-0,203 x 0,742 si es mujer). Se registraron los resultados de biopsias protocolizadas (que son realizadas en todos los pacientes desde hace diez años de manera ordinaria en nuestro hospital a los 3, 6 y 12 meses postrasplante); además, se registraron biopsias indicadas (ya sea por disfunción renal o proteinuria) y todas las biopsias fueron evaluadas por el mismo nefropatólogo utilizando la clasificación histopatológica de Banff17. El estudio fue evaluado y aprobado por el Comité Local de Investigación y Ética.
Análisis estadístico
Los datos se muestran como media ± desviación estándar o números y porcentajes. La t de Student y pruebas de χ2 se utilizaron para las comparaciones entre los grupos. La supervivencia del injerto se evaluó mediante Kaplan-Meier y las comparaciones se realizaron mediante la prueba de Log-rank. El modelo de riesgo proporcional de Cox se utilizó para evaluar la influencia de la abstinencia de los esteroides en el inicio del RA. Los análisis estadísticos se realizaron con el software SPSSä, versión 17 (SPSS, Inc., Chicago, IL).
RESULTADOS
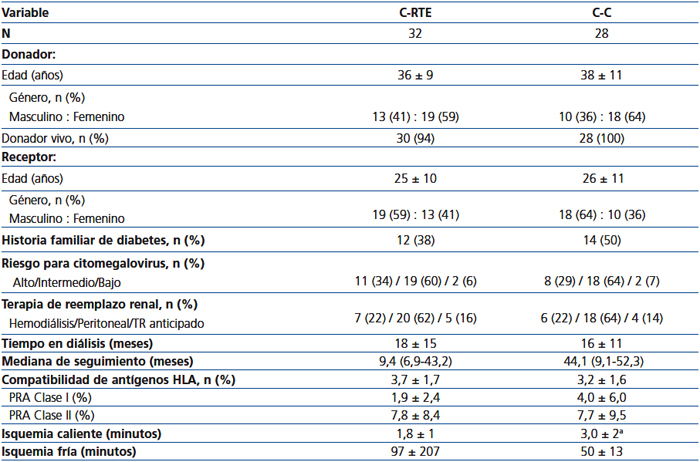
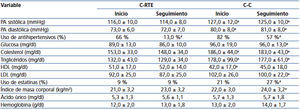
Las características demográficas y del trasplante se muestran en la tabla 1. No se encontraron diferencias entre los grupos en cuanto a la edad y el género del donante y del receptor, el tipo de donante, la historia de diabetes, el riesgo para CMV, la fecha y el tipo de diálisis, y la compatibilidad en el HLA. Dos injertos procedían de donante fallecido en la C-RTE y el resto de los injertos procedían de donante vivo. La isquemia caliente fue más corta en la C-RTE, mientras que la C-C tuvo un seguimiento más prolongado.
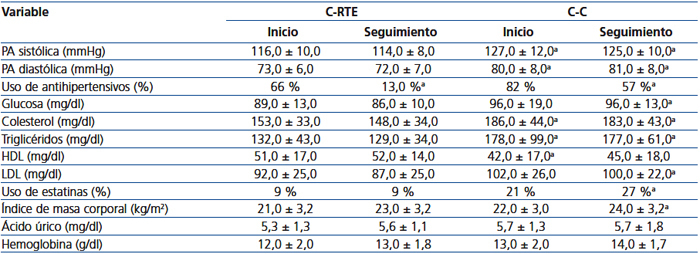
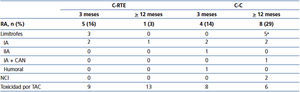
Las comparaciones clínicas y bioquímicas al inicio del estudio y el seguimiento se muestran en la tabla 2. Al inicio del estudio, los pacientes de la C-RTE tenían una presión sanguínea significativamente más baja, colesterol total y triglicéridos bajos y aumento de las concentraciones de HDL, comparados con los controles, aunque el porcentaje de pacientes que usaron antihipertensivos y estatinas no fue significativamente diferente. Al final del seguimiento, los pacientes en la C-C mantienen una mayor presión sanguínea, glucosa, triglicéridos, colesterol total y LDL, y un mayor porcentaje de empleo de estatinas que los de la C-RTE. Un solo paciente al final del seguimiento desarrolló DMPT y correspondió a la C-C.
Curiosamente, el porcentaje de pacientes que usaron fármacos antihipertensivos disminuyó significativamente en la C-RTE del 66 % al 13 % al final del estudio, que fue significativamente menor que el porcentaje de uso en la C-C.
Función del injerto y rechazo agudo
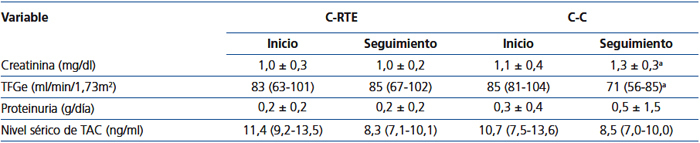
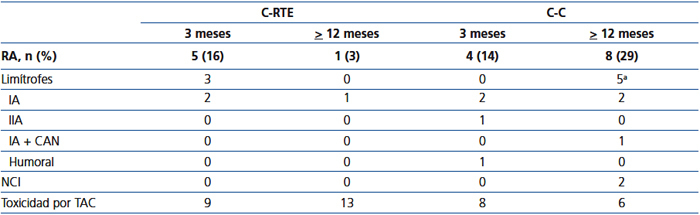
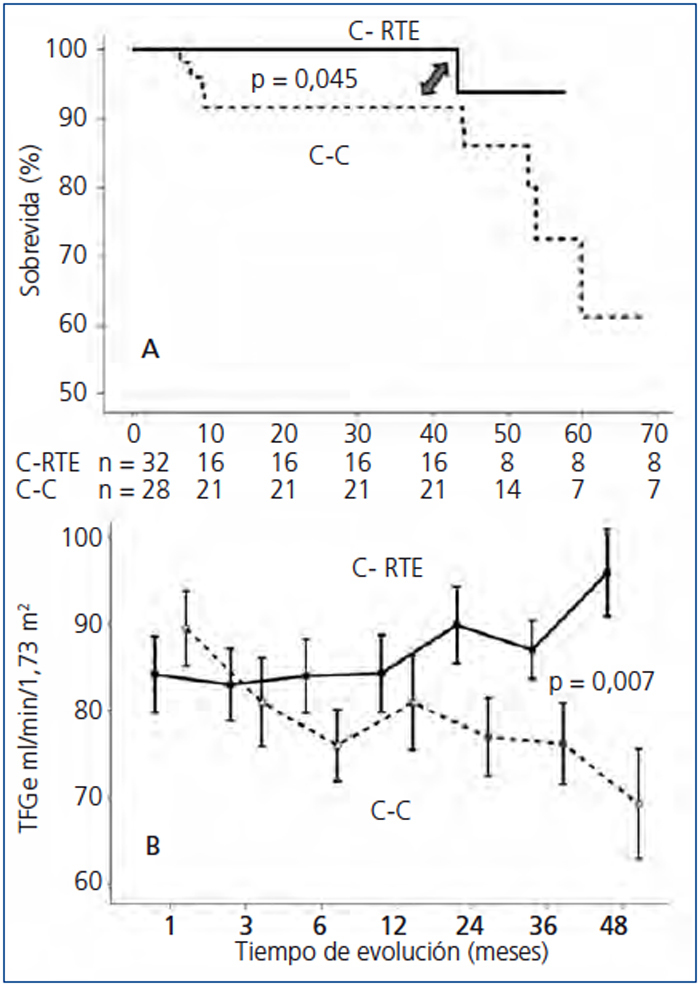
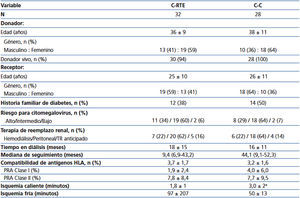
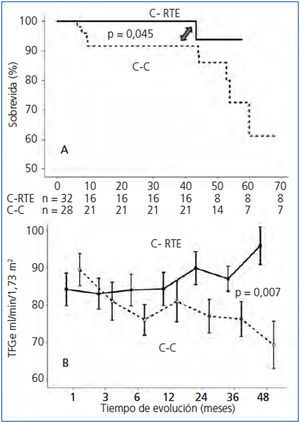
La supervivencia del injerto (definida como la pérdida de la TFG ≥ 30 %) se muestra en la figura 1 A. Los pacientes de la C-RTE tuvieron una función renal significativamente mejor en comparación con los controles (p = 0,04). Al comparar la función renal (medida por creatinina sérica o TFGe), no hubo diferencias entre las cohortes en la evaluación basal; sin embargo, al final del seguimiento los pacientes en la C-RTE tuvieron una mejor función del injerto (figura 1 B y tabla 3). En cuanto a los resultados histopatológicos (# biopsias indicadas por cada cohorte), hubo 9 casos (15 %) de RA en los primeros 3 meses y 9 casos (30 %) al final del seguimiento (tabla 4). La incidencia acumulada de RA fue significativamente menor (p = 0,04) en la C-RTE (19 %) en comparación con la C-C (43 %). El modelo de riesgo de Cox se realizó para evaluar los posibles factores que predijeron RA, como variables independientes incluidas en el esquema de inmunosupresión (RTE 1, control 0), antígenos del HLA, edad, género y colesterol sérico. Sin embargo, ninguna de estas variables fue predictora independiente significativa de RA (modelo c2 2,63, p = 0,76).
La tabla 4 muestra los resultados histopatológicos de las biopsias renales. Nueve episodios de RA fueron encontrados en biopsias protocolizadas realizadas dentro de los 3 primeros meses después del trasplante; de los pacientes en la C-RTE, 3 tuvieron RA limítrofe y 2 Banff IA, mientras que los controles tuvieron 2 RA IA de Banff, 1 IIA de Banff y 1 RA humoral. En las biopsias realizadas entre los 9-12 meses (ya sean protocolizadas o indicadas), de los pacientes en la C-RTE, 1 tuvo un RA IA de Banff, mientras que de los de la C-C 5 tuvieron RA limítrofe y 3 IA. Estos últimos hallazgos fueron significativamente diferentes entre las cohortes (p = 0,006). Tres pacientes de la C-C tuvieron vasculopatía crónica del injerto en las biopsias realizadas después de 1 año de seguimiento. Por otro lado, la toxicidad por TAC se encontró en 23 pacientes (36 eventos de toxicidad): 14 pacientes (61 %) de la C-RTE y 9 casos (39 %) de la C-C (p = 0,21). De ellos, 10 pacientes (4 de la C-RTE/6 de la C-C) fueron cambiados a sirolimus y el IFG entre estos dos grupos no fue diferente (72,31 ± 22,80, 74,37 ± 19,75, p = 0,82), y tampoco ninguno de ellos presentó RA.
A pesar de la mayor frecuencia de toxicidad por TAC (confirmada por biopsia) en la C-RTE, los niveles del fármaco en sangre no fueron significativamente diferentes entre las cohortes y estuvieron dentro del rango terapéutico en todos los casos (tabla 3).
DISCUSIÓN
Los corticosteroides en la actualidad son utilizados en la mayoría de los centros de trasplante renal en todo el mundo. No obstante, hay una tendencia creciente a evitar su uso debido a sus efectos secundarios y al impacto negativo en la supervivencia del injerto y del paciente, incluso a dosis bajas18-20. Resultados de diversos estudios han sido controversiales con el retiro de esteroides, probablemente relacionados con la heterogeneidad de los diferentes protocolos de inmunosupresión utilizados, basados en ciclosporina, TAC, azatioprina, MMF, rapamicina o everolimus12,21, con o sin anticuerpos (monoclonales o policlonales)13,22-24. En población latinoamericana no hay datos disponibles con esta intervención, sobre todo con esquemas homogéneos de inmunosupresión basados en TAC y MMF. Hoy en día existe un riesgo documentado mayor en el desarrollo de obesidad y diabetes en diversas poblaciones8,9 que podría exacerbarse después del trasplante renal (y los corticoesteroides podrían ser un importante factor de riesgo). En nuestro medio, un mayor riesgo de diabetes denovo después del trasplante fue asociado con el uso de corticosteroides10; por lo tanto, intervenciones médicas como el RTE pueden resultar beneficiosas en receptores de trasplante. Evidentemente, esta intervención no tiene que incrementar el riesgo de RA o deteriorar la función renal. En un principio, solo los pacientes con riesgo inmunológico bajo e idealmente usando potentes fármacos inmunosupresores serían los candidatos al retiro de esteroides.
Nosotros incluimos pacientes que cumplieron con estos requisitos y nuestros resultados fueron similares a los de otros estudios realizados en condiciones similares25. Una de las principales preocupaciones con el retiro de corticoesteroides es el mayor riesgo de RA. Los resultados de algunos estudios que han reportado alta tasa13 de RA son cuestionables, ya que un número significativo de ellos no realizaron biopsia renal (estándar de oro) y ni siquiera describen la metodología para el diagnóstico del RA, lo que podría explicar los resultados de una mayor tasa de RA. En el presente estudio se documentó RA con biopsias protocolizadas o indicadas, por lo que tanto rechazos subclínicos como clínicos fueron identificados. Nuestros resultados con RTE no predijeron el desarrollo de RA y la incidencia de RA durante el primer año fue consistente con lo reportado por otros centros26. La mayoría de los episodios finales de RA fueron documentados en biopsias realizadas por un aumento de creatinina sérica, y fueron más frecuentes en la C-C (29 %) en comparación con la C-RTE (3 %). Una posible explicación de este resultado es que la C-RTE presentó mayor toxicidad por TAC documentada histopatológicamente frente a la C-C, a pesar de que los pacientes en la C-RTE recibieron dosis más baja de TAC (datos no mostrados). Desde el punto de vista farmacológico, los corticoesteroides son un estimulante inductor del citocromo P450 (isoenzima CYA4), que es responsable de la biotransformación del TAC, y ante el RTE se favorece una mayor biodisponibilidad del TAC, lo que podría explicar por qué pacientes con RTE tuvieron una mayor toxicidad por TAC y menor tasa de RA27,28. En la C-C la TFGe fue menor en comparación con la C-RTE y su posible explicación podría ser la mayor tasa de RA observada en este grupo durante su seguimiento. El retiro de esteroides potencialmente podría mejorar el perfil hemodinámico y metabólico. González-Molina et al.29 evaluaron de manera retrospectiva 923 receptores renales (donante fallecido) con retiro de esteroides y encontraron menor presión arterial, colesterol total y triglicéridos. En el presente estudio, ambos grupos tenían un control adecuado de la presión arterial y los lípidos séricos; sin embargo, la C-RTE logró tal control con el empleo de una menor dosis y frecuencia de uso de fármacos, resultados consistentes con otros estudios13. Estos resultados han sido motivo de continuar el estudio de esta intervención en nuestra población a través de ensayos clínicos para probar estos hallazgos.
CONCLUSIÓN
En pacientes con riesgo inmunológico bajo, con un esquema de inmunosupresión basado en TAC y MMF, el RTE no modifica la supervivencia del injerto, la función renal y la tasa de RA en esta cohorte. La toxicidad por TAC (confirmada por biopsia) tiene tendencia a ser más frecuente en la C-RTE que en los controles y su causa merece una mayor investigación. Los pacientes de la C-RTE tuvieron un menor requerimiento de antihipertensivos e hipolipemiantes en comparación con la C-C, lo que sugiere un mejor perfil metabólico. Nuestros hallazgos requieren más ensayos clínicos en poblaciones homogéneas para evitar la controversia con este tipo de intervención.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Tabla 1. Características demográficas y trasplante.
Tabla 2. Comparaciones clínicas y bioquímicas entre las cohortes al inicio y al final del seguimiento.
Tabla 3. Comparación de la función renal entre las cohortes al inicio y final del seguimiento.
Tabla 4. Hallazgos histopatológicos en biopsias renales realizadas a los 3 o &
Figura 1. Comparación de la sobrevida de acuerdo a la cohorte de estudio; B. Comparación de la función renal en cada una de las cohortes