Introducción: La resistencia a la insulina (RI) es una alteración prevalente en los pacientes con enfermedad renal crónica (ERC). Su relación con la morbilidad cardiovascular (CV) y la mortalidad en la ERC ha sido poco estudiada. Objetivos: Los objetivos de este estudio fueron determinar la relación de la RI con la progresión de la ERC, el desarrollo de nuevos eventos CV y la mortalidad por cualquier causa en pacientes con ERC prediálisis. Material y métodos: Estudio de cohorte prospectivo observacional en el que se incluyeron 365 pacientes no diabéticos (63 ± 16 años, 169 mujeres) con un filtrado glomerular <30 ml/min. El grado de RI fue estimado mediante el parámetro «Homeostasis Model Assessment» (HOMA). Los sucesos evolutivos analizados fueron: progresión de ERC (entrada en diálisis o duplicar creatinina sérica inicial), desarrollo de nuevos procesos CV, o la mortalidad por cualquier causa. Resultados: Los pacientes con valores HOMA en el tercil inferior (<3,13) mostraron una progresión más lenta de la ERC en un modelo de regresión de Cox ajustado a edad, sexo, filtrado glomerular basal, índice de masa corporal y proteinuria, (razón de riesgo = 0,72; p = 0,03). Durante el período total de seguimiento 51 pacientes desarrollaron nuevos eventos CV y 103 fallecieron. Los valores HOMA no se relacionaron con el desarrollo de nuevos eventos CV ni con la mortalidad en modelos no ajustados o ajustados a edad, sexo, índice de comorbilidad, albúmina sérica y proteína C reactiva. Conclusiones: En conclusión, la progresión de la ERC fue más lenta en pacientes con los valores HOMA más bajos, aunque este parámetro no fue capaz de predecir el desarrollo de nuevos eventos cardiovasculares o la mortalidad.
Introduction: Insulin resistance (IR) is a prevalent disorder in patients with chronic kidney disease (CKD). Little research has been done on how it is linked to cardiovascular (CV) morbidity and mortality in CKD. Objectives: The aims of this study were to determine the links between IR and the progression of CKD, the development of new CV events and all-cause mortality in CKD patients prior to dialysis. Material and Methods: Prospective, observational, cohort study including 365 non-diabetic patients (63±16 years, 169 female patients) with a glomerular filtration rate of <30 ml/min. The degree of IR was estimated by means of the Homeostasis Model Assessment (HOMA) parameter. The following event outcomes were analyzed: progression of CKD (initiation of dialysis or doubling of initial serum creatinine levels), development of new CV processes and all-cause mortality. Results: Patients with HOMA values within the lower tercile (<3.13) showed slower CKD progression, based on a Cox regression model adjusted for age, sex, baseline glomerular filtration rate, body mass index and proteinuria (hazard ratio=0.72; p=0.03). During the total follow-up period 51 patients experienced new CV events and 103 died. The HOMA values did not correlate with the development of new CV events or mortality in either unadjusted models or models adjusted for age, sex, comorbidity index, serum albumin or C-reactive protein. Conclusions: CKD progression was slower in patients with lower HOMA values, although this parameter failed to predict the development of new cardiovascular events or mortality.
INTRODUCCIÓN
La resistencia a la insulina (RI), caracterizada por un déficit funcional de esta hormona a pesar de niveles plasmáticos elevados, conduce a una serie de alteraciones en la composición de los lípidos plasmáticos, coagulación, función endotelial, resistencias vasculares, cambios endocrinos y obesidad, que en conjunto incrementan el riesgo de desarrollo de hipertensión arterial y aterosclerosis acelerada1-4. Este aumento del riesgo cardiovascular asociado con la RI ha sido demostrado en la población general1-4.
Una alta proporción de pacientes con enfermedad renal crónica (ERC) muestran datos bioquímicos compatibles con RI5-8, incluso en los estadios más tempranos de insuficiencia renal. Aunque esta alteración metabólica asociada a la uremia fue descrita por primera vez en los años ochenta por DeFronzo y Alvestrand9,10, sus mecanismos fisiopatológicos no son todavía bien conocidos.
Los pacientes con ERC tienen un riesgo muy elevado de desarrollo de enfermedades cardiovasculares (CV)11,12, y la asociación de estos procesos con los factores tradicionales de riesgo CV es peculiar13. No existen muchos estudios sobre el papel que desempeña la RI en el desarrollo de enfermedad CV y mortalidad en la población con ERC7,14-16.
Los objetivos de este estudio fueron determinar la prevalencia y las características clínicas y bioquímicas asociadas a la RI en una población de pacientes con ERC avanzada prediálisis, y establecer el valor pronóstico de la RI en la progresión de la ERC, el desarrollo de nuevos procesos CV y la mortalidad por cualquier causa.
MATERIAL Y MÉTODOS
Pacientes
Se incluyeron 365 pacientes (edad media 63 ± 16 años, 169 mujeres) con enfermedad renal crónica estadio 4-5, seguidos en la consulta de enfermedad renal crónica avanzada (ERCA). Los criterios de inclusión fueron: edad superior a 18 años, no haber sido diagnosticado de diabetes mellitus, presentar una glucemia basal en ayunas inferior a 126 mg/dl, presentar un estado clínico estable sin enfermedad intercurrente aguda en el momento del estudio basal y no estar en tratamiento con corticoides u otros medicamentos con acción «contra-insular» significativa.
La etiología de la insuficiencia renal fue: no filiada (154 pacientes), glomerulonefritis primarias (76 pacientes), nefritis intersticial crónica (66 pacientes), poliquistosis (31 pacientes), nefropatía isquémica (30 pacientes), y otras etiologías (8 pacientes).
Aunque ninguno de los pacientes incluidos padecía diabetes mellitus, sí fueron frecuentes otras procesos comórbidos: 41 pacientes tenían historia previa de cardiopatía isquémica, 55 de insuficiencia cardíaca, 61 de enfermedad vascular cerebral o periférica, 23 de enfermedad maligna, 40 de enfermedad pulmonar obstructiva crónica, y 19 pacientes tenían otras comorbilidades significativas.
Los fármacos prescritos con más frecuencia fueron antihipertensivos (inhibidores de la enzima de conversión, bloqueadores de los receptores de la angiotensina, betabloqueantes), diuréticos, estatinas, antiagregantes y quelantes del fósforo.
Datos clínicos y análisis de laboratorio
Además de los datos demográficos, se incluyeron las mediciones de la presión arterial sistólica y diastólica, y el índice de masa corporal. El grado de comorbilidad fue cuantificado por el método de Davies et al.17. Por su potencial relación con la resistencia a la insulina, también se incluyeron como variables la toma habitual de fármacos tales como betabloqueantes, diuréticos, e inhibidores de la enzima de conversión de la angiotensina (IECA) y/o antagonistas de los receptores de la angiotensina(ARA).
Se extrajo sangre a los pacientes tras un ayuno prolongado (al menos 8 horas) para determinación de los siguientes parámetros: hemograma, glucosa, urea, creatinina, úrico, calcio, fósforo, colesterol total, triglicéridos, albúmina (Multianalizador Advia Chemistry, Siemens Healthcare Diagnostics) y bicarbonato venoso (ABL 800 FLEX analyzer). La concentración plasmática de proteína C reactiva de alta sensibilidad fue determinada mediante nefelometría (N High Sensitivity CRP, Behring, Marburg, Alemania). Las concentraciones plasmáticas de PTH se determinaron mediante IRMA (1-84 N-tact PTH IRMA Diasorin).
El filtrado glomerular se estimó mediante la fórmula MDRD-4. La tasa de catabolismo proteico (PNPNA) se calculó a través de la excreción del nitrógeno ureico mediante las fórmulas combinadas de Cottini et al. y Maroni et al., según la descripción de Bergström et al.18. El PNPNA fue corregido al peso real del paciente.
Las concentraciones plasmáticas de insulina se determinaron mediante ensayo inmunométrico con dos sitios de unión, quimioluminiscente en fase sólida (Immulite® 2000 Immunoassay System Siemens Healthcare Diagnostics). Los coeficientes de variación intraensayo y total fueron del 6,1 y del 7,1%, respectivamente.
Para establecer el grado de resistencia a la insulina se utilizó el parámetro Homeostasis Model Assessment Insulin Resistance (HOMA)19, cuya utilidad y fiabilidad han sido validadas en pacientes con insuficiencia renal crónica20. Este parámetro se calcula mediante la fórmula: insulina en ayunas (µU/ml) x glucosa en ayunas (mmol/l)/22,5.
Diseño del estudio y análisis estadístico
Este estudio se divide en dos partes, una primera consistente en un análisis transversal en el que se describen las características clínicas y analíticas asociadas al grado de resistencia a la insulina y una segunda, en la que a través de un análisis prospectivo se intenta establecer el valor pronóstico del parámetro HOMA sobre tres sucesos evolutivos: a) progresión de la ERC, definida como comienzo de diálisis o duplicar la creatinina sérica basal; b) desarrollo de nuevos procesos cardiovasculares agudos severos (infarto de miocardio, angina inestable, necesidad de intervención coronaria, accidentes cerebrovasculares transitorios o establecidos, o isquemia severa de miembros inferiores), y c) muerte por cualquier causa.
Los pacientes fueron seguidos tras la evaluación inicial con visitas regulares cada 1-3 meses mientras continuaron en consulta ERCA, o a través de la comunicación de cualquier cambio evolutivo después del inicio de diálisis, siendo censurados en caso de muerte por cualquier causa, trasplante renal, pérdida de seguimiento (16 pacientes), o finalización del período de estudio (1 de noviembre 2008). La fecha de censura que se tomó en los pacientes perdidos fue la de la última consulta.
La mediana de seguimiento hasta el comienzo de diálisis fue de 542 días (rangos intercuartiles: 221–922 días), y la mediana de seguimiento hasta el fallecimiento o censura fue de 1103 días (rangos intercuartiles: 643–1.707 días).
La comparación de variables continuas entre grupos se realizó mediante análisis de la varianza (ANOVA) o test de Kruskal-Wallis, según las características de distribución de las variables. Las comparaciones post hoc fueron realizadas mediante el test de Scheffe. Para la comparación de dos variables continuas independientes se utilizó el test de la t de Student para muestras no apareadas, o el test no paramétrico de Mann-Whitney según las características de distribución de las variables. Para la comparación de variables discretas se utilizó el test de la chi-cuadrado.
Para analizar las variables que mejor se asociaban al parámetro HOMA (variable continua), se utilizaron modelos de regresión lineal multivariable, con elección de covariables de forma automática mediante el proceso de eliminación condicional (hacia atrás).
Para establecer si existía una asociación independiente entre el parámetro HOMA y los sucesos evolutivos de estudio se utilizaron modelos multivariables de riesgo proporcional de Cox, y se determinaron los riesgos relativos e intervalos de confianza del 95%. El parámetro HOMA fue analizado tanto de forma continua como de forma discreta (terciles).
Los modelos fueron ajustados con la introducción de variables o factores de riesgo con influencia potencial sobre los sucesos finales de estudio (edad, sexo, índice de comorbilidad, albúmina plasmática, proteína C reactiva, función renal residual, proteinuria, etc.). La elección de las variables que mejor ajustaron los modelos se realizó de forma automática mediante el proceso de eliminación progresiva condicional.
Para confirmar la proporcionalidad de riesgo en todos los estudios de supervivencia se examinaron los gráficos resultantes de correlacionar el logaritmo (-logaritmo de la tasa de supervivencia) con el logaritmo del tiempo de supervivencia, así como los gráficos de los residuos parciales de cada covariable frente al tiempo de supervivencia.
El porcentaje de datos ausentes fue menor del 1% en todas las variables. Las variables cuantitativas perdidas fueron repuestas con el valor de la medía aritmética del resto de los datos presentes.
Los datos de este estudio se presentan como media y desviación estándar (± DE), o como mediana y rangos intercuartiles o valor mínimo-máximo. Una p <0,05 fue considerada como estadísticamente significativa. El análisis estadístico y los gráficos se realizaron con el programa SPSS versión 15.0 (SPSS, Chicago, EE.UU.).
RESULTADOS
Características clínicas asociadas a la resistencia a la insulina
Los niveles medios de insulina y del parámetro HOMA en el grupo de estudio fueron: 17,31 ± 7,54 mU/ml y 4,28 ± 2,07 mU/ml x mmol/l, respectivamente.
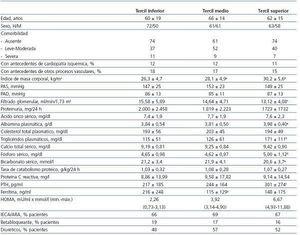
En la tabla 1 se exponen las características clínicas y bioquímicas de los pacientes agrupados por terciles de la frecuencia de distribución del parámetro HOMA. No se observaron diferencias significativas en la edad, sexo, índice de comorbilidad, porcentaje de pacientes con cardiopatía isquémica y proteinuria. Los pacientes en el tercil superior tenían un filtrado glomerular significativamente inferior al de los del tercil inferior. Los pacientes en los terciles superiores de HOMA tenían un índice de masa corporal más elevado que los del tercil inferior. Aunque no se observaron diferencias en las concentraciones de colesterol plasmático total, los pacientes en el tercil superior HOMA mostraron unos niveles de triglicéridos significativamente superiores al de los del resto de los terciles. Los niveles de fósforo sérico también fueron más elevados en los pacientes del tercil superior que en los del resto de los terciles.
Otras diferencias significativas entre terciles se observaron con la albúmina plasmática, bicarbonato y PTH (tabla 1).
Los niveles de proteína C reactiva fueron similares, y no existían diferencias significativas en los fármacos prescritos en los tres subgrupos (tabla 1).
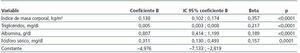
Mediante regresión lineal múltiple, las variables que entraron a formar parte de la mejor ecuación predictiva para los valores HOMA fueron: el índice de masa corporal, los triglicéridos, la albúmina plasmática y los niveles de fósforo sérico (tabla 2).
Relación entre resistencia a la insulina y progresión de la ERC
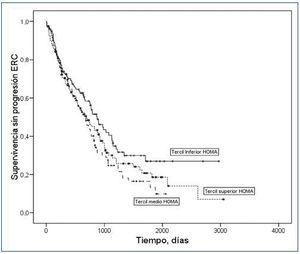
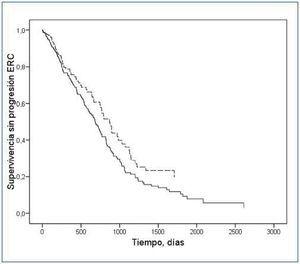
Durante el período de seguimiento, 234 pacientes (64%) cumplieron el criterio de progresión de la ERC (6 pacientes duplicaron la creatinina sérica inicial, y 228 comenzaron diálisis). Mediante análisis de supervivencia de Kaplan-Meier (figura 1) se observó que sólo los pacientes en el tercil inferior HOMA mostraban una supervivencia más prolongada sin los criterios de progresión de la ERC (tercil inferior frente al resto de los pacientes: log rank = 4,19; p = 0,04).
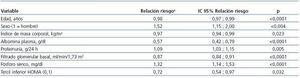
En el análisis de regresión de Cox, ajustado a variables potencialmente relacionadas con la progresión de la ERC (edad, sexo, índice de masa corporal, presión arterial sistólica y diastólica, filtrado glomerular basal, proteinuria, hemoglobina, albúmina, fósforo, bicarbonato, diabetes, y tratamiento antiangiotensina, antagonistas del calcio y diuréticos), presentar un HOMA en el tercil inferior seguía asociándose de forma significativa con una progresión más lenta de la ERC (tabla 3 y figura 2).
Relación entre resistencia a la insulina y desarrollo de nuevos episodios de enfermedad cardiovascular o mortalidad
Durante el período de seguimiento, 51 pacientes presentaron un nuevo episodio cardiovascular y 104 fallecieron por cualquier causa. Mediante curvas de supervivencia de Kaplan-Meier, no se observó una relación significativa entre los terciles de HOMA y el desarrollo de nuevos episodios CV (log rank = 0,117; NS), ni con la mortalidad por cualquier causa (log rank = 2,64; p = 0,267).
En modelos de regresión de Cox ajustados a edad, sexo, índice de masa corporal, índice de comorbilidad, albúmina plasmática, proteína C reactiva, filtrado glomerular basal, proteinuria, fósforo sérico, y medicación antihipertensiva, el parámetro HOMA tanto en forma continua como en terciles, no se asoció ni con el desarrollo de nuevos procesos CV (relación de riesgo para variable continua = 1,106; IC 95%, 0,901–1,358; p = 0,337), ni con la mortalidad por cualquier causa (RR variable continua = 1,091; IC 95%, 0,991–1,200; p = 0,076).
La estratificación de los modelos para un índice de masa corporal superior o inferior a 30 kg/m2 no modificó de forma sustancial los resultados, aunque la relación entre el parámetro HOMA y la mortalidad se situó en el límite de la significación estadística (RR terciles HOMA = 1,28; p = 0,060).
DISCUSIÓN
Los resultados de este estudio muestran que el grado de severidad de la resistencia a la insulina en la ERCA se asocia con la obesidad, niveles de triglicéridos, albúmina y fósforo plasmáticos. Otros parámetros que se asocian de forma univariable con los valores HOMA son el filtrado glomerular, bicarbonato sérico y PTH. Sin embargo, ni las cifras de presión arterial ni los niveles de proteína C reactiva o la magnitud de la proteinuria mostraron una relación significativa con los valores HOMA.
Aunque no existen valores de referencia de la normalidad para el parámetro HOMA (en teoría un joven sano debería tener un valor igual a uno19), las cifras que presentaron los pacientes incluidos en este estudio fueron muy elevadas (dos tercios de los pacientes tenían un valor >3), lo que confirma la alta prevalencia de esta alteración metabólica en la ERC no diabética.
La obesidad es una característica clínica muy prevalente en la ERC21. La RI y la hiperinsulinemia asociada con la obesidad han sido implicadas en el desarrollo de enfermedad renal y de aterosclerosis acelerada22,23. La obesidad fue muy prevalente en los pacientes incluidos en el presente estudio, y determinó de forma significativa el grado de severidad de la RI, sugiriendo una relación patogénica en el desarrollo de esta alteración metabólica, independiente de la atribuible a la uremia.
La hipertrigliceridemia es una dislipemia asociada patogénicamente a la RI3,4. Esta alteración lipídica también es muy frecuente en la ERC24. Los resultados del presente estudio muestran una asociación significativa entre los valores HOMA y los triglicéridos plasmáticos, lo que sugiere un papel importante de la RI en el desarrollo de esta dislipemia en la ERC.
La relación positiva entre los valores HOMA y las concentraciones de albúmina plasmática es un dato destacable en el presente estudio. La concentración de albúmina plasmática refleja la presencia y severidad de distintos procesos que tienen un impacto negativo en la evolución de los pacientes con ERC (p. ej., desnutrición, inflamación, hipervolemia, etc.), y así este parámetro es considerado como un «índice clínico de enfermedad»25, determinante de mortalidad en la mayoría de los estudios en pacientes con ERC.
En pacientes en hemodiálisis, el parámetro HOMA se relaciona positivamente tanto con la tasa de síntesis como con la de degradación proteica muscular, aunque con una tendencia a asociarse negativamente con el balance neto de proteínas musculares26. Mientras que estos hallazgos sugieren un efecto negativo de la RI sobre el estado de nutrición, otros estudios en pacientes con ERC prediálisis muestran que la cantidad de ingesta proteica determina el grado de hiperinsulinemia y sensibilidad a la insulina, mejorando la RI con dietas bajas en proteínas y fósforo27-29.
Una posible explicación a la asociación positiva entre HOMA y albúmina plasmática podrían ser las diferencias en la ingesta proteica y estado de nutrición entre pacientes. Aunque los pacientes en el tercil inferior de HOMA del presente estudio mostraban una tasa de catabolismo proteico (PNNA) inferior a la de los pacientes en los terciles superiores, las diferencias no fueron significativas, y por tanto no se puede aceptar esta hipótesis.
Los niveles de fósforo plasmático también se asociaron positivamente con los valores de HOMA. Redundando en la hipótesis anterior, una ingesta inadecuada al grado de insuficiencia renal podría ayudar a explicar este hallazgo. Una reducción de fósforo en la dieta ha demostrado mejorar el grado de RI en pacientes con ERC28. También hay que señalar el vínculo potencial que tiene la insulina sobre la excreción urinaria de fósforo. La insulina posee un efecto antifosfatúrico30,31, antagonizando incluso la acción fosfatúrica de la PTH32. En el presente estudio no se realizaron balances de fósforo y, por tanto, no es posible confirmar esta hipotética relación entre RI y fósforo.
La hiperinsulinemia y la RI predisponen al desarrollo o al agravamiento de la hipertensión arterial, y al desarrollo y a la progresión de la ERC a través de mecanismos como el aumento de la reabsorción renal de sodio, incremento de la actividad simpática, alteraciones de la función endotelial y del podocito, dislipemia, hiperglucemia, y aumento de la actividad renina-angiotensina33. En algunos estudios se ha observado una relación entre el parámetro HOMA y la tasa de progresión de la ERC en pacientes con glomerulonefritis34, y entre los niveles plasmáticos de insulina y la tasa de progresión del deterioro renal asociado con la edad35.
La progresión de la ERC, según los criterios establecidos en el presente estudio, fue más lenta en pacientes con un menor grado de RI (tercil inferior). Aunque el hallazgo es estadísticamente significativo, incluso después del ajuste con otros determinantes de la progresión de la ERC, y consistente con los potenciales efectos negativos de la hiperinsulinemia, la relevancia clínica de este hallazgo no parece muy importante, si lo comparamos con el efecto que tienen otros factores (proteinuria, edad, fósforo, etc.) en la progresión de la ERC.
Aunque la RI se considera un factor de riesgo cardiovascular y de mortalidad en la población general1-4, el impacto de esta alteración metabólica en la población con ERC es controvertido7,14-16. En la ERC, la asociación entre RI y mortalidad sólo se ha descrito en pacientes japoneses14,16, mientras que en otros grupos étnicos no se ha podido demostrar esta asociación7,15.
Los resultados del presente estudio tampoco apoyan una asociación entre la magnitud del parámetro HOMA y la mortalidad o desarrollo de nuevos sucesos CV en pacientes con ERC avanzada prediálisis, hallazgos, una vez más, discrepantes con los que se observan en la población general.
Este estudio presenta limitaciones. La medida de la severidad de la RI se basa en una sola muestra del parámetro HOMA. El diseño transversal del estudio sobre los determinantes del parámetro HOMA limita la capacidad de explicar adecuadamente las asociaciones. La ausencia de relación entre los niveles HOMA y el desarrollo de nuevos procesos CV no descarta una potencial relación de la RI con la severidad y extensión del daño aterosclerótico vascular medidas por procedimientos más específicos y sensibles. Los criterios de progresión de ERC utilizados en el presente estudio no son tan fiables como la medida o estimación de los cambios del filtrado glomerular durante el período de seguimiento.
En conclusión, la resistencia a la insulina estimada por el parámetro HOMA es prevalente en la ERC avanzada, aunque no parece influir negativamente en el pronóstico vital de estos pacientes.
Tabla 1. Características clínicas y bioquímicas de los pacientes agrupados según terciles del parámetro HOMA
Tabla 2. Variables asociadas con el parámetro HOMA mediante regresión lineal múltiple
Tabla 3. Parámetros incluidos en la mejor ecuación predictiva sobre la progresión de la ERC estimada mediante regresión de Cox
Figura 1. Curvas de Kaplan-Meier de supervivencia sin criterios de progresión de la ERC según terciles de HOMA.
Figura 2. Curvas de supervivencia en pacientes con HOMA en el tercil inferior (línea discontinua) y el resto de los pacientes de estudio (línea continua). El modelo es una estimación tras ajuste con edad, sexo, índice masa corporal, albúmina, proteinuria, fósforo