Introducción: La enfermedad linfoproliferativa postrasplante (ELP) representa un grupo heterogéneo de enfermedades que se caracterizan por una proliferación de linfocitos que se presenta después del trasplante de órganos sólidos. La mayoría de los casos de ELP son de estirpe B y su desarrollo se ha asociado estrechamente con el virus de Epstein-Barr (VEB), cuya proliferación se vería favorecida por la inhibición de la función citotóxica de los linfocitos T debido a la inmunosupresión farmacológica a la que se somete a los receptores de trasplante. Se han descrito varios factores de riesgo para el desarrollo de esta entidad, como son la seronegatividad del receptor para VEB, el grado de inmunosupresión neta global, sobre todo con el uso de anticuerpos monoclonales o policlonales, el rechazo agudo y la enfermedad por citomegalovirus (CMV). Material y métodos: Hemos estudiado la incidencia de ELP y su relación con el VEB, así como su evolución y los posibles factores de riesgo en su desarrollo, en 1.176 receptores adultos de trasplante renal de cadáver realizados en nuestro hospital, entre 1988 y 2009, con un seguimiento de uno a 255 meses. Se determinó la presencia de VEB en el tejido linfoproliferativo mediante hibridación. Analizamos la incidencia de ELP en dos períodos de tiempo, 1988-1998 y 1999-2009 con 472 y 704 pacientes, respectivamente. Resultados: Un total de 28 receptores (2,38 %), 22 hombres y 6 mujeres, con una edad media de 46,5 ± 15,36 años (18-70 años) y con una evolución media postrasplante de 72,9 ± 56,3 meses (1-180 meses), desarrollaron ELP. Trece de ellos (46,4%) no presentaban ninguno de los factores de riesgo clásicos descritos. Se detectó la presencia de VEB en el tejido linfoproliferativo de 18 de los 26 pacientes estudiados (69,2%). Respecto a su estirpe histológica 25 de los 28 eran tipo B (89,2%). Diez de los 28 pacientes diagnosticados (35,7%) recibieron tratamiento con rituximab, seis de ellos fallecieron durante el seguimiento, cinco como consecuencia directa de su enfermedad. Calculada la densidad de incidencia en los dos períodos, ésta fue muy similar en ambos grupos, de 0,003922 casos/años-paciente en el período 1988-1998 y de 0,003995 casos/años-paciente en el período 1999-2009. La supervivencia global postrasplante del paciente que presentó ELP fue del 73,6% a los 5 años y del 36,9 % a los 10 años frente al 87,8% y al 75,9% del receptor libre de enfermedad (p <0,0001). Evidenciamos una supervivencia del injerto del 62,6% a los 5 años y del 27,3% a los 10 años frente al 72,4% y al 53,9% de los injertos de los receptores libres de enfermedad (p <0,0001). En nuestra serie, la supervivencia del paciente al año de presentar la enfermedad fue del 30,9%, y del 23,2% al segundo año, y para el injerto del 15,5% del 7,7%, respectivamente. Conclusiones: Concluimos que la ELP es una entidad en su mayoría de estirpe B, asociada de forma significativa con el VEB, cuya incidencia no ha variado en el tiempo y en la que en la mitad de los casos no se identifican factores de riesgo, condicionando muy mal pronóstico a pesar de los nuevos tratamientos desarrollados.
Introduction: Post-transplant lymphoproliferative disease (PTLD) represents a heterogeneous group of diseases characterised by a proliferation of lymphocytes occurring after solid organ transplantation. Most cases of PTLD are B-cell and their development has been closely associated with the Epstein-Barr virus (EBV), whose proliferation is encouraged by the inhibition of the cytotoxic function of T lymphocytes due to immunosuppressive drug treatment for transplant recipients. Several risk factors have been described for the development of this disorder, such as the seronegative state of the EBV receptor, the degree of overall net immunosuppression, especially with the use of monoclonal and polyclonal antibodies, acute rejection and cytomegalovirus (CMV) disease. Material and method: We studied the incidence of PTLD and its relationship with EBV as well as its evolution and possible risk factors in 1176 adult recipients of cadaveric renal transplantation performed in our hospital between 1988 and 2009, with a follow-up of 1-255 months. The presence of EBV in the lymphoproliferative tissue was determined using in situ hybridisation. We analysed the incidence of PTLD over two time periods, 1988-1998 and 1999-2009 with 472 and 704 patients respectively. Results: A total of 28 recipients (2.38%), 22 men and 6 women with a mean age of 46.5 (15.36) years (18-70 years) with a mean post-transplant evolution of 72.9 (56.3) months (1-180 months), developed PTLD. Thirteen (46.4%) did not show any of the classic risk factors described. The presence of EBV in lymphoproliferative tissue was detected in 18 out of 26 patients studied (69.2%). In terms of histology, 25 out of 28 were type B (89.2%). Ten out of 28 patients diagnosed (35.7%) received treatment with rituximab, six died during the follow-up, five as a direct result of their illness. The incidence for the two time periods was very similar for both groups, with 0.003922 cases/year-patient in the 1988-1998 period and 0.003995 cases/year-patient in the 1999-2009 period. Overall post-transplant survival for patients with PTLD was 73.6% at 5 years and 36.9% at 10 years, versus 87.8% and 75.9% for disease-free recipients (P<.0001). We calculated a graft survival of 62.6% at 5 years and 27.3% at 10 years versus 72.4% and 53.9% for grafts in disease-free recipients (P<.0001). In our study, patient survival one year after presenting the disease was 30.9% and 23.2% at year two. For the graft, survival was 15.5% and 7.7%, respectively. Conclusions: We conclude that PTLD is a disorder that is generally type B; it is significantly associated with EBV. Its incidence has not changed over time and half of all PTLD cases had no identifiable risk factors, which led to a poor prognosis despite the development of new treatments.
INTRODUCCIÓN
La enfermedad linfoproliferativa postrasplante (ELP) representa un grupo heterogéneo de enfermedades que se caracterizan por una proliferación de linfocitos que se presenta después del trasplante de órganos sólidos1.
La mayoría de ELP es de estirpe B2 y su desarrollo se ha asociado estrechamente con el virus de Epstein-Barr (VEB)1,3,4, cuya proliferación se vería favorecida por la inhibición de la función citotóxica de los linfocitos T debido a la inmunosupresión neta global farmacológica a la que se somete a los receptores de trasplante5.
Se han descrito varios factores de riesgo clásicos para el desarrollo de esta entidad, como la seronegatividad del receptor para VEB6,7, el grado de inmunosupresión global, sobre todo con el uso de anticuerpos monoclonales o policlonales6-8, el rechazo agudo7 y la enfermedad por citomegalovirus (CMV)9,10. Recientemente, Opelz ha apuntado la incompatibilidad en los locus DR como factor de riesgo para el desarrollo de la enfermedad, pero no puede concluir si dicho factor sería un reflejo de la necesidad de más inmunosupresión o de una mayor incidencia de inmunogenicidad y de rechazo agudo en estos pacientes11.
En una experiencia de dos décadas, hemos estudiado la incidencia de la ELP y su posible variación a lo largo del tiempo, la relación del VEB en su producción, el pronóstico de la entidad, los posibles factores de riesgo para su desarrollo, así como la influencia de las nuevas estrategias empleadas en su tratamiento.
MATERIAL Y MÉTODOS
Pacientes
Se estudia, de forma descriptiva, la incidencia de ELP en un total de 1.176 receptores adultos que recibieron un trasplante renal procedente de donante cadáver durante un período de 21 años, desde julio de 1988 hasta diciembre de 2009. El tiempo de seguimiento postrasplante fue de uno a 255 meses. Un total de 472 pacientes fueron sometidos a un trasplante en el período 1988-1998 y 704 en el período 1999-2009. La inmunosupresión utilizada inicialmente incluyó ciclosporina, azatioprina y prednisona, sustituyendo a partir de 1998 la azatioprina por micofenolato y usando tacralimus como anticalcineurínico en muchos pacientes también a partir de dicho año. Los receptores de alto riesgo inmunológico recibieron tratamiento de inducción con OKT3 hasta el 2000 y posteriormente con timoglobulina.
El rechazo agudo se diagnosticó mediante biopsia y se trató inicialmente con 3 bolos i.v. de 6-metil-prednisolona (500 mg). En caso de corticorresistencia o de grados II o III de Banff, los pacientes recibieron anticuerpos monoclonales o policlonales.
Evaluamos mediante el estudio de la historia clínica la presencia de factores de riesgo clásicos para el desarrollo de la enfermedad, siendo éstos la seronegatividad para el VEB, el empleo de anticuerpos monoclonales o policlonales, el desarrollo de infección por CMV y el rechazo agudo tratado.
Métodos
Diagnóstico
Histología
Se obtuvo material histológico y/o celularidad en todos los pacientes con enfermedad, y se solicitó estudio necrópsico en aquellos receptores que fallecieron. La valoración histológica se llevó a cabo según estudios morfológicos e inmunohistoquímica. El estudio morfológico se realizó según la clasificación de enfermedades hematopoyéticas de la Organización Mundial de la Salud12, sobre cortes teñidos con hematoxilina y eosina, Giemsa y PAS obtenidos de material fijado en formalina neutra tamponada e incluido en parafina. Los estudios inmunohistoquímicos fueron llevados a cabo sobre tejido fijado e incluido en parafina mediante el método de estreptavidina biotina peroxidasa, con recuperación antigénica de olla exprés durante 15 minutos. Se usaron los siguientes anticuerpos: CD 45 (panleucocitario), marcadores de linfocitos B (CD 20, CD 79, CD 45), marcadores de linfocitos T (CD 43, CD 3, CD 45RO=UCL1), marcador de proliferación celular Ki67, cadenas ligeras, CD 30 (anaplásico), CD 15, proteína bcl2 y proteína p53.
Estudios VEB
Se determinó la serología de VEB mediante VEB-VCA IgG e IgM antes del trasplante en todos los receptores por ELISA. Se determinó su presencia en tejido linfoproliferativo mediante hibridación in situ con sondas PNA-EBER (Dako).
Otros estudios
Se realizaron pruebas de imagen, incluyendo TAC toracoabdominal, en los pacientes diagnosticados de ELP en vida.
Análisis estadístico
La descripción de las características basales de los pacientes se expresa mediante porcentaje para variables cualitativas. Para las cuantitativas con distribución normal se ha determinado la media con desviación estándar. Para las variables cuantitativas que no seguían una distribución normal se utilizó la mediana con su rango intercuartil.
Las variables cualitativas independientes se han analizando mediante tablas de contingencia con el estadístico asociado de la chi-cuadrado. Las comparaciones entre variables cuantitativas han sido analizadas mediante el test de la t de Student.
Se calculó la densidad de incidencia en los dos períodos, expresándola como casos/años-paciente.
Las curvas de supervivencias de injerto y receptor fueron calculadas mediante Kaplan-Maier, y las diferentes comparaciones entre ellas con la prueba de rangos logarítmicos (log rank).
Se consideró significativa una comparación si p <0,05. En el estudio se utilizó el paquete estadístico SPSS.
RESULTADOS
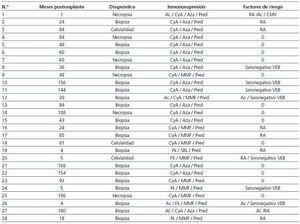
De la población total de 1.176 pacientes, fueron diagnosticados 28 casos de ELP (2,38%), siendo 22 hombres (78,5%) y 6 mujeres (21,5%), con una edad media de 46,5 ± 15,36 años (18-70 años). El seguimiento de los pacientes postrasplante fue de uno a 255 meses y el tiempo medio entre el trasplante y el diagnóstico de la enfermedad fue de 72,9 ± 56,32 meses (1-180). Un total de 5 pacientes (17,8%) desarrollaron la enfermedad durante el primer año postrasplante y 23 (82,2%) más tardíamente (tabla 1). El 78,6% eran VEB seropositivos en el momento previo al trasplante frente al 21,4% que eran seronegativos (tabla 1). Habían recibido ciclosporina como anticalcineurínico 23 de los 28 pacientes diagnosticados de ELP (82,1%) y azatioprina 16 de 28 pacientes (57,1%). Cinco pacientes (17,8%) recibieron tacrolimus y 11 (39,2%), micofenolato, en combinación con ciclosporina o tacrolimus. Únicamente un paciente recibió como parte de su inmunosupresión sirolimus. Un total de 4 pacientes (14,2%) recibieron tratamiento con anticuerpos monoclonales o policlonales (tabla 1).
Trece de los 28 pacientes (46,4%) no presentaron ningún factor de riesgo clásico. De los 15 que sí presentaron algún factor de riesgo, cinco (17,8%) tenían más de uno (tabla 1).
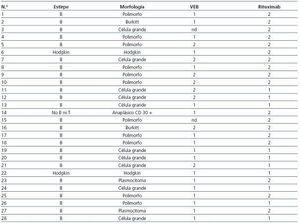
El diagnóstico de ELP se realizó en 6 casos post mortem (21,4%), mientras que en el resto se obtuvo material histológico o celularidad in vivo (tabla 1). La estirpe linfocitaria objetivada fue B en 25 de los 28 pacientes (89,2%) (tabla 2). Se estudió la presencia de VEB en el tejido linfoproliferativo de 26 de los 28 pacientes (92,8%), detectándose el virus en 18 de ellos (69,2%) (tabla 2).
A pesar de que la mayoría de casos pertenecían a la estirpe de células B, dado que el rituximab (anti-CD20) no se comienza a usar hasta el 2003 y que no todos los casos presentaban el antígeno CD20, sólo 10 de los 28 pacientes diagnosticados (35,7%) recibieron tratamiento con dicho fármaco. De ellos, seis fallecieron durante el seguimiento, cinco como consecuencia directa de su enfermedad.
La densidad de incidencia de fue muy similar en aquellos pacientes sometidos a trasplante en el período 1988-1998, 0,003922, con respecto a la de los receptores del período 1999-2009, 0,003995.
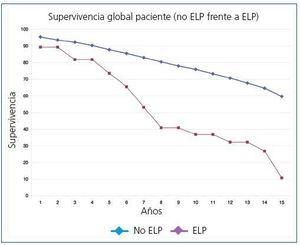
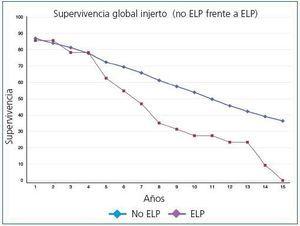
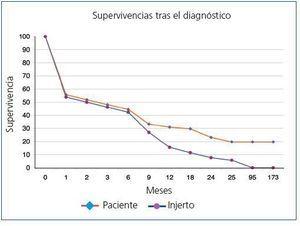
La supervivencia global postrasplante del paciente que presentó ELP fue del 73,6% a los 5 años y del 36,8% a los 10 años frente al 87,8% y al 75,9% del receptor libre de enfermedad (p <0,0001) (figura 1). El injerto presentó una supervivencia del 62,6% a los 5 años y del 27,3% a los 10 años, frente al 72,4% y al 53,9% de los injertos de los receptores libres de enfermedad (p <0,0001) (figura 2). En nuestra serie, la supervivencia del paciente al año de presentar la enfermedad fue del 30,9%, y del 23,2% al segundo año (figura 3) y para el injerto del 15,5% y del 7,7%, respectivamente (figura 3).
DISCUSIÓN
En nuestra experiencia, la relación del VEB con el desarrollo de la enfermedad es estrecha, como lo confirma el hecho de que la mayoría de los receptores que desarrollaron ELP en nuestra serie presentaban VEB en el tejido proliferativo (tabla 2). Además, siete de nuestros pacientes presentaban como factor de riesgo la seronegatividad para dicho virus y, por tanto, la posibilidad de desarrollar una primoinfección, siendo éste el principal factor de riesgo identificado en las grandes series6,7,9. Es llamativo que sólo en la mitad de los casos de nuestra serie hemos podido identificar un factor de riesgo clásico (tabla 1), dato que podría explicarse por la existencia de factores o combinación de factores favorecedores de la enfermedad todavía desconocidos para nosotros.
La influencia de los diferentes agentes inmunosupresores en el desarrollo de la enfermedad ha sido exhaustivamente estudiada en la literatura. De forma general la inmunosupresión es determinante en su aparición, como lo demuestra el dato de que en los pacientes sometidos a trasplante que reinician la diálisis disminuye de manera significativa el riesgo de desarrollo de la enfermedad6,13. Así pues, el uso de anticuerpos monoclonales o policlonales se ha establecido como un factor de riesgo de primer orden6-8. En nuestra serie, sólo 4 de 28 pacientes habían recibido dicho agente inmunosupresor (tabla 1), lo que indicaría otra vez la existencia de otros factores para el desarrollo de la entidad. El uso de los anticuerpos anti-CD25 en la inducción no añade un riesgo sobreañadido de aparición de la enfermedad7,8. En cuanto a otros inmunosupresores, hay que destacar la mayor incidencia de ELP en receptores de trasplante renal que han recibido FK en vez de CyA7,8. En nuestra serie, sólo 5 pacientes recibieron dicho inmunosupresor (tabla 1), lo que nos impide llegar a alguna conclusión. Los antiproliferativos azatioprina y micofenolato se asocian con un riesgo menor de desarrollar la enfermedad7.
Es de destacar que podría ser la inmunosupresión neta global empleada el factor de riesgo que debe considerarse, aunque la importancia del uso de los anticuerpos monoclonales o policlonales sería notable. La identificación del rechazo agudo como factor de riesgo clásico7,8 podría ser un indicativo de la importancia de la inmunosupresión neta global en el desarrollo de la enfermedad.
Ante la posible influencia que el cambio de la inmunosupresión en la última década podría tener en la incidencia de ELP hemos analizado la densidad de incidencia en las dos últimas décadas sin encontrar una diferencia significativa. Estos resultados son respaldados por los publicados por Opelz, en los que evidencia que la incidencia de esta entidad ha permanecido estable en los tres períodos de tiempo que compara8. Este dato no es tranquilizador, pues dado que el tiempo de seguimiento en el segundo período es menor, cabe prever que los casos tardíos de la enfermedad aún no se han presentado.
Existe una controversia sobre la existencia o no de dos entidades diferenciadas dentro de la ELP: una de aparición precoz, muy relacionada con la infección por VEB y con tendencia a la remisión tras la reducción de la inmunosupresión y otra tardía, poco relacionada con el VEB y con una mala evolución clínica con la reducción de la inmunosupresión1,2,6. Los datos de Opelz irían en contra de esta hipótesis, ya que objetivan un similar pronóstico para la ELP sea ésta precoz o tardía8. En nuestra serie, la mayoría de los casos fueron de aparición tardía, por lo que su mal pronóstico podría estar en relación con la mala evolución achacada a la entidad de aparición tardía por autores como Leblond2. No obstante, la mayoría de nuestros pacientes presentaban VEB en el tejido proliferativo, dato poco frecuente en las entidades de desarrollo tardío2,4.
Respecto al tiempo de aparición postrasplante, el mayor riesgo parece objetivarse durante el primer año14. Smith ha comunicado una mayor incidencia de ELP durante el primer año postrasplante que disminuye en los años posteriores, aunque sus datos son de limitado valor al censurar la serie por motivos extramédicos a los 3 años de seguimiento13. Van Leeuwen, con los datos del ANZDATA, recoge una incidencia menor durante el período de 2 a 5 años que durante los primeros 2 años6. Opelz también refiere una mayor incidencia durante el primer año, pero que se mantiene de manera estable durante los siguientes 10 años8, pero otras series comunican un número de casos precoces y tardíos similar4 o incluso, como en el caso de nuestra serie, invierten la proporción a favor de una incidencia tardía de la enfermedad15. Sólo cinco de nuestros pacientes (17,8%) desarrollaron la enfermedad dentro del primer año postrasplante, pero en todos ellos pudimos demostrar la presencia de VEB en el tejido proliferativo, dato que confirma la relación entre la precocidad del desarrollo de la entidad y la presencia de VEB2. El tiempo postrasplante medio en el que se diagnosticó la enfermedad en nuestra serie fue de 77,8 meses, por lo que cabe etiquetar a nuestros pacientes como afectados de ELP tardía, siendo similar la experiencia de Trappe, et al., quienes refieren un tiempo medio postrasplante de 88 meses15. Pascual recoge, en un metanálisis, un tiempo de aparición mucho más tardío, de 117 meses16, pero otras series describen tiempos medios mucho más precoces7,17.
La mayoría de las ELP son de estirpe B2, dato confirmado en nuestra serie, en la que el 89,2% de los pacientes desarrollaron proliferaciones de estirpe B (tabla 2). El tratamiento de dichos casos, siempre que tengan CD20 positivo, está establecido con anti-CD20 y conversión a inhibidores de la m-TOR con obtención de buenos resultados en otras series15,16. En nuestra limitada experiencia, 6 de los 10 pacientes tratados fallecieron, cinco de ellos como consecuencia directa de la enfermedad, lo que apoyaría que, a pesar de los avances recientes, esta entidad sigue siendo una enfermedad de pronóstico grave. Hay que resaltar que la estrategia referida sólo se ha aplicado a los últimos pacientes diagnosticados, con lo que el pronóstico de la enfermedad podría variar en el futuro.
La incidencia global de ELP en nuestra serie es alta, del 2,38%, superior a la de otras series publicadas6,7,17. La presencia de factores de riesgo en nuestros enfermos no explica esta alta incidencia, ya que sólo la mitad de ellos mostraban algunos de los factores de riesgo clásicos descritos. Cabe destacar que más del 20% de nuestros casos fueron diagnosticados mediante la realización de autopsias (tabla 1), fruto de la política del servicio de realizar estudios post mortem a todos los pacientes sin causa definida de mortalidad, lo que aumentaría el número de casos diagnosticados.
El pronóstico de los pacientes con ELP en nuestra experiencia es malo, con una supervivencia del paciente al año y a los 2 años del 30,9% y del 23,2%, respectivamente, significativamente inferior a la de aquellos pacientes que no desarrollaron enfermedad, por lo que el desarrollo de ELP marca de manera determinante la supervivencia de paciente y de injerto en nuestra serie. Dichos datos son confirmados por otros autores, aunque con supervivencias mayores7, siendo la mortalidad al año en la serie de Opelz del 40%8.
Al comparar nuestros resultados actuales con los publicados hace 8 años18, que recogían los datos de pacientes sometidos a trasplante hasta 2001, no observamos cambios significativos en la edad de los pacientes en el momento de desarrollar su enfermedad, tiempo de aparición postrasplante, porcentaje de pacientes con factores de riesgo y pronóstico de la enfermedad, pero debemos destacar que nuestra incidencia casi se ha duplicado, lo que sería debido a un seguimiento más largo de los pacientes, con una incidencia de enfermedad de desarrollo tardío en el postrasplante muy importante, lo que confirma los datos de Opelz, que demuestran la existencia de un riesgo acumulado año tras año de desarrollar la enfermedad desde el momento del trasplante8.
Podemos concluir que la ELP es una entidad en su mayoría de estirpe B, cuya incidencia no ha variado en el tiempo, asociada de forma significativa con el VEB, en la que en la mitad de los casos no se identifican factores de riesgo y con muy mal pronóstico a pesar de los nuevos tratamientos desarrollados.
Tabla 1. Tiempo postrasplante, método diagnóstico, inmunosupresión y factores de riesgo en receptores que desarrollaron la enfermedad
Tabla 2. Clasificación histológica según la OMS12, tratamiento con rituximab y presencia de VEB en tejido de receptores con enfermedad linfoproliferativa
Figura 1. Supervivencia global de los pacientes (no ELP frente a ELP)
Figura 2. Supervivencia global del injerto (no ELP frente a ELP)
Figura 3. Supervivencia de los pacientes tras el diagnóstico