Antecedentes: El deterioro de la función renal se ha asociado con un incremento de la morbimortalidad cardiovascular. El objetivo del estudio fue analizar la asociación del filtrado glomerular (FG) basal, según las fórmulas de Cockcroft-Gault y MDRD, con la incidencia de eventos cardiovasculares (ECV) en una cohorte de personas hipertensas seguida durante 12 años. Métodos: Estudio prospectivo de una muestra aleatoria de 223 hipertensos libres de ECV atendidos en un centro de atención primaria urbano. Se estimó el FG mediante ambas fórmulas. Se consideró ECV la aparición de cardiopatía isquémica, insuficiencia cardíaca, accidente cerebrovascular, vasculopatía periférica o muerte por ECV. Se analizaron los datos mediante el método actuarial y modelos de regresión de Cox. Resultados: La mediana de tiempo de seguimiento fue de 10,7 años (rango intercuartílico, 6,5-12,1). El seguimiento fue completo en 191 participantes (85,7%). La supervivencia acumulada fue del 64,7% (intervalo de confianza [IC] del 95%: 57,9-71,6%). La tasa media de incidencia de ECV durante todo el período de seguimiento fue de 3,6 (IC del 95%, 2,7-4,4%) por 100 personas hipertensas/año. El modelo multivariable final mostró que las variables con mayor poder predictivo de ECV en la población de estudio fueron la diabetes y la estimación del FG >60 ml/min/1,73 m2 mediante fórmula MDRD. Conclusiones: Se observó una relación entre la aparición de ECV y los valores de FG estimados por la fórmula MDRD al inicio del seguimiento superiores a 60 ml/min/1,73 m2, inversa a la esperada. La estimación del FG mediante fórmula de Cockcroft-Gault no se asoció con el riesgo cardiovascular.
Background: A decrease in renal function is associated with cardiovascular morbidity and mortality. The aim of this study was to analyse the association of cardiovascular morbidity and mortality with baseline glomerular filtration rate (GFR), calculated according to the Cockcroft-Gault and MDRD formulas, with the incidence of major adverse cardiovascular events (MACEs) in a cohort of hypertensive individuals followed for 12 years. Method: We performed a prospective study of a random sample of 223 hypertensive patients free of MACEs, who were followed in an urban Primary Care Centre. GFR was estimated using both formulas. MACEs were considered as the onset of ischaemic heart disease, heart failure, heart attacks, peripheral vascular disease or cardiovascular death. Data were analysed using the life-table method and Cox regression modeling. Results: The median follow-up was 10.7 (interquartile range, 6.5-12.1) years. Follow-up was completed in 191 participants (85.7%). The cumulative survival was 64.7% (95% Confidence Interval (CI), 57.9-71.6). The incidence of MACEs during the follow-up period was 3.6 (95% CI, 2.7-4.4) per 100 subject-years. The final multivariable model showed that the most predictive variables of MACEs in the study population were the presence of diabetes mellitus and the estimation of GFR >60ml/min/1.73 m2 Conclusions: There was a relationship between the occurrence of MACEs and an estimated GFR by MDRD above 60 ml/min/1.73 m2 at study entry, inversely to what was expected. GFR estimated by the C-G formula was not associated with cardiovascular risk. by the MDRD equation.
INTRODUCCIÓN
La hipertensión arterial (HTA) supone un importante problema de salud, ya que constituye un reconocido factor de riesgo para el desarrollo de enfermedad cardiovascular1. Una de las afectaciones orgánicas derivadas de la HTA es la enfermedad renal crónica (ERC), definida inicialmente por la presencia de daño renal y, en estadíos posteriores, como una disminución del filtrado glomerular (FG).
Diversas publicaciones han demostrado que la ERC es responsable de un incremento de la morbimortalidad cardiovascular, mayor cuanto más importante es el grado de deterioro de la función renal2-4. Por este motivo, distintas Sociedades y organismos5-8 incluyen el FG reducido como una de las repercusiones orgánicas que hay que buscar en el paciente hipertenso y que es de utilidad en las tablas de decisión terapéutica. Las recomendaciones actuales9,10 van dirigidas, por un lado, a minimizar la progresión del deterioro renal y, por otro, a tratar las complicaciones inherentes a la insuficiencia renal, reduciendo así el riesgo cardiovascular asociado con la ERC.
La ERC es una entidad que puede diagnosticarse en atención primaria (AP) en sus fases tempranas mediante la estimación del FG por distintas fórmulas (ERC oculta), ya que la creatinina plasmática no se ve alterada habitualmente hasta fases más avanzadas. De éstas, las más utilizadas y validadas son las de Cockcroft-Gault11 y MDRD12, que tienen diferentes ventajas y limitaciones y se recomiendan en la bibliografía según el estadío de alteración de la función renal13-15; además, se ha descubierto su asociación con la aparición de eventos cardiovasculares (ECV).
Los estudios realizados en España que analizan la evolución de la morbimortalidad cardiovascular a largo plazo de una cohorte de pacientes hipertensos seguidos en AP, según la función renal, son escasos. Dado que la HTA se detecta y controla fundamentalmente en la AP, cabe pensar que la población hipertensa general está mejor representada por la población visitada en dicho nivel asistencial.
En 1993 se realizó un estudio prospectivo que estableció la prevalencia de hipertrofia ventricular izquierda determinada en una población hipertensa general, libre de enfermedad cardiovascular y atendida en un centro de AP16. A partir de ese año se procedió al seguimiento de la cohorte de pacientes17.
El objetivo del presente estudio fue analizar la asociación de la morbimortalidad cardiovascular con el estado inicial de la función renal, según las fórmulas de Cockcroft-Gault y MDRD, en una cohorte de personas hipertensas seguida durante 12 años.
MATERIAL Y MÉTODOS
El estudio prospectivo «Gòtic» de una cohorte de hipertensos atendida en un centro de salud de Barcelona (España) ha sido la fuente de datos del presente estudio. El seguimiento se inició en 1993 y tuvo una duración de 12 años. Los criterios de selección de la población y las variables analizadas han sido publicados con anterioridad17. Para este estudio se excluyeron, además, los pacientes que presentaban peso corporal extremo (índice de masa corporal [IMC] inferior a 19 kg/m2 o superior a 35 kg/m2), alteraciones importantes en la masa muscular, insuficiencia renal aguda, embarazo, hepatopatía grave, edema generalizado o ascitis y aquellos que seguían tratamiento con fármacos que bloquearan la secreción de creatinina. Finalmente, un total de 223 personas hipertensas formaron la cohorte del estudio.
Se calculó el FG según las fórmulas de Cockcroft-Gault (FG = [140 — edad]*peso(kg)/[creatinina plasmática*72]*0,85, si mujer)11 y MDRD (FG = 186*creatinina plasmática—1,154*edad—0,203*1,212, si raza negra*0,742, si mujer)12 y se clasificó según los estadíos de la ERC9.
Se consideró ECV la aparición de los siguientes episodios durante el período de seguimiento: insuficiencia cardíaca; cardiopatía isquémica (angina, infarto agudo de miocardio); accidente cerebrovascular (permanente o transitorio); vasculopatía periférica (clínica de claudicación intermitente o constatación por eco-Doppler); muerte por causa cardiovascular y muerte súbita. La muerte súbita se definió como la ocurrida en el intervalo de una hora desde el inicio de los síntomas, o acaecida, sin testigos, en personas sin diagnóstico previo de cardiopatía coronaria ni otras enfermedades presumiblemente mortales. El registro de la aparición de los ECV se realizó durante las visitas de seguimiento de la HTA. Todos los ECV recogidos se corroboraron con los médicos responsables de los pacientes y con los sistemas de información y registros tanto hospitalarios como de AP.
Se desarrollaron estrategias para minimizar las pérdidas durante el seguimiento y recuperar la información relacionada con la mortalidad17.
Los ECV y las causas de mortalidad fueron evaluadas por una comisión externa de médicos que desconocía la situación del paciente en relación con su función renal.
El estudio contó con la aprobación del Comité Ético de Investigación Clínica del IDIAP Jordi Gol del Instituto Catalán de la Salud.
El tiempo de supervivencia se midió desde la fecha de inclusión del sujeto en el estudio hasta la aparición de un ECV, si así sucedía. La variable censuradora fue la aparición o no de ECV desde la inclusión de los sujetos en el estudio (1993) hasta la fecha de término del seguimiento (2005). Sólo se tuvo en cuenta el evento inicial en el caso de que se dieran varios episodios de un mismo evento en un mismo paciente. Las tasas de supervivencia e incidencia se estimaron mediante el método actuarial. Para el análisis bivariado se utilizaron la prueba de la t de Student o su correspondiente no paramétrica en el caso de las variables continuas y la prueba de la ji cuadrado en el de las categóricas. Para evaluar la concordancia entre las estimaciones de FG realizadas con ambas fórmulas se utilizó el índice kappa18. El valor pronóstico del FG calculado con cada una de las dos fórmulas y de los factores de ajuste se evaluó mediante modelos de regresión de riesgos proporcionales de Cox. Se evaluó un modelo para cada una de las fórmulas utilizadas.
Las covariables de ajuste de los modelos iniciales fueron: edad (años), sexo (hombre/mujer), tiempo de diagnóstico de HTA (meses), presión arterial sistólica y diastólica media de las dos últimas visitas, presencia al inicio del estudio de obesidad (IMC >30 kg/m2), diabetes mellitus (DM), dislipemia y consumo de tabaco. La selección de las variables incluidas en el modelo final se efectuó combinando criterios estadísticos y sustantivos19,20. Se evaluaron los efectos de confusión y de interacción entre las variables del modelo. Asimismo, se comprobó el supuesto de proporcionalidad de riesgos para las diferentes covariables y para el grupo de las incluidas en el modelo final, así como la presencia de multicolinealidad. Los datos cuantitativos se describen mediante la estimación de la media y la desviación estándar en el caso de seguir una distribución normal; en caso contrario, se emplea la mediana acompañada del intervalo intercuartílico (IQR). Las estimaciones relacionadas directamente con el objetivo del estudio se acompañan de sus respectivos intervalos de confianza (IC) del 95%. El grado de significación estadística aceptado fue una p <0,05. El análisis de los datos se realizó con el paquete estadístico SPSS 15.0 para Windows.
RESULTADOS
De las 265 personas que formaban la cohorte al inicio del estudio sólo se pudo estimar el FG en 223 (84,2%). La relación y los motivos de exclusión fueron: 25 (9,4%) por presentar un IMC >35 kg/m2 y 17 (6,4%) por otros motivos, como el consumo de fármacos que bloquearan la secreción de creatinina, la presencia de hepatopatía grave y la falta de disponibilidad de cifras de creatinina.
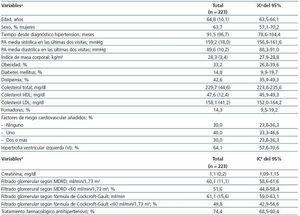
Las características de los participantes al inicio del seguimiento, los valores analíticos medios, la frecuencia de los distintos factores de riesgo cardiovascular (FRC), la distribución de la estimación del FG de acuerdo con las fórmulas del Cockcroft-Gault y MDRD y la proporción con tratamiento farmacológico antihipertensivo se exponen en la tabla 1.
La mediana de tiempo de seguimiento fue de 10,7 (IQR 6,5-12,1) años. El seguimiento fue completo en 191 participantes (85,7%) e incompleto en un total de 32(14,3%). Estos últimos diferían, en comparación con los primeros, en la edad media (68,5 frente a 64,2 años) y el tiempo medio de diagnóstico de hipertensión (149 frente a 82 meses), y la distribución del resto de variables de estudio fue similar en ambos grupos.
La supervivencia acumulada, proporción de participantes que permanecieron libres de eventos cardiovasculares al final del estudio, fue del 64,7% (IC del 95%, 57,9-71,6%). La tasa media de incidencia de ECV durante todo el período de seguimiento fue de 3,6 (IC del 95%, 2,7-4,4%) por 100 personas hipertensas/año.
La distribución de la estimación de FG al inicio del estudio con ambas fórmulas se expone en la tabla 2. La concordancia entre ambas estimaciones fue moderada (kappa = 0,501; IC del 95%, 0,399-0,604). La mayoría de los pacientes se clasificaban en los estadíos 2 y 3 mediante ambas fórmulas. Dentro del estadío 3, el estadío 3a era más frecuente: un 86,8% en el caso del cálculo realizado con la fórmula de Cockcroft-Gault y un 76,1% en el de la fórmula MDRD.
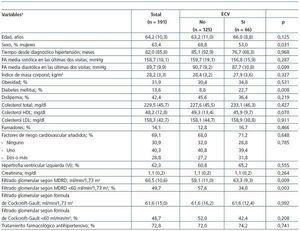
Los resultados obtenidos en el análisis bivariado, en el que se comparaban los participantes según hubieran sufrido o no algún ECV durante el seguimiento, se exponen en la tabla 3. Sólo la presencia de DM se relacionaba con una mayor probabilidad de presentar, como mínimo, un ECV durante el seguimiento. Por el contrario, el sexo femenino y el FG <60 ml/min/1,73 m2 según la fórmula MDRD se asociaban con un menor riesgo de presentar un ECV. Sin embargo, no se encontró asociación entre la aparición de ECV y el FG estimado mediante la fórmula de Cockcroft-Gault.
En el modelo multivariable final (tabla 4) únicamente el FG ≥ 60ml/min/1,73 m2 mediante fórmula MDRD y la presencia de DM al inicio del estudio se relacionaron con un mayor riesgo cardiovascular.
DISCUSIÓN
En el presente estudio, el FG moderadamente reducido no comporta un mayor riesgo cardiovascular. Incluso los pacientes con FG según fórmula MDRD >60 ml/min/1,73 m2 presentan una mayor incidencia de eventos, en sentido contrario al descrito en la literatura2,21. Estos resultados no se confirman con la medida del FG según fórmula de Cockcroft-Gault.
La fórmula MDRD es útil para estimar FG inferiores a 60 ml/min/1,73 m2 y tiene tendencia a infraestimar valores superiores14,15,22. Su autor ha descrito recientemente12 la nueva ecuación CKD-EPI que tiene mayor precisión que la MDRD para FG >60 ml/min/1,73 m12. La fórmula de Cockcroft-Gault, que también es adecuada para estos valores de FG, infraestima menos la función renal en valores por encima de 60 ml/min/1,73 m2.
Otros trabajos han obtenido resultados contradictorios en cuanto al comportamiento de la fórmula MDRD según los estadíos de insuficiencia renal.
En un estudio realizado en nuestro medio con una cohorte retrospectiva de población general entre 35 y 75 años de edad y en estadío 3 de función renal (FG entre 30 y 60 ml/min/1,73 m2), Buitrago et al14 describían que la fórmula de Cockcroft-Gault detectaba más ERC oculta en hombres, con mayor riesgo cardiovascular y más edad. MDRD, en cambio, lo hacía más en el caso de mujeres, con más obesidad, cifras más elevadas de presión arterial diastólica y triglicéridos. La ecuación MDRD podría obviar, pues, casos de gran importancia desde el punto de vista de prevención cardiovascular. La concordancia hallada por estos autores entre las estimaciones realizadas con ambas fórmulas era moderada, resultado similar al observado en el presente estudio. Por otra parte, al igual que en nuestro estudio, tampoco evidenciaron relación entre la ERC oculta detectada por una u otra fórmula y la morbimortalidad cardiovascular23. Lo mismo ha ocurrido en otros estudios de mayor tamaño muestral, como el NHANES-I24, en población general norteamericana.
Esto cuestiona la importancia del FG como herramienta predictiva de riesgo cardiovascular por sí sola, o al menos la utilidad del estadío 3 considerado como un bloque25. Ciertamente, distintos estudios observaron que el riesgo aumentaba significativamente con FG inferiores a 45 ml/min/1,73 m2 (estadío 3b), siendo el riesgo de los pacientes con FG superior (estadío 3a) comparable a los de función renal normal2,26. En nuestro estudio la mayoría de pacientes en estadío 3 corresponden al estadío 3a, tanto por fórmula de Cockcroft-Gault como por MDRD.
La controversia entre fórmulas persiste incluso en los estadíos más avanzados de insuficiencia renal (4 y 5), para los que algunos autores proponen la superioridad de la fórmula de Cockcroft-Gault frente a la MDRD27.
Asimismo, la edad avanzada atenúa la relación del FG estimado con la morbimortalidad según han mostrado algunos estudios28. Otros autores29 no han registrado ningún incremento de la mortalidad en ancianos con FG entre 45 y 59 ml/min/1,73 m2. Otros factores, como el sexo, también podrían influir en el valor pronóstico del FG: se ha descrito una menor correlación en mujeres25,30 que, precisamente, son mayoría en nuestra muestra.
En relación con otros estudios2-4 que sí han encontrado relación entre FG reducido y morbimortalidad cardiovascular, un primer bloque correspondía a población general. La edad media en nuestro estudio es superior a la de los pacientes de Go et al. y de Hallan et al., lo que puede contribuir a un distinto riesgo cardiovascular y a variar la importancia pronóstica de la función renal. El trabajo de Keith et al., con una edad media de la muestra similar a la nuestra, observó que las diferencias pronósticas entre los estadíos 2 y 3 eran inferiores al 5%, con significación estadística en grandes muestras, pero no en aquellas menos numerosas como la nuestra. Asimismo, en el trabajo de Go et al. se describió que las mayores diferencias pronósticas se establecían con FG <45 ml/min/1,73 m2 (estadíos 3b a 5), sobre todo entre 60 y 80 años, y con FG <30 ml/min/1,73 m2 en mayores de 80 años, siendo francamente menores entre estadíos con mejor función renal.
En estudios en población hipertensa, Ruilope et al.31 sí evidenciaron un valor predictivo del FG, pero en pacientes con alto riesgo cardiovascular.
Nuestro estudio presenta, por otra parte, ciertas limitaciones. Una de ellas radicaba en una mayor probabilidad de pérdidas por la larga duración del seguimiento (mayor que la de otros trabajos), lo que puede aumentar la posibilidad de un sesgo de selección que repercutiera en la validez interna. Sin embargo, una serie de estrategias17 permitieron que el porcentaje de pérdidas fuera finalmente del 14,3%.
Otro inconveniente sería la falta de seguimiento de algunos parámetros, como la evolución del FG en el tiempo. Esto podría ser de gran importancia, ya que recientemente se ha descrito que la velocidad de declive de la función renal en personas de >65 años es más importante en relación al riesgo cardiovascular que la creatinina basal32.
Tampoco se registraron sistemáticamente al inicio del estudio la albuminuria o la proteinuria. En 1993 su determinación no figuraba en los protocolos de evaluación del paciente hipertenso. Diversos estudios han hecho hincapié en la importancia de este parámetro con valor pronóstico superior al FG estimado por MDRD. Hemmelgarn et al.26 observaron un mayor riesgo cardiovascular y la progresión de deterioro renal en pacientes con estadíos 1-2 y proteinuria en comparación con pacientes en estadío 3a sin ella. Asimismo, el estudio PREVEND33 demostró que individuos con FG <60 ml/min/1,73 m2 sin proteinuria no presentan mayor riesgo cardiovascular que los de FG superior. Combinar FG reducido y proteinuria podría mejorar la predicción de riesgo25,26,34.
Otros marcadores, como la cistatina C, han demostrado recientemente ser predictores de riesgo cardiovascular y de afectación renal en pacientes ancianos con FG >60 ml/min/1,73 m2, en mayor medida que el FG según MDRD25,35, como ocurre con la citada fórmula CKD-EPI15. Sin embargo, se tiene poco acceso a ambos métodos en AP.
Finalmente, no se evaluó la esperable influencia del tratamiento antihipertensivo u otros, como el hipolipemiante o el antiagregante, durante el seguimiento.
En conclusión, el presente estudio no evidencia un mayor riesgo cardiovascular en población hipertensa con FG moderadamente reducido.
Las fórmulas estimativas de FG, por sí solas, recomendadas actualmente por las guías de práctica clínica, podrían ser de menor utilidad para la predicción de ECV en hipertensión arterial, al no reflejar el riesgo real de algunas poblaciones importantes. Podría ser recomendable considerar la redefinición de los valores de función renal de riesgo (estadíos 3 o 3b) y evaluar el posible beneficio de incorporar el sexo y el valor de la albuminuria para mejorar el valor predictivo del FG estimado. Los pacientes hipertensos con estadíos 2-3a son los más prevalentes en AP y, por tanto, en los que es más necesario definir las mejores estrategias de prevención cardiovascular.
AGRADECIMIENTOS
Este estudio ha sido posible, en primer lugar, gracias a la colaboración de todo el EAP «Gòtic» de Barcelona que ha contribuido al seguimiento óptimo de los pacientes. Además, ha contado con el apoyo del IDIAP Jordi Gol, así como la ayuda (FIS Exp. PI040356) del Instituto de la Salud Carlos III del Ministerio de Ciencia e Innovación. Los autores del estudio declaran la no existencia de conflictos de intereses.
Tabla 1. Características de la cohorte de estudio al inicio del seguimiento (n = 223)
Tabla 2. Distribución de la población de estudio según los valores de filtrado glomerular (FG) al inicio del estudio estimados con las fórmulas de MDRD y Cockcroft-Gault
Tabla 3. Características al inicio del estudio de los pacientes que completaron el seguimiento (n = 191) según la aparición o no de eventos cardiovasculares (ECV) durante el mismo
Tabla 4. Modelo final de regresión de Cox para determinar el poder predictivo de eventos cardiovasculares de las variables de estudio a los 12 años de seguimiento de la cohorte de personas hipertensas (n = 223)