El remdesivir es el único tratamiento antiviral que ha demostrado ser útil frente al SARS-CoV-2 acortando el tiempo de hospitalización frente a placebo. Su efecto en pacientes trasplantados renales (TR) se limita a algunos casos publicados.
Material y métodosEstudio retrospectivo observacional de los pacientes TR que ingresaron entre el 1 de agosto de 2020 hasta el 31 de diciembre de 2020 con neumonía por SARS-CoV-2 y recibieron remdesivir.
El objetivo es describir la experiencia de una cohorte de pacientes TR con neumonía por SARS-CoV-2 tratados con remdesivir.
Resultados37 pacientes TR ingresaron por infección secundaria a SARS-CoV-2, 7 de ellos recibieron tratamiento con remdesivir. El resto de pacientes fueron excluidos por CKD-EPI menor a 30mL/min o por no presentar criterios clínicos. Además de remdesivir, todos recibieron dexametasona y anticoagulación. Cuatro eran hombres, siendo la mediana de edad de 59 (53-71) años. La mediana de tiempo post-trasplante fue de 43 (16-82) meses. Todos los pacientes presentaban neumonía y requirieron oxigenoterapia de bajo flujo al ingreso, precisando en tres de ellos oxigenoterapia de alto flujo durante el ingreso. Dos presentaron deterioro de la función del injerto al diagnóstico, no precisando en ningún caso hemodiálisis, y recuperándose al alta. Dos pacientes elevaron 1,5 veces el valor normal de las transaminasas. Ningún paciente falleció ni precisó ingreso en unidad de críticos. La mediana de días de ingreso fue de 12 (9-27) días.
ConclusionesNuestro estudio sugiere que el uso de remdesivir podría ser útil en los pacientes TR con neumonía por SARS-CoV-2 sin presentar efectos secundarios. Son necesarios más estudios con un mayor número de pacientes para ampliar el conocimiento de este fármaco en la infección por SARS-CoV-2.
Remdesivir is the only antiviral treatment that has been shown to be useful against SARS-CoV-2 infection. It shorts hospitalization time compared to placebo. Its effects in kidney transplant (KT) patients are limited to some published cases.
MethodsWe performed a retrospective observational study that included all KT patients admitted between August 1st, 2020 and December 31st, 2020 with SARS-CoV-2 pneumonia who received remdesivir.
The objective of this study was to describe the experience of a cohort of KT patients treated with remdesivir.
DiscussionA total of 37 KT patients developed SARS-CoV-2 infection, 7 of them received treatment with remdesivir. The rest of the patients did not receive the drug due to either CKD-EPI less than 30mL/min or they did not present clinical criteria. In addition to remdesivir, all patients received dexamethasone and anticoagulation therapy. 4 were men, the median age was 59 (53–71) years. Median time from transplantation was 43 (16–82) months. Chest X-rays of all patients showed pulmonary infiltrates and required low-oxygen flow therapy upon admission, requiring high-flow nasal therapy in 3 cases. Only 2 cases presented deterioration of the graft function, not requiring hemodialysis in any case, and all recovered renal function at hospital discharge. 2 patients rise up 1.5 times the liver function test. No patient died or required admission to the critical care unit. Median days of admission was 12 (9–27) days.
ConclusionsOur study suggests that the use of remdesivir could be useful in KT patients with SARS-CoV-2 pneumonia without side effects. Additional studies are necessary with a larger number of patients to improve the knowledge of this drug in SARS-CoV-2 infection.
El coronavirus es un patógeno humano y animal. A finales de 2019, un nuevo coronavirus, severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2), fue identificado como causa de neumonía en un grupo de pacientes en Wuhan, ciudad de la provincia de Hubei (China)1. El virus SARS-CoV-2, conocido anteriormente como 2019-nCoV, es el agente responsable de la coronavirus disease 2019 (COVID-19)2. La COVID-19 es similar a los síndromes respiratorios agudos graves en su patogenia, espectro clínico y epidemiología1–3. Puede manifestarse como una infección asintomática o sintomática, mostrando un espectro que va desde la neumonía leve hasta la grave. La infección se puede dividir en tres fases: infección leve, la fase pulmonar y la fase inflamatoria4. Dada la propagación de la enfermedad, así como la situación epidemiológica actual, se están estudiando diversos tratamientos para la infección. El remdesivir es el único fármaco antiviral que ha demostrado ser útil en la fase pulmonar frente al SARS-CoV-2 acortando el tiempo de hospitalización frente a placebo3.
Existe un grupo poblacional especialmente vulnerable a esta enfermedad, no solo por tratarse de pacientes inmunodeprimidos, sino por tratarse también de enfermos renales, que son los pacientes trasplantados renales (TR). En los estudios antes mencionados no se incluyeron pacientes TR para valorar la eficacia del remdesivir, siendo su efecto en esta población limitado a algunos casos publicados5. En un estudio observacional que incluyó a 46 pacientes con neumonía por SARS-CoV-2 con insuficiencia renal crónica (16), trasplantados renales (8) e insuficiencia renal aguda (22), la mediana de días desde el ingreso hasta inicio de remdesivir fue de 5 (1-26) días, encontrándose 36 pacientes (78,2%) en diálisis al inicio de la terapia con remdesivir. De ellos, el tratamiento no se completó en seis pacientes a causa de fallecimiento por evolución clínica de la enfermedad y se detuvo el tratamiento en dos pacientes por mejoría clínica. Un único paciente presentó reacción a la infusión; se observaron cambios de comportamiento transitorios en cinco casos y se observó gota aguda en un paciente mientras se encontraba bajo tratamiento. En este estudio se observa buena tolerancia al remdesivir en pacientes con enfermedad renal crónica, incluso en pacientes con diálisis6.
En cuanto a las posibles interacciones entre el remdesivir y el tratamiento inmunosupresor, no hay casos descritos de interacción. Sin embargo, dada la poca experiencia en el campo de interacción de ambos tratamientos, es recomendable tener precaución y realizar una vigilancia estrecha de la concentración de inmunosupresión durante la coadministración con remdesivir debido a la falta de conocimiento y estudios que evalúen la seguridad7.
Dada la escasa evidencia sobre el uso de remdesivir en pacientes TR, sería preciso incluir este grupo de pacientes en situación de vulnerabilidad en ensayos clínicos randomizados, pero a la espera de que esto ocurra, es esencial describir el efecto del remdesivir en esta población.
El objetivo de nuestro estudio fue describir de forma retrospectiva la evolución de los pacientes TR con infección por SARS-CoV-2 que recibieron tratamiento con remdesivir.
Material y métodosPoblación a estudio y diseñoSe realizó un estudio observacional descriptivo retrospectivo que incluyó todos los adultos TR que se encontraban en seguimiento en el Hospital Universitario Germans Trias i Pujol, diagnosticados de COVID-19 entre el 1 de agosto de 2020 hasta el 31 de diciembre de 2020 y que recibieron tratamiento con remdesivir. Se recogieron las características clínicas de los pacientes, los datos de laboratorio, los tratamientos recibidos, el manejo de la inmunosupresión, la función del injerto y la evolución, siendo estos datos extraídos de la historia clínica de los pacientes. Dada la naturaleza descriptiva del estudio no se solicitó consentimiento informado. El estudio fue aprobado por el Comité Ético del hospital.
TratamientoTratamiento antiviralEl remdesivir es un antiviral análogo de nucleótidos que bloquea la ácido ribonucleico (RNA) polimerasa. Un ensayo clínico realizado en China no demostró diferencias estadísticamente significativas en el tiempo frente a la mejora clínica entre remdesivir y placebo8. En cambio, los resultados de un ensayo clínico internacional muestran un tiempo menor hasta la recuperación con remdesivir respecto a placebo (10 días frente a 15 días)3. La indicación médica actualmente autorizada en nuestro país es en pacientes hospitalizados con neumonía secundaria a SARS-CoV-2 con un máximo de siete días desde el inicio de los síntomas, que requieran oxígeno suplementario de bajo flujo y que cumplan dos de los siguientes criterios: frecuencia respiratoria (FR) mayor a 24rpm, saturación de O2 (SatO2) menor a 94% a aire ambiente y la presión parcial de oxígeno entre la ratio de fracción inspirada de oxígeno (PaO2/FiO2) menor de 300mmHg. El remdesivir está contraindicado en pacientes con alanina aminotransferasa (ALT) por encima de cinco veces el límite superior de la normalidad y en pacientes con filtrado glomerular medido por CKD-EPI menor a 30mL/min/1,73m2, y su uso no está recomendado en pacientes que requieren oxigenoterapia de alto flujo, ventilación mecánica (invasiva o no invasiva), oxigenación de membrana extracorpórea (ECMO), ni en pacientes que requieren drogas vasoactivas para mantener presión arterial, mujeres embarazadas, lactantes ni pacientes con evidencia de fracaso multiorgánico. Siguiendo las recomendaciones de la Organización Nacional de Trasplante (ONT) se estableció el mismo protocolo que se aplica a la población general9. A los pacientes se les administró una dosis de carga el primer día de 200mg por vía endovenosa, seguido de una dosis de mantenimiento de 100mg al día por vía endovenosa, con una duración de cinco días. El protocolo empleado a nivel de nuestro hospital fue según las recomendaciones de tratamiento farmacológico de pacientes adultos con infección por SARS-CoV-2 en el ámbito del Sistema sanitari integral d’utilització pública de Catalunya (SISCAT)10.
Tratamiento con corticoesteroidesLos pacientes con COVID-19 con más de 7 días desde el inicio de los síntomas y con satO2 menor a 94% a aire ambiente que necesitaron oxigeno adicional, ventilación mecánica o ECMO11 fueron candidatos a tratamiento con dexametasona a dosis de 6mg/24h vía oral o endovenosa durante 10 días.
Tratamiento anticoagulanteTodos los pacientes con COVID-19 recibieron tratamiento con enoxaparina profiláctica a dosis de 1mg/kg/día en pacientes con CKD-EPI mayor a 30mL/min/1,73m2 y 0,5mg/kg/día en pacientes con CKD-EPI menor a 30mL/min/1,73m2.
Análisis estadísticoLos resultados se muestran en las variables cualitativas con número (fracciones) y en las variables cuantitativas como medianas (rango intercuartílico).
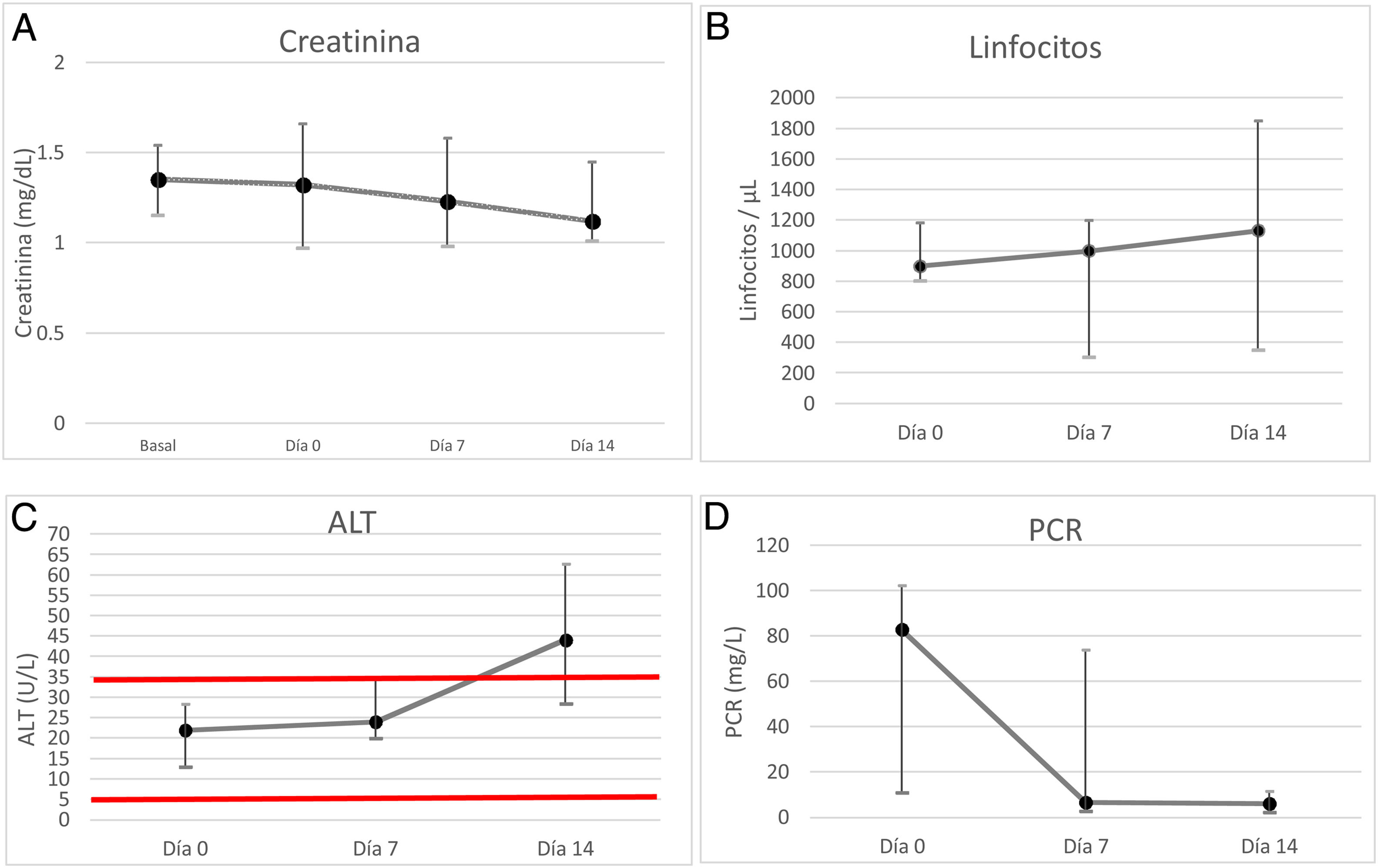
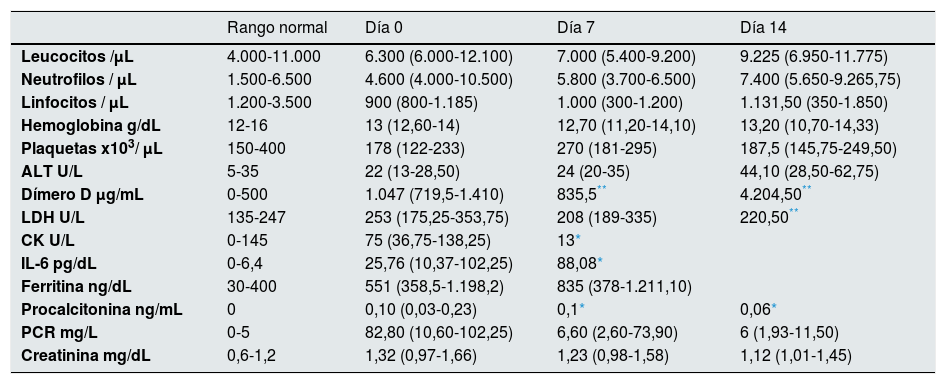
ResultadosDe un total de 37 pacientes TR que ingresaron con neumonía por SARS-CoV-2, siete recibieron tratamiento con remdesivir habiendo transcurrido 6 (3-9) días de mediana desde el inicio de los síntomas. El resto de pacientes fueron excluidos por CKD-EPI menor a 30mL/min o por no presentar criterios clínicos. La mediana de edad fue de 59 (53-71) años. Las características demográficas y la inmunosupresión que recibieron se muestran en la tabla 1. La mediana de tiempo post-trasplante fue de 43 (16-82) meses, siendo la mediana de función renal al ingreso CKD-EPI 47 (40-75) mL/min/1,73m2. La manifestación clínica más frecuente fue disnea (6/7), seguida de tos seca (5/7), taquipnea (5/7) y fiebre (4/7). Todos los pacientes presentaron infiltrados bilaterales en la radiografía y precisaron oxigenoterapia de bajo flujo al ingreso con una PaO2/FiO2 inicial de 325 (206-373), siendo necesaria oxigenoterapia de alto flujo en tres de ellos a lo largo del ingreso. En todos los pacientes se suspendió el tratamiento inmunosupresor el día del ingreso, manteniendo únicamente dexametasona 6mg. La mediana de tiempo hasta re-introducción del tacrolimus fue de 10 (8-18) días. En cuanto al MPA, se inició únicamente en dos pacientes transcurridos dos meses desde el alta. La tabla 2 muestra las características analíticas de los pacientes. Dos presentaron deterioro de la función del injerto por necrosis tubular aguda de origen multifactorial secundario a hipovolemia, nefrotóxicos e infección por SARS-CoV-2 en el momento del ingreso, previo al inicio de remdesivir, con creatinina pico de 2,2mg/dL el día del ingreso en el primer caso, y creatinina pico de 2mg/dL en un paciente recién trasplantado, no precisando hemodiálisis en ningún caso y recuperando función renal normal al décimo día de ingreso en ambos casos (fig. 1-A). La linfopenia presentó su caída máxima al ingreso, recuperándose posteriormente de forma progresiva (fig. 1-B). La ALT ascendió progresivamente, considerándose efecto adverso leve secundario al tratamiento con remdesivir, no llegando a duplicar el límite de la normalidad en ningún caso (fig. 1-C) y la PCR disminuyó progresivamente durante el ingreso (fig. 1-D). Ningún paciente sufrió otros efectos secundarios al tratamiento, no falleció ni precisó ingreso en unidad de críticos. La mediana de días de ingreso fue de 12 (10-18) días.
Antecedentes y tratamiento
| Antecedentes (n = 7) | |
|---|---|
| Sexo | Hombres: 4Mujeres: 3 |
| HTA | 6 |
| DLP | 5 |
| DM | 2 |
| IMC > 30 | 2 |
| Enfermedad pulmonar | 2- 1: SAHS- 1: TBC pasada |
| VitD < 20 (ng/mL) | 2 |
| ERC | No filiada: 4PQRAD: 3 |
| Trasplante renal | Cadáver ME: 7Inducción timoglobulina: 3 |
| Tratamiento (n = 7) | |
|---|---|
| Antibiótico | 4 |
| Remdesivir | 7 |
| Dexametasona | 7 |
| Anticoagulación | 7 |
| Tacrolimus | Tomaba: 7Retirado: 7Re-introducción: 10 (8-18) días |
| Ácido micofenólico | Tomado: 6Retirado: 6Re-introducción: 4 no re-introducido; en 2 pacientes a los 55 días de mediana. |
| iMTOR | Tomado: 0 |
| IECA | Tomaba: 2Retirado durante ingreso: 1Reintroducido al alta: 1 |
HTA: hipertensión arterial; DLP: dislipemia; DM: diabetes mellitus; IMC: índice de masa corporal; VitD: vitamina D; ERC: enfermedad renal crónica. iMTOR: inhibidores de la mammalian target of rapamycine; IECA: inibidor de la enzima convertidora de angiotensina.
Biomarcadores de inflamación en trasplantados renales con neumonía por COVID-19
| Rango normal | Día 0 | Día 7 | Día 14 | |
|---|---|---|---|---|
| Leucocitos /μL | 4.000-11.000 | 6.300 (6.000-12.100) | 7.000 (5.400-9.200) | 9.225 (6.950-11.775) |
| Neutrofilos / μL | 1.500-6.500 | 4.600 (4.000-10.500) | 5.800 (3.700-6.500) | 7.400 (5.650-9.265,75) |
| Linfocitos / μL | 1.200-3.500 | 900 (800-1.185) | 1.000 (300-1.200) | 1.131,50 (350-1.850) |
| Hemoglobina g/dL | 12-16 | 13 (12,60-14) | 12,70 (11,20-14,10) | 13,20 (10,70-14,33) |
| Plaquetas x103/ μL | 150-400 | 178 (122-233) | 270 (181-295) | 187,5 (145,75-249,50) |
| ALT U/L | 5-35 | 22 (13-28,50) | 24 (20-35) | 44,10 (28,50-62,75) |
| Dímero D μg/mL | 0-500 | 1.047 (719,5-1.410) | 835,5** | 4.204,50** |
| LDH U/L | 135-247 | 253 (175,25-353,75) | 208 (189-335) | 220,50** |
| CK U/L | 0-145 | 75 (36,75-138,25) | 13* | |
| IL-6 pg/dL | 0-6,4 | 25,76 (10,37-102,25) | 88,08* | |
| Ferritina ng/dL | 30-400 | 551 (358,5-1.198,2) | 835 (378-1.211,10) | |
| Procalcitonina ng/mL | 0 | 0,10 (0,03-0,23) | 0,1* | 0,06* |
| PCR mg/L | 0-5 | 82,80 (10,60-102,25) | 6,60 (2,60-73,90) | 6 (1,93-11,50) |
| Creatinina mg/dL | 0,6-1,2 | 1,32 (0,97-1,66) | 1,23 (0,98-1,58) | 1,12 (1,01-1,45) |
A. Evolución de la creatinina en laboratorio de los pacientes trasplantados renales (n = 7) partiendo de la creatinina basal y su evolución durante el ingreso (día 0, día +7, y día +14). La mediana de la creatinina y su rango intercuartílico muestran una estabilidad de la función renal durante el ingreso.
B. Evolución de los linfocitos en laboratorio de los pacientes trasplantados renales (n = 7) desde el ingreso (día 0, día +7, y día +14). La mediana de los linfocitos y su rango intercuartílico muestran un ascenso progresivo desde el ingreso, con inicio de recuperación sin llegar a normalizarse el día 14.
C. Evolución de la enzima ALT en laboratorio de los pacientes trasplantados renales (n = 7) desde el ingreso (día 0, día +7, y día +14). La mediana de la ALT y su rango intercuartílico muestran un ascenso progresivo durante el ingreso. Las líneas rojas horizontales muestran los valores de normalidad.
D. Evolución de la PCR en laboratorio de los pacientes trasplantados renales (n = 7) desde el ingreso (día 0, día +7, y día +14). La mediana de la PCR y su rango intercuartílico muestran un descenso en los primeros siete días de ingreso.
El tratamiento de la COVID-19 a día de hoy es desconocido, por lo que se han intentado diferentes líneas terapéuticas, entre ellas el remdesivir3. El presente estudio describe la evolución de un grupo de pacientes TR con COVID-19 tratados con remdesivir.
El remdesivir es un fármaco análogo de nucleósidos con actividad antiviral. Como inhibidor de la ácido ribonucleico (ARN) polimerasa, puede inhibir la replicación de múltiples coronavirus en las células epiteliales respiratorias. En modelos de monos infectados con síndrome respiratorio de Oriente Medio (MERSCoV), el tratamiento con remdesivir 24 horas previas a la infección podía prevenir completamente los síntomas, inhibiendo la replicación viral en el tracto respiratorio y previniendo la formación de lesiones pulmonares. Al administrar remdesivir 12 horas después de la infección se observaron claros beneficios clínicos, reduciendo síntomas, replicación de virus a nivel pulmonar, así como lesiones pulmonares12. En estudios en humanos el remdesivir mostró disminución de los días de ingreso frente a placebo al administrarse al día 9 (7-12) de la infección3. En nuestro estudio se inició 6 (3-9) días tras inicio de los síntomas de mediana. Por ello cabría esperar que, a menor tiempo de evolución de la enfermedad, más efectivo debería ser el tratamiento con remdesivir.
Un estudio enfocado en la detección de efectos secundarios que incluyó 8 pacientes TR no mostró efectos adversos graves6. No hemos encontrado otras series que valoren la eficacia del remdesivir en los pacientes TR con COVID-19.
En cuanto al manejo de la inmunosupresión, es un tema complejo en el contexto de una infección grave, no solo por la propia infección, sino también por la posible interacción con los fármacos utilizados para el tratamiento de la neumonía por SARS-CoV-2. Es importante mencionar que, hasta la fecha, el remdesivir no ha mostrado interacciones con inhibidores de la calcineurina, antimetabolitos, ni iMTOR13,14, aunque tambien es cierto que el remdesivir puede inducir las enzimas citocromo p450, incluidas CYP1A2, CYP2B6 y CYP3A413,14. En nuestro estudio, en todos los pacientes se suspendió la inmunosupresión con inhibidores de la calcineurina y antimetabolitos al diagnóstico previo al inicio con remdesivir. Ninguno de ellos había padecido previamente rechazo y por ello, valorando el beneficio frente al potencial riesgo, se mantuvo tratamiento únicamente con esteroides.
Los principales efectos secundarios del remdesivir son la hepatotoxicidad y la nefrotoxicidad3. El remdesivir está actualmente contraindicado en pacientes con ALT cinco veces por encima del límite superior de la normalidad y en pacientes con filtrado glomerular menor a 30mL/min/1,73m2. Beigel et al. publicaron una cohorte de 155 pacientes con infección por SARS-CoV-2 tratados con remdesivir, en la que únicamente un 1% tuvo que discontinuar el tratamiento por fracaso renal agudo3. Natasha et al. no encontraron mayor incidencia de efectos adversos, deterioro de función renal ni elevación de transaminasas entre paciente con filtrado glomerular mayor y menor a 30mL/min/1,73m215. En nuestro estudio sólo hubo dos casos de deterioro de la función renal previo a la administración de remdesivir. En cuanto a la hepatotoxicidad, hubo un incremento lento, aunque progresivo, de la ALT, pero apenas duplicaron el valor normal de las transaminasas.
El remdesivir es el único tratamiento antiviral que ha demostrado ser útil en la fase pulmonar frente al SARS-CoV-2, acortando el tiempo de recuperación frente a placebo (mediana de 10 días vs. 15 días)3 y acortando la estancia hospitalaria en los pacientes que recibieron dicho tratamiento frente a placebo (mediana 12 días frente a 17 días)3. En una revisión que incluyó 420 casos de la primera ola, donde ningún paciente recibió tratamiento con remdesivir, la duración de la hospitalización fue de 16 (1-100) días16. En el mismo periodo en España, los días de ingreso fueron de 14 (8-21) días17. En nuestro estudio, la mediana de días de ingreso y recuperación en pacientes TR con neumonía por SARS-CoV-2 fue de 12 (10-18) días, sugiriendo una disminución de los días de ingreso en pacientes TR cuando reciben tratamiento con remdesivir.
Los resultados de diferentes estudios muestran una mortalidad del 28% a las 3 semanas en los pacientes TR en comparación con el 1% al 5% de la población general previo a la aprobación de remdesivir18. En el estudio de Villanego et al., de los 1.011 casos incluidos, 548 correspondían a la primera ola y 463 a la segunda (93,6% y 80,4%, respectivamente, del total de pacientes recogidos en el registro). En la segunda ola, los pacientes TR eran más jóvenes, el 18,4% eran asintomáticos y presentaron menos casos de neumonía (49,7% vs. 80,5%). Con respecto a la primera ola, hubo cambios en el tratamiento con un mayor uso de remdesivir y esteroides. Ritonavir/lopinavir, hidroxicloroquina y azitromicina apenas fueron usados en la segunda ola. La hospitalización disminuyó (63,3% en la segunda ola frente al 90% de la primera), pero más receptores de TR ingresaron en la UCI cuando se analizaron sólo los pacientes hospitalizados en la segunda ola. La mortalidad global en esta cohorte fue menor (incluso excluyendo los casos asintomáticos) durante la segunda ola (15,1%) comparado con la primera ola (27,4%) (p < 0,001). La mortalidad en pacientes hospitalizados también fue menor (22,9% en la segunda ola frente a 29,5% en la primera, p < 0,04). Sin embargo, en los pacientes TR críticos la mortalidad fue del 66,7%, no significativamente diferente al reportado en la primera ola (58,1%)17. En nuestra serie de pacientes tratados con remdesivir durante 5 días, la evolución fue favorable, sin necesidad de unidad de críticos y pudiendo ser dados de alta con una mortalidad del 0%, lo que sugiere que el remdesivir podría ser un tratamiento efectivo.
En cuanto al pronóstico, Beigel et al. sugieren que el tratamiento con remdesivir en población general puede haber evitado la progresión a una enfermedad respiratoria más grave, así como disminuir el uso de los escasos recursos sanitarios durante la pandemia3. En nuestro estudio, todos los pacientes presentaban infiltrados bilaterales en la radiografía y precisaron oxigenoterapia de bajo flujo al diagnóstico. Tras el inicio de tratamiento con remdesivir únicamente 3 pacientes precisaron oxigenoterapia de alto flujo sin precisar en ningún caso ingreso en unidad de críticos ni ventilación mecánica invasiva.
Con respecto a la incidencia de insuficiencia renal aguda, en la revisión mencionada previamente, que incluye los trasplantados renales de la primera ola, se describe una incidencia del 44%, siendo en la población general del 29%16. Una proporción sustancial de los que desarrollaron fracaso renal (23%) precisó de terapia renal sustitutiva. Del resto de pacientes, la mayoría de los casos recuperó función renal al alta16. En nuestro estudio de pacientes tratados con remdesivir hubo dos casos de deterioro de la función renal con empeoramiento de 1,5 veces el valor basal al diagnóstico. En cuanto a la causa del deterioro de la función renal, se atribuyó a necrosis tubular aguda secundaria a hipovolemia, nefrotóxicos e infección por SARS-CoV-2 (sin realización de biopsia renal en ningún caso), no siendo atribuido como efecto secundario a remdesivir en ninguno de los casos, con recuperación progresiva durante el ingreso hasta creatinina basal al décimo día del ingreso.
Nuestro estudio es una de las primeras cohortes publicadas de TR con neumonía COVID-19 tratados con remdesivir y analiza su eficacia y seguridad. Por otra parte, se trata de un estudio observacional retrospectivo y con un pequeño tamaño muestral con sus consecuentes sesgos.
ConclusionesNuestro estudio sugiere que los pacientes TR con infección por SARS-CoV-2 bajo tratamiento con remdesivir presentan buena evolución clínica con ausencia de efectos adversos y baja mortalidad. A nivel renal, el remdesivir es bien tolerado en pacientes trasplantados renales, sin evidenciar casos de nefrotoxicidad secundario al fármaco. Son necesarios más estudios con un mayor número de pacientes y controlados para ampliar el conocimiento de este fármaco en la infección por SARS-CoV-2 en pacientes trasplantados renales.
- 1.
El remdesivir es el único tratamiento antiviral que ha demostrado ser útil frente al SARS-CoV-2 acortando el tiempo de hospitalización frente a placebo.
- 2.
En estudios en animales, el remdesivir muestra mejor efecto antivírico a inicio más temprano del fármaco.
- 3.
Los principales efectos adversos del remdesivir son la nefrotoxicidad y la hepatotoxicidad. Sin embargo, existen estudios observacionales que sugieren buena tolerancia al remdesivir en pacientes con ERC, incluso en pacientes en diálisis y trasplante.
- 4.
El remdesivir en pacientes trasplantados renales se ha administrado sin efectos adversos.
- 5.
No hay interacciones descritas entre el remdesivir y el tratamiento inmunosupresor. Sin embargo, dada la poca experiencia, es recomendable mantener una vigilancia activa de la concentración de inmunosupresor cuando se administren concomitantemente.
- 6.
Los pacientes TR con infección por SARS-CoV-2 bajo tratamiento con remdesivir presentan buena evolución clínica con ausencia de efectos adversos y baja mortalidad.
Ninguna.
Conflicto de interesesLos autores no tienen conflictos de intereses.