La infección por el SARS-CoV-2 (COVID-19) ha supuesto un importante impacto en la actividad trasplantadora en nuestro país. Era esperable que la mortalidad y el riesgo de complicaciones asociadas a la COVID-19 en el receptor de trasplante renal (TR) fueran mayores debido a su condición de inmunosupresión y a las frecuentes comorbilidades asociadas. Desde el inicio de la pandemia en marzo del 2020 hemos mejorado rápidamente nuestro conocimiento acerca de la epidemiología, características clínicas y manejo de la COVID-19 postrasplante, redundando en un mejor pronóstico para nuestros pacientes. Las unidades de TR han sabido adaptar sus programas a esta nueva realidad, normalizándose la actividad tanto de donación como de trasplante en nuestro país.
Este manuscrito presenta una propuesta de actualización de las recomendaciones generales para la prevención y el tratamiento de la infección en esta población tan vulnerable como son los receptores de un trasplante renal.
SARS-CoV-2 infection (COVID-19) has had a significant impact on transplant activity in our country. Mortality and the risk of complications associated with COVID-19 in kidney transplant (KT) recipients were expected to be higher due to their immunosuppressed condition and the frequent associated comorbidities. Since the beginning of the pandemic in March 2020 we have rapidly improved our knowledge about the epidemiology, clinical features and management of COVID-19 post-transplant, resulting in a better prognosis for our patients. KT units have been able to adapt their programs to this new reality, normalizing both donation and transplantation activity in our country.
This manuscript presents a proposal to update the general recommendations for the prevention and treatment of infection in this highly vulnerable population such as KT.
La pandemia por COVID-19 ha creado desafíos sin precedentes para los programas de trasplante de órganos sólidos (TOS). Durante los primeros meses de la pandemia, la mayoría de programas de donación y trasplante de órganos redujeron su actividad, o directamente la suspendieron, ante el colapso de las unidades de cuidados intensivos y la dedicación casi exclusiva a la atención de pacientes con COVID-19, especialmente severa en individuos inmunosuprimidos. Con posterioridad, la actividad se ha ido recuperando, y las unidades de trasplantes han ido adaptando los programas a la nueva realidad1,2 hasta prácticamente normalizarse.
Es bien conocido que la incidencia y la tasa de mortalidad por COVID-19 en la población trasplantada renal son superiores a las de la población general, y este peor pronóstico se ha asociado con variables como la edad avanzada o la neumonía grave3,4. Por ello fue uno de los colectivos priorizados para recibir las primeras vacunas frente al SARS-CoV-2 en España5. Sin embargo, han desarrollado una inmunización subóptima por sus características inherentes (inmunosupresión, edad avanzada, enfermedad renal crónica [ERC])6–8. Esto ha generado que, a pesar de las elevadas tasas de vacunación, los pacientes con trasplante renal (TR) sigan presentando una mayor tasa de enfermedad grave e incluso mortalidad por SARS-CoV-29.
Este manuscrito tiene como objetivo actualizar las recomendaciones ya publicadas en el año 202010 sobre la infección por SARS-CoV-2 en la población portadora de TR teniendo en cuenta el contexto epidemiológico actual.
Consideraciones específicas respecto a la donación y el trasplanteUna de las preocupaciones más importantes de los responsables del TR es la necesidad de que este sea seguro para los donantes vivos, receptores y personal sanitario que participa en esta actividad11. La transmisión de la infección COVID-19 a través del trasplante de órganos es excepcional, y cada vez existe más experiencia sobre la utilización de riñones procedentes de donantes COVID-19 positivos, sin que se hayan notificado reacciones adversas en los receptores12,13.
La Organización Nacional de Trasplantes (ONT), en colaboración con las Coordinaciones Autonómicas de Trasplante y el Grupo Corona-TOS, han elaborado un documento14 en el que se recogen las recomendaciones respecto a la donación y el trasplante de órganos en relación con la infección por COVID-19.
Recomendaciones para la evaluación y selección del donante fallecido con respecto a la infección SARS-CoV-2- •
La evaluación del potencial donante de órganos exige una historia clínica detallada y el cribado microbiológico para SARS-CoV-2 a fin de descartar, plantear la sospecha o, en su caso, confirmar el diagnóstico de COVID-19. No se recomienda la realización sistemática de TC torácica como prueba de cribado en potenciales donantes asintomáticos.
- •
Se realizará cribado microbiológico universal de los potenciales donantes de órganos para SARS-CoV-2. El cribado debe basarse en una PCR en tiempo real (RT-PCR) en una muestra de tracto respiratorio obtenida, idealmente, en las 24h previas a la extracción de órganos.
- •
En los potenciales donantes sin antecedente documentado de COVID-19 y con RT-PCR negativa para SARS-CoV-2 en el cribado, se procederá con la donación de órganos.
- •
En los donantes con diagnóstico previo de COVID-19 se procederá con la donación de órganos siempre que se cumplan todos los requisitos siguientes:
- a.
que haya transcurrido un periodo mínimo de 14 días desde el inicio de los síntomas o del diagnóstico microbiológico en caso de personas asintomáticas;
- b.
que el potencial donante haya permanecido un periodo mínimo de 72h libre de síntomas;
- c.
que el potencial donante presente un resultado negativo para SARS-CoV-2 por RT-PCR en una muestra de tracto respiratorio obtenida el mismo día de la donación.
- •
En los donantes con RT-PCR positiva para SARS-CoV-2 (ya sea en el contexto de un diagnóstico previo de COVID-19 o si el diagnóstico se realiza en el momento de la donación), se procederá a la donación renal, siempre que el fallecimiento NO sea atribuible a la COVID-19. Los órganos procedentes de estos donantes se utilizarán preferiblemente en receptores que presenten serología positiva frente a SARS-CoV-2 o hayan recibido una pauta completa de vacunación (tres o más dosis) o tengan antecedentes de COVID-19. De realizar el trasplante en este contexto, se obtendrá consentimiento informado específico y se realizará una monitorización del receptor con RT-PCR en muestra de tracto respiratorio (antes del TR y en los días 3 y 7 después del mismo).
- •
Se recomienda realizar la valoración de donantes con respecto al SARS-CoV-2 con las mismas premisas especificadas para el donante fallecido.
- •
Se recomienda retrasar la donación si existe sospecha clínica fundamentada o diagnóstico confirmado de COVID-19 en el donante, hasta que haya transcurrido un periodo mínimo de 14 días desde el inicio de los síntomas y un período mínimo de 72h libre de síntomas. Es recomendable que el potencial donante presente un resultado negativo para SARS-CoV-2 por RT-PCR antes de la donación. En caso de que no se produzca la negativización de esta prueba, se procederá a una valoración individualizada riesgo/beneficio de cada caso.
- •
En el supuesto de que el potencial donante haya sido un contacto estrecho de un caso confirmado de COVID-19, se recomienda retrasar la donación hasta que hayan transcurrido siete días y se haya confirmado la negatividad de la RT-PCR para SARS-CoV-2.
- •
Ha de incluirse en los consentimientos informados para la donación de vivo información sobre los aspectos relevantes relativos a la infección COVID-19.
- •
Antes del trasplante renal
- -
Historia clínica exhaustiva.
- -
Si el candidato presenta una prueba positiva para COVID-19, se recomienda excluirlo temporalmente hasta que haya transcurrido un periodo mínimo de 14 días desde el inicio de los síntomas y un periodo mínimo de 72h libre de síntomas. Es recomendable que el paciente presente un resultado negativo para SARS-CoV-2 mediante RT-PCR antes del trasplante. En caso de que no se produzca la negativización de dicha prueba, se procederá a una valoración individualizada riesgo/beneficio atendiendo a la situación clínica de cada paciente.
- -
En el supuesto de que el potencial receptor sea contacto estrecho de un caso confirmado de COVID-19, se recomienda retrasar la realización del trasplante hasta que hayan transcurrido siete días desde el último contacto y se haya confirmado la negatividad de la RT-PCR para SARS-CoV-2.
- -
Descartar infección activa por SARS-CoV-2 con una RT-PCR de exudado nasofaríngeo negativa y ausencia de síntomas durante al menos 72h
- -
Revisar las hojas de información y el consentimiento informado. En situación de pandemia es aconsejable incorporar información específica sobre COVID-19.
- -
Intensificar el grado de información que se transmite a los pacientes, especialmente de los riesgos de la COVID-19 postrasplante.
- -
En cualquier situación de TR electivo (p. ej., donante vivo), repetir RT-PCR y confirmar su negatividad.
- -
Realizar detección de anticuerpos anti-IgG SARS-CoV-2 en suero; su presencia sugiere menor riesgo de infección severa.
- -
Limitar indicación y dosis de tratamiento de inducción con anticuerpos policlonales.
- •
Después del trasplante renal11
- -
Medidas estrictas de aislamiento durante el post-TR inmediato.
- -
Si hay función inmediata, limitar al máximo la estancia del ingreso de trasplante (4-6 días).
- -
Si hay función retardada, seguimiento ambulatorio y en hospital de día, con hemodiálisis a demanda.
- -
Desde el momento del alta, limitar al máximo las visitas presenciales, fomentando la consulta de telemedicina.
- •
Se recomienda el uso de mascarillas (preferiblemente FFP2) en espacios cerrados o en aglomeraciones.
- •
Mantener una higiene correcta:
- -
Lavarse las manos frecuentemente con agua y jabón durante al menos 20s, o bien con un desinfectante para manos a base de alcohol (al menos 60% de alcohol), especialmente: después de ir al baño, antes de comer, después de sonarse la nariz, toser o estornudar y después del contacto directo con personas enfermas o su entorno.
- -
Evitar tocarse los ojos, la nariz y la boca antes de lavarse las manos.
- •
Evitar el contacto o mantener una distancia de al menos dos metros con personas que padecen síntomas de infección respiratoria (fiebre, tos, dolores musculares generalizados, dolor de garganta o dificultad respiratoria), y no compartir con ellas las pertenencias personales.
- •
Seguir una correcta alimentación. Evitar compartir comida y utensilios (cubiertos, vasos, servilletas, pañuelos, etc.) y otros objetos sin limpiarlos debidamente.
- •
Evite el consumo de tabaco y alcohol. Además de ser perjudiciales para la salud, estas sustancias debilitan el sistema inmunológico, por lo que el organismo es más vulnerable ante enfermedades infecciosas.
- •
Evitar las grandes aglomeraciones. Se recomienda no asistir a lugares donde pueda haber aglomeraciones o excesivo contacto con otras personas.
- •
Se recomienda ventilar periódicamente los ambientes con aire fresco, abrir las ventanas.
- •
Ante una sospecha de infección por SARS-CoV-2 en un paciente trasplantado renal debe realizarse una prueba diagnóstica de infección activa: un test rápido de detección de antígenos o una prueba de detección de ARN viral mediante RT-PCR en exudado nasofaríngeo.
- •
En caso de infección asintomática o leve, deben consultar a su médico especialista de trasplante o al de atención primaria (preferiblemente mediante comunicación telefónica), para recibir la atención adecuada.
- •
En caso de infección grave debe acudir al servicio de urgencias del hospital de referencia.
A pesar de los nuevos tratamientos frente al SARS-CoV-2, que comentaremos más adelante, los pacientes receptores de TR siguen siendo un grupo muy vulnerable, presentando tasas de progresión a COVID-19 grave y mortalidad muy superiores a los de la población general15. Por ello, resulta fundamental el desarrollo de medidas preventivas en este grupo de pacientes.
Hasta hace poco la vacunación era la única opción de inmunización disponible. No obstante, el efecto de la inmunosupresión tiene un impacto negativo en la respuesta serológica a la vacuna de los pacientes trasplantados16–19. Datos del estudio SENCOVAC revelan que hasta un 37,6% de los receptores de TR no desarrollaron anticuerpos tras 2 dosis de una vacuna de ARNm, lo que llevó a administrar una tercera y cuarta dosis20–23. El reciente desarrollo de anticuerpos monoclonales capaces de bloquear la entrada del virus a las células del huésped ha supuesto una alternativa prometedora en la inmunización de los trasplantados16,24.
VacunasDesde la aprobación de las primeras vacunas frente al SARS-CoV-2 en Europa, la Sociedad Española de Nefrología se posicionó a favor de la inmunización prioritaria de los pacientes con ERC, especialmente aquellos en terapia renal sustitutiva (TRS)25. Actualmente está indicada la vacunación en todos los pacientes TR y especialmente en aquellos que se encuentran en lista de espera de trasplante, ya que se ha observado que se logra una mayor tasa de respuesta que con la vacunación postrasplante23,26. Los inmunosupresores, especialmente antimetabolitos, rituximab y belatacept, son factores de riesgo de ausencia de respuesta a la vacuna. Actualmente se está llevando a cabo un ensayo clínico de fase 4 para evaluar si la suspensión del MMF mejora la respuesta a la vacuna en este grupo de pacientes (https://clinicaltrials.gov/ct2/show/NCT05060991). La experiencia publicada hasta ahora es escasa, con pequeñas series en las que no parece haber diferencias, por lo que no podemos hacer recomendaciones al respecto27–29. Hasta la fecha la única estrategia que ha demostrado ser eficaz en los pacientes TR es la administración de dosis de vacunas repetidas. Otros factores de riesgo identificados para la falta de seroconversión tras la vacuna son la edad, el tiempo postrasplante y la insuficiencia renal16,18.
Se han dispuesto en estos meses de varios tipos de vacuna (tabla 1):
Pautas de inmunización frente al SARS-CoV-2 en pacientes receptores de trasplante renal
| Vacunas | Vacunación primaria | Primera dosis de recuerdob | Segunda dosis de recuerdob | ||
|---|---|---|---|---|---|
| Vacuna | Tipo de vacuna | Pauta inicial | Dosis adicionala | ||
| Comirnaty® (Pfizer BioNTech) | Vacuna ARNm | Dos dosis de 0,3ml, separadas 21 días | Una dosis de 0,3ml de Comirnaty® ≥28 días después de la 2.ª dosis(puede sustituirse por una dosis 0,5ml de Spikevax®) | Una dosis de 0,3ml ≥5 meses de la última dosis(Puede sustituirse por una dosis 0,25ml de Spikevax® o 0,5ml de Novaxovid®) | Una dosis de 0,3ml ≥5 meses de la última dosis (Puede sustituirse por una dosis 0,25ml de Spikevax®) |
| Spikevax® (Moderna) | Vacuna ARNm | Dos dosis de 0,5ml, separadas 28 días | Una dosis de 0,5ml de Spikevax® ≥28 días después de la 2.ª dosispuede sustituirse por una dosis 0,3ml de Comirnaty®) | Una dosis de 0,25ml ≥5 meses de la última dosis(Puede sustituirse por una dosis 0,25ml de Comirnaty® o 0,5ml de Novaxovid®) | Una dosis de 0,3ml ≥5 meses de la última dosis (Puede sustituirse por una dosis 0,25ml de Spikevax®) |
| Vaxzevria® (AstraZeneca) | Vacuna de vector viral | Dos dosis de 0,5ml, separadas de 4-12 semanas | Una dosis de 0,3ml de Comirnaty® o 0,5ml de Spikevax® ≥28 días después de la 2.ª dosis | Una dosis de 0,3ml de Comirnaty®, 0,25ml de Spikevax® o 0,5ml de Nuvaxovid ≥3 meses después de la última dosis | Una dosis de 0,3ml ≥5 meses de la última dosis (Puede sustituirse por una dosis 0,25ml de Spikevax®) |
| Jcovden® (Janssen [Johnson and Johnson]) | Vacuna de vector viral | Una dosis de 0,5ml | Una dosis de 0,3ml de Comirnaty® o0,5ml de Spikevax® ≥28 días después de la 2.ª dosis | Una dosis de 0,3ml de Comirnaty®, 0,25ml de Spikevax® o 0,5ml de Nuvaxovid® ≥3 meses después de la última dosis | Una dosis de 0,3ml ≥5 meses de la última dosis (Puede sustituirse por una dosis 0,25ml de Spikevax®) |
| Nuvaxovid® (Novavax) | Vacuna de subunidades proteicas | Dos dosis de 0,5ml, separadas 21 días | Una dosis de 0,5ml de Nuvaxovid® ≥6 meses después de la última dosis | Una dosis de 0,3ml ≥5 meses de la última dosis (Puede sustituirse por una dosis 0,25ml de Spikevax®) | |
| Anticuerpos monoclonales | Dosis | ||||
| tixagevimab/cilgavimab (Evusheld®) | 150mg de tixagevimab y 150mg de cilgavimab administrados como dos inyecciones intramusculares secuenciales separadas, pudiéndose repetir su administración a los 6 meses. En valoración aumentar la dosis de Evusheld® a 300mg de cilgavimab y 300mg de tixagevimab para asegurar la eficacia frente a las nuevas variantes de SARS-CoV-2. | ||||
- •
BNTb162b2 (Comirnaty®; Pfizer-BioNTech): Fue la primera vacuna de este tipo en aprobarse. Demostró una efectividad del 95% en la reducción del número de casos de COVID-19 sintomáticos en grupos de riesgo de progresión a enfermedad grave30. Aunque en el ensayo clínico no se incluyeron pacientes inmunodeprimidos, actualmente contamos con series que reportan una reducción de aproximadamente el 54% en la tasa de hospitalización y progresión a enfermedad grave en receptores de TOS31, que asciende hasta el 78% tras la tercera dosis32. La pauta de 2 dosis no parece haber demostrado beneficios en la supervivencia9 y la tasa de seroconversión tras 3 dosis en los receptores de TOS se sitúa en torno al 70%33.
- •
mRNA-1273 (Spikevax®; Moderna): La tasa de respuesta serológica parece ser mayor que la observada con la vacuna BNTb162b2 en receptores de TOS, en torno al 68%34,35, datos del registro español de COVID-19 reportaron una mayor supervivencia en pacientes TR vacunados con 2 dosis de mRNA-1273 e infección por SARS-CoV-2 frente a los que habían recibido 2 dosis de BNTb162b29. Se han postulado diversas explicaciones para estos resultados: la mayor dosis administrada en cada vial, la diferente composición lipídica de las nanopartículas utilizadas para transportar el contenido de ARNm en cada vacuna y, por último, el mayor tiempo entre dosis para mRNA-1273.
- •
ChAdOx1 nCov-19 (Vaxzevria®; AstraZeneca): Dado que en los ensayos clínicos iniciales no se disponían de datos en grupos de riesgo y solo se habían incluido pacientes entre 18 y 55 años, las vacunas ARNm se reservaron para los grupos más vulnerables y la indicación de Vaxzevria® se mantuvo principalmente para personas del grupo 3 y grupo 4 (colectivos con función esencial para la sociedad [fuerzas y cuerpos de seguridad, personal de educación]) de 18 a 55 años36. No obstante, una vez iniciada la campaña de vacunación, hubo un pequeño porcentaje de pacientes TR que, al compartir características con estos grupos y con el objetivo de alcanzar la inmunidad en el menor tiempo posible, recibieron Vaxzevria®9,20,36–38. Las series publican tasas de seroconversión significativamente inferiores a las descritas con las vacunas ARNm, situándose en torno al 15%38.
- •
Ad26.COV.2 (Jcovden®; Janssen [Johnson and Johnson]): La experiencia en pacientes inmunodeprimidos es muy escasa. Sin embargo, dada su composición, no están contraindicadas en los pacientes TR. Según datos del estudio SENCOVAC, apenas un 0,5% de los pacientes con ERC en España la han recibido y no se han publicado series que aporten datos en vida real20. En una serie en la que se incluyeron 12 TOS, indujo una tasa de seroconversión de 17%39,40.
- •
NVX-CoV2373 (Nuvaxovid®; Novavax): Nuvaxovid se compone de la proteína recombinante de la espícula del SARS-CoV-2 purificada junto con el adyuvante Matrix-M basado en saponina. Desencadenan respuestas inmunitarias de linfocitos B y T a la proteína S. Ha sido la última vacuna en aprobarse en nuestro país y hasta la fecha no disponemos de datos concretos en pacientes trasplantados41. Su principal indicación es la de contraindicación a las vacunas disponibles o vacunación incompleta por reacciones adversas graves a las vacunas de ARNm por antecedentes de alergia a algunos de sus componentes (principalmente el polietilenglicol [PEG] en el caso de vacunas ARNm y el polisorbato 80 en vacunas de adenovirus). Nuvaxovid también contiene polisorbato 80 existiendo la posibilidad de una reacción cruzada con PEG, aunque la evidencia de esto es aún muy limitada23.
Inicialmente la pauta propuesta fue de dos dosis para las vacunas de Pfizer-Biontech, Moderna, AstraZeneca y Novavax y de una sola dosis para la de Jannsen. Sin embargo, por los datos que mostraban falta de respuesta en una proporción significativa de casos y una disminución de la efectividad a lo largo del tiempo, en septiembre de 2021 se indicó la administración de una dosis de recuerdo, preferiblemente con vacunas ARNm a administrar pasados al menos 28 días de la última dosis recibida21–23. Por otra parte, la publicación de series con casos graves de infección por SARS-CoV-2 y altas tasas de mortalidad en pacientes TR ponían de manifiesto una menor protección de las vacunas en esta población9. Así, en febrero de 2022 se aprobó la administración de una dosis adicional en pacientes de alto riesgo, entre los que se encuentran los receptores de TR. Para esta dosis adicional, se pueden emplear vacunas de ARNm o Nuvaxovid®. Su administración se hará a los 5 meses de la última dosis en caso de haber recibido exclusivamente vacunas ARNm o Nuvaxovid®, mientras que aquellos pacientes a los que se les haya administrado una dosis de Janssen o 2 dosis de Vaxzevria®, la dosis adicional se podrá administrar a partir de los 3 meses21–23.
La ausencia de vacunación pretrasplante no contraindica el TR, pero, como hemos comentado, es altamente aconsejable que el paciente se vacune antes del mismo. En los que no hubiesen completado la pauta, se aconseja seguir con la vacunación a partir del tercer mes postrasplante. Asimismo, es conveniente esperar este mismo periodo antes de administrar la siguiente dosis en los que hayan recibido corticoides a dosis inmunosupresoras o inmunomoduladores biológicos y no biológicos. Si se le ha administrado rituximab, deberemos retrasar la siguiente dosis de la vacuna al menos 6 meses23. En relación a la primovacunación, en el caso de que el paciente haya pasado la infección por SARS-CoV-2 se le administrará la dosis que corresponda cuando esté completamente recuperado, sin necesidad de esperar23.
Según la última recomendación del Ministerio de Sanidad, se aconseja una nueva dosis de recuerdo en las personas con condiciones de riesgo independientemente del número de dosis recibidas y del número de infecciones previas42. Esta dosis de recuerdo también se recomienda en convivientes con personas con alto grado de inmunosupresión y se realizará con las nuevas vacunas ARNm bivalentes (frente a la cepa original y frente a nuevas variantes ómicron). En esta actualización de septiembre de 2022, se indica que «las vacunas de Moderna BA.1 y Pfizer BA.4/5 (vacunas disponibles actualmente) son dos alternativas adecuadas y no hay evidencia para favorecer a una u otra», sin embargo, los linajes actualmente predominantes en España son BA.4 y BA.5. Se administrará al menos 5 meses desde la última dosis de ARNm. En el caso de una infección reciente por SARS-CoV-2, esta dosis de recuerdo se administrará respetando un periodo de 3 meses tras la infección. Se recomienda su administración conjunta con la vacuna de la gripe y con las vacunas frente al neumococo si es posible. Aquellas personas que no hubieran completado la primovacunación (incluida la dosis adicional en personas con inmunosupresión), la completarán lo antes posible42.
Anticuerpos monoclonales- •
Tixagevimab/cilgavimab (Evusheld®): Es una combinación de dos anticuerpos monoclonales IgG1k de acción prolongada, cilgavimab y tixagevimab, derivados de células B de pacientes convalecientes con infección por SARS-CoV-2 indicada como profilaxis pre-exposición en grupos de riesgo de desarrollo de enfermedad grave. En España ha sido incluido en la Estrategia de Vacunación frente a COVID-19 como complemento a la vacunación en las personas de ≥12 años y que pesen al menos 40kg con alto grado de inmunosupresión y que no responden adecuadamente a la vacunación, entre las que se encuentran los receptores de TOS24. Se deben administrar como inyecciones intramusculares secuenciales separadas en diferentes lugares de inyección en dos músculos diferentes, preferiblemente en los glúteos. La eficacia y seguridad de Evusheld® se ha estudiado en el ensayo PROVENT43, de fase 3, demostrando una reducción del 83% en el riesgo de enfermedad grave. En este estudio los participantes del grupo de Evusheld® sufrieron eventos cardiovasculares más graves que los de grupo placebo, aunque no se ha establecido una relación causal entre Evusheld® y estos eventos43. Previa a su administración, la persona tendrá que haber recibido al menos 3 dosis de la vacuna, salvo contraindicación a la misma, y disponer preferentemente de una prueba serológica realizada al menos 15 días tras la administración de la misma. Hasta ahora se había establecido que un título de anticuerpos frente a la proteína S menor de 260BAU/ml se consideraba una respuesta inadecuada a la vacunación. Sin embargo, dado que no se ha validado el umbral frente a las nuevas variantes de interés esta cifra se puede considerar orientativa y se deberá tener en cuenta el grado de inmunosupresión del paciente y riesgo individual de infección. También serían candidatas aquellas personas de riesgo en las que no es posible completar la pauta de vacunación, ya sea por contraindicación a las vacunas frente al COVID-19 o por haber desarrollado reacciones adversas graves asociadas a la vacunación. En el caso de haber pasado la infección por el SARS-CoV-2 recientemente, podrán recibir Evusheld® al menos 6 meses tras la infección43. En las últimas recomendaciones de la Ponencia de Programa y Registro de Vacunaciones, tras la revisión realizada en septiembre de 2022 en la Unión Europea, la posología en profilaxis pre-exposición se mantiene en 300mg de Evusheld® (150mg tixagevimab y 150mg cilgavimab) recomendando administración de nueva dosis también de 150mg de tixagevimab/150mg de cilgavimab a los 6 meses después de la primera administración42.
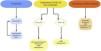
La vacunación y la inmunización pasiva con anticuerpos monoclonales no son excluyentes (fig. 1). La administración de anticuerpos monoclonales se aconseja al menos 15 días después de la vacunación, mientras que las vacunas COVID-19 se pueden administrar a la vez o en cualquier momento después de la administración de Evusheld®42,44.
Recomendaciones sobre la prevención y el tratamiento de la infección por SARS-CoV-2..
MAB: anticuerpos monoclonales; IL-6: Interleucina-6; KJ: Kinasa Janus.
1Vacunación e inmunización pasiva con MAB no son excluyentes. Para administrar MAB se aconseja al menos 15 días desde la vacunación; las vacunas COVID-19 pueden administrarse simultáneamente o en cualquier momento después del MAB.
2Evitarlo si interacciones farmacológicas, por lo que no suele indicarse como primera opción en trasplantados. Existen propuestas de ajuste de dosis en FGe<30ml/min/1,73 m2, no avalados en práctica clínica52.
3Aunque limitadas, algunas experiencias publicadas no muestran mayor toxicidad en ERC avanzada54,55. Algunas guías plantean su uso con FGe<30ml/min/1,73m2, valorando los riesgos-beneficios45.
4Indicados, en general, si la respuesta de anticuerpos IgG anti-S se considera inadecuada para el grado de inmunosupresión del paciente (tabla 2).
5Menor eficacia que otras terapias anti-COVID-19.
La información acerca del tratamiento de COVID-19 está en continua evolución. Hay en marcha numerosísimos estudios controlados y randomizados sobre distintas terapias frente a la infección por SARS-CoV-2 por lo que las evidencias en este campo están sometidas a rápidos cambios. Actualmente tratamientos ampliamente recomendados hace unos meses, tales como hidroxicloroquina, lopinavir/ritonavir, azitromicina o interferón, han sido descartados por falta de eficacia15,16. El empleo de plasma hiperinmune está también cada vez más discutido considerándose no indicado antes de la aparición de Ómicron, aunque en la actual situación epidemiológica no hay evidencias suficientes y podría considerarse, junto a otras estrategias, en situaciones de inmunodepresión grave15,16,45,46.
Tratamiento de pacientes con COVID-19 no severoLos receptores de TOS son considerados pacientes de alto riesgo de evolución a COVID-19 grave por lo que puede estar indicado el tratamiento con antivirales o anticuerpos monoclonales neutralizantes (MAB) existiendo aprobación para ello de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS)47.
Las alternativas terapéuticas existentes actualmente se detallan a continuación (fig. 1). Las dosis e interacciones con el tratamiento inmunosupresor aparecen resumidas en la tabla 2.
Pautas de tratamiento y recomendaciones sobre antivirales y anticuerpos monoclonales empleados frente a SARS-CoV-2
| Fármaco | Periodo de administración desde el inicio de los síntomas | Dosis | Interacciones con anticalcineurínicos e inhibidores mTOR | Recomendaciones | ||
|---|---|---|---|---|---|---|
| FGe (ml/min/1,73m2) | ||||||
| >60 | 59-30 | <30 | ||||
| Nirmatrelvir/ritonavir | 5 primeros días | Nirmatrelvir 300mg/2 cp+ritonavir 100mg/1 cp/cada 12hVía: oralDuración: 5 días | Nirmatrelvir 150mg/1 cp+ritonavir 100mg/1 cp/cada 12hDuración: 5 días | No recomendado | Interacción elevada con exposición aumentada de los inmunosupresores | Uso en COVID-19 leve-moderado.Requiere ajuste mediante niveles.Emplear con gran precaución en pacientes trasplantados.Preferible MAB o remdesivir en el paciente trasplantado |
| Remdesivir | 7 primeros días para COVID-19 leve-moderado.10 primeros días para COVID-19 grave | Día 1: dosis única de 200mgA partir del día 2: 100mg/una vez al díaVía: perfusión IVDuración: En COVID-19 leve-moderado, 3 días. En COVID-19 grave, 5 días (puede prolongarse a 10) | Igual dosis | No recomendado | No interacción | Indicado en COVID-19 leve-moderado si no hay disponibilidad de serología o IgG anti-S>260 BAU/ml*.Puede también emplearse en COVID-19 grave |
| Molnupiravir | 5 primeros días | 800mg/4 cp/cada 12hVía: oralDuración: 5 días | Igual dosis | Igual dosis | No interacción | Uso en COVID-19 leve-moderado.Menor eficacia.Experiencia limitada en trasplantados |
| Sotrovimab | 5 primeros días | 500mg.Vía: perfusión IVDuración: dosis única | Igual dosis | Igual dosis | No interacción | Indicado en COVID-19 leve-moderado o grave.Realizar serología IgG anti-S.Indicado si serología negativa o título de anticuerpo IgG anti-S <260BAU/mla |
| Bebtelovimab | 7 primeros días | 175mg.Vía: perfusión IVDuración: dosis única | Igual dosis | Igual dosis | No interacción | Aprobado en EE. UU. en COVID-19 leve-moderado solo si no se considera adecuado nirmatrelvir/ritonaviro remdesivir.No dispone de aprobación actual por la EMA |
| Tixagevimab/cilgavimab | 7 primeros días | 300mg/300mgVía: IMDuración: dosis única | Igual dosis | Igual dosis | No interacción | Aprobado por la EMA en COVID-19 que no requiere suplemento de oxígeno, con riesgo de progresar a enfermedad severa. |
Cp: comprimidos/cápsulas; EMA: Agencia Europea de Medicamentos; FGe: tasa de filtrado glomerular estimado; IM: intramuscular; IV: intravenoso; MAB: anticuerpo monoclonal.
a Este punto de corte es orientativo dada la gran variabilidad de los test comerciales. Además de valorar la cuantificación de los títulos de anticuerpos frente a la proteína S, se debe tener en cuenta el grado de inmunosupresión del paciente. Es decir, la interpretación del resultado de la serología tendrá que llevarse a cabo junto con las características del paciente en cuanto a su grado de inmunosupresión y el riesgo individual de infección y en caso de ser el resultado mayor de 260BAU/ml debe valorarse de manera individualizada4,76.
- •
Nirmatrelvir/ritonavir (Paxlovid®): Nirmatrelvir coadministrado con ritonavir ha demostrado un 89% de reducción en hospitalización o muerte en pacientes con COVID-19 leve o moderado con riesgo de progresión a enfermedad severa cuando se administra dentro de los 5 primeros días de inicio de los síntomas48. Sin embargo, ritonavir es un potente inhibidor del citocromo P450 (CYP A3) y de la P-glicoproteína condicionando una intensa interacción con anticalcineurínicos e inhibidores mTOR por lo que se precisa la suspensión temporal y/o descenso de dosis de estos inmunosupresores. Una vez finalizado el tratamiento con ritonavir la actividad del CYP A3 necesita unos días para su recuperación. Por todo ello, la administración de nirmatrelvir/ritonavir requiere ajuste de las dosis de inmunosupresores y realización de niveles de estos fármacos lo que puede complicar su empleo en los pacientes trasplantados con COVID-19, aunque no lo contraindica49. El grupo del New York Presbiterian Hospital ha propuesto un protocolo de manejo de tacrolimus y ciclosporina en pacientes tratados con nirmatrelvir/ritonavir, publicando aceptables resultados49,50. No obstante, la experiencia publicada hasta ahora en trasplantados es muy limitada. La Sociedad Americana de Trasplante recomienda otros tratamientos (MAB o remdesivir) con preferencia sobre nirmatrelvir/ritonavir, por los riesgos asociados con este fármaco, aunque sugiere también estrategias de uso en caso de optarse por él51. Por otro lado, en pacientes con insuficiencia renal moderada la dosis deber ser reducida (con un ajuste de dosis que no ha sido clínicamente testado) y no se recomienda con filtrado glomerular estimado (FGe) inferior a 30ml/min/1,73m2. Basándose en la farmacología de nirmatrelvir, Hiremath S. et al hacen una propuesta de ajuste de dosis en pacientes con FGe menor de 30ml/min/1,73m2 o en diálisis52. No obstante, no hay hasta ahora estudios que avalen esta propuesta por lo que el uso en estos casos debe realizarse con extremada precaución, valorando estrechamente riesgos y beneficios y optando prioritariamente por otras opciones terapéuticas no contraindicadas en ERC avanzada.
- •
Remdesivir (Veklury®): Es un inhibidor de la polimerasa de RNA dependiente de RNA viral que inhibe la replicación del virus, con actividad in vitro frente a SARS-CoV-2. Ha mostrado acelerar la curación en pacientes hospitalizados con neumonía COVID-19, especialmente en aquellos que no requieren oxígeno o que precisan oxígeno a bajo flujo45,46. Por otro lado, más recientemente, el estudio PINETREE puso de manifiesto que un curso de 3 días de tratamiento en pacientes ambulatorios disminuyó un 87% el riesgo de hospitalización o muerte frente a placebo53. Basándose en ello, un ciclo de 3 días de tratamiento con este antiviral se considera indicado en pacientes inmunodeprimidos con riesgo de progresión a enfermedad grave, como los trasplantados, en los 7 primeros días desde el inicio de los síntomas, si no se dispone de tratamientos efectivos con MAB45–47. Los ensayos clínicos han excluido a los pacientes con FGe inferior a 30ml/min/1,73m2. Se ha planteado que remdesivir podría causar daño tubular dependiente de la dosis o por acumulación del excipiente sulfobutiléter-beta-ciclodextrina en pacientes con función renal disminuida, por lo que se considera contraindicado en estos casos15,16,45,46. Sin embargo, los resultados son contradictorios y experiencias recientes no muestran mayor toxicidad cuando se usa en pacientes con ERC avanzada54,55. Las guías del Instituto Nacional de la Salud (NIH) de EE. UU., por ello, plantean la posibilidad de que sea usado en pacientes con FGe inferior a 30ml/min/1,73m2 si se considera que los beneficios pueden superar el riesgo, debiendo ser suspendido si se detecta un aumento mayor de 10 veces en los valores de ALT u otras evidencias de inflamación hepática45.
- •
Molnupiravir (Lagevrio®): Es un antiviral ribonucleósido que ha sido aprobado también para pacientes con COVID-19 no severo, dentro de los 5 días de inicio de los síntomas, si bien parece menos efectivo que otros antivirales y que sotrovimab56,57. No es excretado a nivel renal por lo que se considera que puede ser usado con seguridad independientemente de la función renal. Está contraindicado en el embarazo por ser teratogénico, lo que debe advertirse a los pacientes45,46. La experiencia en trasplantados es limitada58. Es aconsejado en aquellos casos en los que nirmatrelvir/ritonavir, sotrovimab o remdesivir no puedan ser usados15,16,45–47.
La respuesta a la vacuna en los pacientes trasplantados es muy pobre, especialmente tras 1 o 2 dosis. Los datos del registro COVID-19 de la Sociedad Española de Nefrología no mostraron mejoría en la supervivencia en los pacientes trasplantados renales que habían recibido dos dosis de vacuna frente a los no vacunados9. Esto ha generado un gran interés por la inmunización pasiva. Los MAB dirigidos frente a la proteína spike del SARS-CoV-2 han emergido como una nueva terapia para reducir la carga viral y disminuir el riesgo de progresión a enfermedad grave. Varias formulaciones han ido apareciendo en los últimos meses (bamlanivimab, casirivimab/imdevimab, bamlanivimab-etesevimab, sotrovimab, bebtelovimab, tixagevimab/cilgavimab). Son MAB anti-spike diseñados para bloquear el dominio de unión al receptor del virus, interfiriendo así en su entrada en la célula. Han demostrado eficacia en pacientes seronegativos hospitalizados que requieren oxígeno de bajo flujo15,16,45,46. Algunos estudios sugieren un efecto adverso si se administran a pacientes que han desarrollado anticuerpos neutralizantes endógenos desconociéndose los posibles mecanismos de este daño y si es o no específico de algunos MAB45. Asimismo, en pacientes no hospitalizados con infección reciente (3-7 días desde el inicio de los síntomas) y con factores de riesgo de progresión a formas severas de COVID-19, han mostrado reducir significativamente esta progresión y disminuir las hospitalizaciones. Sin embargo, la rápida aparición de mutaciones ha hecho que la mayoría de estos MAB carezcan de eficacia frente a las nuevas cepas del virus. Solo sotrovimab, bebtelovimab y tixagevimab/cilgavimab han mantenido potencial actividad frente a ómicron, aunque con limitaciones que comentaremos a continuación15,16,45–47.
- •
Sotrovimab (Xevudy®): Está aprobado en nuestro país para el tratamiento de COVID-19 en pacientes con anticuerpos frente a SARS-CoV-2 negativos o títulos bajos que presenten enfermedad leve-moderada o grave, inicio reciente (5 días desde el comienzo de los síntomas) y factores de riesgo de mala evolución (como los trasplantados)47. Recientemente hemos comunicado la experiencia con este MAB en 82 trasplantados renales con COVID-19 en nuestro país59. Observamos una excelente tolerancia incluso en pacientes con muy alta comorbilidad o con estadios avanzados de ERC, y la administración en las fases iniciales de la enfermedad se asoció con disminución de la necesidad de soporte ventilatorio, ingreso en la UCI y mortalidad.
Sotrovimab ha sido diseñado para unirse a una región más conservada del dominio de unión al receptor presente en otros sarbecovirus, lo que le confiere una potencial protección para mantener su actividad frente a nuevas mutaciones47,59. Sin embargo, su eficacia frente a la subvariante BA.2 está en discusión. Aunque los estudios in vitro muestran menor actividad neutralizante frente a estos recientes sublinajes de ómicron, los efectos in vivo son objeto de investigación. Datos recientes revelan que, a pesar de la disminución de la actividad neutralizante en cultivos celulares, sotrovimab redujo los niveles de virus y citocinas proinflamatorias en el pulmón de ratones infectados con BA.2 demostrando estas diferencias entre la pérdida de potencia in vitro y la protección mantenida in vivo60. No obstante, la Agencia de Administración de Alimentos y Medicamentos (FDA) retiró la autorización de uso en EE. UU. en abril de 202261. Por el contrario, en Europa, la Agencia Europea de Medicamentos (EMA) ha mantenido la autorización de sotrovimab basándose en el desconocimiento que se tiene sobre la relevancia clínica que pueda tener la disminución de actividad neutralizante frente a ómicron BA.262. Un reciente estudio multicéntrico francés ha comparado la eficacia de sotrovimab para prevenir COVID-19 severo en pacientes de alto riesgo infectados por ómicron BA.1 o por BA.2, observando una baja tasa de hospitalizaciones y una reducción de carga viral nasofaríngea similar en ambos grupos63. El impacto de los nuevos sublinajes de ómicron BA.2.11, BA.2.12.1 y BA.4/5 en la capacidad neutralizante de Sotrovimab no parece ser superior a lo observado con BA.2. Los primeros datos sobre la reciente subvariante BA.2.75 (centaurus) son contradictorios: algunos apuntan a una pérdida de actividad neutralizante inferior a lo detectado con los sublinajes previos de ómicron en tanto que otros estudios encuentran muy escasa actividad64,65. La información actualizada sobre la susceptibilidad de las distintas variantes y subvariantes del virus a los MAB puede ser consultada en https://covdb.stanford.edu/page/susceptibility-data/
- •
Bebtelovimab: Datos in vitro sobre este MAB sugieren que mantiene su actividad neutralizante frente a las nuevas subvariantes de ómicron, pero no se dispone de estudios controlados que evalúen su uso en pacientes con alto riesgo de progresión a COVID-19 severo45,64. De momento solo ha sido evaluado en pacientes de bajo riesgo mostrando buena tolerancia y un descenso más rápido de la carga viral frente a placebo45. Ha sido aprobado en EE. UU. en los primeros 7 días de síntomas y solo si no se considera adecuado el uso de nirmatrelvir/ritonavir o remdesivir. Experiencias iniciales en pacientes trasplantados muestran resultados que parecen similares a los obtenidos con otros MAB66,67. En el momento de realizar esta revisión, en septiembre de 2022, no ha sido aprobado en Europa.
- •
Tixagevimab/cilgavimab (Evusheld®): Tixagevimab muestra pérdida significativa en su capacidad de neutralización frente a las nuevas variantes de Ómicron en tanto que para cilgavimab y la combinación tixagevimab/cilgavimab la reducción parece leve-moderada (https://covdb.stanford.edu/page/susceptibility-data/). Muy recientemente han sido publicados los resultados del estudio TACKLE, un estudio randomizado frente a placebo en el que pacientes, no vacunados, con COVID-19 leve-moderado sin necesidad de oxígeno fueron tratados con 600mg de tixagevimab/cilgavimab (2 inyecciones intramusculares consecutivas de 300mg de cilgavimab y 300mg de tixagevimab) en los primeros 7 días desde el inicio de los síntomas. Las variantes del virus eran anteriores a ómicron. COVID-19 severo o muerte ocurrió en un 4% de los tratados con tixagevimab/cilgavimab frente al 9% en el grupo placebo, con un descenso del 50,5% en el riesgo relativo (p=0,0096)68. El número de pacientes en el estudio incluidos en la categoría «inmunodeprimidos» era muy reducida (5%). La experiencia comunicada en trasplante es aún muy limitada69. La EMA ha aprobado el uso de tixagevimab/cilgavimab en tratamiento en tanto que la FDA lo mantiene de momento solo en uso pre-exposición70.
En situaciones de COVID-19 más severo (disnea, frecuencia respiratoria mayor de 22rpm, SatO2 basal <94%) deben considerarse tratamientos de soporte como oxigenoterapia, profilaxis tromboembólica y/o tratamiento antibiótico si hay sospecha de sobreinfección bacteriana. En cuanto a terapias específicas existen evidencias en relación con las siguientes:
- •
Esteroides: Han demostrado reducir la mortalidad en pacientes que precisan oxígeno suplementario, con máximo beneficio en los que necesitan ventilación mecánica. Sin embargo, en formas menos graves sin necesidad de oxigenoterapia no ha demostrado beneficio, no pudiendo descartarse un efecto incluso perjudicial16,46,65. Se recomienda preferentemente el uso de dexametasona por ser el esteroide más testado en ensayos clínicos mostrando mayores ventajas en supervivencia. Es preciso vigilar el riesgo de hiperglucemia y de infecciones secundarias.
- •
Tocilizumab: Inhibidor de la interleucina-6 que parece disminuir la necesidad de ventilación mecánica y la duración de la estancia hospitalaria, pero con efecto dudoso sobre la mortalidad15. Actualmente se puede indicar junto con dexametasona en casos de severa hipoxemia y PCR mayor de 75 o si necesidad de ventilación mecánica. Se recomienda también en pacientes con empeoramiento a pesar de tratamiento con dexametasona46. En trasplante la eficacia no ha podido ser claramente establecida, pero ha sido utilizado sin efectos secundarios específicos para esta población16,71.
- •
Baricitinib: Es un fármaco también con actividad antiinflamatoria, inhibidor de la Kinasa Janus, empleado hasta ahora en el tratamiento de la artritis reumatoide. Se han descrito beneficios similares a tocilizumab pudiendo emplearse en lugar de este72. No se recomienda el uso conjunto de ambos porque, al ser potentes inmunosupresores, puede potenciarse el riesgo de infecciones17.
- •
Anakinra: Actúa inhibiendo interleucina-6. Puede emplearse si existe disponibilidad de suPAR y el resultado es mayor de 6ng/ml46. La evidencia con este fármaco es más limitada que con tocilizumab y baricitinib73.
- •
Remdesivir: No ha demostrado reducir la mortalidad, pero sí el tiempo de recuperación. Está recomendado en pacientes que necesitan oxígeno de bajo flujo, en pauta de tratamiento de 5 días y durante los primeros 10 días de inicio de los síntomas15,46,47. Aunque no hay evidencia clara, prolongar la administración durante 10 días podría indicarse en casos graves con ventilación mecánica o ECMO o pacientes con inmunosupresión grave47.
- •
Sotrovimab: Podría ser utilizado, con las mismas consideraciones antes recogidas, en pacientes hospitalizados graves con serología negativa o nivel bajo de anticuerpos frente a SARS-CoV-247,48. No obstante, no se ha demostrado la eficacia de sotrovimab en pacientes hospitalizados por COVID-19 grave o crítico.
Los pacientes TR, debido a la inmunosupresión, tienen alterada la respuesta inmune, y particularmente la respuesta inmune de células T, exponiéndose a un mayor riesgo de infecciones53. El primer escalón del tratamiento de cualquier enfermedad infecciosa de origen viral es la prevención, a través de estrategias como la vacunación, la profilaxis con antivirales y el control de la misma con medidas generales74. Sin embargo, si esto fracasa y el paciente desarrolla la infección, el tratamiento de la misma incluye no sólo el tratamiento antiviral dirigido sino también la reducción o modulación de la inmunosupresión.
En este sentido, la evidencia acumulada sobre el manejo de la inmunosupresión en pacientes trasplantados de riñón con infección por SARS-CoV-2, en estos 2 primeros años de pandemia se ha centrado en la publicación de estudios observacionales, retrospectivos, no aleatorizados que han ayudado a despejar las dudas iniciales sobre la estrategia inmunosupresora a seguir y su repercusión a medio plazo75–84. En todos ellos se reconoce que la reducción de la inmunosupresión ha sido uno de los pilares del manejo terapéutico, en ausencia de un tratamiento antiviral específico, y esta reducción se ha realizado de acuerdo a la situación clínica del paciente, al tiempo de trasplante, al riesgo inmunológico del paciente y siempre bajo la supervisión de un nefrólogo.
En un estudio multicéntrico español82, que recoge la experiencia del manejo de la inmunosupresión de la mayor parte de los pacientes con TR infectados por COVID-19 en España durante la primera y la segunda ola de la pandemia, se observó que el manejo de la inmunosupresión se basó fundamentalmente en la suspensión del ácido micofenólico y en reducciones o suspensiones muy discretas de los inhibidores de calcineurina. Estos cambios supervisados e intencionados en la terapia inmunosupresora no influyeron en la función renal ni en la sensibilización HLA a los 6 meses del diagnóstico del COVID-19. En otro estudio multicéntrico francés84 también observaron que, tras la modulación de la inmunosupresión durante la infección por coronavirus, la incidencia de anticuerpos donante específicos de novo (ADE de novo) tras la infección por SARS-CoV-2 fue del 4%, cifra muy similar a la incidencia de ADE de novo en pacientes con TR no COVID-19 (5%) y la función renal se mantuvo estable en todos ellos, lo que indica que esta práctica de reducción de la inmunosupresión en situaciones de infección grave no parece implicar un mayor riesgo inmunológico para el injerto y permite al paciente la adquisición, en un corto periodo de tiempo, de la inmunidad celular necesaria para controlar la infección y evitar así la progresión de la misma y sus complicaciones vitales.
En el estudio español82 no existía un protocolo común de manejo de la inmunosupresión, sin embargo, en todos los centros se redujo la inmunosupresión de forma progresiva a medida que la situación clínica del paciente empeoraba. Basándonos en este estudio, que aglutina la práctica clínica de la mayor parte de las unidades de TR en España, podemos recomendar la siguiente pauta de manejo de la inmunosupresión durante la infección por SARS-CoV-2:
- -
En los casos de infección por SARS-CoV-2 con síntomas leves o asintomáticos, no es necesario modificar la inmunosupresión basal del paciente.
- -
En los casos de infección moderada con neumonía e hipoxemia con necesidad de oxigenoterapia con gafas nasales, se recomienda suspender el tratamiento inmunosupresor con ácido micofenólico o inhibidores m-TOR, reducir la dosis de inhibidor de calcineurina (un 30%), si el paciente tiene riesgo inmunológico bajo y asociar o aumentar la dosis de esteroides (prednisona o metilprednisolona a 20mg/al día).
- -
En los casos de infección severa con neumonía que requiere ventilación mecánica o ingreso en UCI, se recomienda la suspensión completa y temporal de la inmunosupresión y el aumento de esteroides (prednisona o metilprednisolona a 20-40mg/al día). En los pacientes altamente sensibilizados con infección severa, se podría indicar inmunoglobulina inespecífica intravenosa cada 15 días hasta la recuperación de la inmunosupresión, siempre que sea posible.
Respecto al reinicio de la terapia inmunosupresora, se debe realizar una vez que el paciente haya presentado mejoría, tanto clínica y analítica como radiológica, la cual dependerá de la situación basal de cada paciente y de la comorbilidad asociada. Se debe restablecer, en primer lugar, la dosis plena de los inhibidores de calcineurina y si el paciente permanece estable clínicamente, a continuación, reiniciar el tratamiento inmunosupresor con antimetabolitos o inhibidores de m-TOR, reduciendo de forma progresiva la dosis de esteroides hasta su dosis habitual.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses relacionados con los contenidos del artículo.