La anemia es una complicación frecuente de la enfermedad renal crónica (ERC) y se asocia con una disminución en la calidad de vida y a un mayor riesgo de transfusiones, de morbimortalidad y de progresión de la ERC. El Grupo de Trabajo en Anemia de la Sociedad Española de Nefrología realizó un estudio Delphi entre expertos en anemia de la ERC para consensuar respuestas a preguntas relevantes que no se hubieran podido resolver con la evidencia existente. Se empleó la metodología de consensos RAND/UCLA. Se definieron 15 preguntas con una estructura PICO, seguida de una revisión en bases de datos de literatura científica. A partir de la evidencia se formularon enunciados. Diecinueve expertos los evaluaron mediante un proceso iterativo tipo Delphi a dos rondas. Se consensuaron 16 enunciados en respuesta a 8 preguntas referidas a la ferropenia y suplementación con Fe (impacto y gestión de ferropenia con o sin anemia, marcadores de ferropenia, seguridad de hierro i.v.) y a 7 relacionadas con agentes estimuladores de la eritropoyesis (AEE) y/o con estabilizadores del factor inducible por la hipoxia (HIF), alcanzándose consenso en todos ellos (individualización del objetivo de Hb, impacto y gestión de resistencia a AEE, AEE en el periodo inmediato post trasplante y estabilizadores de HIF: impacto sobre la ferrocinética, interacción con inflamación y seguridad cardiovascular). Existe una necesidad de estudios clínicos que aborden los efectos de la corrección del déficit de Fe con independencia de la anemia y el impacto del tratamiento de esta con diversos AEE sobre la calidad de vida, la progresión de ERC y los eventos cardiovasculares.
Anemia is a common complication of chronic kidney disease (CKD) and is associated with a decrease in quality of life and an increased risk of transfusions, morbidity and mortality, and progression of CKD. The Anemia Working Group of the Sociedad Española de Nefrología conducted a Delphi study among experts in anemia in CKD to agree on relevant unanswered questions by existing evidence. The RAND/UCLA consensus methodology was used. We defined 15 questions with a PICO structure, followed by a review in scientific literature databases. Statements to each question were developed based on that literature review. Nineteen experts evaluated them using an iterative Two-Round Delphi-like process. Sixteen statements were agreed in response to 8 questions related to iron deficiency and supplementation with Fe (impact and management of iron deficiency with or without anemia, iron deficiency markers, safety of i.v. iron) and 7 related to erythropoiesis stimulating agents (ESAs) and/or hypoxia-inducible factor stabilizers (HIF), reaching consensus on all of them (individualization of the Hb objective, impact and management of resistance to ESA, ESA in the immediate post-transplant period and HIF stabilizers: impact on ferrokinetics, interaction with inflammation and cardiovascular safety). There is a need for clinical studies addressing the effects of correction of iron deficiency independently of anemia and the impact of anemia treatment with various ESA on quality of life, progression of CKD and cardiovascular events.
La anemia es una complicación frecuente de la enfermedad renal crónica (ERC) y se asocia a una disminución en la calidad de vida (CdV) de los pacientes, aumento de riesgo de transfusiones, así como a un aumento de la morbimortalidad y de progresión de la ERC1.
La principal causa de anemia en la ERC es la producción inadecuada de eritropoyetina endógena; aunque en los últimos años se ha reconocido el origen multifactorial de la misma. Otros factores implicados son, por ejemplo, una respuesta eritropoyética disminuida de la médula ósea, la disminución de la disponibilidad de hierro (Fe) para la eritropoyesis y el aumento de los niveles de hepcidina (déficit absoluto o funcional de Fe), una vida media disminuida de los hematíes, o déficits vitamínicos (vitamina B12 o ácido fólico)1,2.
La prevalencia de anemia aumenta a medida que disminuye la función renal y es prácticamente universal en pacientes en hemodiálisis. Por otra parte, la deficiencia de Fe (DFe) es muy común en pacientes con ERC desde estadios más precoces de la enfermedad3.
La introducción de los agentes estimuladores de la eritropoyesis (AEE) a finales de los años ochenta supuso un avance fundamental para los pacientes renales, pues aumentó los niveles de hemoglobina (Hb) y la calidad de vida y redujo la morbimortalidad y la necesidad de transfusiones1. Sin embargo, existen aspectos no resueltos en el manejo de la anemia renal, como los objetivos individuales de tratamiento (Hb y ferrocinética), la hiporrespuesta a AEE, la variabilidad en los niveles de Hb, la seguridad de los AEE y de la ferroterapia, entre otros. Por ese motivo la Sociedad Española de Nefrología (S.E.N.), a través de su Grupo de Trabajo en Anemia, planteó realizar un estudio DELPHI entre expertos en anemia de la ERC para consensuar respuestas a preguntas relevantes que no se hubieran podido resolver con la evidencia de los ensayos clínicos.
MetodologíaEste trabajo se llevó a cabo siguiendo la metodología de consensos desarrollada por la RAND/UCLA4. El Grupo Elaborador de Recomendaciones (GER) se compuso de 8 nefrólogos (dos coordinadores y 6 asesores) con experiencia en el manejo del paciente con ERC y la anemia. En la primera reunión en abril del 2021 se definieron 15 preguntas con estructura PICO (pacientes, intervención, comparador, resultado)5.
A partir de las preguntas se realizó una revisión de la literatura en las bases de datos PubMed, Scopus, Web Of Science (cierre datos: junio 2021) a través de sintaxis controlada (ver datos suplementarios 1), con un límite temporal de 10 años. A las referencias halladas mediante la búsqueda en bases de datos, el GER pudo añadir estudios identificados de otras maneras o que no cumplían con los criterios preestablecidos (por ejemplo, temporales) pero que se consideraron relevantes para responder a las preguntas de investigación. El proceso de selección de las referencias se describe en la figura suplementaria 1. Posteriormente se realizó una lectura crítica de las publicaciones, se extrajo la evidencia pertinente y se formularon los enunciados que respondían a las preguntas.
Diecinueve expertos, evaluaron los enunciados propuestos a través de un proceso iterativo tipo Delphi a dos rondas según una escala Likert de 1 a 9 (1: totalmente en desacuerdo; 9: totalmente de acuerdo) en cuestionario online. Junto con el enlace al cuestionario, los panelistas recibieron un dossier con un resumen de la evidencia utilizada por los expertos para la formulación de los enunciados, con las referencias bibliográficas relativas. Se utilizó la metodología RAND/UCLA para el análisis del consenso en paneles Delphi4. Cada ítem del cuestionario queda clasificado según el grado de acuerdo y la puntuación mediana del panel en Apropiado (mediana en rango 7-9), Incierto (mediana en rango 4-6 o cualquier mediana en desacuerdo) o Inapropiado (mediana en rango 1-3). El acuerdo se logró si al menos un tercio de la muestra respondió dentro del mismo rango de puntuación que la mediana, desacuerdo si la puntuación mediana cayó en cualquiera de los dos extremos y más de un tercio de la muestra respondió en el intervalo extremo opuesto, o si la mediana cayó en el intervalo central, y al menos un tercio de la muestra respondió en uno de los otros dos intervalos, y “neutral” si no cumplía alguno de los criterios anteriores4. Siempre basado en los comentarios recibidos en primera ronda, se decidió desdoblar uno de los enunciados, para más claridad. Un total de 16 enunciados (100%) propuestos entre la primera y segunda ronda Delphi fueron consensuados por el panel de expertos.
Ferropenia y suplementación del hierroEl DFe absoluto o funcional es una condición común en la ERC. Las guías de práctica clínica de Nefrología han considerado la ferroterapia en presencia de ferropenia y anemia6. Sin embargo, en los últimos años se ha visto la relevancia del DFe per se, independientemente de la anemia, en otras situaciones clínicas, como la insuficiencia cardíaca con fracción de eyección reducida (ICFEr)7. Los resultados de los ensayos clínicos publicados en pacientes con ICFEr o el estudio PIVOTAL en pacientes en hemodiálisis, así como resultados de estudios observacionales plantean la conveniencia de tratar la ferropenia más allá de la anemia en pacientes renales8.
Las recomendaciones relacionadas con esta sección se pueden encontrar en la tabla 1
Enunciados relacionados con la ferropenia y la suplementación del hierro
| P | Enunciado | Mediana, propiedad, grado de acuerdo |
|---|---|---|
| 1 | La ferropenia (tanto déficit absoluto, como funcional de hierro), se asocia con eventos clínicos adversos, con independencia de la presencia de anemia en pacientes con ERC. Sin embargo, estos estudios solo demuestran asociación, pues dado su carácter observacional no puede inferirse causalidad. | 9, apropiado, acuerdo |
| 2 | La anemia y el DFe son muy frecuentes en la ERC y se asocian con un mal pronóstico. Se ha descrito un efecto beneficioso de la administración de hierro en pacientes ferropénicos con insuficiencia cardíaca con fracción de eyección reducida Independiente de la presencia de anemia, sin embargo, no existen datos concluyentes en la ERC. El impacto clínico del DFe y su corrección, independientemente de la anemia, está considerada un área de investigación prioritaria en la ERC. | 9, apropiado, acuerdo |
| 3 | El diagnóstico de la deficiencia de hierro se ha basado preferentemente en dos parámetros: el índice de saturación de transferrina (IST), como marcador del Fe circulante y la ferritina sérica, considerado un indicador de los depósitos de Fe en el organismo. Los parámetros funcionales que pueden complementar el estudio de la ferrocinética en la ERC son la hemoglobina reticulocitaria, como indicador precoz de respuesta a ferroterapia (tres días) y el porcentaje de hematíes hipocrómicos, como marcador del estado férrico de los dos meses anteriores. | 8, apropiado, acuerdo |
| 4 | Las guías actuales consideran la ferroterapia en el paciente renal exclusivamente como coadyuvante en el tratamiento del paciente anémico. Sin embargo, hay evidencia de que el DFe per se tiene un impacto pronóstico en esta población. La corrección de la ferropenia podría asociarse a un efecto beneficioso o neutro de manera independiente de la anemia, aunque la evidencia es escasa y debe ser confirmada con estudios más robustos, específicamente diseñados para ello. | 8, apropiado, acuerdo |
| 5 | El Dfe debe corregirse cuando existe anemia según se define en las guías de práctica clínica: cifras de Hb <13 g/dl en varones y <12 g/dl en mujeres. No es preciso esperar a que las cifras de Hb bajen a valores inferiores. En la actualidad, la mayor importancia del déficit de Fe en la ERC es su papel en el desarrollo de anemia crónica, que es fácilmente corregible. | 8, apropiado, acuerdo |
| 6 | Si bien es cierto que no existen estudios de gran tamaño diseñados para estudiar variables de desenlace “duras” como mortalidad o eventos cardiovasculares en pacientes con enfermedad renal crónica (no dependientes de diálisis) e insuficiencia cardiaca, se puede extrapolar de las guías de insuficiencia cardiaca, la recomendación de corregir la ferropenia con Fe i.v. en pacientes con ERC, IC con fracción de eyección reducida y DFe, independientemente de la anemia. | 8, apropiado, acuerdo |
| 7 | La ferroterapia i.v. es segura y es más eficaz y rápida que la oral para conseguir aumentar los niveles de Hb y reducir las dosis de AEE | 9, apropiado, acuerdo |
| 8 | En los pacientes con ERC dependiente de hemodiálisis, la administración mensual proactiva de 400 mg de Fe intravenoso (en el caso de que la ferritina sérica sea menor de 700 mg/l e IST menor al 40%) es superior a una estrategia reactiva (administrar sólo si ferritina sérica menor de 700 mg/l o IST menor al 40%), ya que reduce la dosis de AEE y reduce el riesgo combinado de muerte por todas las causas, infarto de miocardio no fatal, ictus no fatal y hospitalización por insuficiencia cardiaca (Major adverse cardiovascular events +, MACE +). Según la evidencia disponible, actualmente no es razonable recomendar estrategias más agresivas. | 8, apropiado, acuerdo |
| En pacientes con ERC no dependientes de hemodiálisis, la estrategia de Fe i.v. a dosis altas y baja frecuencia es más eficaz y conveniente y con un perfil de seguridad adecuado. En algunos pacientes podría tener sentido realizar una prueba con Fe oral primero, cambiando a Fe intravenoso si el paciente presenta intolerancia al Fe o no logra el objetivo de Hb en tres meses. | 8, apropiado, acuerdo |
AEE, agentes estimuladores de la eritropoyesis; DFe, deficiencia de Fe; ERC, enfermedad renal crónica; Hb, hemoglobina; i.v., intravenosa; IST, índice de transferrina sérica; MACE, Evento combinado Mortalidad o infarto o accidente cerebrovascular; P, pregunta
Se discute en conjunto con la pregunta II.
¿Se deben medir los parámetros férricos en el paciente con ERC independientemente de la presencia de anemia? (papel preventivo de la anemia)Se ha demostrado que el DFe en pacientes con ICFEr tiene un impacto pronóstico negativo y su corrección con Fe intravenoso (i.v.) mejora la situación clínica y reduce la morbilidad, independientemente de la presencia de anemia8. Además existen evidencias crecientes de que el DFe per se tiene implicaciones pronósticas negativas en pacientes en todo el espectro de la ERC9–21, así como sobre la calidad de vida relacionada con la salud (CVRS)22 o la sintomatología23 de pacientes con ERC. Dado que las definiciones de DFe y las poblaciones de los estudios no son homogéneas, es difícil cuantificar el riesgo atribuible al DFe absoluto o funcional, pero coinciden en un aumento del riesgo de mortalidad total9–12,14,16,17,19,21, hospitalización de causa cardiovascular (CV)13, mortalidad CV9,10,17,21, insuficiencia cardíaca (IC)15,20 o eventos CV11,19 en presencia de DFe (absoluto o funcional) en la mayoría de estudios. Sin embargo, estos estudios sólo demuestran asociación, pues dado su carácter observacional no puede inferirse causalidad. Tampoco existe una evidencia clara del beneficio de la corrección del DFe en eventos CV, pues los ensayos se han diseñado para valorar sus efectos eritropoyéticos en presencia de anemia. En las guías de anemia de la Kidney Disease Improving Global Outcomes (KDIGO) del año 20126 se recomienda la detección y la monitorización de los parámetros férricos únicamente a los pacientes con anemia. De hecho, las últimas controversias KDIGO concluían que comprender el impacto clínico del DFe y su corrección, independientemente de la existencia de anemia, es un área de investigación de alta prioridad para futuros estudios en pacientes con ERC24.
¿Deben incorporarse los nuevos marcadores de déficit de Fe (% hematíes hipocromos/Hb reticulocitaria) en el estudio de la ferrocinética en ERC?El diagnóstico del DFe se ha basado clásicamente en el IST, como marcador del Fe circulante (y disponible para la médula ósea) y la ferritina sérica, considerado un indicador de los depósitos de Fe en el organismo. Sin embargo, estos indicadores se consideran poco fiables para estimar las reservas de Fe (la ferritina es un reactante de fase aguda que puede aumentar en presencia de inflamación) o para predecir la respuesta a la ferroterapia en pacientes con ERC. Tanto la Hb reticulocitaria (CHr) como el porcentaje de hematíes hipocrómicos son parámetros funcionales que pueden ayudar en el estudio de la ferrocinética en la ERC, ya que son parámetros más fiables para la evaluación de la homeostasis del Fe excepto en presencia de una talasemia. Actualmente, la mayoría de los laboratorios de hematología son capaces de medir estos indicadores. Adicionalmente, tienen la ventaja de su bajo coste, escasa variabilidad y no estar influenciados por la inflamación ni las infecciones. Sin embargo, fuera de la evidencia diagnóstica, existe escasa experiencia en la implementación de estos marcadores en la práctica clínica. Se recomienda usar el porcentaje de hematíes hipocrómicos, pero solo si es posible procesar la muestra de sangre dentro de las 6 h siguientes a su extracción. Probablemente, la combinación de todos estos parámetros ferrocinéticos, permita conseguir un algoritmo más preciso para el diagnóstico de la deficiencia de Fe y la respuesta eritropoyética a la ferroterapia en los pacientes renales. Sin embargo, según las últimas controversias sobre el manejo de la anemia de la Guía KDIGO24, el uso clínico generalizado de ambos parámetros está limitado por la ausencia de límites de decisión clínica universales, así como por el requisito de su determinación en muestras de sangre fresca en el caso del porcentaje de hematíes hipocrómicos. Estas áreas han sido identificadas como de alta prioridad para futuras investigaciones, por lo que es difícil recomendar su uso generalizado y sustituir a la ferritina e IST.
¿Existe evidencia acerca de corregir el déficit de Fe independientemente de la anemia y/o tratamiento con agentes estimuladores de la eritropoyesis?En el estudio PIVOTAL25, pacientes incidentes en hemodiálisis tratados con AEE fueron aleatorizados a un grupo proactivo que recibió 400mg/mes de Fe sacarosa i.v. hasta alcanzar niveles de ferritina >700?ng/ml o un IST >40% frente al grupo reactivo que recibió Fe sacarosa a dosis bajas si la ferritina era <200 ng/ml o el IST 20%. Tras un seguimiento de 2,1 años presentaron un evento compuesto CV (muerte, infarto de miocardio, ictus u hospitalización por IC) el 29,3% del grupo proactivo frente a 32,3% del grupo reactivo (HR 0,85, IC 95% 0,73-1,0). Analizando los eventos individualmente, se observó una reducción del riesgo de mortalidad, de hospitalización por IC o de infarto de miocardio mortal y no mortal, con tasas similares de ictus. Las tasas de hospitalización y/o de infección fueron similares en los dos grupos. Los autores concluyeron que, en pacientes en hemodiálisis, un régimen de Fe i.v. de dosis altas administrado de forma proactiva fue superior a un régimen de dosis bajas administrado de forma reactiva y requirió la administración de dosis más bajas de AEE (reducción del 19%), por lo que el beneficio observado podría ser, al menos en parte, debido a las menores dosis de AEE requeridas25.
El estudio FIND-CKD26 aleatorizó 626 pacientes anémicos con ERC no en diálisis (ND) (FGe <60ml/min/1,73 m2) y DFe (IST <20%, ferritina <100 ng/ml) a dos estrategias diferentes de Fe i.v.: ferritina alta (400-600 ng/ml) o baja (100-200 ng/ml) o ferroterapia oral. Se demostró la superioridad de la estrategia de ferritina alta en prevenir otros tratamientos de la anemia26, sin diferencias en cuanto a seguridad después de 1 año de seguimiento (eventos adversos [EA] graves, eventos cardíacos, mortalidad, infecciones o progresión de la ERC) entre los diferentes grupos25,27.
Un estudio piloto28 analizó el efecto de una dosis fija de citrato férrico frente a tratamiento estándar en pacientes con ERC avanzada. Se aleatorizaron a 203 pacientes con FGe ≤20ml/min/1,73 m2, fósforo ≥3,0 mg/dl, Hb >8,0 g/dl, índice de IST <55%. El grupo que recibió citrato férrico aumentó significativamente la Hb, el IST y la ferritina sérica, y redujo significativamente el fosfato sérico y el FGF23 intacto (p <0,001 para todos). En comparación con el tratamiento habitual, el tratamiento con citrato férrico resultó en un número significativamente menor de ingresos hospitalarios anuales, menos tiempo de hospitalización y una menor incidencia del criterio de valoración combinado de muerte, necesidad de diálisis o trasplante (p = 0,002)28.
Un estudio prospectivo, doble ciego, aleatorizado en pacientes no anémicos con ERC en estadios 3b-5 y DFe, investigó si 1000mg de Fe i.v. (derisomaltosa férrica -FDI-) podrían mejorar la capacidad de ejercicio. Tras ajustar por las características basales, no hubo diferencias significativas en el test de la marcha durante 6 minutos (6MWT) entre los dos grupos al mes (p = 0,736) o a los tres meses (p = 0,741). Hubo aumentos no significativos en 6MWT desde el inicio hasta 1 y 3 meses en el brazo de FDI. La Hb se mantuvo estable y hubo aumentos estadísticamente significativos en la ferritina e IST a 1 y 3 meses (p <0,001). Hubo una modesta mejora numérica en los parámetros de CdV. No hubo eventos adversos atribuibles a FDI29.
Así pues, los resultados apuntan a un beneficio de la corrección del DFe en la ERC. Sin embargo, su efecto es difícil de separar de la mejora de la Hb o de la reducción de dosis de AEE, por lo que se precisan estudios aleatorizados específicamente diseñados que confirmen estos aspectos.
¿Debe corregirse el déficit de Fe al diagnóstico de la anemia según los parámetros de población general – hombre Hb <13 y mujer Hb <12g/dl – en el paciente con ERC?El DFe puede causar anemia e hiporrespuesta a los AEE por lo que debe corregirse a fin de asegurar una optimización de la eritropoyesis en pacientes anémicos con ERC.
En pacientes con anemia asociada a la ERC, la ferroterapia está destinada a asegurar reservas de Fe adecuadas para la eritropoyesis, evitar o retrasar la necesidad de AEE y, en pacientes que reciben tratamiento con AEE, prevenir el desarrollo de DFe y reducir las necesidades de AEE. Como ya se ha comentado antes, la anemia en la ERC se asocia con un mayor riesgo de morbilidad, mortalidad, y progresión de la ERC por lo que es deseable su corrección precoz8.
Las recomendaciones de las guías clínicas sobre la administración de Fe coinciden en hacerlo en pacientes con ERC anémicos. No es adecuado extrapolar los umbrales de Hb que se aplican para el inicio de la prescripción de AEE (Hb <10g/dl), que son más bajos, basados en los resultados de los ensayos clínicos con estos agentes30,31.
El Fe, a diferencia de los AEE, es un factor necesario para una eritropoyesis eficiente, pero no un factor de crecimiento, por lo que no existe riesgo de sobrepasar el nivel de Hb por encima del límite objetivo29,32 (salvo en pacientes con policitemia/poliglobulia).
¿Debe corregirse el déficit de Fe en pacientes ERC con insuficiencia cardiaca sin anemiaSe estima que existe un DFe en aproximadamente un 46% de los pacientes no anémicos con IC estable. La presencia de DFe, independientemente de la presencia de anemia, se asocia con mayor sintomatología, disminución de la capacidad de ejercicio, de la CdV y mayor mortalidad y hospitalizaciones por progresión de la IC33,34.
En este sentido, varios ensayos clínicos aleatorizados como FAIR-HF35, CONFIRM-HF36, EFFECT-HF37 y AFFIRM-AHF38 en pacientes con ICFEr y DFe (pero no específicamente ERC) han demostrado la seguridad de la suplementación con Fe carboximaltosa (FCM), así como una mejora de la sintomatología y de algunas variables de desenlaces CV.
En un pequeño ensayo que analizaba pacientes con ERC, IC, anemia y DFe, la administración de Fe i.v. se asoció a mejora en parámetros funcionales miocárdicos y de las dimensiones cardiacas39. En un estudio piloto observacional con pacientes con ICFEr, DFe y disfunción renal (FGe medio 40ml/min),) la repleción miocárdica de Fe se asoció a mejoría en la fracción de eyección del ventrículo izquierdo y su volumen telesistólico, independiente del cambio en los niveles de Hb40, lo que se ha confirmado en otro estudio reciente más amplio en pacientes con menor deterioro de función renal41. En pacientes con ERC, una estrategia de una dosis alta con FDI frente a dosis bajas repetidas de Fe sacarosa se asoció con un aumento de la Hb y de parámetros férricos más rápida, así como menor número de eventos CV, incluyendo IC42. Un metaanálisis sobre el efecto de la ferroterapia i.v. en pacientes con ICFEr y DFe43 demostró una mejoría de la clase funcional, de la sintomatología, de la capacidad de ejercicio y de la CdV. Demostró también una reducción del desenlace combinado de muerte por cualquier causa y hospitalización por causa CV, del riesgo del desenlace combinado de muerte CV y hospitalización por empeoramiento de la IC, y una reducción del riesgo de hospitalización por IC. Otro metaanálisis más reciente de los estudios con FCM en pacientes con ICFEr y DFe mostró resultados clínicos similares, aunque el efecto beneficio fue menor en pacientes con IST >20%44.
El estudio IRONOUT HF45 estudió a 225 pacientes con IC sintomática y DFe a los que se aleatorizó a recibir 150 mg de Fe polisacárido vía oral o placebo. Los pacientes que recibieron Fe oral no consiguieron mejorar los depósitos de Fe o la capacidad funcional.
Es por todo esto que las guías de IC de la European Society of Cardiology (ESC) recomiendan considerar el tratamiento con FCM i.v. en pacientes con ICFEr que estén sintomáticos, y que presenten DFe. Sin embargo, la misma guía puntualiza que los estudios en los que basa la recomendación no poseían potencia estadística suficiente para evaluar mortalidad o eventos CV, o analizar los efectos independientes de los niveles de Hb46.
En pacientes en hemodiálisis, el estudio PIVOTAL ha demostrado una reducción de las hospitalizaciones por IC (este estudio excluyó a pacientes con IC clase funcional IV de la New York Heart Association), con la administración proactiva de Fe i.v., frente a una administración reactiva sólo en caso de ferropenia25.
Todo lo cual apoya la administración de FCM i.v. en pacientes con ICFEr y ERC, extrapolando los resultados obtenidos en pacientes con IC.
¿Es más eficaz el Fe i.v. que el Fe oral en la corrección de la anemia en ERC (3-5) o diálisis?Qunibi y cols.47 compararon la eficacia y seguridad de FCM i.v. a dosis altas frente a Fe oral en 255 pacientes con ERC-ND. Tras 8 semanas, la Hb aumentó más con FCM (1,31g/dl frente a 0,83g/dl, p <0,01) y en un mayor porcentaje de pacientes que recibieron FCM aumentó la Hb ≥1 g/dl respecto a la ferroterapia oral (60,4% frente al 34,7% de los pacientes), independientemente de si estaban recibiendo AEE. Resultados similares se observan en el estudio PROGRESS con 351 pacientes ERC--ND con Fe isomaltósido i.v. y similar tiempo se seguimiento48.
En el estudio FIND-CKD49, el grupo FCM i.v.-ferritina alta presentó niveles de Hb y de ferritina superiores a los otros dos grupos, sin diferencias en cuanto a EA o EA graves entre los diferentes grupos, aunque hubo una tasa mayor de abandonos en el grupo de Fe oral, especialmente por EA gastrointestinales49. El metaanálisis de Shepshelovich y cols.50 incluyó 24 ensayos, 13 con 2369 pacientes con ERC-ND y 11 que incluyeron a 818 pacientes con ERC-5D. Los pacientes tratados con Fe i.v. tuvieron una mayor probabilidad de conseguir un aumento de la Hb >1g/dl y los niveles de ferritina fueron significativamente superiores en todos los grupos de Fe i.v. frente al grupo de Fe oral. Respecto a la seguridad, el análisis demostró tasas comparables de EA y EA graves entre Fe i.v. y oral. Sin embargo, como limitación en muchos estudios los períodos de seguimiento generalmente se limitaban a tres meses, por lo que no hay suficientes datos sobre la seguridad del Fe i.v. prediálisis a medio-largo plazo.
Solo dos ensayos clínicos aleatorizados en pacientes con ERC han abordado el impacto del Fe i.v. en resultados diferentes de la corrección de la anemia. El estudio REVOKE51 fue un ensayo clínico, unicéntrico, aleatorizado que comparó el efecto de Fe sacarosa i.v. frente a ferroterapia oral en 137 pacientes con ERC- ND sobre la función renal como evento primario a 104 semanas. El estudio se interrumpió prematuramente por el aumento del riesgo de EA en el grupo tratado con Fe i.v. Sin embargo, deben considerarse algunas limitaciones metodológicas. La mayoría de los EA ocurrieron mucho después de que se completara la intervención, se habían incluido todos los EA (incluso si fueron repetidos en el mismo paciente) en lugar de tiempo al primer EA. Por otro lado, el número de pacientes con EA graves fue similar en ambos grupos y la diferencia fue significativa sólo tras ajustar, por lo que este estudio tiene un alto riesgo de sesgo. El otro ensayo clínico es el PIVOTAL25 ya mencionado que demostró que la pauta de Fe i.v. proactiva a dosis altas fue superior frente a la pauta reactiva a dosis bajas para reducir la tasa de evento combinado CV y muerte por cualquier causa en pacientes en hemodiálisis anémicos tratados con AEE. En este estudio el grupo proactivo alcanzó antes los objetivos de Hb, se redujo la dosis de AEE y no se asoció a un aumento de riesgo de trombosis del acceso vascular, infecciones ni de hospitalización.
¿Cuál es el perfil de seguridad de las dosis altas de Fe i.v. en pacientes con ERC y anemia en comparación con Fe oral o dosis bajas de Fe i.v.?En el estudio PIVOTAL25, aquellos pacientes aleatorizados a recibir dosis alta y proactiva de Fe sacarosa i.v. presentaron una menor incidencia de MACE + que los pacientes asignados a dosis bajas reactivas de Fe i.v., con un perfil de seguridad similar, demostrando la superioridad de la estrategia proactiva en reducir eventos CV.
En el estudio FIND-CKD en pacientes con ERC-ND, ya mencionado, no hubo diferencias en seguridad entre los grupos. Además, un análisis post hoc mostró que solo el 21,6% de los pacientes tratados con Fe oral lograban un aumento de Hb ≥1 g/dl en 4 semanas y entre los que no respondieron en ese tiempo, menos de un 30% lo conseguían al final del estudio, en la semana 5249. Este hallazgo podría sugerir que una respuesta ineficaz precoz al tratamiento con Fe oral podría ser motivo para considerar un cambio temprano a ferroterapia i.v.
En el estudio FERWON-NEPHRO, los pacientes fueron aleatorizados a recibir una dosis única de 1 g de Fe isomaltósido i.v. o hasta 5 dosis de 200 mg de Fe sacarosa i.v. en un periodo de dos semanas. La dosis única más alta de Fe isomaltósido i.v. indujo una respuesta hematológica no inferior a las 8 semanas, tasas bajas y similares de reacciones de hipersensibilidad con una incidencia significativamente menor del evento adverso CV compuesto (MACE, angina inestable, IC, fibrilación auricular, hipertensión o hipotensión)52.
El estudio REPAIR IDA53 aleatorizó a dos dosis de FCM 750mg i.v. en 1 semana o Fe sacarosa 200 mg i.v. administrados hasta en 5 dosis durante 14 días. No se encontraron diferencias en el evento de seguridad compuesto (muerte CV, infarto e ictus), pero hubo más episodios de hipertensión transitoria en el grupo de FCM i.v. En cuanto a la eficacia, un número mayor de pacientes del grupo de FCM alcanzó un aumento de Hb ≥1 g/dl.
Con estos datos, se puede recomendar que cuando se elige tratamiento con Fe i.v. en pacientes ND, la estrategia de elección sea de dosis alta y baja frecuencia. Tal como recomiendan las guías del National Institute of Health and Care Excellence (NICE)31, dosis alta y frecuencia baja es un esquema en el que se administran al menos 500 mg de Fe en cada infusión, con un máximo de dos infusiones, pauta que ha demostrado ser segura y eficaz.
Agentes estimuladores de la eritropoyesis (AEE) y estabilizadores del factor inducido por la hipoxia (IPH-HIF)Las recomendaciones relacionadas con esta sección se pueden encontrar en la tabla 2
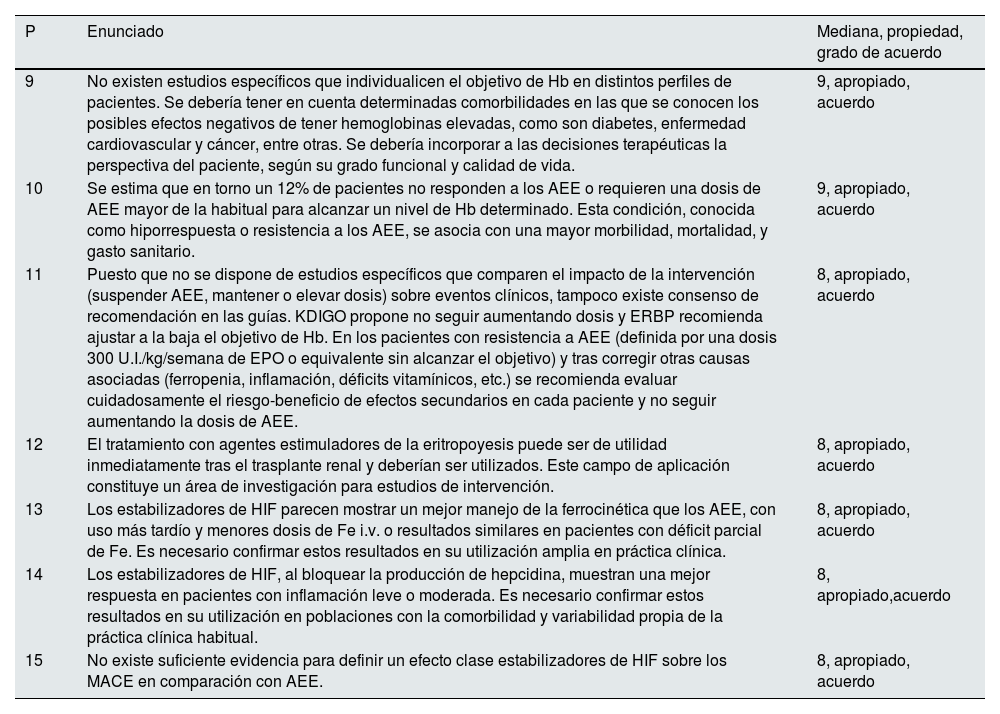
Enunciados relacionados con agentes estimuladores de la eritropoyesis (AEEs) y estabilizadores del factor inducido por la hipoxia (IPH-HIF)
| P | Enunciado | Mediana, propiedad, grado de acuerdo |
|---|---|---|
| 9 | No existen estudios específicos que individualicen el objetivo de Hb en distintos perfiles de pacientes. Se debería tener en cuenta determinadas comorbilidades en las que se conocen los posibles efectos negativos de tener hemoglobinas elevadas, como son diabetes, enfermedad cardiovascular y cáncer, entre otras. Se debería incorporar a las decisiones terapéuticas la perspectiva del paciente, según su grado funcional y calidad de vida. | 9, apropiado, acuerdo |
| 10 | Se estima que en torno un 12% de pacientes no responden a los AEE o requieren una dosis de AEE mayor de la habitual para alcanzar un nivel de Hb determinado. Esta condición, conocida como hiporrespuesta o resistencia a los AEE, se asocia con una mayor morbilidad, mortalidad, y gasto sanitario. | 9, apropiado, acuerdo |
| 11 | Puesto que no se dispone de estudios específicos que comparen el impacto de la intervención (suspender AEE, mantener o elevar dosis) sobre eventos clínicos, tampoco existe consenso de recomendación en las guías. KDIGO propone no seguir aumentando dosis y ERBP recomienda ajustar a la baja el objetivo de Hb. En los pacientes con resistencia a AEE (definida por una dosis 300 U.I./kg/semana de EPO o equivalente sin alcanzar el objetivo) y tras corregir otras causas asociadas (ferropenia, inflamación, déficits vitamínicos, etc.) se recomienda evaluar cuidadosamente el riesgo-beneficio de efectos secundarios en cada paciente y no seguir aumentando la dosis de AEE. | 8, apropiado, acuerdo |
| 12 | El tratamiento con agentes estimuladores de la eritropoyesis puede ser de utilidad inmediatamente tras el trasplante renal y deberían ser utilizados. Este campo de aplicación constituye un área de investigación para estudios de intervención. | 8, apropiado, acuerdo |
| 13 | Los estabilizadores de HIF parecen mostrar un mejor manejo de la ferrocinética que los AEE, con uso más tardío y menores dosis de Fe i.v. o resultados similares en pacientes con déficit parcial de Fe. Es necesario confirmar estos resultados en su utilización amplia en práctica clínica. | 8, apropiado, acuerdo |
| 14 | Los estabilizadores de HIF, al bloquear la producción de hepcidina, muestran una mejor respuesta en pacientes con inflamación leve o moderada. Es necesario confirmar estos resultados en su utilización en poblaciones con la comorbilidad y variabilidad propia de la práctica clínica habitual. | 8, apropiado,acuerdo |
| 15 | No existe suficiente evidencia para definir un efecto clase estabilizadores de HIF sobre los MACE en comparación con AEE. | 8, apropiado, acuerdo |
AEE, agentes estimuladores de la eritropoyesis; ERBP, European Renal Best Practice; Hb, hemoglobina; HIF, factor inducible por la hipoxia; i.v., intravenosa; MACE, Evento combinado Mortalidad o infarto o accidente cerebrovascular; P, pregunta;
De acuerdo con las guías KDIGO 2012, los AEE deben indicarse en los pacientes ERC-ND con niveles de Hb <10 g/dl y en pacientes ERC-5D con Hb de 9,0-10,0 g/dl. La Hb objetivo para el mantenimiento es de 10-11,5 g/dl en el conjunto de pacientes con ERC54. También establecen que no deben conseguirse intencionadamente niveles de Hb >13 g/dl con AEE en los pacientes adultos.
Por otro lado, la guía European Renal Best Practice (ERBP) indica que se debe indicar los AEE cuando la concentración de Hb es ˂10 g/dl en todos los pacientes con ERC, proponiendo una individualización tanto del inicio (más precoz en individuos activos de bajo riesgo) como de objetivos de Hb, aunque sin superar Hb de12g/dl en ningún caso.
Finalmente, las recientes guías NICE31 recomiendan individualizar los objetivos teniendo en cuenta también la opinión de los pacientes, los síntomas y las comorbilidades. Recomiendan un objetivo global de Hb de 10-12 g/dl y no escalar de forma indefinida las dosis de AEE si no se consiguen los objetivos terapéuticos preespecificados.
Ninguna de las tres guías reseñadas aporta resultados de estudios con objetivos específicos por perfiles de pacientes.
¿Cuál es el porcentaje de resistencia a AEE en pacientes tratados?Se discute en conjunto con la pregunta XI.
En pacientes con resistencia a AEE, ¿hay que mantener el tratamiento con altas dosis de AEE, aunque no se llegue al objetivo de Hb?
No existe una definición universalmente aceptada de hiporrespuesta o resistencia a los AEE. En la práctica, significa no lograr una concentración de Hb objetivo a pesar de recibir una dosis superior a la habitual de un AEE dado, o precisar dosis muy elevadas para mantener un nivel de Hb objetivo. Las principales guías la definen de forma diferente: las NKF-KDOQI 55 y las NICE56 como unas dosis de eritropoyetina superiores a 300 o 450 U/Kg/semana si se administran s.c. o i.v. respectivamente, las NICE también incluyen una dosis de darbepoietina >1,5 μg/Kg/semana (una vez descartada una causa conocida de resistencia como sangrado crónico o comorbilidad mantenida). Las guías KDIGO6 la definen como la ausencia de aumento de la Hb después de tratamiento con AEE durante 1 mes a las dosis adecuadas según peso.
A pesar de la ausencia de una definición precisa de hiporrespuesta a los AEE, se ha empleado el cociente entre la dosis de epoetina en UI/Kg/semana (o el equivalente para otros AEE) y la concentración de Hb en g/dl, conocido como índice de resistencia eritropoyético (IRE). Se define resistencia un IRE superior a 12,720 UI semanales de epoetina/Kg de peso/g/dl de Hb57.
La prevalencia de resistencia al tratamiento con AEE en pacientes con ERC y anemia variará en función de la definición y de la población estudiada. Por ejemplo, estimaciones recientes de prevalencia oscilan entre el 12,5% cuando tanto el nivel de Hb como la dosis de AEE se incluyeron en la definición57, al 30,3% cuando solo se consideró en los pacientes el cambio desde el valor inicial en la Hb con Hb basal <11 g/dl58. Independientemente de la definición, la hiporrespuesta a AEE se asocia con una mayor mortalidad por todas las causas59–63 probablemente como consecuencia de la comorbilidad subyacente. Recientemente, se ha demostrado una asociación similar en pacientes con IC tratados con AEE64. Sin embargo, un análisis reciente del estudio DOPPS demuestra que la resistencia a los AEE en la mayoría de casos es transitoria y que mejora al corregir sus causas65.
Las guías NICE recomiendan considerar interrumpir el tratamiento con AEE en casos de resistencia, en pacientes que precisan trasfusiones frecuentes y dosis elevadas de AEE, siempre que se hayan descartado y tratado todas las causas reversibles de resistencia a AEE31.
El aumento de la dosis de AEE no mejora el pronóstico en los pacientes que presentan un IRE elevado. De hecho, varios estudios muestran que el uso de dosis altas de AEE puede producir resultados clínicos adversos. En el estudio CHOIR66, pacientes con ERC-ND fueron aleatorizados para alcanzar un objetivo de Hb de 11,3 o 13,5 g/dl con epoetina α administrada una vez a la semana. La incidencia del desenlace principal (combinado de muerte, IC, accidente cerebrovascular e infarto agudo de miocardio) fue superior en los pacientes asignados a la Hb objetivo más alta. Un análisis posterior mostró que los pacientes que recibieron dosis elevadas de epoetina α (≥20 000 U/semana) tuvieron más eventos adversos67. La incapacidad para alcanzar el objetivo de Hb y el uso protocolizado de epoetina en dosis altas se asociaron con un aumento del riesgo del evento combinado en los análisis no ajustados. Sin embargo, en modelos ajustados, solo epoetina α en dosis altas se asoció con un riesgo significativamente mayor de alcanzar el evento combinado, lo que sugiere que el uso de dosis altas de los AEE en el contexto de hiporrespuesta puede ser más perjudicial que beneficioso. En el estudio TREAT en pacientes con diabetes mellitus, el tratamiento con darbepoetina α en los pacientes asignados al grupo de corrección de la Hb(Hb de 13,0 g/dl) duplicó el riesgo de ictus en comparación con placebo68, y en aquellos con hiporrespuesta inicial se asoció con un aumento del riesgo cardiovascular60. Se observaron resultados similares en el estudio RED-HF realizado en pacientes con IC y que utilizó los criterios de inclusión del TREAT69. Estos datos sugieren que los riesgos de administrar dosis muy elevadas de AEE son superiores a los beneficios en los pacientes con hiporrespuesta a los AEE70, y apoyan las recomendaciones de las guías KDIGO de no incrementar las dosis de AEE indiscriminadamente en caso de hiporrespuesta6.
¿Es conveniente mantener los AEE en el periodo inmediato post trasplante para mejorar la evolución?La anemia postrasplante (APT) afecta del 30%-45% de los receptores de trasplante renal y se asocia con un aumento de la morbilidad71–73 pero solo una minoría de ellos recibe tratamiento con AEE73. Las razones podrían ser la falta de una evidencia clara sobre el riesgo-beneficio de la terapia, así como el coste de los tratamientos. En el momento actual no existen recomendaciones específicas para el tratamiento de la APT6.
El estudio Neo-PDGF, aleatorizó 104 pacientes. El empleo de epoetina β en dosis altas (4 dosis de 30 000 UI, aproximadamente 430 U/kg y dosis a lo largo de 2 semanas) durante las primeras dos semanas postrasplante aumentó significativamente los niveles de Hb un mes después del trasplante en comparación con la no administración (Hb media 11,1 frente a 10,5 g/dl; p = 0,038) pero sin diferencias significativas en la incidencia de disfunción inicial del injerto o filtrado glomerular74. De manera similar, la administración intraoperatoria de epoetina α en dosis altas (40 000 UI dosis única, aproximadamente 570 U/kg) a 72 receptores de trasplante renal no mejoró la incidencia de disfunción inicial del injerto, la función renal al mes ni la Hb al mes del trasplante75. El limitado tamaño muestral de estos estudios impide valorar correctamente los posibles riesgos de dosis tan altas de AEE.
En un estudio de cohorte transversal retrospectivo de 1794 receptores de trasplante renal, la anemia (Hb ˂12,5 g/dl) se asoció significativamente con mayor mortalidad. En pacientes sin AEE, el aumento espontáneo de la Hb se asoció con una disminución de la mortalidad por cualquier causa. En los pacientes tratados con AEE, la mejora de la anemia (Hb hasta 12,5 g/dl) también se asoció con una disminución de la mortalidad, aunque alcanzar una Hb >14 g/dl aumentaba de forma significativa el riesgo de muerte76. En el ensayo CAPRIT77, se aleatorizaron 125 receptores de trasplante renal a epoetina β con objetivos de Hb de 13-15 g/dl (corrección completa) o 10,5-11,5 g/dl (corrección parcial). En comparación con el grupo de corrección parcial, el grupo de corrección completa tuvo una disminución menor en el aclaramiento de creatinina estimado (5,9 frente a 2,4 ml/min/1,73 m2), una menor tasa de ERC terminal (21% frente a 4,8%) y una mayor supervivencia del injerto (80% frente a 95%). También hubo una mejoría significativa en la CdV. Con respecto a la seguridad CV no hubo eventos cardíacos (IC, arritmia o infarto de miocardio) en el grupo de corrección completa en comparación con el grupo de corrección parcial (4 pacientes, 8%). Estos datos concuerdan con un estudio realizado en Japón a 127 trasplantados de riñón tratados con AEE durante tres años78. Más recientemente se ha publicado otro ensayo en 55 pacientes trasplantados renales con APT a los tres meses79. Los pacientes fueron aleatorizados a recibir epoetina β con un objetivo entre 11,5-13,5 g/dl o a no recibir tratamiento para la anemia. Tras dos años de seguimiento no hubo diferencias en cuanto a la evolución de la función renal entre los dos grupos, siendo similar la tasa de descenso del filtrado glomerular; no hubo tampoco diferencias en cuanto a la proteinuria o al control de la presión arterial. Sí que se observó una mejoría más acentuada de la CdV en el grupo tratado con AEE. El pequeño número de participantes de estos ensayos no permite obtener información adecuada sobre la seguridad CV de los niveles objetivos más alto en el trasplante renal.
Los resultados de estos estudios, así como los del gran estudio observacional de Heinze76 sugieren que el nivel objetivo óptimo de Hb en APT es más alto que el objetivo sugerido en la ERC y probablemente debería ser de hasta 12–13 g/dl. Un ensayo clínico más grande, diseñado como el estudio CAPRIT, con un seguimiento más prolongado podría ayudar a definir el nivel de Hb objetivo. El estudio ALERT demuestra que la anemia es un factor de riesgo de pérdida del injerto renal pero no de morbimortalidad CV o mortalidad total Los niveles de Hb están inversamente relacionados con la pérdida del injerto (HR 0,86 [0,80-0,92] por 1 g/dl Hb p <0,001)80.
Así pues, aunque los datos del tratamiento con AEE de la anemia en el postransplate renal sugieren un beneficio, el beneficio de mantener los AEE en el postransplante inmediato requiere estudios específicos que conformen su beneficio
¿Existe un efecto diferencial sobre la ferrocinética de los estabilizadores de HIF frente a AEE?Existe un soporte fisiopatológico que apoya el efecto de los inhibidores de las prolil-hidroxilasa (IPH) de hypoxia inducible factor (HIF), también llamados estabilizadores de HIF, sobre la ferrocinética. Los estabilizadores de HIF aumentan la expresión del HIF, permitiendo su dimerización y translocación al núcleo celular. Ello desencadena una activación de genes que promueve el aumento de la producción de EPO y expresión de su receptor, y otras acciones sobre el metabolismo férrico como son el aumento en la producción de transportadores de Fe en la pared celular (DMT1, DcytB), de niveles de transferrina y de su receptor, y el bloqueo de la hepcidina30,81,82, favoreciendo la absorción y movilización de Fe y su transporte hasta la médula para la eritropoyesis.
Un metaanálisis reciente incluyo un total de 30 estudios con 13 146 pacientes tratados con roxadustat, daprodustat, vadadustat, molidustat, desidustat o enarodustat. Los estabilizadores de HIF redujeron los niveles de hepcidina, ferritina y hierro sérico, mientras que la capacidad total de fijación de hierro y los niveles de transferrina aumentaron frente a los del grupo de placebo o AEE83. Sin embargo, los resultados con las diferentes moléculas (como daprodustat o vadadustat) no son uniformes y podrían existir diferencias entre ellas a este respecto o ser debidas a diferencias en el diseño de los protocolos
¿Existe un efecto independiente de la inflamación en la corrección de la anemia por estabilizadores de HIF (IPH-HIF)?Los estudios preclínicos demuestran que el aumento de la expresión de HIF reduce los niveles de hepcidina, un reactante de fase aguda que está elevado en la ERC y se ha implicado en el déficit funcional de Fe84. Un reciente metaanálisis demuestra que el tratamiento con estabilizadores de HIF puede reducir los niveles de hepcidina, tanto frente a placebo como frente a AEE83. En los estudios comparados con placebo la reducción de hepcidina se mantiene en todos los subgrupos. Por ambas razones se puede hablar de un efecto de clase.
En los estudios de roxadustat en ERC-ND se estratificó a los pacientes por quintiles de proteína C reactiva (PCR) y se demostró que mantenían los resultados de eficacia y dosificación en todos los subgrupos. Igualmente, mientras los pacientes con PCR basal elevada tratados con roxadustat mantuvieron la dosis, aquellos que recibían AEE precisaron aumentar la dosis durante el seguimiento85.
En los estudios de vadadustat, no hubo correlación entre los niveles de PCR basal y el incremento de Hb86.
Debe quedar claro que los estudios fase 3 no fueron diseñados para medir la respuesta eritropoyética en pacientes resistentes a AEEs y que su análisis post-hoc83, sólo destaca una menor afectación de la respuesta eritropoyética por eventos inflamatorios intercurrentes en pacientes tratados con estabilizadores de HIF.
¿Podemos considerar que existe un efecto clase (estabilizadores de HIF) en cuanto a respuesta enMajor Adverse Cardiovascular Events(MACE)?
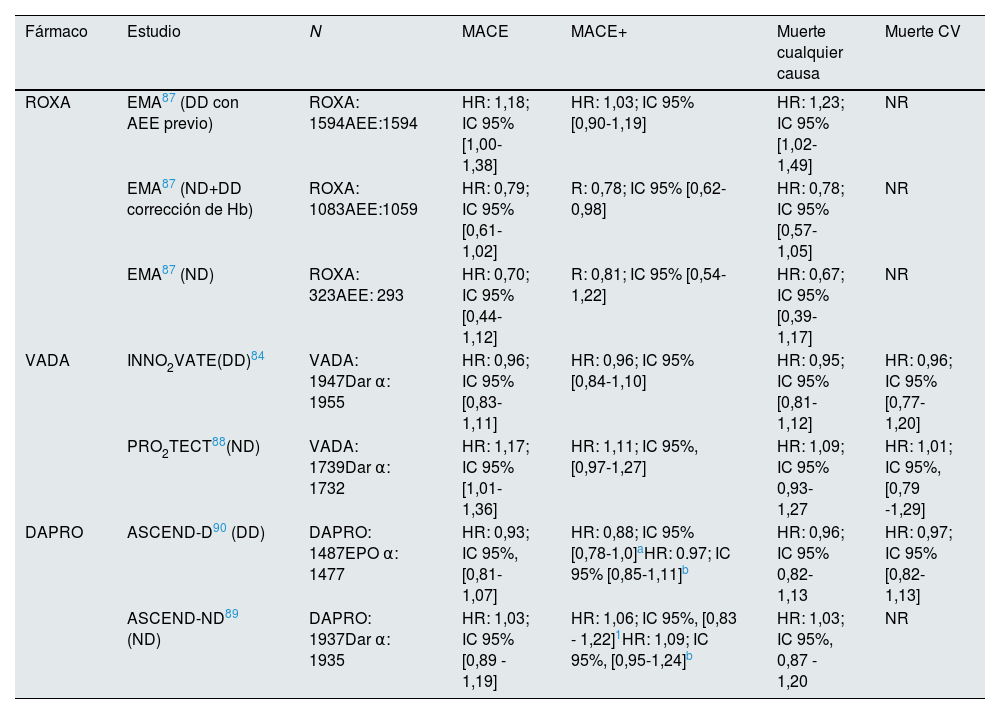
No existen estudios comparativos de seguridad CV entre los diferentes estabilizadores de HIF. La tabla 3 resume resultados en eventos CV de los distintos ensayos clínicos de los estabilizadores de HIF. Tras los resultados de los distintos ensayos clínicos y análisis por las agencias reguladoras84,87–90 se puede concluir que las distintas moléculas presentan un perfil con respecto a MACE de no inferioridad en aquellos pacientes DD, pero sus resultados en ND resultan más controvertidos. Este hecho justificaría la realización de más estudios para poder garantizar la seguridad de estas moléculas en todos los pacientes con ERC.
Resumen de los resultados obtenidos en los ensayos clínicos con estabilizadores de HIF comparados con AEE
| Fármaco | Estudio | N | MACE | MACE+ | Muerte cualquier causa | Muerte CV |
|---|---|---|---|---|---|---|
| ROXA | EMA87 (DD con AEE previo) | ROXA: 1594AEE:1594 | HR: 1,18; IC 95% [1,00-1,38] | HR: 1,03; IC 95% [0,90-1,19] | HR: 1,23; IC 95% [1,02-1,49] | NR |
| EMA87 (ND+DD corrección de Hb) | ROXA: 1083AEE:1059 | HR: 0,79; IC 95% [0,61-1,02] | R: 0,78; IC 95% [0,62-0,98] | HR: 0,78; IC 95% [0,57-1,05] | NR | |
| EMA87 (ND) | ROXA: 323AEE: 293 | HR: 0,70; IC 95% [0,44-1,12] | R: 0,81; IC 95% [0,54-1,22] | HR: 0,67; IC 95% [0,39-1,17] | NR | |
| VADA | INNO2VATE(DD)84 | VADA: 1947Dar α: 1955 | HR: 0,96; IC 95% [0,83-1,11] | HR: 0,96; IC 95% [0,84-1,10] | HR: 0,95; IC 95% [0,81-1,12] | HR: 0,96; IC 95% [0,77-1,20] |
| PRO2TECT88(ND) | VADA: 1739Dar α: 1732 | HR: 1,17; IC 95% [1,01-1,36] | HR: 1,11; IC 95%, [0,97-1,27] | HR: 1,09; IC 95% 0,93- 1,27 | HR: 1,01; IC 95%, [0,79 -1,29] | |
| DAPRO | ASCEND-D90 (DD) | DAPRO: 1487EPO α: 1477 | HR: 0,93; IC 95%, [0,81-1,07] | HR: 0,88; IC 95% [0,78-1,0]aHR: 0.97; IC 95% [0,85-1,11]b | HR: 0,96; IC 95% 0,82-1,13 | HR: 0,97; IC 95% [0,82-1,13] |
| ASCEND-ND89 (ND) | DAPRO: 1937Dar α: 1935 | HR: 1,03; IC 95% [0,89 - 1,19] | HR: 1,06; IC 95%, [0,83 - 1,22]1HR: 1,09; IC 95%, [0,95-1,24]b | HR: 1,03; IC 95%, 0,87 - 1,20 | NR |
MACE o hospitalización por insuficiencia cardiaca
AEE, Agente estimulador de la eritropoyesis; DAPRO, Daprodustat; Dar: Darbepoietina; DD, ERC dependiente de diálisis (Hemodiálisis o Diálisis Peritoneal); EPO, eritropoyetina; ND, ERC no dependiente de diálisis; MACE, Evento combinado Mortalidad o infarto o accidente cerebrovascular; ROXA, Roxadustat; VADA, Vadadustat
El trabajo DELPHI realizado ha permitido revisar la evidencia disponible de los tratamientos actuales en el manejo de la anemia renal y formular recomendaciones consensuadas con los expertos basadas en una revisión sistemática de la literatura. Por otro lado, recomendamos realizar nuevos estudios con el objetivo principal de evaluar el impacto del tratamiento de la anemia sobre la CVRS y la progresión de la ERC, y los efectos de la corrección del DFe con independencia de la anemia sobre el pronóstico de estos pacientes. El novedoso mecanismo de acción de los estabilizadores de HIF abre una nueva etapa para la investigación en este campo y ofrece una alternativa terapéutica que precisa más estudios para evaluar sus beneficios potenciales (por ejemplo, reducción de necesidades de ferroterapia, pacientes resistentes a AEE).
FinanciaciónVifor Pharma y Astellas han proporcionado a la S.E.N. una beca no condicionada para eldesarrollo de este proyecto, y de ningún modo han intervenido en la elección de preguntas PICO, selección bibliográfica ni ha estado presente en las discusiones durante el desarrollo del mismo.
Autoría/colaboradoresTodos los autores han hecho contribuciones sustanciales en cada uno de los siguientes aspectos: 1) la concepción y el diseño del estudio, o el análisis y la interpretación de los datos, 2) elborrador del artículo o la revisión crítica del contenido intelectual, 3) la aprobación definitiva de la versión que se presenta.
Conflicto de interesesJose Portolés declara haber participado en estudios pivotales de fármacos relacionados con anemia de Janssen-Cilag, Roche, AMGEN, Vifor Pharma, Astellas, Otsuka y GSK. por acciones de formación y consultoría de Astellas, GSK, Otsuka y Sanofi, Novartis y Vifor Pharma. Alejandro Martín Malo declara haber recibido honorarios por conferencias y consultorías de AstraZeneca, Astellas, Baxter, Medtronic y Vifor Pharma. Leyre Martín declara haber recibido pago u honorarios por consultoría de Astellas y BD-Bard; financiación en forma de beca de investigación de Vifor Pharma. Soporte para asistencia a reuniones de Baxter y Vifor Pharma. Gema Fernández-Fresnedo declara haber recibido pago u honorarios por conferencias,ponencias de Vifor Pharma, AstraZeneca, Novo Nordisk, Novartis, Boehringer-Ingelheim. Patricia de Sequera declara haber recibido pago u honorarios por conferencias, ponencias de
Vifor Pharma, Amgen, Fresenius, AstraZeneca, GSK, Braun y Baxter. Soporte para asistencia a reuniones de Nipro, Vifor Pharma, Amgen, Fresenius, AstraZeneca and Baxter. Por participación en Advisory Board de Astellas, Vifor Pharma, Baxter, AstraZeneca. J. Emilio Sánchez declara haber recibido pago u honorarios por conferencias, ponencias de Vifor Pharma, Amgen, AstraZeneca, Novo Nordisk, Astellas y Baxter y por participación en Advisory Board de Astellas, Vifor Pharma y GSK.
Alberto Ortiz-Arduan declara haber recibido financiación en forma de beca de investigación de Sanofi y por consultoría, por conferencias o para asistencia a reuniones de Advicciene, Astellas, AstraZeneca, Amicus, Amgen, Fresenius Medical Care, GSK, Bayer, Sanofi-Genzyme, Menarini, Mundipharma, Kyowa Kirin, Alexion, Freeline, Idorsia, Chiesi, Otsuka, Novo-Nordisk, Sysmex and Vifor Fresenius Medical Care Renal Pharma y es Director de la Cátedra Mundipharma-UAM de enfermedad renal diabética y de la Cátedra AstraZeneca-UAM de ERC y Alteraciones Hidroelectrolíticas.
Aleix Cases declara haber recibido financiación en forma de beca de investigación de Vifor Pharma, por consultoría de Astellas, AstraZeneca, Bayer, Boehringer-Ingelheim, GSK, Novo Nordisk, Otsuka y Vifor Pharma, por conferencias de: Astellas, AstraZeneca, Amgen, Bayer, BMS, Medscape, Novo Nordisk, Sanofi México, Vifor Pharma, así como otros conceptos de Arbor Research, Astellas, Boehringer-Ingelheim, Diaverum, GSK, Novo Nordisk, Otsuka, Sociedad Española de Nefrología y Vifor Pharma.
Los panelistas miembros del grupo de estudio DELPHI-GAS comprende los siguientes coautores:José Luis Gorriz MD PhD Prof H. Clínico de Valencia; José Herrero MD PhD H. Clínico de Madrid; Manuel Macia MD PhD Hospital Universitario Nuestra Señora de Candelaria; Marco Montomoli Hospital Clínico Universitario de Valencia; Miguel Pérez Fontán MD PhD Prof C.H.U A Coruña-CHUAC; María Auxiliadora Bajo MD PhD Prof H.U La Paz, Madrid; Borja Quiroga MD PhD H. U. La Princesa, Madrid; Sagrario Soriano MD PhD H. U Reina Sofía Córdoba; Nuria Areste MD PhD Hospital Universitario Virgen Macarena; Marta Crespo MD PhD H. del Mar Barcelona; Cesar Remón MD PhD Hospital Puerta del Mar, Cádiz Los autores quieren agradecer el soporte y colaboración de Medical Statistics Consulting (MSC) en el desarrollo de la metodología Delphi, así como la colaboración de María Giovanna Ferrario, PhD y de Antoni Torres-Collado, PhD (MSC) en la coordinación y edición del manuscrito.